ANSM - Mis à jour le : 18/06/2010
CERNEVIT, poudre pour solution injectable ou pour perfusion
Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser ce médicament.
· Gardez cette notice, vous pourriez avoir besoin de la relire.
· Si vous avez toute autre question, si vous avez un doute, demandez plus d'informations à votre médecin ou à votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez jamais à quelqu'un d'autre, même en cas de symptômes identiques, cela pourrait lui être nocif.
· Si l'un des effets indésirables devient grave ou si vous remarquez un effet indésirable non mentionné dans cette notice, parlez-en à votre médecin ou à votre pharmacien.
Dans cette notice :
1. QU'EST-CE QUE CERNEVIT, poudre pour solution injectable ou pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER CERNEVIT, poudre pour solution injectable ou pour perfusion ?
3. COMMENT UTILISER CERNEVIT, poudre pour solution injectable ou pour perfusion ?
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
5. COMMENT CONSERVER CERNEVIT, poudre pour solution injectable ou pour perfusion ?
6. INFORMATIONS SUPPLEMENTAIRES
Classe pharmacothérapeutique: ADDITIFS POUR SOLUTIONS INTRAVEINEUSES/VITAMINES.
CERNEVIT est un mélange équilibré de vitamines hydrosolubles (solubles dans l'eau) et liposolubles (solubles dans les graisses) permettant la supplémentation en vitamines, au cours de la nutrition parentérale de l'adulte et de l'enfant de plus de 11 ans.
Liste des informations nécessaires avant la prise du médicament
Sans objet.
N'utilisez jamais CERNEVIT, poudre pour solution injectable ou pour perfusion:
· en cas d'hypersensibilité aux principes actifs, notamment à la vitamine B1 ou aux excipients,
· chez le nouveau-né, le nourrisson et l'enfant de moins de 11 ans,
Précautions d'emploi ; mises en garde spéciales
Faites attention avec CERNEVIT, poudre pour solution injectable ou pour perfusion:
Vérifier l'intégrité du flacon.
Opérer dans des conditions aseptiques.
Ne pas conserver un flacon partiellement utilisé. ou présentant une coloration anormale lors de sa reconstitution.
Du fait de la présence d'acide glycocholique dans les excipients de CERNEVIT, l'administration répétée et prolongée chez des patients présentant un ictère d'origine hépatique (jaunisse) ou une cholestase biologique importante (perturbation des paramètres biologiques du foie), nécessite une surveillance attentive de la fonction hépatique.
En raison de la présence d'acide folique dans CERNEVIT, l'association aux médicaments antiépileptiques contenant du phénobarbital, de la phénytoïne, ou de la primidone nécessite des précautions d'emploi: surveillance clinique et, éventuellement, des taux plasmatiques; adaptation, s'il y a lieu, de la posologie de l'antiépileptique pendant la supplémentation folique et après son arrêt.
En raison de la présence de pyridoxine dans CERNEVIT, l'association à la lévodopa, qui peut réduire l'activité de la L-Dopa, nécessite des précautions d'emploi. Un inhibiteur de la dopadécarboxylase, tel que la carbidopa, peut être ajouté pour prévenir cette interaction.
Une carence en une ou plusieurs vitamines doit être corrigée par une supplémentation spécifique.
CERNEVIT ne renfermant pas de vitamine K, celle-ci devra être administrée séparément si nécessaire.
La compatibilité doit être testée avant mélange à d'autres solutions pour perfusion et, tout particulièrement, lors de l'ajout de CERNEVIT dans des poches de mélanges binaires de nutrition parentérale, associant du glucose des électrolytes et une solution d'acides aminés, ainsi qu'aux mélanges ternaires associant du glucose des électrolytes, une solution d'acides aminés et des lipides.
Interactions avec d'autres médicaments
Utilisation d'autres médicaments
En raison de la présence de pyridoxine dans CERNEVIT, l'association à la lévodopa nécessite des précautions d'emploi.
En raison de la présence d'acide folique dans CERNEVIT, l'association aux médicaments anticonvulsivants contenant du phénobarbital, de la phénytoïne, ou de la primidone nécessite des précautions d'emploi.
Si vous prenez ou avez pris récemment un autre médicament, y compris un médicament obtenu sans ordonnance, parlez-en à votre médecin ou à votre pharmacien.
Interactions avec les aliments et les boissons
Aliments et boissons
Sans objet.
Interactions avec les produits de phytothérapie ou thérapies alternatives
Sans objet.
Utilisation pendant la grossesse et l'allaitement
Grossesse
CERNEVIT peut être prescrit pendant la grossesse si besoin, dans le respect de l'indication et des posologies de manière à éviter un surdosage vitaminique.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Allaitement
L'utilisation de CERNEVIT est déconseillée au cours de l'allaitement du fait du risque de surdosage en vitamine A chez le nouveau-né.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Sans objet.
Effets sur l'aptitude à conduire des véhicules ou à utiliser des machines
Sans objet.
Liste des excipients à effet notoire
Sans objet.
3. COMMENT UTILISER CERNEVIT, poudre pour solution injectable ou pour perfusion ?
Instructions pour un bon usage
CERNEVIT, poudre pour solution injectable ou pour perfusion. est réservé à l'adulte et à l'enfant de plus de 11 ans.
Posologie, Mode et/ou voie(s) d'administration, Fréquence d'administration et Durée du traitement
Posologie
La posologie quotidienne habituelle est d'un flacon de 5 ml.
Mode d'administration
Voie intraveineuse stricte.
Après reconstitution, administrer par injection intraveineuse lente (au moins dix minutes) ou en perfusion dans une solution de glucose à 5 % ou de chlorure de sodium à 0,9 %.
CERNEVIT peut entrer dans la composition de mélanges nutritifs, associant glucides, lipides, acides aminés, électrolytes, sous réserve d'avoir vérifié préalablement la compatibilité et la stabilité dans le cas de chaque mélange nutritif utilisé.
Technique de reconstitution
CERNEVIT (flacon sans BIO-SET)
A l'aide d'une seringue, injecter dans le flacon 5 ml d'eau pour préparations injectables ou de solution de glucose à 5% ou de chlorure de sodium à 0,9 %.
Agiter légèrement pour dissoudre la poudre.
La solution obtenue est de couleur jaune-orangé.
CERNEVIT BIO-SET
CERNEVIT BIO-SET permet une reconstitution directe dans les poches (poches en plastique simple ou multi-compartiment) comportant un site de supplémentation.
Poche simple:
1. Enlever le capuchon en le tournant puis en le tirant pour casser la bague de sécurité

2. Connecter directement le BIO-SET au site de supplémentation de la poche
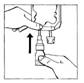
3. Appliquer une pression sur la partie mobile transparente du BIO-SET pour perforer le bouchon en caoutchouc du flacon
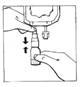
4. Tenir en position verticale le système connecté (CERNEVIT BIO-SET/poche de perfusion), la poche étant au dessus. Presser doucement la poche de perfusion plusieurs fois pour transférer de la solution dans le flacon (environ 5 ml). Agiter le flacon pour dissoudre CERNEVIT.
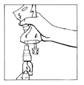
5. Retourner le système connecté en le tenant verticalement la poche étant en bas. Presser doucement la poche de perfusion plusieurs fois pour faire passer l'air de la partie supérieure de la poche dans le flacon, permettant ainsi le retour de la solution dans la poche de perfusion
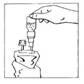
6. Répéter les instructions 4 et 5 jusqu'à ce que le flacon soit vide
7. Retirer le flacon de CERNEVIT BIO-SET et le jeter
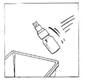
8. Mélanger doucement
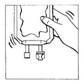
Poche multi-compartiment:
La reconstitution de CERNEVIT BIO-SET doit être effectuée avant la reconstitution de la poche multi-compartiment (avant l'ouverture des soudures non permanentes et avant le mélange du contenu des compartiments)
1. Placer la poche multi-compartiment sur un plan de travail.
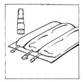
2. Enlever le capuchon de CERNEVIT BIO-SET en le tournant puis en le tirant pour casser la bague de sécurité
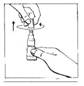
3. Connecter directement le BIO-SET au site de supplémentation de la poche multi-compartiment
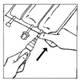
4. Appliquer une pression sur la partie mobile transparente du BIO-SET pour perforer le bouchon en caoutchouc du flacon
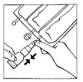
5. Tenir le flacon verticalement partie supérieure vers le haut. Presser doucement le compartiment plusieurs fois pour transférer de la solution dans le flacon (environ 5 ml). Agiter le flacon pour dissoudre CERNEVIT.
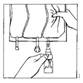
6. Retourner le système connecté en tenant le flacon verticalement partie supérieure vers le bas. Presser doucement le compartiment plusieurs fois pour faire passer l'air de la partie supérieure du compartiment dans le flacon permettant ainsi le retour de la solution dans la poche de perfusion
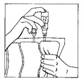
7. Répéter les étapes 5 et 6 jusqu'à ce que le flacon soit vide.
8. Retirer le flacon de CERNEVIT BIO-SET et le jeter
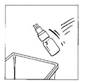
9. Enfin, reconstituer la poche multi-compartiment
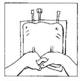
10. Mélanger en retournant la poche au moins 3 fois

Avertissement:
Faire attention à ce que le BIO-SET ne se déconnecte pas du site de supplémentation pendant tout le processus de reconstitution.
Fréquence d'administration et durée de traitement
L'administration peut être poursuivie pendant toute la durée de la nutrition parentérale.
Se conformer à l'avis médical.
Symptômes et instructions en cas de surdosage
Si vous avez utilisé plus de CERNEVIT, poudre pour solution injectable ou pour perfusion que vous n'auriez dû:
Les signes d'un surdosage en CERNEVIT sont essentiellement ceux résultant de l'administration de doses excessives de vitamine A.
Signes cliniques de doses de vitamines A supérieures à 150 000 UI:
· troubles digestifs, céphalées, hypertension intracrânienne, œdème papillaire, troubles psychiatriques, irritabilité, voire convulsions, desquamation généralisée retardée.
Signes cliniques d'une intoxication chronique à la vitamine A:
· hypertension intracrânienne, gonflements sous-cutanés sensibles ou douloureux au niveau des extrémités des membres.
Conduite à tenir en cas de surdosage aigu ou chronique:
· cesser l'administration de CERNEVIT, réduire les apports calciques (en calcium), augmenter la diurèse (élimination urinaire) et réhydrater.
Instructions en cas d'omission d'une ou de plusieurs doses
Si vous oubliez d'utiliser CERNEVIT, poudre pour solution injectable ou pour perfusion:
Consultez votre médecin ou votre pharmacien.
Sans objet.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Description des effets indésirables
Comme tous les médicaments, CERNEVIT, poudre pour solution injectable ou pour perfusion est susceptible d'avoir des effets indésirables, bien que tout le monde n'y soit pas sujet.
Compte tenu de la présence de vitamine B1, il est possible d'observer des réactions d'hypersensibilité chez des sujets présentant un terrain allergique (cf. Rubrique "Informations nécessaires avant d'utiliser CERNEVIT").
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien.
5. COMMENT CONSERVER CERNEVIT, poudre pour solution injectable ou pour perfusion ?
Tenir hors de la portée et de la vue des enfants.
Ne pas utiliser après la date de péremption figurant sur la boîte.
A conserver à une température ne dépassant pas 25°C.
Conserver le conditionnement primaire dans l'emballage extérieur.
Après reconstitution, la stabilité physico-chimique a été démontrée pendant 24 heures à 25°C. D'un point de vue microbiologique, le produit devrait être utilisé immédiatement après reconstitution. S'il n'est pas utilisé immédiatement, la durée et les conditions de conservation avant utilisation sont de la responsabilité de l'utilisateur et ne devraient pas normalement dépasser 24 heures entre 2°C et 8°C, sauf si la reconstitution a été effectuée dans des conditions d'asepsie contrôlées et validées.
Si nécessaire, mises en garde contre certains signes visibles de détérioration
Les médicaments ne doivent pas être jetés au tout à l'égout ou avec les ordures ménagères. Demandez à votre pharmacien ce qu'il faut faire des médicaments inutilisés. Ces mesures permettront de protéger l'environnement.
6. INFORMATIONS SUPPLEMENTAIRES
Liste complète des substances actives et des excipients
Que contient CERNEVIT, poudre pour solution injectable ou pour perfusion ?
Les substances actives sont:
Un flacon de 5 ml contient:
Rétinol (Vitamine A) ......................................................................................................................... 3500 UI
Sous forme de palmitate de rétinol
Cholécalciférol (Vitamine D3) .............................................................................................................. 220 UI
Alpha-tocophérol (Vitamine E) ........................................................................................................ 11,200 UI
Quantité correspondant à DL alpha-tocophérol ................................................................................ 10,200 mg
Acide ascorbique (Vitamine C) .................................................................................................... 125,000 mg
Thiamine (Vitamine B1) .................................................................................................................. 3,510 mg
Sous forme de tétrahydrate de cocarboxylase .................................................................................. 5,800 mg
Riboflavine (Vitamine B2) ................................................................................................................ 4,140 mg
Sous forme de phosphate sodique de riboflavine dihydraté ................................................................. 5,670 mg
Pyridoxine (Vitamine B6) ................................................................................................................ 4,530 mg
Sous forme de chlorhydrate de pyridoxine ........................................................................................ 5,500 mg
Cyanocobalamine (Vitamine B12) ................................................................................................... 0,006 mg
Acide folique (Vitamine B9) ............................................................................................................ 0,414 mg
Acide pantothénique (Vitamine B5) ................................................................................................ 17,250 mg
Sous forme de dexpanthénol ......................................................................................................... 16,150 mg
Biotine (Vitamine B8) ..................................................................................................................... 0,069 mg
Nicotinamide (Vitamine PP) .......................................................................................................... 46,000 mg
Les autres composants sont:
Glycine, acide glycocholique, lécithine de soja, hydroxyde de sodium, acide chlorhydrique.
Forme pharmaceutique et contenu
Qu'est-ce que CERNEVIT, poudre pour solution injectable ou pour perfusion et contenu de l'emballage extérieur ?
Ce médicament se présente sous forme de poudre pour solution injectable ou pour perfusion.
Boîte de 1, 10 ou 20 flacons.
Boîte de 1, 10 ou 20 flacons avec set de transfert BIO-SET.
CLINTEC PARENTERAL S.A.
6, AVENUE LOUIS PASTEUR
B.P. 56
78311 MAUREPAS CEDEX
BAXTER S.A.
6, AVENUE LOUIS PASTEUR
B.P. 56
78311 MAUREPAS CEDEX
BAXTER S.A
BOULEVARD R. BRANQUART 80
7860 LESSINES
BELGIQUE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants:
Conformément à la réglementation en vigueur.
Date d’approbation de la notice
La dernière date à laquelle cette notice a été approuvée est le {date}.
AMM sous circonstances exceptionnelles
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’Afssaps (France).
Informations réservées aux professionnels de santé
Sans objet.
Sans objet.