
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 06/11/2014
IZEANE 0,02 mg/3 mg, comprimé pelliculé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
24 comprimés pelliculés (actifs) blancs :
Ethinylestradiol................................................................................................................ 0,020 mg
Drospirénone................................................................................................................... 3,000 mg
Pour un comprimé pelliculé.
Excipients à effet notoire : chaque comprimé contient 48,53 mg de lactose monohydraté et 0,070 mg de lécithine de soja.
4 comprimés pelliculés placebos (inactifs) verts :
Ces comprimés ne contiennent pas de substances actives.
Excipients à effet notoire : chaque comprimé contient 37,26 mg de lactose anhydre et 0,003 mg de jaune orangé S (E110).
Pour la liste complète des excipients, voir rubrique 6.1.
Le comprimé actif est un comprimé pelliculé blanc à blanc cassé, rond, biconvexe, d’environ 6 mm de diamètre gravé « G73 » sur une face.
Le comprimé placebo est un comprimé pelliculé vert, rond, biconvexe, d’environ 6 mm de diamètre, sans inscription.
4.1. Indications thérapeutiques
La décision de prescrire IZEANE doit être prise en tenant compte des facteurs de risque de la patiente, notamment ses facteurs de risque de thrombo-embolie veineuse (TEV), ainsi que du risque de TEV associé à IZEANE en comparaison aux autres CHC (Contraceptifs Hormonaux Combinés) (voir rubriques 4.3 et 4.4).
4.2. Posologie et mode d'administration
Voie d'administration: voie orale.
Mode d'utilisation d’IZEANE :
Les comprimés doivent être pris chaque jour, à peu près à la même heure, éventuellement avec un peu de liquide, en respectant l'ordre indiqué sur la plaquette.
La prise des comprimés doit se faire de façon continue. Prendre un comprimé chaque jour pendant 28 jours consécutifs.
Commencer la plaquette suivante le jour suivant la prise du dernier comprimé de la plaquette précédente. Une hémorragie de privation débute généralement 2 ou 3 jours après avoir commencé à prendre les comprimés placebos (situés sur la dernière rangée) et il est possible qu'elle ne soit pas terminée au moment d'entamer la plaquette suivante.
Modalités d'instauration du traitement par IZEANE :
· Absence de contraception hormonale antérieure (le mois précédent) :
La prise des comprimés doit commencer le 1er jour du cycle, c'est-à-dire le premier jour des règles.
· Relais d'une méthode contraceptive estroprogestative (contraceptif oral combiné / COC, anneau vaginal ou patch transdermique) :
Prendre le 1er comprimé d’IZEANE de préférence le jour qui suit la prise du dernier comprimé actif (dernier comprimé contenant les substances actives) de la précédente COC, ou au plus tard le jour qui suit la période habituelle d'arrêt des comprimés, ou le jour suivant la prise du dernier comprimé placebo de la précédente COC. En cas de relais d'un anneau vaginal ou d'un patch transdermique, prendre le 1er comprimé d’IZEANE de préférence le jour du retrait ou au plus tard le jour prévu pour la nouvelle pose.
· Relais d'une contraception progestative seule (pilule progestative seule, forme injectable, implant) ou par un système intra-utérin (SIU) contenant un progestatif :
Chez une femme, le relais peut se faire: à tout moment du cycle s'il s'agit d'une pilule progestative seule; le jour du retrait s'il s'agit d'un implant ou d'un SIU ; ou le jour prévu pour l'injection suivante s'il s'agit d'une forme injectable. Dans tous les cas, il sera recommandé aux femmes d'utiliser une méthode de contraception mécanique complémentaire pendant les 7 premiers jours de prise d’IZEANE.
· Après une interruption de grossesse au cours du premier trimestre :
Il est possible de commencer une contraception immédiatement chez ces femmes. Il n'est pas nécessaire d'utiliser une méthode de contraception complémentaire.
· Après un accouchement ou une interruption de grossesse au cours du deuxième trimestre :
Il sera conseillé aux femmes de ne commencer une contraception qu'après 21 à 28 jours.
Si cette contraception est démarrée plus tardivement, il leur sera recommandé d'utiliser une méthode de contraception mécanique complémentaire pendant les 7 premiers jours de traitement. Cependant, si des rapports sexuels ont déjà eu lieu, il convient de s'assurer de l'absence de grossesse avant le début de la prise du contraceptif oral estroprogestatif ou d'attendre le retour des règles.
En cas d'allaitement, voir rubrique 4.6.
Conduite à tenir en cas d'oubli d'un ou plusieurs comprimés :
Les 4 derniers comprimés de la plaquette sont des comprimés placebos, l’oubli de ces comprimés n'a donc pas de réelle importance. Cependant, les comprimés oubliés doivent être jetés pour éviter toute prolongation non intentionnelle de la période sous placebo.
Les conseils suivants s'appliquent uniquement en cas d'oubli de comprimés actifs.
Un retard de moins de 12 heures dans la prise d'un comprimé ne modifie pas l'efficacité contraceptive. Il sera conseillé aux femmes de prendre le comprimé oublié dès que cet oubli est constaté; la prise des comprimés suivants s'effectuant à l'heure habituelle.
Si le retard est supérieur à 12 heures, la sécurité contraceptive peut être diminuée. En cas d'oubli de comprimés, les deux règles suivantes doivent être connues car nécessaires pour choisir la conduite à tenir :
1. La prise de comprimés ne doit jamais être interrompue plus de 4 jours ;
2. Sept jours de prise ininterrompue du traitement sont nécessaires afin d'obtenir une inhibition correcte de l'axe hypothalamo-hypophyso-ovarien.
En conséquence, les conseils suivants pourront être donnés dans le cadre de la pratique quotidienne.
· Jour 1 à 7 :
Il devra être demandé aux femmes de prendre le dernier comprimé oublié dès que l'oubli est constaté, même si cela implique la prise de deux comprimés en même temps. Les comprimés suivants devront être pris à l'heure habituelle. Une contraception mécanique complémentaire (préservatifs par exemple) est cependant nécessaire pendant les 7 jours suivants.
Si des rapports sexuels ont eu lieu au cours des 7 jours précédant l'oubli, il existe un risque de grossesse. Le risque de grossesse est d'autant plus élevé que le nombre de comprimés oubliés est important ou que la date de l'oubli est proche du début de la rangée des comprimés placebos.
· Jour 8 à 14 :
Il devra être recommandé aux femmes de prendre le dernier comprimé oublié dès que l'oubli est constaté, même si cela implique la prise de deux comprimés en même temps. Les comprimés suivants devront être pris à l'heure habituelle.
Si les comprimés ont été pris correctement au cours des 7 jours précédant le premier comprimé oublié, aucune mesure contraceptive complémentaire n'est nécessaire. Cependant, en cas d'oubli de plusieurs comprimés, il devra être recommandé aux femmes de prendre des précautions complémentaires pendant 7 jours.
· Jour 15 à 24 :
Le risque de diminution de l'activité contraceptive est maximal en raison de la proximité de la prise des 4 jours de comprimés placebos.
Il est cependant possible de prévenir la diminution de l'effet contraceptif en ajustant comme suit les modalités de prise des comprimés :
o Si la femme a pris correctement tous les comprimés pendant les 7 jours précédant l'oubli d'un comprimé, aucune mesure contraceptive complémentaire n'est nécessaire. Il est alors possible de suivre l'un des 2 schémas de prise décrits ci-dessous.
o Dans le cas contraire, il devra être recommandé aux femmes de suivre le premier schéma de prise et d'utiliser une méthode contraceptive complémentaire pendant les 7 jours suivants.
Schéma 1 :
Il sera recommandé aux femmes de prendre le dernier comprimé oublié dès que cet oubli est constaté, même si deux comprimés doivent être pris en même temps.
Les comprimés suivants sont ensuite pris à l'heure habituelle, jusqu'à avoir terminé les comprimés actifs de la plaquette. Les 4 derniers comprimés de la plaquette (comprimés placebos) ne doivent pas être pris. La plaquette suivante doit être commencée immédiatement. Une hémorragie de privation est peu probable avant la fin des comprimés actifs de la seconde plaquette, mais des « spottings » ou des métrorragies peuvent être observés pendant la durée de prise des comprimés.
Schéma 2 :
On peut alternativement conseiller à la femme d'interrompre la prise des comprimés actifs de la plaquette en cours. Elle devra alors prendre les 4 derniers comprimés de la plaquette (comprimés placebos) pendant 4 jours maximum, incluant le nombre de jours où des comprimés ont été oubliés, et elle commencera ensuite la plaquette suivante.
Chez une femme ayant oublié de prendre un (des) comprimé(s), l'absence d'hémorragie de privation durant la prise des comprimés placebos devra faire rechercher une éventuelle grossesse.
Conduite à tenir en cas de troubles gastro-intestinaux :
En cas de troubles gastro-intestinaux sévères (par exemple des vomissements ou une diarrhée), l'absorption d'un comprimé peut ne pas être complète; des mesures contraceptives complémentaires doivent donc être prises.
Si des vomissements se produisent dans les 3-4 heures qui suivent la prise d'un comprimé actif, un nouveau comprimé doit être pris en remplacement dès que possible. Le nouveau comprimé doit être pris si possible dans les 12 heures qui suivent l'heure habituelle de prise.
Si plus de 12 heures se sont écoulées, les mêmes consignes que celles données pour les oublis de comprimés doivent s'appliquer (voir rubrique 4.2 « Conduite à tenir en cas d'oubli d'un ou plusieurs comprimés »).
Si la femme ne veut pas modifier le calendrier normal de prise des comprimés, elle devra prendre le ou les comprimé(s) supplémentaire(s) sur une autre plaquette.
Comment retarder les règles ?
La survenue des règles peut être retardée en commençant une nouvelle plaquette d’IZEANE sans prendre les comprimés placebos de la plaquette en cours.
Les règles peuvent être retardées jusqu'à la fin des comprimés actifs de la seconde plaquette si nécessaire.
Pendant cette période, des métrorragies ou des « spottings » peuvent se produire.
IZEANE peut ensuite être repris normalement après la prise des comprimés placebos.
Il est possible de décaler la survenue des règles à un autre jour de la semaine en raccourcissant la durée de la prise des comprimés placebos du nombre de jours nécessaires.
Comme pour un retard de règles, plus l'intervalle est court, plus le risque d'absence d'hémorragie de privation et de survenue de métrorragies ou de « spottings » lors de la prise des comprimés de la plaquette suivante est important.
En cas de survenue pour la première fois de l'une de ces pathologies lors de la prise d’un COC, interrompre immédiatement le traitement.
Les contraceptifs hormonaux combinés (CHC) ne doivent pas être utilisés dans les situations suivantes :
· Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
· Hypersensibilité à l’arachide ou au soja.
· Présence ou risque de thrombo-embolie veineuse (TEV) :
o Thrombo-embolie veineuse – présence de TEV (patiente traitée par des anticoagulants) ou antécédents de TEV (p. ex. thrombose veineuse profonde [TVP] ou embolie pulmonaire [EP]) ;
o Prédisposition connue, héréditaire ou acquise, à la thrombo-embolie veineuse, telle qu’une résistance à la protéine C activée (PCa) (y compris une mutation du facteur V de Leiden), un déficit en antithrombine III, un déficit en protéine C, un déficit en protéine S ;
o Intervention chirurgicale majeure avec immobilisation prolongée (voir rubrique 4.4) ;
o Risque élevé de thrombo-embolie veineuse dû à la présence de multiples facteurs de risque (voir rubrique 4.4).
· Présence ou risque de thrombo-embolie artérielle (TEA) :
o Thrombo-embolie artérielle – présence ou antécédents de thrombo-embolie artérielle (p. ex. infarctus du myocarde [IM]) ou de prodromes (p. ex. angine de poitrine) ;
o Affection cérébrovasculaire – présence ou antécédents d’accident vasculaire cérébral (AVC) ou de prodromes (p. ex. accident ischémique transitoire [AIT]) ;
o Prédisposition connue, héréditaire ou acquise, à la thrombo-embolie artérielle, telle qu’une hyperhomocystéinémie ou la présence d’anticorps anti-phospholipides (anticorps anti-cardiolipine, anticoagulant lupique) ;
o Antécédents de migraine avec signes neurologiques focaux ;
o Risque élevé de thrombo-embolie artérielle dû à la présence de multiples facteurs de risque (voir rubrique 4.4) ou d’un facteur de risque sévère tel que :
§ diabète avec symptômes vasculaires,
§ hypertension artérielle sévère,
§ dyslipoprotéinémie sévère.
· Affection hépatique sévère ou antécédent d'affection hépatique sévère, en l'absence de normalisation des tests fonctionnels hépatiques ;
· Insuffisance rénale sévère ou aiguë ;
· Tumeur hépatique (bénigne ou maligne) évolutive ou ancienne ;
· Tumeur maligne hormono-dépendante connue ou suspectée (exemple: organes génitaux ou seins) ;
· Saignements vaginaux d'origine inconnue.
4.4. Mises en garde spéciales et précautions d'emploi
Si la patiente présente l’un des troubles ou l’un des facteurs de risque mentionnés ci-dessous, la pertinence du traitement par IZEANE doit être discutée avec elle.
En cas d’aggravation ou de survenue de l’un de ces troubles ou facteurs de risque, la nécessité d’interrompre l’utilisation d’IZEANE doit être discutée entre le médecin et la patiente.
· Troubles circulatoires
Risque de thrombo-embolie veineuse (TEV)
Le risque de TEV est augmenté chez les femmes qui utilisent un contraceptif hormonal combiné (CHC) en comparaison aux femmes qui n’en utilisent pas. Les CHC contenant du lévonorgestrel, du norgestimate ou de la noréthistérone sont associés au risque de TEV le plus faible. Le risque de TEV associé aux autres CHC, tels qu’IZEANE, peut être jusqu’à deux fois plus élevé. La décision d’utiliser tout autre CHC que ceux associés au risque de TEV le plus faible doit être prise uniquement après concertation avec la patiente afin de s’assurer qu’elle comprend le risque de TEV associé à IZEANE, l’influence de ses facteurs de risque actuels sur ce risque et le fait que le risque de TEV est maximal pendant la première année d’utilisation. Certaines données indiquent également une augmentation du risque lors de la reprise d’un CHC après une interruption de 4 semaines ou plus.
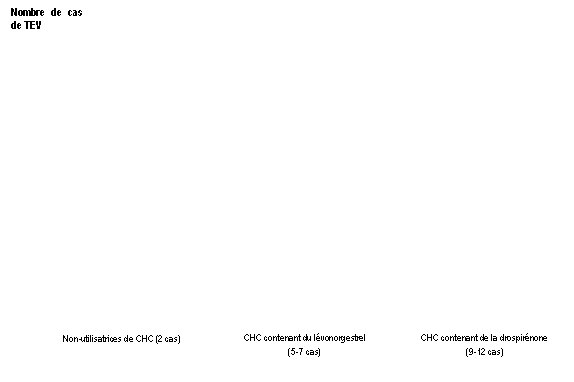
Parmi les femmes qui n’utilisent pas de CHC et qui ne sont pas enceintes, environ 2 sur 10 000 développeront une TEV sur une période d’un an. Cependant, chez une femme donnée, le risque peut être considérablement plus élevé, selon les facteurs de risque qu’elle présente (voir ci-dessous).
On estime1 que sur 10 000 femmes qui utilisent un CHC contenant de la drospirénone, 9 à 12 développeront une TEV sur une période d’un an ; ce nombre est à comparer à celui d’environ 62 chez les femmes qui utilisent un CHC contenant du lévonorgestrel.
Dans les deux cas, le nombre de TEV par année est inférieur à celui attendu pendant la grossesse ou en période post-partum.
La TEV peut être fatale dans 1 à 2 % des cas.
1 Ces incidences ont été estimées à partir de l’ensemble des données des études épidémiologiques, en s’appuyant sur les risques relatifs liés aux différents CHC en comparaison aux CHC contenant du lévonorgestrel.
2 Point central de l’intervalle de 5-7 pour 10 000 années-femmes sur la base d’un risque relatif, pour les CHC contenant du lévonorgestrel par rapport à la non-utilisation d’un CHC, d’environ 2,3 à 3,6.
Nombre de cas de TEV pour 10 000 femmes sur une période d’un an


De façon extrêmement rare, des cas de thrombose ont été signalés chez des utilisatrices de CHC dans d’autres vaisseaux sanguins, p. ex. les veines et artères hépatiques, mésentériques, rénales ou rétiniennes.
Facteurs de risque de TEV
Le risque de complications thrombo-emboliques veineuses chez les utilisatrices de CHC peut être considérablement accru si d’autres facteurs de risque sont présents, en particulier si ceux-ci sont multiples (voir le tableau ci-dessous).
IZEANE est contre-indiqué chez les femmes présentant de multiples facteurs de risque, ceux-ci les exposant à un risque élevé de thrombose veineuse (voir rubrique 4.3). Lorsqu’une femme présente plus d’un facteur de risque, il est possible que l’augmentation du risque soit supérieure à la somme des risques associés à chaque facteur pris individuellement – dans ce cas, le risque global de TEV doit être pris en compte. Si le rapport bénéfice/risque est jugé défavorable, le CHC ne doit pas être prescrit (voir rubrique 4.3).
Tableau : Facteurs de risque de TEV
|
Facteur de risque |
Commentaire |
|
Obésité (indice de masse corporelle supérieur à 30 kg/m²) |
L’élévation de l’IMC augmente considérablement le risque. Ceci est particulièrement important à prendre en compte si d’autres facteurs de risque sont présents. |
|
Immobilisation prolongée, intervention chirurgicale majeure, toute intervention chirurgicale sur les jambes ou le bassin, neurochirurgie ou traumatisme majeur
Remarque : l’immobilisation temporaire, y compris les trajets aériens > 4 heures, peut également constituer un facteur de risque de TEV, en particulier chez les femmes présentant d’autres facteurs de risque |
Dans ces situations, il est conseillé de suspendre l’utilisation de la pilule (au moins quatre semaines à l’avance en cas de chirurgie programmée) et de ne reprendre le CHC que deux semaines au moins après la complète remobilisation. Une autre méthode de contraception doit être utilisée afin d’éviter une grossesse non désirée. Un traitement anti-thrombotique devra être envisagé si IZEANE n’a pas été interrompu à l’avance.
|
|
Antécédents familiaux (thrombo-embolie veineuse survenue dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, c.-à-d. avant 50 ans) |
En cas de prédisposition héréditaire suspectée, la femme devra être adressée à un spécialiste pour avis avant toute décision concernant l’utilisation de CHC |
|
Autres affections médicales associées à la TEV |
Cancer, lupus érythémateux disséminé, syndrome hémolytique et urémique, maladies inflammatoires chroniques intestinales (maladie de Crohn ou rectocolite hémorragique) et drépanocytose |
|
Âge |
En particulier au-delà de 35 ans |
Il n’existe aucun consensus quant au rôle éventuel joué par les varices et les thrombophlébites superficielles dans l’apparition ou la progression d’une thrombose veineuse.
L’augmentation du risque de thrombo-embolie pendant la grossesse, et en particulier pendant les 6 semaines de la période puerpérale, doit être prise en compte (pour des informations concernant « Grossesse et allaitement », voir rubrique 4.6).
Symptômes de TEV (thrombose veineuse profonde et embolie pulmonaire)
Les femmes doivent être informées qu’en cas d’apparition de ces symptômes, elles doivent consulter un médecin en urgence et lui indiquer qu’elles utilisent un CHC. Les symptômes de la thrombose veineuse profonde (TVP) peuvent inclure :
· gonflement unilatéral d’une jambe et/ou d’un pied ou le long d’une veine de la jambe ;
· douleur ou sensibilité dans une jambe, pouvant n’être ressentie qu’en position debout ou lors de la marche ;
· sensation de chaleur, rougeur ou changement de la coloration cutanée de la jambe affectée.
Les symptômes de l’embolie pulmonaire (EP) peuvent inclure :
· apparition soudaine et inexpliquée d’un essoufflement ou d’une accélération de la respiration ;
· toux soudaine, pouvant être associée à une hémoptysie ;
· douleur thoracique aiguë ;
· étourdissements ou sensations vertigineuses sévères ;
· battements cardiaques rapides ou irréguliers.
Certains de ces symptômes (p. ex. « essoufflement », « toux ») ne sont pas spécifiques et peuvent être interprétés à tort comme des signes d’événements plus fréquents ou moins sévères (infections respiratoires, p. ex.).
Les autres signes d’une occlusion vasculaire peuvent inclure : douleur soudaine, gonflement et coloration légèrement bleutée d’une extrémité.
Si l’occlusion se produit dans l’œil, les symptômes peuvent débuter sous la forme d’une vision trouble indolore pouvant évoluer vers une perte de la vision. Dans certains cas, la perte de la vision peut survenir presque immédiatement.
Risque de thrombo-embolie artérielle (TEA)
Des études épidémiologiques ont montré une association entre l’utilisation de CHC et l’augmentation du risque de thrombo-embolie artérielle (infarctus du myocarde) ou d’accident cérébrovasculaire (p. ex. accident ischémique transitoire, AVC). Les événements thrombo-emboliques artériels peuvent être fatals.
Facteurs de risque de TEA
Le risque de complications thrombo-emboliques artérielles ou d’accident cérébrovasculaire chez les utilisatrices de CHC augmente avec la présence de facteurs de risque (voir le tableau). IZEANE est contre-indiqué chez les femmes présentant un facteur de risque sévère ou de multiples facteurs de risque de TEA qui les exposent à un risque élevé de thrombose artérielle (voir rubrique 4.3). Lorsqu’une femme présente plus d’un facteur de risque, il est possible que l’augmentation du risque soit supérieure à la somme des risques associés à chaque facteur pris individuellement – dans ce cas, le risque global doit être pris en compte.
Si le rapport bénéfice/risque est jugé défavorable, le CHC ne doit pas être prescrit (voir rubrique 4.3).
Tableau : Facteurs de risque de TEA
|
Facteur de risque |
Commentaire |
|
Âge |
En particulier au-delà de 35 ans |
|
Tabagisme |
Il doit être conseillé aux femmes de ne pas fumer si elles souhaitent utiliser un CHC. Il doit être fortement conseillé aux femmes de plus de 35 ans qui continuent de fumer d’utiliser une méthode de contraception différente. |
|
Hypertension artérielle |
|
|
Obésité (indice de masse corporelle supérieur à 30 kg/m2) |
L’élévation de l’IMC augmente considérablement le risque. Ceci est particulièrement important à prendre en compte chez les femmes présentant d’autres facteurs de risque. |
|
Antécédents familiaux (thrombo-embolie artérielle survenue dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, c.-à-d. avant 50 ans) |
En cas de prédisposition héréditaire suspectée, la femme devra être adressée à un spécialiste pour avis avant toute décision concernant l’utilisation de CHC. |
|
Migraine |
L’accroissement de la fréquence ou de la sévérité des migraines lors de l’utilisation d’un CHC (qui peut être le prodrome d’un événement cérébrovasculaire) peut constituer un motif d’arrêt immédiat du CHC. |
|
Autres affections médicales associées à des événements indésirables vasculaires |
Diabète, hyperhomocystéinémie, valvulopathie cardiaque et fibrillation auriculaire, dyslipoprotéinémie et lupus érythémateux disséminé |
Symptômes de TEA
Les femmes doivent être informées qu’en cas d’apparition de ces symptômes, elles doivent consulter un médecin en urgence et lui indiquer qu’elles utilisent un CHC.
Les symptômes d’un accident cérébrovasculaire peuvent inclure :
· apparition soudaine d’un engourdissement ou d’une faiblesse du visage, d’un bras ou d’une jambe, en particulier d’un côté du corps ;
· apparition soudaine de difficultés à marcher, de sensations vertigineuses, d’une perte d’équilibre ou de coordination ;
· apparition soudaine d’une confusion, de difficultés à parler ou à comprendre ;
· apparition soudaine de difficultés à voir d’un œil ou des deux yeux ;
· céphalée soudaine, sévère ou prolongée, sans cause connue ;
· perte de conscience ou évanouissement avec ou sans crise convulsive.
Des symptômes temporaires suggèrent qu’il s’agit d’un accident ischémique transitoire (AIT).
Les symptômes de l’infarctus du myocarde (IM) peuvent inclure :
· douleur, gêne, pression, lourdeur, sensation d’oppression ou d’encombrement dans la poitrine, le bras ou sous le sternum ;
· sensation de gêne irradiant vers le dos, la mâchoire, la gorge, le bras, l’estomac ;
· sensation d’encombrement, d’indigestion ou de suffocation ;
· transpiration, nausées, vomissements ou sensations vertigineuses ;
· faiblesse, anxiété ou essoufflement extrêmes ;
· battements cardiaques rapides ou irréguliers.
· Cancers :
Certaines études épidémiologiques suggèrent que les contraceptifs oraux pourraient être associés à une augmentation du risque de cancer du col de l'utérus chez les utilisatrices de COC à long terme (> 5 ans). Il n'est cependant pas établi si cette augmentation du risque est due à d’autres facteurs comme le comportement sexuel et le papilloma virus humain (HPV).
Une méta-analyse de 54 études épidémiologiques a conclu qu'il existe une légère augmentation du risque relatif (RR = 1,24) de cancer du sein chez les femmes sous contraception orale. Cette majoration du risque disparaît progressivement au cours des 10 ans qui suivent l’arrêt d'une contraception orale combinée.
Le cancer du sein étant rare chez les femmes de moins de 40 ans, le nombre plus élevé de cancers diagnostiqués chez les utilisatrices habituelles ou nouvelles utilisatrices d'une contraception orale reste faible par rapport au risque global de cancer du sein.
Ces études ne permettent pas d'établir une relation de causalité. Il est possible que, chez les utilisatrices de contraception orale combinée, cette augmentation du risque soit due à un diagnostic plus précoce du cancer du sein, aux effets biologiques de cette contraception ou à l'association des deux. Les cancers du sein diagnostiqués chez les utilisatrices ont tendance à être moins évolués cliniquement par rapport à ceux diagnostiqués chez des femmes n'en ayant jamais utilisé.
Dans de rares cas, des tumeurs bénignes du foie, et dans de plus rares cas encore, des tumeurs malignes du foie ont été rapportées chez des utilisatrices de contraceptifs oraux combinés.
Dans des cas isolés, ces tumeurs ont conduit à des hémorragies intra-abdominales mettant en jeu le pronostic vital. Chez les femmes sous contraceptifs oraux, la survenue de douleurs de la partie supérieure de l'abdomen, d'augmentation du volume du foie ou de signes d'hémorragie intra-abdominale doit faire évoquer une tumeur hépatique.
L’utilisation de contraceptifs oraux plus fortement dosés (50 µg éthinylestradiol) diminue le risque de cancer de l’endomètre et de l’ovaire. Ceci demande à être confirmé avec les contraceptifs oraux plus faiblement dosés.
· Autres pathologies :
IZEANE contient un progestatif qui est un antagoniste de l'aldostérone ayant des propriétés d'épargne potassique. Dans la plupart des cas, aucune augmentation de la kaliémie n'est attendue. Cependant, dans une étude clinique, une augmentation modérée non significative de la kaliémie a été observée chez des patientes présentant une insuffisance rénale légère à modérée lors de la prise concomitante de drospirénone et de médicaments épargneurs de potassium. De ce fait, il est recommandé de vérifier la kaliémie lors du premier cycle du traitement chez les patientes présentant une insuffisance rénale pour lesquelles la kaliémie est située dans la limite supérieure à la normale avant traitement, en particulier en cas de prise associée de médicaments épargneurs de potassium (voir également rubrique 4.5).
Chez les femmes atteintes d'hypertriglycéridémie ou ayant des antécédents familiaux d'hypertriglycéridémie, un risque accru de pancréatite peut survenir en cas d’utilisation d'une contraception orale combinée.
Une augmentation modérée de la pression artérielle a été observée chez de nombreuses femmes sous contraception orale combinée mais rarement cliniquement significative. Une interruption immédiate de la contraception orale n’est justifiée que dans ces rares cas.
La persistance de chiffres tensionnels élevés ou le non contrôle des chiffres tensionnels par un traitement antihypertenseur chez une femme hypertendue prenant une contraception orale doit faire interrompre celle-ci. Cette contraception pourra éventuellement être reprise après normalisation des chiffres tensionnels par un traitement antihypertenseur.
La survenue ou l'aggravation des pathologies suivantes a été observée au cours de la grossesse ou chez des femmes prenant des contraceptifs oraux combinés, bien que la responsabilité des estroprogestatifs n'ait pu être établie : ictère et/ou prurit dû à une cholestase, lithiase biliaire, porphyrie, lupus érythémateux disséminé, syndrome hémolytique et urémique, chorée de Sydenham, herpès gravidique, hypoacousie par otosclérose.
Chez les femmes présentant un angiœdème héréditaire, les estrogènes exogènes peuvent induire ou aggraver des symptômes d’angiœdème.
La survenue d'anomalies hépatiques aiguës ou chroniques peut nécessiter l'arrêt des contraceptifs oraux combinés jusqu'à la normalisation des paramètres hépatiques.
La récidive d'un ictère cholestatique et/ou d'un prurit liés à une cholestase survenue au cours d'une grossesse précédente ou de la prise antérieure d'hormones stéroïdiennes doit faire arrêter les contraceptifs oraux.
Les contraceptifs oraux combinés peuvent avoir un effet sur la résistance périphérique à l'insuline et la tolérance au glucose ; il n'est cependant pas obligatoire de modifier le traitement chez des diabétiques utilisant une contraception orale combinée faiblement dosée (contenant moins de 0,05 mg d'éthinylestradiol).
Les femmes diabétiques doivent cependant être étroitement surveillées, en particulier lors de l'instauration d'une contraception orale combinée.
Des cas d'aggravations de dépression endogène, d'épilepsie, de maladie de Crohn et de rectocolite hémorragique ont été observés sous contraceptifs oraux combinés.
Un chloasma peut survenir, en particulier chez les femmes ayant des antécédents de chloasma gravidique. Les femmes ayant une prédisposition au chloasma sous contraceptifs oraux doivent éviter de s'exposer au soleil ou aux rayons ultra-violets.
Les comprimés pelliculés actifs contiennent 48,53 mg de lactose monohydraté et les comprimés inactifs contiennent 37,26 mg de lactose anhydre par comprimé pelliculé.
Ce médicament contient du lactose. Son utilisation est déconseillée chez les patients présentant une intolérance au galactose, un déficit en lactase de Lapp ou un syndrome de malabsorption du glucose ou du galactose (maladies héréditaires rares).
Ce médicament contient un agent colorant azoïque (E110), et peut provoquer des réactions allergiques.
Ce médicament contient 0,070 mg de lécithine de soja par comprimé et peut provoquer des réactions d’hypersensibilité (urticaire, choc anaphylactique).
Consultation/examen médical
Avant l’instauration ou la reprise d’un traitement par IZEANE, une recherche complète des antécédents médicaux (y compris les antécédents familiaux) doit être effectuée et la présence d’une grossesse doit être exclue. La pression artérielle doit être mesurée et un examen physique doit être réalisé, en ayant à l’esprit les contre-indications (voir rubrique 4.3) et les mises en garde (voir rubrique 4.4). Il est important d’attirer l’attention des patientes sur les informations relatives à la thrombose veineuse et artérielle, y compris le risque associé à IZEANE comparé à celui associé aux autres CHC, les symptômes de la TEV et de la TEA, les facteurs de risque connus et la conduite à tenir en cas de suspicion de thrombose.
Il sera conseillé aux femmes de lire attentivement la notice et de respecter les recommandations qu’elle contient. La fréquence et la nature des examens doivent être définies sur la base des recommandations établies et elles seront adaptées à chaque patiente.
Les patientes doivent être averties que les contraceptifs hormonaux ne protègent pas contre l’infection par le VIH (SIDA) et les autres maladies sexuellement transmissibles.
Diminution de l'efficacité :
L'efficacité d’une COC peut être diminuée en cas d'oubli de comprimés (voir rubrique 4.2), de troubles gastro-intestinaux durant la prise de comprimés actifs (voir rubrique 4.2) ou de prise concomitante de certains traitements (voir rubrique 4.5).
Troubles du cycle :
Des saignements irréguliers (« spottings » ou métrorragies) peuvent survenir sous contraceptifs oraux combinés, en particulier au cours des premiers mois. Ces saignements irréguliers seront considérés comme significatifs s'ils persistent après environ 3 cycles.
Si les saignements irréguliers persistent ou surviennent après des cycles réguliers, une recherche étiologique doit alors être effectuée; des examens diagnostiques appropriés doivent être pratiqués afin d'exclure une tumeur maligne ou une grossesse. Ces examens peuvent comporter un curetage.
Chez certaines femmes, les hémorragies de privation peuvent ne pas survenir durant la prise des comprimés placebos. Si la contraception orale a été suivie telle que décrite dans la rubrique 4.2, il est peu probable que la femme soit enceinte. Cependant, si la contraception orale combinée n'a pas été suivie correctement avant l’absence de la première hémorragie de privation ou si deux hémorragies de privation successives ne se produisent pas, il convient de s'assurer de l'absence de grossesse avant de poursuivre cette contraception orale combinée.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Remarque : les informations relatives à la prescription de médicaments associés doivent être consultées afin d’identifier toute interaction éventuelle.
· Influence d'autres médicaments sur drospirénone/éthinylestradiol :
Les interactions entre les contraceptifs oraux et d'autres médicaments peuvent entraîner des métrorragies et/ou conduire à un échec de la contraception.
Les interactions suivantes ont été rapportées dans la littérature :
Métabolisme hépatique
Des interactions peuvent se produire avec des médicaments inducteurs des enzymes hépatiques, ce qui peut conduire à une augmentation de la clairance des hormones sexuelles (par exemple, phénytoïne, barbituriques, primidone, carbamazépine, rifampicine, bosentan et les médicaments contre le VIH (par exemple ritonavir, névirapine) et aussi de façon possible avec l'oxcarbazépine, le topiramate, le felbamate, la griséofulvine et les préparations contenant du millepertuis (Hypericum perforatum, plante médicinale)).
En général, l'induction enzymatique maximale est observée au bout d'environ 10 jours de traitement ; mais, elle peut se prolonger au moins 4 semaines après l'arrêt du traitement.
Interférences avec la circulation entéro-hépatique
Des échecs de la contraception ont également été rapportés avec les antibiotiques de la classe des pénicillines et des tétracyclines. Le mécanisme de cet effet n'est pas connu.
Conduite à tenir
Les femmes prenant pendant une courte durée un médicament appartenant à l'une des classes mentionnées ci-dessus ou d'autres substances actives (médicaments inducteurs enzymatiques hépatiques) autre que la rifampicine, doivent utiliser temporairement, en plus de leur contraception orale combinée, pendant toute la durée de ce traitement et pendant les 7 jours qui suivent l'arrêt du traitement, une méthode contraceptive mécanique complémentaire.
En cas de traitement par la rifampicine, les mêmes précautions s'appliquent mais la contraception mécanique doit être poursuivie 28 jours après l'arrêt de l'antibiotique.
Chez les femmes prenant un traitement à long terme par des substances actives ayant une action inductrice sur les enzymes hépatiques, une autre méthode de contraception fiable, non hormonale est recommandée.
Les femmes sous traitement par antibiotiques (autre que la rifampicine, voir ci-dessus) doivent utiliser une contraception mécanique pendant les 7 jours qui suivent l'arrêt du traitement.
Si l'administration du traitement concomitant va au-delà de la fin des comprimés actifs de la plaquette du contraceptif oral combiné en cours, les comprimés placebos doivent être jetés et la plaquette suivante commencée immédiatement.
Les principaux métabolites de la drospirénone présents dans le plasma sont formés sans implication du système de cytochrome P450. Les inhibiteurs de ce système enzymatique ne devraient donc pas avoir d'influence sur le métabolisme de la drospirénone.
· Influence de drospirénone/éthinylestradiol sur d'autres médicaments :
Les contraceptifs oraux peuvent modifier le métabolisme de certaines autres substances actives. Par conséquent, les concentrations plasmatiques et tissulaires peuvent soit augmenter (ex: ciclosporine) soit diminuer (ex: lamotrigine).
Des études d'inhibition in vitro et des études d'interaction in vivo réalisées chez des femmes volontaires prenant de l'oméprazole, de la simvastatine et du midazolam comme marqueur, ont montré qu'une interaction de la drospirérone à des doses de 3 mg avec le métabolisme d'autres substances actives était peu probable.
· Autres interactions :
Chez les patientes ayant une fonction rénale normale, l’utilisation conconmitante de drospirénone avec un IEC ou un AINS n'a pas montré d'effet significatif sur la kaliémie. Néanmoins, l'utilisation en association de drospirénone/éthinylestradiol avec des antagonistes de l'aldostérone ou des diurétiques épargneurs de potassium n'a pas été étudiée. Dans ce cas, il conviendra de vérifier la kaliémie au cours du premier cycle de traitement. Voir rubrique 4.4.
· Examens biologiques :
L'utilisation de contraceptifs stéroïdiens peut modifier les résultats de certains examens biologiques tels que : les tests fonctionnels hépatiques, thyroïdiens, surrénaliens et rénaux, le taux plasmatique des protéines (porteuses) comme la corticosteroid-binding globulin (CBG) et des fractions lipidiques/lipoprotéiniques, les paramètres du métabolisme glucidique, les paramètres de la coagulation et de la fibrinolyse. Les modifications restent en général dans les limites de la normale. En raison de sa légère activité anti-minéralocorticoïde, la drospirénone accroît l'activité rénine plasmatique et l'aldostéronémie.
IZEANE n'est pas indiqué pendant la grossesse.
En cas de survenue d’une grossesse au cours de l’utilisation d’IZEANE, le traitement devra être immédiatement interrompu. Des études épidémiologiques de grande ampleur n’ont pas révélé de risque accru de malformations congénitales chez les enfants nés de femmes ayant utilisé des COC avant la grossesse, ni d’effet tératogène lorsqu’un COC avait été pris par inadvertance au cours de la grossesse.
Les études chez l'animal ont montré la présence d'effets indésirables au cours de la grossesse et de l'allaitement (voir rubrique 5.3). D’après ces données chez l’animal, des effets indésirables dus à l’action hormonale des principes actifs ne peuvent être exclus. Cependant, l’expérience générale de l’utilisation des CHC pendant la grossesse n’a pas fourni d’élément indiquant de réels effets indésirables dans l’espèce humaine.
Les données disponibles concernant l'utilisation de l’association drospirénone et éthinylestradiol au cours de la grossesse sont trop peu nombreuses pour permettre de conclure à d'éventuels effets néfastes d’IZEANE sur la grossesse ou sur la santé du fœtus ou du nouveau-né. Aucune donnée épidémiologique pertinente n’est disponible.
L’augmentation du risque de TEV en période post-partum doit être prise en compte lors de la reprise d’IZEANE (voir rubriques 4.2 et 4.4).
Les contraceptifs oraux combinés pouvant influer sur l’allaitement car ils peuvent réduire la quantité et modifier la composition du lait maternel. Par conséquent, l’utilisation de COC n’est pas recommandée avant que la mère qui allaite ait complètement sevré son enfant. De petites quantités de stéroïdes contraceptifs et/ou de leurs métabolites peuvent être excrétées dans le lait lors de l’utilisation de COC. Ces quantités peuvent avoir des répercussions sur l’enfant.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Il n'a pas été observé d'effet sur l'aptitude à conduire ou à utiliser des machines chez les utilisatrices de contraceptifs oraux combinés.
Pour les effets indésirables sévères des COC, voir rubrique 4.4.
Les effets indésirables suivants ont été rapportés lors de l’utilisation combinée de drospirénone et d’éthinylestradiol :
Tableau 1 : drospirénone/éthinylestradiol 3 mg/0,02 mg, Posologie de 24+4 jours – effets indésirables associés à l’utilisation d’un contraceptif oral ou dans le traitement de l’acné modérée selon la terminologie et la classification système-organe MedDRA. Les fréquences sont basées sur les données d’essais cliniques.
|
Classe de systèmes d’organes |
Fréquent |
Peu fréquent |
Rare |
Indéterminé (ne peut être estimé sur la base des données disponibles) |
|
Infections et infestations |
|
|
Candidose |
|
|
Affections hématologiques et du système lymphatique |
|
|
Anémie |
|
|
Affections du système immunitaire |
|
|
Réaction allergique |
Hypersensibilité |
|
Affections endocriniennes |
|
|
Troubles endocriniens |
|
|
Troubles du métabolisme et de la nutrition |
|
|
Augmentation de l’appétit Anorexie Hyperkaliémie Hyponatrémie |
|
|
Affections psychiatriques |
Labilité émotionnelle |
Dépression Diminution de la libido Nervosité Somnolence |
Anorgasmie Insomnie |
|
|
Affections du système nerveux |
Céphalées |
Etourdissements Paresthésie |
Vertige Tremblements |
|
|
Affections oculaires |
|
|
Conjonctivite Sécheresse oculaire Troubles oculaires |
|
|
Affections cardiaques |
|
|
Tachycardie |
|
|
Affections vasculaires |
|
Migraine Varices Hypertension |
Thrombo-embolie veineuse (TEV) Thrombo-embolie artérielle (TEA) Phlébite Troubles vasculaires Epistaxis Syncope |
|
|
Affections gastro-intestinales |
Nausées |
Douleur abdominale Vomissements Dyspepsie Flatulence Gastrite Diarrhée |
Distension abdominale Troubles gastro-intestinaux Réplétion gastro-intestinale Hernie hiatale Candidose buccale Constipation Sécheresse buccale |
|
|
Affections hépatobiliaires |
|
|
Douleur biliaire Cholécystite |
|
|
Affections de la peau et du tissu sous-cutané |
|
Acné Prurit Eruption cutanée |
Chloasma Eczéma Alopécie Dermatite acnéiforme Sécheresse de la peau Erythème noueux Hypertrichose Troubles cutanés Vergetures Dermatite de contact Dermatite photosensible Nodule cutané |
Erythème polymorphe |
|
Affections musculo-squelettiques et systémiques |
|
Douleur dorsale Douleur aux extrémités Crampes musculaires |
|
|
|
Affections des organes de reproduction et du sein |
Douleur mammaire Métrorragie* Aménorrhée |
Candidose vaginale Douleur pelvienne Augmentation du volume mammaire Maladie fibrokystique du sein Pertes vaginales Bouffées de chaleur Vaginite Troubles menstruels Dysménorrhée Hypoménorrhée Ménorragie Sécheresse vaginale Frottis cervical douteux |
Dyspareunie Vulvovaginite Saignement postcoïtal Hémorragie de privation Kyste mammaire Hyperplasie mammaire Néoplasie mammaire Polype cervical Atrophie de l’endomètre Kyste ovarien Augmentation de volume de l’utérus |
|
|
Troubles généraux et anomalies au site d’administration |
|
Asthénie Augmentation de la sudation |
Malaise |
|
|
Investigations |
|
Prise de poids |
Perte de poids |
|
* les saignements irréguliers disparaissent généralement avec la poursuite du traitement.
Description de certains effets indésirables particuliers
Une augmentation du risque d'événement thrombotique et thrombo-embolique artériel et veineux, incluant l’infarctus du myocarde, l’AVC, les accidents ischémiques transitoires, la thrombose veineuse et l’embolie pulmonaire, a été observée chez les femmes utilisant des CHC ; ceci est abordé plus en détails en rubrique 4.4.
Les effets indésirables graves suivants observés chez des femmes utilisatrices de contraceptifs oraux combinés sont également décrits à la rubrique 4.4. :
· hypertension ;
· tumeurs hépatiques ;
· survenue ou aggravation d'affections dont l'association avec les contraceptifs oraux combinés n'est pas certaine : maladie de Crohn, colite hémorragique, épilepsie, fibrome utérin, porphyrie, lupus érythémateux disséminé, herpès gravidique, chorée de Sydenham, syndrome hémolytique et urémique, ictère cholestatique ;
· chloasma ;
· troubles aigus ou chroniques de la fonction hépatique pouvant nécessiter l'arrêt de la contraception orale combinée jusqu'à normalisation des marqueurs de la fonction hépatique ;
· survenue ou aggravation des symptômes d'angiœdème par les estrogènes exogènes chez les femmes présentant un angioedème héréditaire.
La fréquence de diagnostic de cancer du sein est très légèrement augmentée chez les utilisatrices de contraceptifs oraux. Comme le cancer du sein est rare chez les femmes de moins de 40 ans cette augmentation est faible par rapport au risque général de cancer du sein. La relation de causalité avec l'utilisation d'un contraceptif oral combiné est inconnue. Pour plus d'informations se reporter aux rubriques 4.3 et 4.4.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.ansm.sante.fr.
Il n’y a encore aucune expérience de surdosage avec la drospirénone et l’éthinylestradiol. Compte tenu de l’expérience générale de l’utilisation des contraceptifs oraux combinés, les symtômes susceptibles d’apparaître dans ce cas sont les suivants : nausées, vomissements et chez les jeunes filles, légers saignements vaginaux. Il n’existe pas d’antidote et le traitement subséquent doit être purement symptomatique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique: Progestatifs et Estrogènes. Associations Fixes
Code ATC: G03AA12
Indice de Pearl pour échec de la méthode: 0,41 (limite supérieure de l'intervalle de confiance bilatéral à 95 %: 0,85). Indice de Pearl global (échec de la méthode + échec de la patiente) : 0,80 (limite supérieure de l’intervalle de confiance bilatéral à 95 % : 1,30).
Mécanisme d’action
L’effet contraceptif de l’éthinylestradiol/drospirénone repose sur l’interaction de différents facteurs, les plus importants étant l’inhibition de l’ovulation et les modifications de l’endomètre.
IZEANE est un contraceptif oral combiné associant l’éthinylestradiol et un progestatif, la drospirénone. Aux doses thérapeutiques, la drospirénone possède également des propriétés anti-androgéniques et une légère activité antiminéralocorticoïde. Elle n’a aucune activité œstrogénique, glucocorticoïde ou anti-glucocorticoïde, ce qui donne à la drospirénone un profil pharmacologique proche de celui de l’hormone naturelle, la progestérone.
Les études cliniques indiquent que la légère propriété anti-minéralocorticoïde entraîne un effet anti-minéralocorticoïde modéré.
Deux études multicentriques, randomisées, en double aveugle, contrôlées contre placebo ont été menées pour évaluer l'efficacité et la tolérance de l’utilisation combinée de drospirénone et éthinylestradiol chez des femmes ayant une acné vulgaire modérée.
Après six mois de traitement, comparé au placebo, l’association drospirénone et éthinylestradiol a montré une réduction plus importante, statistiquement significative, de 15,6 % (49,3 % contre 33,7 %) du nombre de lésions inflammatoires, 18,5 % (40,6 % contre 22,1 %) de lésions non inflammatoires et 16,5 % (44,6 % contre 28,1 %) du nombre total de lésions. De plus, le pourcentage de femmes ayant présenté un score « exempt » ou « pratiquement exempt » selon l'échelle globale d'évaluation par l'investigateur ISGA (Investigator's Static Global Assessment) était plus élevé, 11,8% (18,6% contre 6,8 %).
5.2. Propriétés pharmacocinétiques
Absorption
Administrée par voie orale, l'absorption de la drospirénone est rapide et presque complète. Les concentrations sériques maximales de la substance active d’environ 38 ng/ml, sont atteintes 1 à 2 heures après une prise unique. La biodisponibilité se situe entre 76 et 85 %. La prise concomitante d'aliments n'a pas d'influence sur la biodisponibilité de la drospirénone.
Distribution
Après administration orale, les concentrations sériques de la drospirénone diminuent avec une demi-vie terminale de 31 heures. La drospirénone se lie à l'albumine sérique, mais pas à la globuline liant les hormones sexuelles (SHBG) ni à la globuline liant les corticostéroïdes (CBG). Seulement 3 à 5 % des concentrations sériques totales de la substance active se retrouvent sous forme de stéroïde libre. L'augmentation de la SHBG induite par l'éthinylestradiol n'influence pas la liaison de la drospirénone aux protéines sériques. Le volume de distribution apparent moyen de la drospirénone est de 3,7 ± 1,2 l/kg.
Biotransformation
La drospirénone subit une métabolisation intense après administration orale. Les principaux métabolites plasmatiques sont la forme acide de la drospirénone, formée par ouverture du noyau lactone et le 3-sulfate de 4,5-dihydrodrospirénone ces deux métabolites sont formés sans implication du système du cytochrome P450. La drospirénone est peu métabolisée par le cytochrome P450 3A4; in vitro elle a démontré une capacité à inhiber cette enzyme ainsi que le cytochrome P450 1A1, le cytochrome P450 2C9 et le cytochrome P450 2C19.
Elimination
La vitesse de clairance métabolique sérique de la drospirénone est de 1,5 ± 0,2 ml/min/kg. La drospirénone n'est excrétée sous forme inchangée qu'à l'état de traces. Les métabolites de la drospirénone sont excrétés par voies fécale et urinaire selon un rapport de 1,2 à 1,4. La demi-vie de l'excrétion urinaire et fécale des métabolites est d'environ 40 h.
Conditions à l'état d'équilibre:
Au cours d'un cycle de traitement, les concentrations sériques maximales à l'état d'équilibre de la drospirénone (environ 70 ng/ml) sont atteintes au bout de 8 jours de traitement. Les taux sériques de drospirénone s'accumulent selon un facteur d'environ 3 en fonction du rapport de la demi-vie terminale et de l'intervalle entre les doses.
Populations particulières
Effet sur l'insuffisance rénale:
Chez les femmes présentant une insuffisance rénale légère (clairance de la créatinine Clcr: 50-80 ml/min), les concentrations sériques de drospirénone à l’état d’équilibre sont comparables à celles de femmes présentant une fonction rénale normale. Chez les femmes présentant une insuffisance rénale modérée (Clcr : 30-50 ml/min), les concentrations sériques de drospirénone sont en moyenne supérieures de 37 % à celles observées chez des femmes ayant une fonction rénale normale.
Le traitement par la drospirénone est également bien toléré par les femmes présentant une insuffisance rénale légère à modérée. Le traitement par drospirénone n’a montré aucun effet cliniquement significatif sur la kaliémie.
Effet sur l'insuffisance hépatique :
Dans une étude à dose unique, la clairance orale (Cl/F) était diminuée d'environ 50 % chez les volontaires ayant une insuffisance hépatique modérée par rapport à ceux présentant une fonction hépatique normale. La diminution observée de la clairance de la drospirénone chez les volontaires ayant une insuffisance hépatique modérée ne s’est pas traduite par une différence apparente en termes de concentrations sériques de potassium. Même en cas de diabète et de traitement concomitant par la spironolactone (deux facteurs pouvant prédisposer un patient à une hyperkaliémie), aucune augmentation des concentrations sériques de potassium au-dessus de la limite supérieure de la normale n’a été observée. Il peut être conclu que la drospirénone est bien tolérée chez les patientes présentant une insuffisance hépatique légère ou modérée (Child-Pugh B).
Groupes ethniques
Aucune différence cliniquement significative des paramètres pharmacocinétiques de la drospirénone ou de l'éthinylestradiol n'a été observée entre les femmes japonaises et les femmes caucasiennes.
· Ethinylestradiol :
Absorption
Après administration par voie orale, l'absorption de l'éthinylestradiol est rapide et complète. Les concentrations sériques maximales d’environ 33 ng/ml sont atteintes 1 à 2 heures après une prise unique par voie orale. En raison de la conjugaison présystémique et du métabolisme de premier passage, la biodisponibilité absolue est de 60 %. La prise concomitante de nourriture a entraîné une diminution de la biodisponibilité de l’éthinylestradiol chez environ 25 % des sujets étudiés, mais aucune modification n’a été observée chez les autres sujets étudiés.
Distribution
Les concentrations sériques d'éthinylestradiol diminuent en 2 phases : la phase de disposition terminale se caractérise par une demi-vie d'environ 24 heures. L'éthinylestradiol est fortement lié à l’albumine sérique, mais de manière non spécifique (environ 98,5 %) et induit une augmentation des concentrations sériques de SHBG et de CBG. Un volume de distribution apparent d'environ 5 l/kg a été déterminé.
Biotransformation
L'éthinylestradiol est soumis à une conjugaison pré-systémique au niveau de la muqueuse de l'intestin grêle ainsi que dans le foie. L'éthinylestradiol est principalement métabolisé par hydroxylation aromatique mais un grand nombre de métabolites hydroxylés et méthylés sont formés et ceux-ci sont présents sous forme de métabolites libres et de conjugués glucuronés et sulfonés. La vitesse de clairance métabolique de l'éthinylestradiol est d’environ 5 ml/min/kg.
Elimination
L'éthinylestradiol n'est pas excrété de façon significative sous forme inchangée. Les métabolites de l'éthinylestradiol sont excrétés avec un ratio d'excrétion rénale par rapport à biliaire de 4 :6. La demi-vie d'excrétion des métabolites est d'environ 1 jour.
Conditions à l'état d'équilibre :
L'état d'équilibre est atteint au cours de la seconde moitié d’un cycle de traitement et les concentrations sériques d’éthinylestradiol s’accumulent selon un facteur d’environ 2,0 à 2,3.
5.3. Données de sécurité préclinique
Noyau : lactose monohydraté, amidon de maïs, amidon de maïs prégélatinisé, copolymère greffé de macrogol et de poly(alcool vinylique), stéarate de magnésium.
Pelliculage (OPADRY II blanc) : poly(alcool vinylique), dioxyde de titane (E171), macrogol 3350, talc, lécithine de soja.
Comprimé inactif (vert)
Noyau : lactose anhydre, cellulose microcristalline, amidon de maïs prégélatinisé, stéarate de magnésium, silice colloïdale anhydre.
Pelliculage (OPADRY II vert) : poly(alcool vinylique), dioxyde de titane (E171), macrogol 3350, talc, laque aluminique d’indigotine (E132), jaune de quinoléine (E104), oxyde de fer noir (E172), jaune orangé S (E110).
2 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
A conserver dans l’emballage extérieur d’origine, à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
24 comprimés blancs et 4 comprimés verts sous plaquette (PVC/PE/PVDC/Aluminium). Boîte de 1.
24 comprimés blancs et 4 comprimés verts sous plaquette (PVC/PE/PVDC/Aluminium). Boîte de 3.
24 comprimés blancs et 4 comprimés verts sous plaquette (PVC/PE/PVDC/Aluminium). Boîte de 6.
24 comprimés blancs et 4 comprimés verts sous plaquette (PVC/PE/PVDC/Aluminium). Boîte de 13.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d'exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
15, boulevard Charles de Gaulle
92707 Colombes Cedex
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 269 191-3 ou 34009 269 191 3 9 : 24 comprimés blancs et 4 comprimés verts sous plaquette (PVC/PE/PVDC/Aluminium). Boîte de 1.
· 269 193-6 ou 34009 269 193 6 8 : 24 comprimés blancs et 4 comprimés verts sous plaquette (PVC/PE/PVDC/Aluminium). Boîte de 3.
· 584 238-2 ou 34009 584 238 2 6 : 24 comprimés blancs et 4 comprimés verts sous plaquette (PVC/PE/PVDC/Aluminium). Boîte de 6.
· 584 239-9 ou 34009 584 239 9 4 : 24 comprimés blancs et 4 comprimés verts sous plaquette (PVC/PE/PVDC/Aluminium). Boîte de 13.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[A compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[A compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I