Schéma 1
Schéma 2
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 19/07/2017
TANGANIL 500 mg/5ml, solution injectable I.V. en ampoule
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Acétylleucine........................................................................................................................ 500 mg
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
Traitement symptomatique de la crise vertigineuse.
4.2. Posologie et mode d'administration
2 ampoules par jour (jusqu’à 4 si nécessaire) par voie intraveineuse directe.
La durée du traitement est variable selon l’évolution clinique.
hypersensibilité à l’acétylleucine ou à l’un des excipients
4.4. Mises en garde spéciales et précautions d'emploi
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
4.6. Fertilité, grossesse et allaitement
Compte tenu des données disponibles, il est préférable, par mesure de prudence, de ne pas utiliser l’acétylleucine au cours de la grossesse quel qu’en soit le terme.
En effet, les données cliniques sont rassurantes mais encore limitées et les données animales ne permettent pas de conclure.
En l’absence de données disponibles, il est préférable de ne pas utiliser l’acétylleucine pendant l’allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Très rarement : éruptions cutanées (parfois associées à un prurit), urticaire.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ANTIVERTIGINEUX.
Antivertigineux de mécanisme d’action inconnu.
5.2. Propriétés pharmacocinétiques
Après administration de 1 g de TANGANIL par voie intraveineuse, on observe une cinétique bicompartimentale avec une phase de distribution très rapide (demi-vie moyenne de 0,11 H) et une phase d’élimination rapide (demi-vie moyenne de 1,08 H).
5.3. Données de sécurité préclinique
Monoéthanolamine, eau pour préparations injectables.
Après ouverture: le produit doit être utilisé immédiatement.
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
5 ml en ampoule (verre). Boîte de 5 ou 10.
6.6. Précautions particulières d’élimination et de manipulation
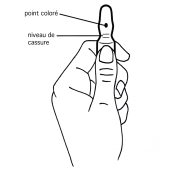
Mode d’ouverture des ampoules OPC (One point cut)
Avant d’ouvrir l’ampoule assurez-vous qu’il ne reste plus de solution dans la partie supérieure de l’ampoule.
Les ampoules sont munies d’un système d’ouverture OPC et doivent être cassées selon les instructions suivantes :
1. D’une main tenir fermement le corps de l’ampoule, point coloré face à vous (schéma 1)
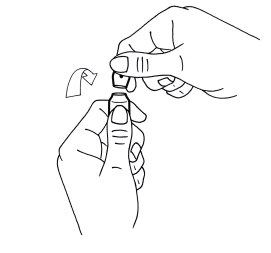
2. De l’autre saisir la partie supérieure de l’ampoule (index posé derrière le col de l’ampoule et le pouce sur le point coloré comme indiqué dans le schéma n°2)
3. En tenant fermement chaque partie de l’ampoule, casser d’un coup sec la partie supérieure en exerçant une pression dans la direction opposée au point coloré (schéma 2)
|
|
|
|
Schéma 1 |
Schéma 2 |
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
45, PLACE ABEL GANCE
92100 BOULOGNE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 3400932722594 ou 327 225-9: 5 ml en ampoule (verre), boîte de 5.
· 3400931033677 ou 310 336-7: 5 ml en ampoule (verre), boîte de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
Date de première autorisation: 30 septembre 1992
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.