RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 05/03/2018
LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Comprimés roses (comprimés actifs) :
Chaque comprimé enrobé contient 100 microgrammes de lévonorgestrel et 20 microgrammes d’éthinylestradiol.
Excipients à effet notoire : chaque comprimé enrobé contient environ 48 mg de lactose monohydraté et 14 mg de saccharose.
Comprimés jaunes (comprimés placebo) :
Les comprimés enrobés jaunes ne contiennent pas de substances actives.
Excipients à effet notoire : chaque comprimé enrobé placebo contient environ 53 mg de lactose monohydraté et 14 mg de saccharose.
Pour la liste complète des excipients, voir rubrique 6.1.
Comprimés actifs :
Comprimé enrobé rose, rond, biconvexe, lisse sur les deux faces, d’un diamètre d’environ 5,6 mm.
Comprimés placebo :
Comprimé dragéifié jaune, rond, biconvexe, d’un diamètre d’environ 5,6 mm.
4.1. Indications thérapeutiques
La décision de prescrire LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé doit être prise en tenant compte des facteurs de risque de la patiente, notamment ses facteurs de risque de thrombo-embolie veineuse (TEV), ainsi que du risque de TEV associé à LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé en comparaison aux autres CHC (Contraceptifs Hormonaux Combinés) (voir rubriques 4.3 et 4.4).
4.2. Posologie et mode d'administration
Comment prendre LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé :
Les comprimés doivent être pris par voie orale dans l’ordre indiqué sur la plaquette à peu près à la même heure chaque jour, avec un peu de liquide si nécessaire.
Les comprimés doivent être pris chaque jour pendant 28 jours consécutifs. Chaque plaquette suivante doit être commencée le jour suivant la prise du dernier comprimé de la plaquette précédente. Une hémorragie de privation débute généralement 2 ou 3 jours après avoir commencé la rangée des comprimés placebo (dernière rangée) et il est possible qu'elle ne soit pas terminée au moment d'entamer la plaquette suivante.
Comment commencer LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé :
· Absence de contraception hormonale antérieure (le mois précédent)
La prise des comprimés doit débuter le premier jour du cycle naturel de la femme (= le premier jour des règles).
Elle peut éventuellement débuter entre le deuxième et le cinquième jour mais, dans ce cas, une méthode contraceptive mécanique supplémentaire est recommandée au cours des 7 premiers jours du premier cycle.
· Relais d'un autre contraceptif hormonal combiné (contraceptif oral combiné (COC), anneau vaginal, dispositif transdermique)
La femme doit commencer à prendre LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé le jour suivant la prise du dernier comprimé actif du COC précédent ou au plus tard le jour suivant la période habituelle sans comprimé ou le jour suivant le dernier comprimé placebo du COC précédent.
Dans le cas de l'anneau vaginal ou du dispositif transdermique, la femme doit commencer LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé le jour du retrait ou au plus tard le jour prévu pour l'application du nouveau dispositif ou du nouvel anneau.
· Relais d’une contraception progestative seule (pilule microdosée, forme injectable, implant) ou d’un système intra-utérin (SIU) contenant un progestatif
La femme peut débuter LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé à n'importe quel moment à partir d'une pilule microdosée (pour un implant ou un DIU, le jour de son retrait, pour un contraceptif injectable, le jour où l'injection suivante aurait dû avoir lieu), mais il convient dans tous les cas de lui conseiller d'utiliser une méthode contraceptive supplémentaire mécanique pendant les 7 premiers jours de la prise des comprimés.
· Après une interruption de grossesse du premier trimestre
La femme peut commencer à prendre les comprimés immédiatement. Dans ce cas, il ne sera pas nécessaire de prendre des mesures contraceptives complémentaires.
· Après un accouchement ou une interruption de grossesse du deuxième trimestre
Il sera conseillé aux femmes de ne commencer une contraception qu'après 21 à 28 jours après l’accouchement ou l’interruption de grossesse du deuxième trimestre. Si cette contraception est démarrée plus tardivement, une méthode de contraception mécanique complémentaire doit être utilisée pendant les 7 premiers jours de traitement. Cependant, si des rapports sexuels ont déjà eu lieu, il convient de s'assurer de l'absence de grossesse avant le début de la prise du contraceptif oral estroprogestatif ou d'attendre les premières règles.
En cas d'allaitement, voir rubrique 4.6.
Conduite à tenir en cas d'oubli d'un ou plusieurs comprimés :
Les sept derniers comprimés de la plaquette sont des comprimés placebo. L’oubli d’un de ces comprimés n’a pas d’effet sur l’efficacité de LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé.
Cependant, les comprimés oubliés doivent être jetés pour éviter toute prolongation non intentionnelle de la période sous placebo.
Les conseils suivants s’appliquent uniquement en cas d’oubli de comprimés actifs (les 21 premiers comprimés).
LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé contient une dose très faible des deux hormones et, en conséquence, la marge d’efficacité contraceptive est étroite si une pilule est omise.
Un retard de moins de 12 heures dans la prise d'un comprimé ne modifie pas l’efficacité contraceptive. La femme doit prendre le comprimé dès qu'elle y pense ; les comprimés restants seront pris comme d'habitude.
Si le retard est supérieur à 12 heures, la sécurité contraceptive peut être diminuée. En cas d'oubli de comprimés, les deux règles suivantes doivent être connues car nécessaires pour choisir la conduite à tenir :
1. L’intervalle entre 2 plaquettes de comprimés actifs ne doit jamais dépasser 7 jours ;
2. Sept jours de prise ininterrompue du traitement sont nécessaires afin d’obtenir une inhibition correcte de l'axe hypothalamo-hypophyso-ovarien.
En conséquence, les conseils suivants pourront être donnés dans le cadre de la pratique quotidienne.
Semaine 1
La femme prendra le dernier comprimé oublié dès qu’elle y pense, même si cela veut dire qu’elle doit prendre 2 comprimés en même temps. Elle continuera ensuite à prendre les comprimés suivants à l’heure habituelle. Elle devra aussi utiliser simultanément une contraception mécanique complémentaire (par exemple, un préservatif) pendant les 7 jours suivants. En cas de rapports sexuels au cours des 7 jours qui précèdent, la possibilité d’une grossesse doit être envisagée. Le risque de grossesse est d'autant plus élevé que le nombre de comprimés oubliés est important ou que la date de l'oubli est proche du début de la prise des comprimés placebo.
Semaine 2
La femme doit prendre le dernier comprimé oublié dès qu'elle s'en rend compte, même si cela implique de prendre deux comprimés en même temps. Elle continuera ensuite à prendre les comprimés suivants à l'heure habituelle. Si la femme a correctement pris ses comprimés au cours des 7 jours qui précèdent le premier comprimé oublié, aucune mesure contraceptive supplémentaire n'est nécessaire. Si elle n'a pas correctement pris ses comprimés ou si elle a oublié de prendre plusieurs comprimés, il faut recommander des précautions contraceptives supplémentaires pendant les 7 jours qui suivent.
Semaine 3
Le risque de moindre fiabilité contraceptive est important parce que l'on se rapproche de la période de 7 jours de prise des comprimés placebo. Toutefois, il est possible d’empêcher la réduction de l’efficacité contraceptive en modulant la prise de comprimés. Il ne sera donc pas nécessaire de prendre des mesures contraceptives complémentaires si l’on suit l’une des alternatives ci-dessous, à condition que tous les comprimés aient été pris correctement pendant les 7 jours qui précèdent le premier comprimé oublié. Toutefois, si cela n’est pas le cas, il sera recommandé à la femme de suivre la première des deux alternatives et d’utiliser simultanément une autre méthode de contraception pendant les 7 jours suivants.
1. La femme prendra le dernier comprimé oublié dès qu’elle y pense, même si cela veut dire qu’elle doit prendre 2 comprimés en même temps. Elle continuera ensuite à prendre les comprimés suivants à l’heure habituelle, jusqu’à avoir terminé les comprimés actifs de la plaquette. Les sept comprimés placebo ne doivent pas être pris. La plaquette suivante doit être commencée immédiatement après avoir pris le dernier comprimé actif. L’apparition d’une hémorragie de privation avant la fin des comprimés actifs de la deuxième plaquette est peu probable mais des spottings (gouttes ou taches de sang) ou des métrorragies sont possibles pendant la durée de prise des comprimés.
2. Il pourra aussi être conseillé à la femme d’arrêter de prendre les comprimés actifs de la plaquette en cours. Dans ce cas, elle devra prendre les comprimés placebo pendant 7 jours maximum, incluant le nombre de jours où elle a oublié de prendre les comprimés actifs, et elle commencera ensuite la plaquette suivante.
Si la femme a oublié plusieurs comprimés et ne présente pas d'hémorragie de privation pendant la phase d'arrêt sans comprimés, il convient d'envisager l'éventualité d'une grossesse.
Conseils en cas de troubles gastro-intestinaux
En cas de symptômes gastro-intestinaux sévères, une absorption incomplète des principes actifs est possible et des mesures contraceptives supplémentaires doivent donc être prises.
Si des vomissements ou une diarrhée sévère surviennent dans les 3 à 4 heures qui suivent la prise d'un comprimé, la femme doit appliquer les conseils donnés en cas d'oubli d'un comprimé. Si la femme ne veut pas changer son programme normal de comprimés, elle doit prendre les comprimés supplémentaires dans une autre plaquette. Si plus de 12 heures se sont écoulées, la femme doit appliquer les conseils donnés pour les comprimés oubliés tels que donnés dans la rubrique 4.2 « Conduite à tenir en cas d’oubli d’un ou plusieurs comprimés ». Si la femme ne veut pas changer son programme normal de comprimés, elle doit prendre les comprimés supplémentaires dans une autre plaquette.
En cas de symptômes gastro-intestinaux persistants ou récurrents, des mesures contraceptives supplémentaires doivent être prises et le médecin doit en être informé.
Comment changer le premier jour ou retarder les règles
Pour retarder la survenue des règles, la femme doit commencer une nouvelle plaquette de LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé immédiatement après avoir terminé les comprimés actifs de la plaquette précédente, sans interruption. Les règles peuvent être retardées aussi longtemps qu'on le souhaite, mais jamais au-delà de la fin de la seconde plaquette. Au cours de cette période, la femme peut présenter des métrorragies ou des spottings. LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé peut ensuite être repris de façon régulière après la période habituelle de 7 jours de comprimés placebo.
Si la femme veut modifier le premier jour de ses règles pour un autre jour de la semaine, on peut conseiller à la femme de raccourcir la prochaine période de comprimés placebo du nombre de jours souhaités. Plus on raccourcit la phase de placebo, plus le risque d'absence d'hémorragie de privation augmente et plus la femme risque de présenter une métrorragie ou un spotting pendant l'utilisation de la plaquette suivante (exactement comme lorsque l'on cherche à retarder les règles).
Population pédiatrique
LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé est seulement indiqué après l’apparition des premières règles.
Personnes âgées
LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé n’est pas indiqué après la ménopause.
Insuffisance hépatique
LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé est contre-indiqué chez les femmes ayant des maladies sévères du foie. Voir également la rubrique 4.3.
Insuffisance rénale
LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé n’a pas été spécifiquement étudié chez les patients insuffisants rénaux. Les données disponibles ne suggèrent pas un changement de traitement dans cette population.
Mode d’administration
Voie orale.
Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
Les contraceptifs hormonaux de type combiné (CHC) ne doivent pas être utilisés dans les conditions suivantes. En cas d'apparition d'une des affections suivantes pour la première fois pendant la prise d'un contraceptif hormonal de type combiné, l'utilisation du médicament doit cesser immédiatement.
Présence ou risque de thrombo-embolie veineuse (TEV) :
· Thrombo-embolie veineuse – présence de TEV (patiente traitée par des anticoagulants) ou antécédents de TEV (p. ex. thrombose veineuse profonde [TVP] ou embolie pulmonaire [EP]) ;
· Prédisposition connue, héréditaire ou acquise, à la thrombo-embolie veineuse, telle qu’une résistance à la protéine C activée (PCa) (y compris une mutation du facteur V de Leiden), un déficit en antithrombine III, un déficit en protéine C, un déficit en protéine S ;
· Intervention chirurgicale majeure avec immobilisation prolongée (voir rubrique 4.4) ;
· Risque élevé de thrombo-embolie veineuse dû à la présence de multiples facteurs de risque (voir rubrique 4.4).
Présence ou risque de thrombo-embolie artérielle (TEA) :
· Thrombo-embolie artérielle – présence ou antécédents de thrombo-embolie artérielle (p. ex. infarctus du myocarde [IM]) ou de prodromes (p. ex. angine de poitrine) ;
· Affection cérébrovasculaire – présence ou antécédents d’accident vasculaire cérébral (AVC) ou de prodromes (p. ex. accident ischémique transitoire [AIT]) ;
· Prédisposition connue, héréditaire ou acquise, à la thrombo-embolie artérielle, telle qu’une hyperhomocystéinémie ou la présence d’anticorps antiphospholipides (anticorps anticardiolipine, anticoagulant lupique) ;
· Antécédents de migraine avec signes neurologiques focaux ;
· Risque élevé de thrombo-embolie artérielle dû à la présence de multiples facteurs de risque (voir rubrique 4.4) ou d’un facteur de risque sévère tel que :
o diabète avec symptômes vasculaires,
o hypertension artérielle sévère,
o dyslipoprotéinémie sévère ;
· Affection hépatique sévère ou antécédent d'affection hépatique sévère, en l'absence de normalisation des tests fonctionnels hépatiques ;
· Présence ou antécédents de tumeur hépatique, bénigne ou maligne ;
· Tumeur maligne hormono-dépendante, diagnostiquée ou suspectée (par exemple, des organes génitaux ou des seins) ;
· Hémorragie vaginale non diagnostiquée ;
· Aménorrhée d'étiologie inconnue.
LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé est contre-indiqué pour l’utilisation concomitante avec les médicaments contenant de l’ombitasvir/paritaprévir/ritonavir et du dasabuvir, (voir rubrique 4.4 et rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
En présence de l'une des pathologies ou de l'un des facteurs de risque mentionnés ci-dessous, les bénéfices liés à l'utilisation de LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé doivent faire l'objet d'une discussion avec la femme.
Si l'une de ces pathologies ou l'un de ces facteurs de risque s'aggrave ou apparaît pour la première fois, la patiente doit prendre contact avec son médecin, qui décidera alors s'il convient de cesser ou non d'utiliser LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé.
Troubles vasculaires
Risque de thrombo-embolie veineuse (TEV)
Le risque de TEV est augmenté chez les femmes qui utilisent un contraceptif hormonal combiné (CHC) en comparaison aux femmes qui n’en utilisent pas. Les produits qui contiennent du lévonorgestrel (y compris LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé), du norgestimate ou de la noréthistérone sont associés au risque le plus faible de TEV. La décision d’utiliser LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé doit être prise uniquement après concertation avec la patiente afin de s’assurer qu’elle comprend le risque de TEV associé à LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé, l’influence de ses facteurs de risque actuels sur ce risque et le fait que le risque de TEV est maximal pendant la première année d’utilisation. Certaines données indiquent également une augmentation du risque lors de la reprise d’un CHC après une interruption de 4 semaines ou plus.
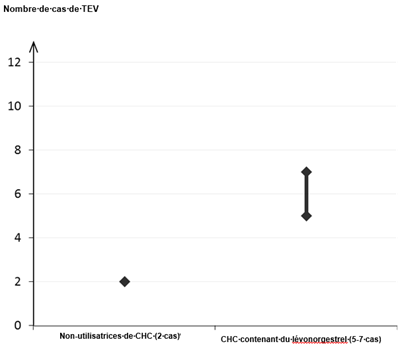
Parmi les femmes qui n’utilisent pas de CHC et qui ne sont pas enceintes, environ 2 sur 10 000 développeront une TEV sur une période d’un an. Cependant, chez une femme donnée, le risque peut être considérablement plus élevé, selon les facteurs de risque qu’elle présente (voir ci-dessous).
On estime que sur 10 000 femmes qui utilisent un CHC contenant du lévonorgestrel, environ 6[1] développeront une TEV sur une période d’un an.
(1)Point central de l’intervalle de 5-7 pour 10 000 années-femmes sur la base d’un risque relatif, pour les CHC contenant du lévonorgestrel par rapport à la non-utilisation d’un CHC, d’environ 2,3 à 3,6
Ce nombre de TEV par année est inférieur à celui attendu pendant la grossesse ou en période post-partum.
La TEV peut être fatale dans 1 à 2 % des cas.
Nombre de cas de TEV pour 10 000 femmes sur une période d’un an

De façon extrêmement rare, des cas de thrombose ont été signalés chez des utilisatrices de CHC dans d’autres vaisseaux sanguins (p. ex. les veines et artères hépatiques, mésentériques, rénales ou rétiniennes).
Facteurs de risque de TEV
Le risque de complications thrombo-emboliques veineuses chez les utilisatrices de CHC peut être considérablement accru si d’autres facteurs de risque sont présents, en particulier si ceux-ci sont multiples (voir le tableau ci-dessous).
LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé est contre-indiqué chez les femmes présentant de multiples facteurs de risque, ceux-ci les exposant à un risque élevé de thrombose veineuse (voir rubrique 4.3). Lorsqu’une femme présente plus d’un facteur de risque, il est possible que l’augmentation du risque soit supérieure à la somme des risques associés à chaque facteur pris individuellement – dans ce cas, son risque global de TEV doit être pris en compte. Si le rapport bénéfice/risque est jugé défavorable, le CHC ne doit pas être prescrit (voir rubrique 4.3).
Tableau : Facteurs de risque de TEV
|
Facteur de risque |
Commentaire |
|
Obésité (indice de masse corporelle supérieur à 30 kg/m²) |
L’élévation de l’IMC augmente considérablement le risque. Cela est particulièrement important à prendre en compte si d’autres facteurs de risque sont présents. |
|
Immobilisation prolongée, intervention chirurgicale majeure, toute intervention chirurgicale sur les jambes ou le bassin, neurochirurgie ou traumatisme majeur Remarque : l’immobilisation temporaire, y compris les trajets aériens >4 heures, peut également constituer un facteur de risque de TEV, en particulier chez les femmes présentant d’autres facteurs de risque |
Dans ces situations, il est conseillé de suspendre l’utilisation de la pilule (au moins quatre semaines à l’avance en cas de chirurgie programmée) et de ne reprendre le CHC que deux semaines au moins après la complète remobilisation. Une autre méthode de contraception doit être utilisée afin d’éviter une grossesse non désirée. Un traitement antithrombotique devra être envisagé si LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé n’a pas été interrompu à l’avance. |
|
Antécédents familiaux (thrombo-embolie veineuse survenue dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, c.-à-d. avant 50 ans) |
En cas de prédisposition héréditaire suspectée, la femme devra être adressée à un spécialiste pour avis avant toute décision concernant l’utilisation de CHC |
|
Autres affections médicales associées à la TEV |
Cancer, lupus érythémateux disséminé, syndrome hémolytique et urémique, maladies inflammatoires chroniques intestinales (maladie de Crohn ou rectocolite hémorragique) et drépanocytose |
|
Âge |
En particulier au-delà de 35 ans |
Il n’existe aucun consensus quant au rôle éventuel joué par les varices et les thrombophlébites superficielles dans l’apparition ou la progression d’une thrombose veineuse.
L’augmentation du risque de thrombo-embolie pendant la grossesse, et en particulier pendant les 6 semaines de la période puerpérale, doit être prise en compte (pour des informations concernant « Fertilité, grossesse et allaitement », voir rubrique 4.6).
Symptômes de TEV (thrombose veineuse profonde et embolie pulmonaire)
Les femmes doivent être informées qu’en cas d’apparition de ces symptômes, elles doivent consulter un médecin en urgence et lui indiquer qu’elles utilisent un CHC.
Les symptômes de la thrombose veineuse profonde (TVP) peuvent inclure :
· gonflement unilatéral d’une jambe et/ou d’un pied ou le long d’une veine de la jambe ;
· douleur ou sensibilité dans une jambe pouvant n’être ressentie qu’en position debout ou lors de la marche ;
· sensation de chaleur, rougeur ou changement de la coloration cutanée de la jambe affectée.
Les symptômes de l’embolie pulmonaire (EP) peuvent inclure :
· apparition soudaine et inexpliquée d’un essoufflement ou d’une accélération de la respiration ;
· toux soudaine pouvant être associée à une hémoptysie ;
· douleur thoracique aiguë ;
· étourdissements ou sensations vertigineuses sévères ;
· battements cardiaques rapides ou irréguliers.
Certains de ces symptômes (p. ex. « essoufflement », « toux ») ne sont pas spécifiques et peuvent être interprétés à tort comme des signes d’événements plus fréquents ou moins graves (p. ex., infections respiratoires).
Les autres signes d’une occlusion vasculaire peuvent inclure : douleur soudaine, gonflement et coloration légèrement bleutée d’une extrémité.
Si l’occlusion se produit dans l’œil, les symptômes peuvent débuter sous la forme d’une vision trouble indolore pouvant évoluer vers une perte de la vision. Dans certains cas, la perte de la vision peut survenir presque immédiatement.
Risque de thrombo-embolie artérielle (TEA)
Des études épidémiologiques ont montré une association entre l’utilisation de CHC et l’augmentation du risque de thrombo-embolie artérielle (infarctus du myocarde) ou d’accident cérébrovasculaire (p. ex., accident ischémique transitoire, AVC). Les événements thrombo-emboliques artériels peuvent être fatals.
Facteurs de risque de TEA
Le risque de complications thrombo-emboliques artérielles ou d’accident cérébrovasculaire chez les utilisatrices de CHC augmente avec la présence de facteurs de risque (voir le tableau). LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé est contre-indiqué chez les femmes présentant un facteur de risque sévère ou de multiples facteurs de risque de TEA qui les exposent à un risque élevé de thrombose artérielle (voir rubrique 4.3). Lorsqu’une femme présente plus d’un facteur de risque, il est possible que l’augmentation du risque soit supérieure à la somme des risques associés à chaque facteur pris individuellement – dans ce cas, le risque global doit être pris en compte. Si le rapport bénéfice/risque est jugé défavorable, le CHC ne doit pas être prescrit (voir rubrique 4.3).
Tableau : Facteurs de risque de TEA
|
Facteur de risque |
Commentaire |
|
Âge |
En particulier au-delà de 35 ans |
|
Tabagisme |
Il doit être conseillé aux femmes de ne pas fumer si elles souhaitent utiliser un CHC. Il doit être fortement conseillé aux femmes de plus de 35 ans qui continuent de fumer d’utiliser une méthode de contraception différente. |
|
Hypertension artérielle |
|
|
Obésité (indice de masse corporelle supérieur à 30 kg/m2) |
L’élévation de l’IMC augmente considérablement le risque.
Cela est particulièrement important à prendre en compte chez les femmes présentant d’autres facteurs de risque. |
|
Antécédents familiaux (thrombo-embolie artérielle survenue dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, c.-à-d. avant 50 ans). |
En cas de prédisposition héréditaire suspectée, la femme devra être adressée à un spécialiste pour avis avant toute décision concernant l’utilisation de CHC. |
|
Migraine |
L’accroissement de la fréquence ou de la sévérité des migraines lors de l’utilisation d’un CHC (qui peut être le prodrome d’un événement cérébrovasculaire) peut constituer un motif d’arrêt immédiat du CHC. |
|
Autres affections médicales associées à des événements indésirables vasculaires. |
Diabète, hyperhomocystéinémie, valvulopathie cardiaque et fibrillation auriculaire, dyslipoprotéinémie et lupus érythémateux disséminé |
Symptômes de TEA
Les femmes doivent être informées qu’en cas d’apparition de ces symptômes, elles doivent consulter un médecin en urgence et lui indiquer qu’elles utilisent un CHC.
Les symptômes d’un accident cérébrovasculaire peuvent inclure :
· apparition soudaine d’un engourdissement ou d’une faiblesse du visage, d’un bras ou d’une jambe, en particulier d’un côté du corps ;
· apparition soudaine de difficultés à marcher, de sensations vertigineuses, d’une perte d’équilibre ou de coordination ;
· apparition soudaine d’une confusion, de difficultés à parler ou à comprendre ;
· apparition soudaine de difficultés à voir d’un œil ou des deux yeux ;
· céphalée soudaine, sévère ou prolongée, sans cause connue ;
· perte de conscience ou évanouissement avec ou sans crise convulsive.
Des symptômes temporaires suggèrent qu’il s’agit d’un accident ischémique transitoire (AIT).
Les symptômes de l’infarctus du myocarde (IM) peuvent inclure :
· douleur, gêne, pression, lourdeur, sensation d’oppression ou d’encombrement dans la poitrine, le bras ou sous le sternum ;
· sensation de gêne irradiant vers le dos, la mâchoire, la gorge, le bras, l’estomac ;
· sensation d’encombrement, d’indigestion ou de suffocation ;
· transpiration, nausées, vomissements ou sensations vertigineuses ;
· faiblesse, anxiété ou essoufflement extrêmes ;
· battements cardiaques rapides ou irréguliers.
Une autre méthode de contraception appropriée doit être instaurée, en raison du potentiel tératogène du traitement anticoagulant (dérivés coumariniques).
o Tumeurs
Un risque accru de cancer du col utérin chez les utilisatrices de COC à long terme a été signalé dans certaines études épidémiologiques, mais on continue à se demander dans quelle mesure cette observation ne serait pas imputable à un biais lié au comportement sexuel et à d'autres facteurs tels que le papillomavirus humain (HPV).
Une méta-analyse de 54 études épidémiologiques a démontré une légère augmentation du risque relatif (RR = 1,24) de cancer du sein chez les femmes utilisant des COC. Cette augmentation du risque disparaît progressivement dans les dix années qui suivent l'arrêt de l'utilisation du COC. Le cancer du sein étant rare chez les femmes de moins de 40 ans, le nombre supérieur de cancers diagnostiqués chez les utilisatrices actuelles ou récentes de COC est faible par rapport au risque global de cancer du sein. Ces études n'apportent aucun élément en faveur d'une relation de causalité. Cette augmentation du risque pourrait être due à un diagnostic plus précoce du cancer du sein chez les utilisatrices de COC, aux effets biologiques de ces contraceptifs ou à une association des deux. Les cancers du sein diagnostiqués chez les utilisatrices de COC ont également tendance à être cliniquement moins avancés que ceux enregistrés chez des patientes n'ayant jamais utilisé de COC.
Quelques rares cas de tumeurs hépatiques bénignes et, encore plus rarement, de tumeurs hépatiques malignes chez les utilisatrices de COC ont été rapportés. Dans quelques cas isolés, ces tumeurs se sont manifestées par des hémorragies intra-abdominales menaçant le pronostic vital. Le diagnostic différentiel doit envisager une tumeur hépatique en cas de douleurs sévères de la partie supérieure de l'abdomen, d'augmentation de volume du foie ou de signes d'hémorragie intra-abdominale chez des patientes sous COC.
o Autres pathologies
Les femmes atteintes d'hypertriglycéridémie ou présentant des antécédents familiaux d'hypertriglycéridémie courent un risque accru de pancréatite lors de l'utilisation de COC.
Augmentations de l’ALAT
Pendant les essais cliniques avec des patients traités pour les infections par le virus de l’hépatite C (VHC) avec les médicaments contenant de l’ombitasvir/ritonavir et du dasabuvir avec ou sans ribavirine, des augmentations des transaminases (ALAT) supérieures à 5 fois la limite supérieure de la normale (LSN) survenaient significativement moins fréquemment chez les femmes utilisant des médicaments contenant de l’éthinylestradiol tels que les contraceptifs hormonaux combinés (CHC) (voir rubriques 4.3 et 4.5).
Bien que de faibles augmentations de la tension artérielle aient été décrites chez un grand nombre de femmes utilisant des COC, les élévations cliniquement significatives sont rares. L'arrêt immédiat des COC n'est justifié que dans ces rares cas. Aucune relation systématique n'a été établie entre l'emploi de COC et une hypertension artérielle clinique.
Toutefois, si l'utilisation de COC chez des femmes hypertendues s'accompagne de valeurs constamment élevées de la pression artérielle ou d'une augmentation significative des chiffres tensionnels ne répondant pas au traitement antihypertenseur, il convient d'arrêter les COC. Le cas échéant, le COC pourra être repris après normalisation des valeurs tensionnelles sous traitement antihypertenseur.
L'apparition ou une aggravation des pathologies suivantes a été décrite tant pendant la grossesse que lors de l'utilisation de COC, sans qu'une corrélation avec ces derniers n'ait été mise en évidence : ictère et/ou prurit associés à une cholestase, lithiases biliaires, porphyrie, lupus érythémateux disséminé, syndrome hémolytico-urémique, chorée de Sydenham, herpès gravidique, hypoacousie par otosclérose, états dépressifs.
Chez les femmes présentant un angioœdème héréditaire, les œstrogènes exogènes peuvent induire ou aggraver des symptômes d'angioœdème.
Des troubles aigus ou chroniques de la fonction hépatique peuvent nécessiter l'abandon de l'utilisation des COC jusqu'à normalisation des paramètres de la fonction hépatique. Une récidive d'un ictère et/ou d'un prurit cholestatique survenu précédemment pendant la grossesse ou lors de l'utilisation antérieure de stéroïdes sexuels nécessite l'abandon des COC.
Bien que les COC soient susceptibles d'exercer un effet sur la résistance périphérique à l'insuline et sur la tolérance au glucose, on ne dispose d'aucune indication de la nécessité de modifier le traitement chez les diabétiques utilisant des contraceptifs oraux combinés faiblement dosés (contenant < 0,05 mg d’éthinylestradiol). Les patientes diabétiques doivent cependant faire l'objet d'un suivi attentif lorsqu'elles utilisent des COC, en particulier lors de l'instauration.
Une aggravation d'une dépression endogène, d'une comitialité, d'une maladie de Crohn et d'une rectocolite hémorragique a été décrite lors de l'utilisation de COC.
Un chloasma peut survenir occasionnellement, en particulier chez les femmes ayant des antécédents de chloasma gravidique. Les femmes qui ont une tendance à cette affection doivent éviter l'exposition au soleil ou aux rayons ultraviolets lorsqu'elles prennent des COC.
Consultation/examen médical
Avant l’instauration ou la reprise d’un traitement par LOLISTREL CONTINU 100 microgrammes/20 microgrammes, comprimé enrobé, une recherche complète des antécédents médicaux (y compris les antécédents familiaux) doit être effectuée et la présence d’une grossesse doit être exclue. La pression artérielle doit être mesurée et un examen physique doit être réalisé, en ayant à l’esprit les contre-indications (voir rubrique 4.3) et les mises en garde (voir rubrique 4.4). Il est important d’attirer l’attention des patientes sur les informations relatives à la thrombose veineuse et artérielle, y compris le risque associé à LOLISTREL CONTINU 100 microgrammes/20 microgrammes, comprimé enrobé comparé à celui associé aux autres CHC, les symptômes de la TEV et de la TEA, les facteurs de risque connus et la conduite à tenir en cas de suspicion de thrombose.
Il doit également être indiqué aux patientes de lire attentivement la notice et de suivre les conseils fournis. La fréquence et la nature des examens doivent être définies sur la base des recommandations en vigueur et adaptées à chaque patiente.
Les patientes doivent être averties que les contraceptifs hormonaux ne protègent pas contre l’infection par le VIH (SIDA) et les autres maladies sexuellement transmissibles.
Réduction d'efficacité
L'efficacité des COC peut être diminuée, par exemple, en cas d'oubli de comprimés actifs (voir rubrique 4.2), de vomissements, de diarrhées ou de l'utilisation concomitante d'autres médicaments (voir rubrique 4.5).
Altération du contrôle du cycle menstruel
Des hémorragies vaginales irrégulières (spottings ou métrorragies) peuvent survenir sous COC, en particulier au cours des premiers mois d'utilisation. Par conséquent, la recherche des causes d'hémorragies irrégulières ne se justifie qu'après une période d'adaptation d'environ trois cycles. Plus de 50 % des utilisatrices de LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé ont signalé des saignements (spottings et/ou métrorragies) au cours des 6 premiers mois de traitement.
Si les saignements irréguliers persistent ou se produisent après des cycles jusque-là réguliers, une cause extra-hormonale doit alors être recherchée et des examens diagnostiques appropriés pratiqués afin d'exclure une tumeur maligne ou une grossesse. Ces examens peuvent comporter un curetage.
Chez certaines femmes, il arrive qu'aucune hémorragie de privation ne se produise au cours de l'intervalle sans comprimés actifs. Si le COC a été pris conformément aux directives figurant à la rubrique 4.2, il est peu probable que la femme soit enceinte. Par contre, si le COC n'a pas été pris conformément aux directives avant la première absence d'hémorragie de privation ou si deux hémorragies de privation successives ne se produisent pas, il convient d'exclure une grossesse avant de poursuivre l'utilisation du COC.
Tests de laboratoire
L'utilisation de stéroïdes contraceptifs peut influencer les résultats de certains tests de laboratoire, notamment les paramètres biochimiques du foie, de la thyroïde, des glandes surrénales et de la fonction rénale, les taux plasmatiques de protéines (porteuses) (comme la globuline liant les corticoïdes et fractions lipidiques/lipoprotéiques), les paramètres du métabolisme des hydrates de carbone et des paramètres de la coagulation sanguine et de la fibrinolyse. Les modifications restent en général dans les limites de la normale.
LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé contient du lactose et du saccharose
Les comprimés actifs roses contiennent environ 48 mg de lactose et 14 mg de saccharose par comprimé. Les comprimés placebo jaunes contiennent environ 53 mg de lactose et 14 mg de saccharose par comprimé. Les patientes présentant une intolérance au fructose ou au galactose, un syndrome de malabsorption du glucose et du galactose ou un déficit en sucrase/isomaltase (maladies héréditaires rares) ne doivent pas prendre ce médicament.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Effets d'autres médicaments sur LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé
Des interactions peuvent se produire avec des médicaments qui induisent les enzymes microsomales pouvant entraîner une augmentation de la clairance des hormones sexuelles et conduire à la survenue de saignements et/ou à l'échec de la contraception.
Conduite à tenir
L'induction enzymatique peut déjà être observée après quelques jours de traitement. L'induction enzymatique est maximale généralement quelques semaines après le début de la prise. Après la cessation de la thérapie médicamenteuse, l’induction enzymatique peut être maintenue pendant environ 4 semaines.
Traitement à court terme
Les femmes traitées avec des médicaments inducteurs enzymatiques doivent utiliser temporairement une méthode barrière ou une autre méthode de contraception en plus du COC. La méthode barrière doit être utilisée pendant toute la durée du traitement médicamenteux concomitant et pendant 28 jours après son arrêt. Si le traitement médicamenteux va au-delà de la fin des comprimés actifs dans la boîte de COC, les comprimés placebo doivent être jetés et la prochaine boîte de COC doit être démarrée juste après la précédente.
Traitement à long terme
Chez les femmes ayant un traitement à long terme avec des substances actives inductrices enzymatiques au niveau hépatique, une autre méthode de contraception fiable non hormonale est recommandée.
Absorption réduite : les médicaments qui augmentent la motilité gastro-intestinale, comme le métoclopramide, peuvent réduire l’absorption hormonale.
Substances augmentant la clairance du COC (efficacité diminuée du COC par induction enzymatique), par exemple :
Les barbituriques, le bosentan, la carbamazépine, la phénytoïne, la primidone, la rifampicine et les médicaments contre le VIH tels que le ritonavir, la névirapine et l'éfavirenz et peut-être aussi le felbamate, la griséofulvine, l'oxcarbazépine, le topiramate et des produits à base de la plante millepertuis (Hypericum perforatum).
Substances ayant des effets variables sur la clairance du COC :
En cas de co-administration avec les COC, de nombreuses combinaisons d'inhibiteurs de la protéase du VIH et des inhibiteurs non nucléosidiques de la transcriptase inverse, y compris des combinaisons avec des inhibiteurs de VHC, peuvent augmenter ou diminuer les concentrations plasmatiques d'œstrogènes ou progestatifs. L'effet net de ces changements peut être cliniquement pertinent dans certains cas.
Par conséquent, les informations de prescription de médicaments concomitants VIH/VHC doivent être consultées pour identifier les interactions potentielles et les recommandations connexes. En cas de doute, une méthode contraceptive de barrière supplémentaire devrait être utilisée par les femmes sous inhibiteurs de la protéase ou les inhibiteurs non nucléosidiques de la transcriptase inverse.
Substances diminuant la clairance des COC (inhibiteurs enzymatiques) :
La pertinence clinique des interactions potentielles avec les inhibiteurs enzymatiques reste inconnue.
L'administration concomitante d'inhibiteurs puissants du CYP3A4 peut augmenter les concentrations plasmatiques de l'œstrogène ou de la progestérone, ou les deux.
On a montré que des doses d’étoricoxib de 60 à 120 mg/jour peuvent augmenter les concentrations plasmatiques de l'éthinylestradiol respectivement de 1,4 à 1,6 fois, lorsqu'il est pris en association avec un contraceptif hormonal combiné contenant 0,035 mg d'éthinylestradiol.
Interactions pharmacodynamiques
L’utilisation concomitante avec les médicaments contenant de l’ombitasvir/paritaprévir/ritonavir et du dasabuvir, avec ou sans ribavirine, peut augmenter le risque d’élévation de l’ALAT (voir rubriques 4.3 et 4.4). En conséquence, les utilisatrices de LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé doivent passer à une autre méthode de contraception (p. ex., contraception uniquement avec de la progestérone ou méthodes non hormonales) avant de commencer le traitement avec ce schéma posologique combiné. LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé peut être réintroduit 2 semaines après la fin du traitement avec ce schéma posologique combiné.
Effets des COC sur d’autres médicaments
La troléandomycine peut augmenter le risque de cholestase intrahépatique lors de l'administration concomitante de contraceptifs oraux œstroprogestatifs.
Les COC peuvent affecter le métabolisme d’autres médicaments. Une augmentation des concentrations plasmatiques de ciclosporine a été rapportée en association avec les COC. Il a été démontré que les COC induisent le métabolisme de la lamotrigine provoquant des concentrations plasmatiques de lamotrigine inférieures aux concentrations thérapeutiques.
Des données cliniques suggèrent que l’éthinylestradiol inhibe la clairance des substrats du CYP1A2 provoquant une augmentation légère (par exemple, théophylline) ou modérée (par exemple, tizanidine) de leur concentration plasmatique.
4.6. Fertilité, grossesse et allaitement
Grossesse
LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé n’est pas indiqué pendant la grossesse.
En cas de découverte d’une grossesse pendant la prise de LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé, son utilisation devra être immédiatement interrompue.
Néanmoins, la plupart des études épidémiologiques n'ont révélé ni risque accru d'anomalies congénitales chez les enfants nés de mères ayant utilisé des contraceptifs oraux combinés juste avant leur grossesse, ni effets tératogènes lorsque des contraceptifs oraux combinés avaient été pris par erreur au début de la grossesse.
Une augmentation du risque de TEV pendant le post-partum est à prendre en considération lors de la reprise de LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé (voir rubriques 4.2 et 4.4).
L'allaitement peut être influencé par les contraceptifs oraux combinés car ils sont susceptibles de réduire la quantité de lait maternel et d'en modifier la composition.
Par conséquent, l'utilisation de contraceptifs oraux combinés est généralement déconseillée aussi longtemps que la mère continue à allaiter. De faibles quantités de stéroïdes contraceptifs et/ou de leurs métabolites peuvent passer dans le lait maternel. Ces quantités peuvent affecter le nourrisson.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Les effets indésirables les plus fréquents associés à l'utilisation de LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé sont les nausées, douleurs abdominales, prise de poids, céphalées, humeur dépressive, troubles de l’humeur, tension mammaire, douleurs mammaires. Ils ont été rapportés chez ≥1 % à <10 % des utilisatrices.
Les effets indésirables graves sont les thrombo-embolies veineuse et artérielle.
Tableau des effets indésirables
Les effets indésirables sont regroupés selon leur fréquence.
Les fréquences sont définies de la façon suivante :
Fréquent ≥1/100, <1/10
Peu fréquent ≥1/1 000, <1/100
Rare ≥1/10 000, <1/1 000
Les effets indésirables rapportés chez les utilisatrices de contraceptifs hormonaux combinés dont LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé sont :
|
Classe de |
Fréquent |
Peu fréquent |
Rare |
|
Affections du système immunitaire |
|
|
Hypersensibilité |
|
Troubles du métabolisme et de la nutrition |
|
Rétention hydrique |
|
|
Affections psychiatriques |
Humeur dépressive, troubles de l'humeur |
Diminution de la libido |
Augmentation de la libido |
|
Affections du système nerveux |
Céphalées |
Migraine |
|
|
Affections oculaires |
Intolérance aux lentilles de contact |
||
|
Affections vasculaires |
|
|
Thrombo-embolie veineuse (TEV), thrombo-embolie artérielle (TEA) |
|
Affections gastro-intestinales |
Nausées, douleurs abdominales |
Vomissements, diarrhée |
|
|
Affections de la peau et du tissu sous-cutané |
|
Rash, urticaire |
Érythème nodulaire, érythème polyforme |
|
Troubles du système reproducteur et des seins |
Tension mammaire et douleurs mammaires |
Augmentation du volume des seins |
Écoulement mammaire, perte vaginale |
|
Investigations |
Prise de poids |
Perte de poids |
*Le terme MedDRA le plus approprié (version 12.0) est listé pour décrire certains effets indésirables. Les synonymes ou les affections s'y rapportant ne sont pas listés mais doivent également être pris en considération.
Description de certains effets indésirables particuliers
Une augmentation du risque d'événements thrombotiques et thrombo-emboliques artériels et veineux, incluant l’infarctus du myocarde, l’AVC, les accidents ischémiques transitoires, la thrombose veineuse et l’embolie pulmonaire, a été observée chez les femmes utilisant des CHC ; ceci est abordé plus en détail dans la rubrique 4.4.
Des effets indésirables avec une très basse fréquence ou une apparition retardée des symptômes, considérés comme étant liés au groupe des contraceptifs oraux combinés sont listés ci-dessous (voir aussi rubriques 4.3 et 4.4) :
Tumeurs
· La fréquence de diagnostic de cancer du sein est très légèrement augmentée chez les utilisatrices de COC. Le cancer du sein étant rare chez les femmes de moins de 40 ans, ce nombre supérieur de cas diagnostiqués est faible par rapport au risque global de cancer du sein. On ne sait pas s'il existe une relation de causalité avec les COC. Pour plus d'informations, se reporter aux rubriques 4.3 et 4.4.
· Tumeurs hépatiques (bénignes et malignes).
Autres pathologies
· Augmentation du risque de pancréatite chez les femmes présentant une hypertriglycéridémie.
· Hypertension.
· Survenue ou aggravation de pathologies pour lesquelles l'imputabilité des contraceptifs oraux combinés n'a pas été établie : ictère et/ou prurit associés à une cholestase, lithiases biliaires, porphyrie, lupus érythémateux disséminé, syndrome hémolytico-urémique, chorée de Sydenham, herpès gravidique, hypoacousie par otosclérose.
· Survenue ou aggravation des symptômes d'angioœdème par les œstrogènes chez les femmes présentant un angioœdème héréditaire.
· Troubles de la fonction hépatique.
· Modification de la tolérance au glucose ou effet sur la résistante périphérique à l’insuline.
· Maladie de Crohn, rectocolite hémorragique.
· Chloasma.
Interactions
Une hémorragie de privation et/ou un échec de la contraception peuvent résulter de l’interaction d’autres médicaments (inducteurs enzymatiques) avec les contraceptifs oraux (voir rubrique 4.5).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
Il n'existe aucun rapport d'effets indésirables graves associés à un surdosage. Les symptômes susceptibles d'être associés à un surdosage sont des nausées, des vomissements et, chez les jeunes filles, une légère hémorragie vaginale. Il n'existe pas d'antidote et le traitement est symptomatique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
L'effet contraceptif d'une COC repose sur l'interaction de divers facteurs. Les plus importants sont une inhibition de l'ovulation et des modifications du mucus cervical.
Des essais cliniques ont été réalisés chez un total de 2 498 femmes âgées de 18 à 40 ans. L’indice de Pearl calculé sur la base de ces essais était d’environ 0,69 (intervalle de confiance à 95 % : 0,30 – 1,36) sur un total de 15 026 cycles de traitement.
Les contraceptifs oraux combinés, lorsqu’ils sont pris correctement, ont un taux d’échec d’environ 1 % par an. Le taux d’échec peut augmenter lorsque les pilules sont oubliées ou prises de manière incorrecte.
5.2. Propriétés pharmacocinétiques
Absorption
Après administration orale, le lévonorgestrel est absorbé rapidement et complètement. Des concentrations sériques maximales de l'ordre de 2,3 ng/ml sont atteintes environ 1,3 heure après la prise d'un comprimé de LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé. La biodisponibilité est proche de 100 %.
Distribution
Le lévonorgestrel est lié à l'albumine sérique et à la globuline de liaison des hormones sexuelles (SHBG). Seulement 1,1 % de la concentration sérique totale du médicament se trouve sous forme de stéroïde libre, environ 65 % sont spécifiquement liés à la SHBG et environ 35 % sont liés de façon non spécifique à l'albumine. L'augmentation de la concentration de SHBG induite par l'éthinylestradiol influence la distribution relative du lévonorgestrel dans les différentes fractions protéiques. L'induction de la protéine de liaison entraîne une augmentation de la fraction liée à la SHBG et une réduction de la fraction liée à l'albumine. Le volume de distribution apparent du lévonorgestrel est de 129 l après une dose unique.
Biotransformation
Le lévonorgestrel (LNG) est fortement métabolisé. Les principales voies métaboliques sont la réduction du groupe Δ4-3-oxo et des hydroxylations en positions 2a, 1b et 16b, suivie par la conjugaison. De plus, le CYP3A4 est impliqué dans le métabolisme oxydatif du LNG. Néanmoins, des données in vitro suggèrent que cette voie métabolique est moins pertinente que la réduction et la conjugaison.
Sa clairance métabolique du sérum est de l'ordre de 1,0 ml/min/kg.
Élimination
La concentration sérique de lévonorgestrel diminue selon deux phases. La phase terminale se caractérise par une demi-vie d'environ 25 heures.
Le lévonorgestrel n'est pas excrété sous forme non modifiée. Ses métabolites sont excrétés selon un rapport voie urinaire - voie biliaire (fèces) voisin de 1:1. La demi-vie d'excrétion des métabolites est d'environ 1 jour.
État d'équilibre
Lors d'une utilisation continue de LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé, les concentrations sériques de lévonorgestrel sont quasiment multipliées par trois, pour atteindre un état d'équilibre au cours de la seconde moitié du cycle de traitement. Les paramètres pharmacocinétiques du lévonorgestrel sont influencés par le taux sérique de SHBG, qui augmente d'un facteur 1,5 à 1,6 lors de l'utilisation d'œstradiol. Par conséquent, la clairance sérique et le volume de distribution sont légèrement plus faibles à l'état d'équilibre (0,7 ml/min/kg et environ 100 l).
ÉTHINYLESTRADIOL
Absorption
Après administration orale, l'éthinylestradiol est absorbé rapidement et complètement. Des concentrations sériques maximales de l'ordre de 50 pg/ml sont atteintes environ 1 à 2 heures après la prise d'un comprimé de LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé. Au cours de l'absorption et du métabolisme de premier passage hépatique, l'éthinylestradiol est fortement métabolisé. De ce fait, la biodisponibilité orale moyenne est de l'ordre de 45 % (variation individuelle : environ 20 à 65 %).
Distribution
L'éthinylestradiol est lié en grande partie (environ 98 %), mais de manière non spécifique, à l'albumine sérique et induit une augmentation des concentrations sériques en SHBG. Le volume de distribution apparent de l'éthinylestradiol est de 2,8 à 8,6 l/kg.
Biotransformation
L’éthinylestradiol est sujet à un métabolisme significatif au niveau de l’intestin et du premier passage hépatique.
L'éthinylestradiol et ses métabolites oxydatifs sont essentiellement conjugués au glucuronide ou au sulfate. Sa clairance métabolique du sérum est de 2,3 à 7 ml/min/kg.
In vitro, l’éthinylestradiol est un inhibiteur réversible des CYP2C19, CYP1A1 et CYP1A2, ainsi qu’un inhibiteur des mécanismes basés sur les CYP3A4/5, CYP2C8 et CYP2J2.
Élimination
La concentration sérique d'éthinylestradiol diminue selon deux phases, caractérisées par des demi-vies respectives de l'ordre de 1 heure et de 10 à 20 heures.
L'éthinylestradiol n'est pas excrété sous forme inchangée. Ses métabolites sont excrétés selon un rapport voie urinaire - voie biliaire de 4:6 et leur demi-vie est d'environ 1 jour.
État d'équilibre
La concentration sérique d'éthinylestradiol est quasiment doublée lors d'une utilisation continue de LOLISTREL CONTINU 100 microgrammes / 20 microgrammes, comprimé enrobé. En raison de la demi-vie variable de la phase terminale de sa clairance sérique et de l'administration quotidienne, l'état d'équilibre est atteint au bout d'environ une semaine.
5.3. Données de sécurité préclinique
Il faut néanmoins garder à l'esprit que les stéroïdes sexuels sont susceptibles de favoriser la croissance de certains tissus et de certaines tumeurs hormono-dépendantes.
Comprimés enrobés actifs (roses) :
· Noyau :
o Lactose monohydraté
o Cellulose microcristalline
o Croscarmellose sodique
o Povidone (K-25)
o Stéarate de magnésium
· Enrobage :
o Povidone (K-90)
o Talc
o Glycérol
o Saccharose
o Carbonate de calcium
o Macrogols
o Dioxyde de titane (E171)
o Oxyde de fer rouge (E712)
o Oxyde de fer jaune (E172)
o Cire de carnauba
Comprimés enrobés placebo (jaunes) :
· Noyau :
o Lactose monohydraté
o Amidon de maïs
o Povidone K-25
o Talc
o Stéarate de magnésium
· Enrobage :
o Povidone (K-90)
o Talc
o Glycérol
o Saccharose
o Carbonate de calcium
o Macrogols
o Dioxyde de titane (E171)
o Oxyde de fer jaune (E172)
o Cire de carnauba
2 ans.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Plaquettes PVC/PVDC/Aluminium de 28 comprimés, comprenant 21 comprimés actifs et 7 comprimés placebo par plaquette.
LOLISTREL CONTINU est disponible en boîtes de 28 ou 84 comprimés.
Présentations :
1 x 28 comprimés enrobés (21 comprimés actifs et 7 comprimés placebo)
3 x 28 comprimés enrobés (21 comprimés actifs et 7 comprimés placebo)
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
117 ALLEE DES PARCS
69800 SAINT-PRIEST
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 405 6 7 : Comprimés enrobés sous plaquettes (PVC/PVDC/Aluminium). Boîte de 1 plaquette de 28 comprimés (21 comprimés roses et 7 comprimés jaunes)
· 34009 301 405 7 4 : Comprimés enrobés sous plaquettes (PVC/PVDC/Aluminium). Boîte de 3 plaquettes de 28 comprimés (21 comprimés roses et 7 comprimés jaunes)
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.