RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 11/04/2019
1. DENOMINATION DU MEDICAMENT
ESKERIELE 685 mg, solution pour application cutanée
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Peroxyde d’hydrogène......................................................................................................... 685 mg
Pour 1,5 mL.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution pour application cutanée.
Solution limpide, incolore.
4. DONNEES CLINIQUES
4.1. Indications thérapeutiques
ESKERIELE est indiqué chez l'adulte dans le traitement des lésions de kératose séborrhéique non pédiculées et présentant un diamètre maximal de 15 mm chacune.
4.2. Posologie et mode d'administration
Posologie
Une fois que l’applicateur ESKERIELE à usage unique est activé, la solution est appliquée directement sur la (les) lésion(s) cible(s) jusqu’à 4 fois, à 1 minute d’intervalle environ. Voir « Mode d’administration ».
Il est habituellement recommandé de traiter un maximum de 4 lésions (corps, extrémités et visage) au cours d’une même séance (voir rubrique 4.4). Seules des données limitées sont disponibles concernant le traitement d’un plus grand nombre de lésions (jusqu’à 10) au cours d’une même séance.
Pour une efficacité optimale, une deuxième séance de traitement est recommandée si la lésion n’a pas disparu après un premier traitement. Celle-ci devra être réalisée au moins 3 semaines après le traitement initial, une fois que la peau aura récupéré des éventuelles réactions cliniquement significatives provoquées par le traitement précédent.
Si les lésions n'ont pas disparu après un ou plusieurs traitement(s) par ESKERIELE, il est possible de renouveler le traitement, sans dépasser un maximum de 4 séances de traitement par lésion au total. Un intervalle de 3 semaines minimum doit être respecté entre chaque séance de traitement supplémentaire. Si les lésions ne disparaissent pas, d’autres options thérapeutiques pourront être envisagées.
Il est généralement décidé d'enlever les lésions de la kératose séborrhéique dans un but esthétique, mais cela peut également être indiqué lorsque les lésions provoquent une gêne pour le patient.
Avant de traiter de nouvelles lésions séborrhéiques chez un patient, il est conseillé d’évaluer les résultats esthétiques finaux à long terme des lésions initialement traitées par ESKERIELE.
Mode d’administration
Réservé uniquement au traitement topique des lésions de kératose séborrhéique.
ESKERIELE doit être administré exclusivement par des professionnels de santé qualifiés. Les lésions cibles doivent être identifiées en consultation par un médecin disposant de l’expertise et des connaissances nécessaires en matière de lésions cutanées pigmentées. Le diagnostic de kératose séborrhéique doit être confirmé et différencié des autres types de lésions cutanées, notamment malignes.
Il convient de porter des gants médicaux en nitrile ou vinyle pendant l’activation de l’applicateur ESKERIELE et au cours de l’administration de la solution sur la (les) lésion(s). Le mode d'emploi pour préparer l’applicateur ESKERIELE avant utilisation est illustré ci-dessous.
Les lésions de kératose séborrhéique ciblées par le traitement doivent être nettoyées et sèches avant l’application d’ESKERIELE.
Lésions faciales
Éviter d’exposer les yeux ou les muqueuses à ESKERIELE car ESKERIELE contient 40 % de peroxyde d’hydrogène, un puissant agent oxydant et corrosif. Lors du traitement d’une kératose séborrhéique du visage, prendre des mesures appropriées pour s’assurer qu’ESKERIELE n’entre pas en contact avec les yeux ou la zone située dans un périmètre de 5 mm autour de l’orbite, de la bouche, des muqueuses ou de plaies ouvertes, par exemple en allongeant le patient sur le dos, la tête légèrement surélevée et penchée, de façon à ce que l’éventuel surplus de médicament s’écoule dans la direction opposée à l’œil. Par ailleurs, de la vaseline peut être appliquée autour de l’orbite et au niveau des commissures palpébrales internes et externes (étirer délicatement la peau au moment de l’application afin de distendre les éventuelles rides péri-orbitaires [« pattes d’oie »]) afin de limiter le risque que le médicament coule vers l’œil.
En cas d’exposition accidentelle, rincer à l’eau pendant 15 à 30 minutes, surveilleret réévaluer plus tard si nécessaire.
|
Activation de l'applicateur
|
|
Tenir l’applicateur éloigné de vous et du patient au moment de son activation. Ne pas retirer le capuchon avant d’avoir terminé l’étape 4 (ci-dessous). Pour l’activation, tenir l’applicateur avec le manchon en carton et le capuchon de l’applicateur orientés vers le haut (figure 1).
|
|
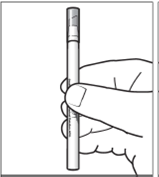
|
|
Tenir l’applicateur en plaçant le pouce et l’index au niveau du losange inscrit sur le manchon en carton de l’applicateur et exercer une pression avec le pouce et l’index de façon à casser l’ampoule contenant la solution et à libérer la solution dans l’applicateur (figure 2).
|
|
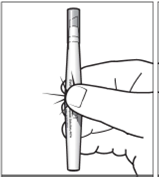
|
|
En tenant toujours l’applicateur avec le capuchon orienté vers le haut, tapoter le bas de l’applicateur afin d’extraire la solution de l’ampoule cassée (figure 3).
|
|
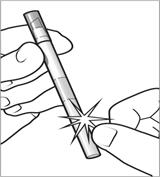
|
|
Retirer délicatement le capuchon de l’applicateur en le faisant tourner tout en tirant dessus (figure 4).
|
|
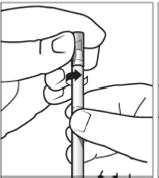
|
|
Application
|
|
Une fois l’applicateur activé, presser délicatement le corps de l’applicateur (à distance du patient) afin de faire sortir la solution au niveau de l’extrémité de l’applicateur. Veiller à ce que l’extrémité de l’applicateur ESKERIELE soit imbibée (mais qu’elle ne goutte pas) (figure 5).
|
|
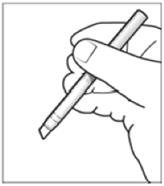
|
|
Appliquer la solution directement sur la (les) lésion(s) de kératose séborrhéique en appuyant fermement, comme lors de l’utilisation d’une gomme, et en effectuant un mouvement circulaire, pendant environ 20 secondes jusqu’à ce que la lésion soit entièrement imprégnée (figure 6).
|
|
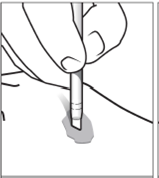
|
|
Éviter tout contact avec la peau environnante. Au cours de l’application, éliminer le surplus de solution sur la peau environnante à l’aide d’une compresse absorbante propre (gaze, par exemple).
Attendre 1 minute et observer. Le blanchiment de la lésion est normal. Laisser le temps à la lésion traitée d’absorber la solution, puis renouveler l’application jusqu’à ce que la lésion soit totalement saturée. Au total, il est possible d’effectuer jusqu’à 4 applications par séance de traitement, à une minute d’intervalle. Ne pas poursuivre par une nouvelle application si l’érythème/œdème est sévère ou si la douleur dépasse un niveau d’intensité légère. La pression à exercer lors des applications suivantes peut être moins importante.
|
Une fois le traitement de chaque lésion cible terminé, ne pas toucher la (les) lésion(s) tant que la solution n’a pas entièrement séché. Si nécessaire, tamponner la (les) lésion(s) traitée(s), sans frotter, à l’aide d’une compresse absorbante (gaze, par exemple) pour s’assurer que les lésions traitées sont bien sèches. Après l’utilisation, remettre le capuchon en place et éliminer l’applicateur à usage unique.
Il est également possible d’utiliser une poche de glace pour réduire le gonflement, le cas échéant.
L’application d’ESKERIELE en quantité ou à une fréquence plus importantes que celles recommandées ne donnera pas des résultats plus rapides ni meilleurs et pourrait favoriser la survenue et/ou augmenter l’intensité des effets indésirables locaux, notamment l’irritation, l’érythème, la vésiculation, l’ulcération, les sensations de piqûre ou de brûlure.
Population pédiatrique
Il n’existe pas d’utilisation justifiée d’ESKERIELE dans la population pédiatrique dans l’indication de kératose séborrhéique. La kératose séborrhéique n’est pas observée dans ce groupe d’âge.
4.3. Contre-indications
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· Lésions de kératose séborrhéique situées à l’intérieur du périmètre de la cavité orbitaire.
· Lésion(s) de kératose séborrhéique ouverte(s) ou infectée(s).
4.4. Mises en garde spéciales et précautions d'emploi
ESKERIELE ne doit pas être appliqué sur une kératose séborrhéique au niveau des paupières ou dans un périmètre de 5 mm autour de l’orbite, sur les plis intertrigineux ou les zones couvertes de poils (voir la rubrique 4.2 pour savoir comment éviter l’exposition des yeux et des muqueuses).
Les données disponibles sont limitées sur le traitement de plus de 4 lésions de kératose séborrhéique, d’un diamètre de plus de 15 mm chacune, chez les patients.
Les données disponibles sont limitées concernant l’hypopigmentation chez les personnes ayant une peau foncée.
Toutes les réactions cutanées locales n'ont pas entièrement disparu 3 mois après le traitement et il est possible que certaines réactions cutanées locales, telles que les cicatrices, ne se disparaissent jamais totalement.
Les patients doivent contacter leur médecin en cas d’apparition d’une nouvelle lésion cutanée pigmentée ou s’ils observent la moindre modification au niveau d’une lésion cutanée pigmentée existante.
Information supplémentaire
Éviter tout contact avec les cheveux ou les tissus teints car ils pourraient être décolorés par ce produit.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas de données ou il existe des données limitées sur l’utilisation de peroxyde d’hydrogène chez la femme enceinte.
Lors des études pharmacocinétiques effectuées chez l’animal et chez l’homme, l’utilisation d’ESKERIELE n’a pas conduit à l’augmentation des concentrations sériques en peroxyde d’hydrogène. Par conséquent, des effets délétères liés à une toxicité sur la reproduction sont improbables.
Par mesure de précaution, il est préférable d’éviter l’utilisation d’ESKERIELE pendant la grossesse.
Allaitement
On ne sait pas si le peroxyde d’hydrogène est excrété dans le lait maternel.
Aucun effet sur le nouveau-né/nourrisson allaité n’est attendu dans la mesure où l’utilisation d’ESKERIELE n’a pas entraîné d’augmentation des concentrations sériques en peroxyde d’hydrogène.
Fertilité
Aucune étude n’a été réalisée concernant la fertilité. Aucun effet sur la fertilité humaine n’est attendu dans la mesure où l’utilisation d’ESKERIELE n’a pas entraîné d’augmentation des concentrations sériques en peroxyde d’hydrogène.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
ESKERIELE n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
4.8. Effets indésirables
Résumé du profil de sécurité
Les effets indésirables observés le plus fréquemment sont des réactions cutanées locales telles que érythème, sensations de piqûre/ douleur, œdème, desquamation/exfoliation et formation de croûtes. Ils surviennent habituellement dans les minutes suivant le début du traitement et atteignent leur pic d’intensité en 1 semaine. Toutes les réactions cutanées locales n'ont pas entièrement disparu 3 mois après le traitement et il est possible que certaines réactions cutanées locales, telles que les cicatrices, ne disparaissent jamais totalement.
Les réactions cutanées locales sont directement liées au mode d’action de la substance active, le peroxyde d’hydrogène. Les réactions transitoires sont attendues et au moins partiellement nécessaires à l’obtention de l’efficacité thérapeutique du médicament.
Aucun événement indésirable grave lié au traitement ne s’est produit au cours des essais cliniques.
Tableau récapitulatif des effets indésirables
Les effets indésirables sont présentés par fréquence. Les catégories de fréquence sont définies comme suit : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau 1 : Effets indésirables observés au cours des essais cliniques, par classe de système d’organe MedDRA
|
Classe de système d'organes (MedDRA)
|
Très fréquent
|
Fréquent
|
Peu fréquent
|
|
Affections oculaires
|
|
|
· Œdème palpébral
· blépharospasme
|
|
Affections gastro-intestinales
|
|
|
· Gonflement de la lèvre
|
|
Affections de la peau et du tissu sous-cutané
|
|
· Prurit généralisé
|
|
|
Troubles généraux et anomalies au site d’administration
|
Sur la zone d’application :
· érythème,
· douleur,
· œdème,
· exfoliation*,
· formation de croûtes,
· prurit,
· décoloration**,
· vésicules,
· érosion
|
Sur la zone d’application :
· ulcération,
· atrophie,
· cicatrice
|
|
|
Lésions, intoxications et complications d'interventions
|
|
|
· Complication consécutive à la procédure
|
* incluant la desquamation
** incluant l’hyperpigmentation et l’hypopigmentation
Description de certains effets indésirables particuliers
Les réactions cutanées locales ont été très fréquentes dans les 7 premiers jours ayant suivi le traitement. Lors de la visite effectuée 7 jours après le traitement initial, les réactions cutanées locales les plus fréquentes, d’après le pourcentage de patients atteints, ont été la desquamation/l’exfoliation (71 %), la formation de croûtes (67 %), l’érythème (64 %), le prurit (18 %) et la décoloration du site (14 %), et ces réactions ont été le plus souvent légères à modérées. Les réactions cutanées locales les plus fréquentes 15 semaines après le traitement initial ont été : la décoloration du site (25 %), l’érythème (21 %), l’exfoliation (15 %) et la formation de croûtes (11 %), qui ont été majoritairement d’intensité légère à modérée.
Sur la base du pourcentage de lésions, les effets indésirables sévères observés à n'importe quelle visite ont été l’érythème (6,2 % juste après le premier traitement), l'œdème (5,6 % juste après le premier traitement), la douleur avec sensation de piqûre (4,5 % juste après le premier traitement), la formation de croûtes (2,5 % une semaine après le premier traitement) et le prurit (1,0 % juste après le premier traitement). Au dernier jour de l’étude (jour 106), les effets indésirables sévères se limitaient à la formation de croûtes (0,1 %), érythème (0,05 %) et desquamation/exfoliation (0,05 %).
La majorité des réactions cutanées locales rapportées ont disparu dans les 12 semaines ayant suivi un maximum de 2 traitements ; les réactions cutanées encore présentes 12 semaines après le dernier traitement étaient l’érythème (chez 21,1 % des patients), la formation de croûtes (11,6 %), la desquamation (15,5 %), l’hyperpigmentation (18,1 %), l’hypopigmentation (6,9 %), le prurit (1,9 %), la sensation de piqûre (0,2 %), l’atrophie (0,7 %), l’ulcération (0,0 %), les cicatrices (1,1 %) ; la majorité de ces réactions étaient d’intensité légère.
De même, la majorité des réactions cutanées locales rapportées après un maximum de 4 traitements ont disparu en l’espace de 12 semaines ; les réactions cutanées encore présentes 12 semaines après le dernier traitement étaient l’érythème (chez 8,1 % des patients), la formation de croûtes (13,8 %), la desquamation (33,8 %), l’hyperpigmentation (14,0 %), l’hypopigmentation (6,7 %), le prurit (0,9 %), la sensation de piqûre (0,0 %), l’atrophie (0,0 %), l’ulcération (0,0 %), les cicatrices (0,5 %) ; la majorité de ces réactions étaient d’intensité légère.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
4.9. Surdosage
Le surdosage topique d’ESKERIELE peut entraîner une augmentation de l’incidence et de la sévérité des réactions cutanées locales. Éliminer le surplus de solution à l’aide d’une compresse absorbante propre (gaze, par exemple).
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Autres produits dermatologiques, Code ATC : D11AX25.
Mécanisme d'action
Le peroxyde d’hydrogène est un agent oxydant qui enlève le tissu lésionnel de la kératose séborrhéique en induisant la peroxydation lipidique et membranaire et l’oxydation des protéines, entraînant la mort cellulaire par apoptose et nécrose des cellules atteintes par la kératose séborrhéique.
Efficacité et sécurité cliniques
Au cours de deux essais cliniques de phase 3, en double aveugle, contrôlés contre placebo (SEBK‑301 et SEBK‑302) menés chez 937 patients présentant quatre lésions cibles de kératose séborrhéique sur le visage, le tronc ou les extrémités, 467 patients ont été traités par ESKERIELE et 470 patients par un placebo (véhicule). Chaque lésion a reçu un maximum de deux traitements, à trois semaines d’intervalle. La disparition des lésions de kératose séborrhéique a été évaluée au jour 106 en utilisant l’échelle validée d’évaluation des lésions par le médecin à quatre points (PLA, Physician Lesion Assessment), caractérisant les lésions comme ayant disparu (PLA = 0), ayant presque disparu (PLA = 1), fines (PLA = 2) ou épaisses (PLA = 3).
Les groupes de traitement de chaque étude étaient bien équilibrés, avec des caractéristiques démographiques et des caractéristiques initiales similaires dans la population d’évaluation de la sécurité, aussi bien entre les groupes de traitement au sein de chaque étude qu’entre les deux études. Sur les deux études groupées, 389 patients (41,5 %) étaient de sexe masculin et 548 (58,5 %) de sexe féminin. L’âge moyen était de 68,7 ans (intervalle : 42 à 91 ans ; 41,7 % étaient âgés d’au moins 71 ans) et 917 patients (97,9 %) étaient caucasiens. La répartition des types de peau des patients selon la classification de Fitzpatrick était la suivante : 12,6 % de type 1, 46,7 % de type 2, 30,3 % de type 3, 9,2 % de type 4, 1,1 % de type 5 et 0,1 % de type 6.
Efficacité
Au cours de l’étude SEBK‑301, tous les patients traités par le placebo et 92 % des patients traités par ESKERIELE ont reçu deux traitements sur au moins trois lésions. Au cours de l’étude SEBK‑302, 98 % des patients traités par le placebo et 90 % des patients traités par ESKERIELE ont reçu 2 traitements pour au moins trois lésions.
Dans l’essai SEBK‑301, 47,5 % des lésions ont disparu ou presque disparu (PLA ≤ 1) après le traitement par ESKERIELE, contre 10,2 % des lésions traitées par le placebo (p < 0,001). Dans l’essai SEBK‑302, 54,3 % des lésions ont disparu ou presque disparu après le traitement par ESKERIELE, contre 4,7 % des lésions traitées par le placebo (p < 0,0001) (tableau 2). Globalement, les résultats des deux essais cliniques ont montré que 51,0 % des lésions traitées par ESKERIELE ont disparu ou presque disparu (PLA ≤ 1) à la fin des essais, contre 7,3 % des lésions dans les groupes placebo.
Tableau 2 : Pourcentage de lésions considérées comme disparues ou presque disparues d’après le score PLA (évaluation des lésions par le médecin)
|
Pourcentage moyen par patient de lésions disparues ou presque disparues (PLA ≤ 1)
|
|
Etude
|
ESKERIELE
|
Véhicule
|
Valeur de p
|
|
SEBK-301
|
47,5 %
|
10,2 %
|
< 0,0001
|
|
SEBK-302
|
54,3 %
|
4,7 %
|
< 0,0001
|
Entre 25,2 % et 34,2 % des lésions traitées par patient ont totalement disparu (PLA = 0) après application d’ESKERIELE, contre 0,6 % à 1,9 % des lésions traitées par le placebo (tableau 3).
Globalement, chez 6 % des patients traités par ESKERIELE, les quatre lésions cibles de kératose séborrhéique ont toutes disparu. La disparition de l’ensemble des quatre lésions n’a été obtenue chez aucun des patients traités par le placebo. Ces différences ont été hautement statistiquement significatives (p < 0,0001).
Tableau 3 : Pourcentage de lésions totalement disparues d’après le score PLA (évaluation des lésions par le médecin)
|
Pourcentage moyen par patient des lésions disparues (PLA = 0)
|
|
Etude
|
ESKERIELE
|
Placebo
|
P-value
|
|
SEBK-301
|
25,2 %
|
1,9 %
|
< 0,0001
|
|
SEBK-302
|
34,2 %
|
0,6 %
|
< 0,0001
|
Les deux essais comportaient un autre critère d’efficacité portant sur le pourcentage de patients traités par ESKERIELE ayant obtenu une disparition totale (PLA = 0) d’au moins trois des quatre lésions cibles de kératose séborrhéique. Dans l’essai SEBK‑301, 13,5 % des patients traités par ESKERIELE ont obtenu la disparition d’au moins trois des quatre lésions cibles (p < 0,0001) ; dans l’essai SEBK‑302, 23,0 % des patients traités ont obtenu la disparition d’au moins trois des quatre lésions cibles (p < 0,0001). Ce critère n’a été atteint chez aucun des patients traités par le placebo.
Au sein de la population totale des patients, le pourcentage de patients répondeurs ayant présenté une disparition d’au moins trois des quatre lésions cibles a été de 18,4 % parmi les patients traités par ESKERIELE, contre 0 % dans le groupe traité par le véhicule (p < 0,0001).
Analyse selon la localisation corporelle
L’effet thérapeutique d’ESKERIELE a été plus marqué pour les lésions faciales que pour l’ensemble des lésions : le pourcentage moyen de lésions faciales disparues ou presque disparues (PLA ≤ 1) a été respectivement de 64,4 % et 62,8 % dans les études SEBK‑301 et SEBK‑302 (tableau 4). Le pourcentage moyen de lésions totalement disparues (PLA = 0) après traitement par ESKERIELE a été de 40,5 % pour le visage, 25,9 % pour le tronc et 14,3 % pour les extrémités sur l’ensemble des deux études, contre 2,8 %, 1,1 % et 0,7 %, respectivement, avec le traitement par le placebo.
Tableau 4 : Pourcentage de lésions faciales disparues ou presque disparues d’après le score PLA (évaluation des lésions par le médecin)
|
Pourcentage moyen par patient de lésions faciales disparues ou presque disparues (PLA ≤ 1)
|
|
Etude
|
ESKERIELE
|
Véhicule
|
Valeur de p
|
|
SEBK-301
|
64,4 %
|
15,0 %
|
< 0,0001
|
|
SEBK-302
|
62,8 %
|
6,2 %
|
< 0,0001
|
Analyse par nombre de traitements requis
Entre 6,8 % et 10,2 % des lésions ont disparu ou presque disparu après un traitement par ESKERIELE ; entre 41,9 % et 43,3 % ont disparu ou presque disparu après deux séances de traitement par ESKERIELE. À titre de comparaison, 10,0 % des lésions tout au plus ont disparu ou presque disparu après deux traitements par le placebo.
Tableau 5 : Nombre de traitements nécessaires pour obtenir des lésions comme ayant disparu (PLA = 0) ou ayant presque disparu d’après le score PLA (évaluation des lésions par le médecin)
|
Pourcentage de lésions de KS disparues ou presque disparues (PLA ≤ 1), selon le traitement, après 1 ou 2 séance(s)
|
|
Etude
|
1 × ESKERIELE
|
1 × Véhicule
|
2 × ESKERIELE
|
2 × Véhicule
|
|
SEBK-301
|
6,8 %
|
0,1 %
|
41,9 %
|
10,0 %
|
|
SEBK-302
|
10,2 %
|
0,0 %
|
43,3 %
|
4,7 %
|
Analyse selon la taille des lésions
L’épaisseur et la superficie des lésions ont eu un effet négligeable sur le pourcentage de lésions disparues ou presque disparues à la fin de l’étude.
Parmi les lésions dont la taille était inférieure ou égale à la taille médiane des lésions incluses dans les études SEBK, 54,2 % ont disparu ou presque disparu en jour 106. Parmi les lésions dont la taille était supérieure à la taille médiane des lésions incluses dans les études SEBK, 48,5 % ont disparu ou presque disparu en jour 106.
Population pédiatrique
L’Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec ESKERIELE dans tous les sous-groupes de la population pédiatrique pour le traitement de la kératose séborrhéique (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).
Personnes âgées
Parmi les 937 patients traités par ESKERIELE au cours des essais cliniques, 70 % étaient âgés de 65 ans et plus et 26 % étaient âgés de 75 ans et plus. Aucune différence globale de sécurité ou d'efficacité n’a été observée entre ces patients et les patients plus jeunes.
5.2. Propriétés pharmacocinétiques
Aucune donnée n'est disponible sur l'exposition systémique après une application topique.
5.3. Données de sécurité préclinique
Les études de toxicologie en administration répétée n’ont pas révélé de risque particulier en termes d’effets systémiques mais ont montré des réactions locales.
D’après les données publiées, le peroxyde d’hydrogène présente des propriétés génotoxiques in vitro. Cependant, cette génotoxicité observée in vitro ne se traduit généralement pas par des effets in vivo, probablement en raison de la métabolisation rapide du H2O2.
Aucune modification significative des concentrations plasmatiques en peroxyde d’hydrogène n’a été observée chez l’animal lors des études en application dermique répétée. Par conséquent, le risque potentiel de cancérogénicité systémique et de toxicité sur les fonctions de reproduction et de développement est négligeable. Aucune étude adéquate n’a été réalisée pour évaluer le risque de cancérogénicité au site d’application. Un risque de cancérogénicité dermique/locale ne peut être totalement exclu au vu du potentiel génotoxique du H2O2. Ce risque est toutefois considéré comme faible en raison de l’utilisation intermittente d’ ESKERIELE et de la courte durée d’action locale du H2O2.
6. DONNEES PHARMACEUTIQUES
6.1. Liste des excipients
Alcool isopropylique, eau.
6.2. Incompatibilités
Sans objet.
6.3. Durée de conservation
2 ans.
Utiliser dans les 4 heures suivant l’activation de l’applicateur.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
Ne pas congeler.
Le produit doit être jeté après une seule utilisation.
6.5. Nature et contenu de l'emballage extérieur
ESKERIELE est présenté en ampoule en verre de type I borosilicate à usage unique contenant 1,5 mL, à l’intérieur d’un applicateur. Chaque applicateur à usage unique est conditionné sous plaquette dans une boîte.
Conditionnements :
· 1 applicateur à usage unique
· Emballage multiple contenant 3 (3 boîtes de 1) applicateurs à usage unique
· Emballage multiple contenant 12 (12 boîtes de 1) applicateurs à usage unique.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Elimination
Pas d’exigences particulières pour l’élimination.
A usage unique.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
ACLARIS THERAPEUTICS INTERNATIONAL LTD
1 Ashley road
Altrincham
cheshire WA14 2DT
Royaume-uni
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 769 0 0 : 1,5 mL en ampoule avec applicateur à usage unique. Boîte de 1.
· 34009 301 769 2 4 : 1,5 mL en ampoule avec applicateur à usage unique. 3 X 1 boîte.
· 34009 301 769 3 1 : 1,5 mL en ampoule avec applicateur à usage unique. 12 X 1 boîte.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
11. DOSIMETRIE
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste II.
Réservé à l'usage professionnel selon l'article R.5121-80 du code de la santé publique.
Prescription réservée aux spécialistes en dermatologie.





