NOTICE
ANSM - Mis à jour le : 06/01/2012
Dénomination du médicament
SPIRIVA 18 microgrammes, poudre pour inhalation en gélule
Tiotropium
Encadré
Veuillez lire attentivement l'intégralité de cette notice avant de prendre ce médicament.
· Gardez cette notice, vous pourriez avoir besoin de la relire.
· Si vous avez toute autre question, si vous avez un doute, demandez plus d'informations à votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez jamais à quelqu'un d'autre, même en cas de symptômes identiques, cela pourrait lui être nocif.
· Si l'un des effets indésirables devient sérieux ou si vous remarquez un effet indésirable non mentionné dans cette notice, parlez-en à votre médecin ou votre pharmacien.
Sommaire notice
Dans cette notice :
1. QU'EST-CE QUE SPIRIVA 18 microgrammes, poudre pour inhalation en gélule ET DANS QUELS CAS EST-IL UTILISE ?
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER SPIRIVA 18 microgrammes, poudre pour inhalation en gélule ?
3. COMMENT UTILISER SPIRIVA 18 microgrammes, poudre pour inhalation en gélule ?
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
5. COMMENT CONSERVER SPIRIVA 18 microgrammes, poudre pour inhalation en gélule ?
6. INFORMATIONS SUPPLEMENTAIRES
1. QU'EST-CE QUE SPIRIVA 18 microgrammes, poudre pour inhalation en gélule ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique
Classe pharmacothérapeutique ou mode d'action
Spiriva appartient à la classe des médicaments anticholinergiques. C'est un bronchodilatateur (il augmente le calibre des bronches pour favoriser le passage de l'air dans les poumons) à longue durée d'action qui s'administre par voie inhalée et sa durée d'action est de 24 heures.
Indications thérapeutiques
Le tiotropium est indiqué chez l'adulte pour soulager les symptômes chez les patients présentant une bronchopneumopathie chronique obstructive (BPCO) comme traitement bronchodilatateur continu en prises régulières et quotidiennes.
Spiriva agit sur les bronches pour augmenter les débits d'air dans les poumons (air inspiré et air expiré).
L'utilisation quotidienne et régulière de Spiriva peut vous aider à diminuer l'essoufflement afin d'améliorer votre activité physique. Spiriva doit être pris tous les jours de façon régulière et quotidienne.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER SPIRIVA 18 microgrammes, poudre pour inhalation en gélule ?
Liste des informations nécessaires avant la prise du médicament
Sans objet.
Contre-indications
Ne prenez jamais SPIRIVA 18 microgrammes, poudre pour inhalation en gélule dans le cas suivants:
· Si vous êtes allergique (hypersensible) au bromure de tiotropium, à l'atropine ou à ses dérivés (tels que l'ipratropium ou l'oxitropium) au lactose ou aux protéines de lait.
· Si vous êtes âgé de moins de 18 ans.
Précautions d'emploi ; mises en garde spéciales
Faites attention avec SPIRIVA 18 microgrammes, poudre pour inhalation en gélule
· Spiriva est indiqué pour le traitement continu de votre bronchopneumopathie chronique obstructive, il n'est pas destiné à être utilisé pour traiter l'apparition soudaine d'une difficulté respiratoire ou de respiration sifflante.
· Des réactions allergiques immédiates, comme une éruption cutanée, un dème, des démangeaisons, une respiration sifflante ou des difficultés respiratoires, peuvent survenir après l'administration de Spiriva. Si ce type de situation survient, consultez immédiatement votre médecin.
· Comme tous les autres traitements administrés par voie inhalée, Spiriva peut provoquer une oppression du thorax, une toux, une respiration sifflante ou des difficultés respiratoires immédiatement après l'inhalation.
Si ce type de situation survient, consultez immédiatement votre médecin.
· Spiriva doit être utilisé avec prudence en cas d'hypertrophie de la prostate ou de rétrécissement du col de la vessie.
· Spiriva doit être utilisé avec prudence en cas de glaucome à angle fermé (maladie de l'il)
· Prenez soin de ne pas projeter de la poudre dans vos yeux ce qui pourrait entraîner le déclenchement ou l'aggravation d'un glaucome à angle fermé. Une douleur ou une gène oculaire, des troubles de la vision, la vision de halos autour de la lumière ou d'images colorées, associées à une rougeur oculaire sont des signes éventuels d'un glaucome à angle fermé. Les symptômes oculaires peuvent s'accompagner de céphalées, de nausées ou de vomissements. En cas de survenue de symptômes évocateurs d'un glaucome à angle fermé après la prise de ce médicament ou de projection accidentelle dans l'il, interrompre le traitement et consultez immédiatement votre médecin (de préférence un ophtalmologue).
· La sécheresse buccale, telle qu'observée avec les traitements anticholinergiques, peut à long terme favoriser le développement des caries dentaires. Par conséquent vous devez garder une bonne hygiène buccale.
· Le traitement par Spiriva devra faire l'objet d'une surveillance étroite en cas d'insuffisance rénale modérée à sévère.
Si vous prenez déjà d'autres médicaments, veuillez lire également la rubrique "Utilisation de Spiriva en association avec d'autres médicaments".
Veuillez consulter votre médecin si l'une des mises en garde mentionnées ci-dessus s'applique à votre cas, ou si elle s'est appliquée dans le passé.
Le médicament peut être administré indifféremment des horaires des repas.
Interactions avec d'autres médicaments
Prise d'autres médicaments
Veuillez indiquer à votre médecin ou à votre pharmacien si vous prenez ou avez pris récemment un autre médicament, même s'il s'agit d'un médicament obtenu sans ordonnance.
Afin d'éviter d'éventuelles interactions entre plusieurs médicaments, et notamment avec des médicaments similaires pour traiter votre maladie pulmonaire (par exemple de l'ipratropium ou de l'oxitropium), signalez systématiquement tout autre traitement en cours à votre médecin ou à votre pharmacien.
Interactions avec les aliments et les boissons
Sans objet.
Interactions avec les produits de phytothérapie ou thérapies alternatives
Sans objet.
Utilisation pendant la grossesse et l'allaitement
Grossesse et allaitement
L'utilisation de ce médicament est déconseillée pendant la grossesse et l'allaitement.
Si vous découvrez que vous êtes enceinte pendant le traitement, consultez votre médecin, car lui seul peut juger du traitement le mieux adapté à votre cas.
Vous ne devez pas utiliser ce médicament sauf s'il vous a été recommandé spécifiquement par votre médecin.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Sportifs
Sans objet.
Effets sur l'aptitude à conduire des véhicules ou à utiliser des machines
Conduite de véhicules et utilisation de machines
La survenue d'étourdissements, d'une vision trouble ou de céphalées peut influencer votre aptitude à conduire des véhicules ou à utiliser des machines.
Liste des excipients à effet notoire
Informations importantes concernant certains composants de SPIRIVA 18 microgrammes, poudre pour inhalation en gélule: lactose (contient des protéines de lait).
3. COMMENT UTILISER SPIRIVA 18 microgrammes, poudre pour inhalation en gélule ?
Instructions pour un bon usage
Sans objet.
Posologie, Mode et/ou voie(s) d'administration, Fréquence d'administration et Durée du traitement
· La poudre contenue dans les gélules doit être administrée par voie inhalée à l'aide du dispositif Handihaler destiné à cet effet.
· Ne pas avaler les gélules.
Respectez toujours la posologie indiquée par votre médecin.
Suivre rigoureusement ces instructions, sauf avis contraire de votre médecin. En cas d'incertitude, consulter votre médecin ou votre pharmacien.
La dose habituelle chez l'adulte est l'inhalation du contenu d'une gélule une fois par jour à la même heure, à l'aide du dispositif Handihaler.
Seul le dispositif Handihaler vous permet d'inhaler le produit contenu dans la gélule. Dans tous les cas, se conformer strictement à l'ordonnance de votre médecin.
En cas de persistance des troubles, ne pas augmenter la dose, mais consulter votre médecin.
Patients âgés et patients atteints d'insuffisance hépatique: la dose habituelle est d'une gélule par jour à heure fixe dans la journée.
Patients atteints d'insuffisance rénale: le médecin adaptera la dose en fonction de votre cas.
|
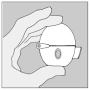
|
Suivez toujours scrupuleusement les instructions de votre médecin pour utiliser SPIRIVA. Le dispositif HandiHaler est exclusivement conçu pour SPIRIVA et vous ne devez pas l'utiliser pour prendre un autre médicament. Vous pouvez utiliser ce dispositif pendant un an maximum pour prendre SPIRIVA.
|
|
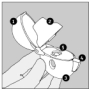
|
Le dispositif HandiHaler
1 Capuchon anti-poussière
2 Embout buccal
3 Base
4 Bouton-perforateur
5 Chambre centrale
|
|
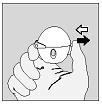
|
1. Pour libérer le capuchon anti-poussière, appuyer complètement sur le bouton perforateur puis relâchez-le
|
|
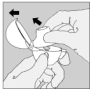
|
2. Relevez complètement le capuchon anti-poussière en le tirant vers le haut puis ouvrez l'embout buccal en le tirant vers le haut.
|
|
|
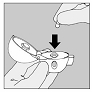
3. Prenez une gélule de SPIRIVA du blister (juste avant l'utilisation) et placez-la dans la chambre centrale (5), conformément à l'illustration. La façon dont la gélule est placée dans la chambre centrale importe peu.
|
|
|
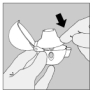
4. Refermez l'embout buccal jusqu'à ce que vous entendiez un clic et laissez le capuchon anti-poussière ouvert
|
|
|
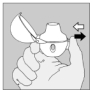
5. Tenez le dispositif HandiHaler vertical, l'embout buccal dirigé vers le haut et enfoncez complètement le bouton-perforateur (vert) d'une seule pression, puis relâchez. Ceci perfore la gélule et libère le médicament que vous inhalerez lorsque vous inspirerez
|
|

|
6. Expirez à fond.
Important: ne jamais expirer dans l'embout buccal.
|
|
|
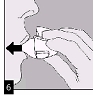
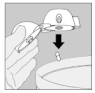
7. Portez le HandiHaler à votre bouche et refermez fermement les lèvres autour de l'embout buccal. Maintenez la tête droite et inspirez lentement et profondément, à un rythme toutefois suffisant pour que vous entendiez ou sentiez la gélule vibrer. Inspirez jusqu'à remplir complètement vos poumons, puis retenez votre respiration aussi longtemps que vous le pouvez et ôtez le dispositif HandiHaler de votre bouche. Reprenez une respiration normale et répétez une fois les étapes 6 et 7, ce qui videra totalement la gélule de son contenu.
|
|
|
8. Ouvrez à nouveau l'embout buccal. Faites tomber la gélule et jetez-la. Refermez l'embout buccal et le capuchon anti-poussière pour conserver votre dispositif HandiHaler.
|
Nettoyage du HandiHaler
|
|
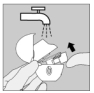
Nettoyez votre HandiHaler une fois par mois. Ouvrez le capuchon anti-poussière et l'embout buccal, puis ouvrez la base en soulevant le bouton perforateur. Rincez complètement l'inhalateur à l'eau chaude pour enlever toute poudre restante. Séchez soigneusement le HandiHaler en absorbant l'excès d'eau sur une serviette en papier puis laissez sécher à l'air, en laissant l'embout buccal, le capuchon anti-poussière et la base ouverts.
Cette opération de séchage à l'air prend 24 heures. Nettoyez donc votre HandiHaler juste après l'avoir utilisé et il sera prêt pour votre dose suivante. Si nécessaire, nettoyez la surface externe de l'embout buccal avec un chiffon humide mais non mouillé.
|
Manipulation du blister
|
|
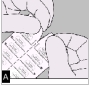
A. Séparez le blister prédécoupé en détachant selon la perforation
|
|
|
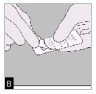
B. Relevez la feuille d'aluminium (juste avant l'utilisation) jusqu'à ce qu'une seule gélule devienne complètement visible.
Si une seconde gélule est exposée à l'air par inadvertance, celle-ci doit être jetée.
|
|

|
C. Sortez la gélule.
|
Les gélules de Spiriva ne contiennent qu'une petite quantité de poudre et ne sont donc pas complètement remplies.
Si vous avez l'impression que l'effet de SPIRIVA 18 microgrammes, poudre pour inhalation en gélule est trop fort ou trop faible, consultez votre médecin ou votre pharmacien.
Symptômes et instructions en cas de surdosage
Si vous avez pris plus de SPIRIVA 18 microgrammes, poudre pour inhalation en gélule que vous n'auriez dû: vous pouvez être exposé à un risque plus important de présenter un effet indésirable comme une sécheresse de la bouche, une constipation, des difficultés à uriner, des troubles de la vision, et/ou une augmentation du rythme du cur. Consultez votre médecin.
Instructions en cas d'omission d'une ou de plusieurs doses
Si vous oubliez de prendre SPIRIVA 18 microgrammes, poudre pour inhalation en gélule: ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Risque de syndrome de sevrage
Si vous arrêtez de prendre SPIRIVA 18 microgrammes, poudre pour inhalation en gélule: consultez toujours votre médecin si vous envisagez d'arrêter le traitement.
Si vous arrêtez le traitement par Spiriva, les signes et les symptômes de la BPCO peuvent s'aggraver.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Description des effets indésirables
Comme tous les médicaments, SPIRIVA 18 microgrammes, poudre pour inhalation en gélule est susceptible d'avoir des effets indésirables, bien que tout le monde n'y soit pas sujet.
La fréquence de survenue des effets indésirables est la suivante:
· Fréquent: survient chez moins de 1 patient sur 10 mais plus de 1 patient sur 100;
· Peu fréquent: survient chez moins de 1 patient sur 100 mais plus de 1 patient sur 1000;
· Rare: survient chez moins de 1 patient sur 1000 mais plus de 1 patient sur 10000;
· Non déterminée: la fréquence de survenue ne peut être estimée sur la base des données cliniques disponibles.
Les effets indésirables décrits ci-dessous ont été observés chez des patients prenant ce médicament et sont listés selon leur fréquence de survenue rapportée: fréquent, peu fréquent, rare, ou avec une fréquence non déterminée.
Fréquent:
· Sécheresse buccale: légère dans la majorité des cas.
Peu fréquent:
· Sensations vertigineuses,
· Maux de tête,
· Troubles du goût,
· Vision trouble,
· Irrégularité du rythme cardiaque (fibrillation auriculaire),
· Inflammation de la gorge (pharyngite),
· Enrouement (dysphonie),
· Toux,
· Inflammation de la bouche (stomatite),
· Sensation d'aigreur d'estomac (reflux gastro sophagien),
· Constipation,
· Nausées,
· Eruption cutanée (rash),
· Difficulté à uriner (dysurie) ou rétention aigue d'urine
Rare:
· Difficulté à s'endormir (insomnies),
· Vision de halos lumineux autour des images lumineuses ou colorées, avec rougeur oculaire
· Augmentation de la pression oculaire (glaucome),
· Irrégularité du rythme cardiaque (tachycardie supraventriculaire),
· Accélération du rythme cardiaque (tachycardie),
· Perception anormale de battements cardiaques dans la poitrine (palpitations),
· Oppression du thorax associée à une toux, une respiration sifflante ou des difficultés respiratoires survenant immédiatement après l'inhalation du produit (bronchospasme),
· Saignements du nez (epistaxis)
· Inflammation du larynx (laryngite),
· Inflammation des sinus (sinusite)
· Blocage du transit intestinal ou absence de mouvements intestinaux (occlusion intestinale ou iléus paralytique),
· Inflammation des gencives (gingivite),
· Inflammation de la langue (glossite),
· Infection dans la bouche et la gorge causée par un champignon (candidose oropharyngée),
· Difficultés à avaler (dysphagie),
· Réaction allergiques,
· Urticaire,
· Démangeaisons (prurit),
· Infection des voies urinaires.
Non déterminée:
· Déshydratation,
· Caries dentaires,
· Réactions allergiques sévères entraînant un dème du visage ou de la gorge (dème de Quincke),
· Infections ou ulcérations de la peau,
· Sécheresse de la peau,
· Gonflement des articulations
La survenue d'effets graves suivants doit conduire à arrêter immédiatement le traitement (ne pas renouveler la prise): réactions allergiques entraînant un dème du visage ou de la gorge (dème de Quincke) ou l'oppression du thorax associée à une toux, une respiration sifflante ou des difficultés respiratoires survenant immédiatement après l'inhalation (bronchospasme).
Dans ce cas arrêter le traitement et consultez immédiatement un médecin.
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien.
5. COMMENT CONSERVER SPIRIVA 18 microgrammes, poudre pour inhalation en gélule ?
Tenir hors de la portée et de la vue des enfants.
Date de péremption
Après la première ouverture de la plaquette thermoformée, les gélules sont à conserver 9 jours maximum.
Ne pas utiliser après la date de péremption figurant sur la boîte ou le blister.
Conditions de conservation
A conserver à une température ne dépassant pas +25°C.
Ne pas congeler.
Si nécessaire, mises en garde contre certains signes visibles de détérioration
Les médicaments ne doivent pas être jetés au tout à l'égout ou avec les ordures ménagères. Demandez à votre pharmacien ce qu'il faut faire des médicaments inutilisés. Ces mesures permettront de protéger l'environnement.
6. INFORMATIONS SUPPLEMENTAIRES
Liste complète des substances actives et des excipients
Que contient SPIRIVA 18 microgrammes, poudre pour inhalation en gélule?
La substance active est:
Tiotropium ........................................................................................................................ 18 microgrammes
Sous forme de bromure de tiotropium monohydraté ........................................................... 22,5 microgrammes
Pour une gélule.
La dose délivrée à l'embout buccal du dispositif Handihaler, est de 10 microgrammes de tiotropium.
L' autre composant est:
Lactose monohydraté.
Forme pharmaceutique et contenu
Ce médicament se présente sous la forme de poudre pour inhalation en gélule.
Les gélules sont conditionnées sous forme de plaquettes thermoformées prédécoupées contenant 10 gélules.
Ce médicament est présenté en boîtes de 30, 60 et 90 gélules, en boîtes de 10 et 30 gélules avec le dispositif Handihaler.
Conditionnements hospitaliers: fardelage contenant 5 boîtes de 60 gélules et fardelage contenant 5 boîtes de 30 gélules + le dispositif Handihaler.
Toutes les présentations peuvent ne pas être commercialisées.
Nom et adresse du titulaire de l'autorisation de mise sur le marché et du titulaire de l'autorisation de fabrication responsable de la libération des lots, si différent
Titulaire
BOEHRINGER INGELHEIM INTERNATIONAL GmbH
Binger Strasse 173
55216 Ingelheim am Rhein
ALLEMAGNE
Exploitant
BOEHRINGER INGELHEIM FRANCE
14, rue Jean Antoine de Baif
75013 PARIS
Fabricant
BOEHRINGER INGELHEIM PHARMA GmbH & CO. KG
BINGER STRASSE 173
D - 55216 INGELHEIM AM RHEIN
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants:
Conformément à la réglementation en vigueur.
Date dapprobation de la notice
La dernière date à laquelle cette notice a été approuvée est le {date}.
AMM sous circonstances exceptionnelles
Sans objet.
Informations Internet
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de lAfssaps (France).
Informations réservées aux professionnels de santé
Sans objet.
Autres
INFORMATIONS SUPPLEMENTAIRES
Prenez contact avec votre médecin ou votre pharmacien pour toute information relative à ce médicament.
Pour toute information complémentaire concernant ce médicament, veuillez prendre contact avec le représentant local du titulaire de l'autorisation de mise sur le marché.
BOEHRINGER INGELHEIM FRANCE
14, rue Jean Antoine de Baïf
75013 PARIS
FRANCE













