ANSM - Mis à jour le : 29/11/2004
ZOVIRAX 250 mg, poudre pour solution injectable (IV)
Aciclovir
Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser ce médicament.
· Gardez cette notice, vous pourriez avoir besoin de la relire.
· Si vous avez toute autre question, si vous avez un doute, demandez plus d'informations à votre médecin ou à votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez jamais à quelqu'un d'autre, même en cas de symptômes identiques, cela pourrait lui être nocif.
· Si l'un des effets indésirables devient grave ou si vous remarquez un effet indésirable non mentionné dans cette notice, parlez-en à votre médecin ou à votre pharmacien.
Dans cette notice :
1. QU'EST-CE QUE ZOVIRAX 250 mg, poudre pour solution injectable (IV) ET DANS QUELS CAS EST-IL UTILISE ?
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER ZOVIRAX 250 mg, poudre pour solution injectable (IV) ?
3. COMMENT UTILISER ZOVIRAX 250 mg, poudre pour solution injectable (IV) ?
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
5. COMMENT CONSERVER ZOVIRAX 250 mg, poudre pour solution injectable (IV) ?
6. INFORMATIONS SUPPLEMENTAIRES
ANTIVIRAUX A ACTION DIRECTE.
Ce médicament est un anti-viral.
Il est indiqué pour le traitement de certaines infections dues au virus de l'herpès et certaines formes de la varicelle et du zona.
Liste des informations nécessaires avant la prise du médicament
Sans objet.
N'utilisez jamais ZOVIRAX 250 mg, poudre pour solution injectable (IV) en cas d'allergie connue à l'aciclovir, ou à l'un des autres constituants de la poudre.
Précautions d'emploi ; mises en garde spéciales
Faites attention avec ZOVIRAX 250 mg, poudre pour solution injectable (IV):
Précautions d'emploi
Dans certains cas, par exemple si vous avez une insuffisance rénale ou en fonction de votre âge, votre médecin pourra modifier les doses habituellement préconisées. Prévenez le en cas d'insuffisance rénale connue.
Chez les patients âgés, l'apport en eau doit être suffisant pendant la durée du traitement (boissons ou perfusion).
En cas de traitement intra-veineux associé, il est préférable d'éviter d'injecter plusieurs médicaments en même temps dans une même tubulure ou à fortiori de les mélanger dans une même perfusion. En effet, ce médicament peut cristalliser quand il est associé à certains produits.
Ce médicament contient 28 mg de sodium par flacon: en tenir compte chez les personnes suivant un régime pauvre en sel, strict.
Interactions avec d'autres médicaments
Prise ou utilisation d'autres médicaments
Si vous prenez ou avez pris récemment un autre médicament, y compris un médicament obtenu sans ordonnance, parlez-en à votre médecin ou à votre pharmacien.
Interactions avec les aliments et les boissons
Sans objet.
Interactions avec les produits de phytothérapie ou thérapies alternatives
Sans objet.
Utilisation pendant la grossesse et l'allaitement
Grossesse et allaitement
En cas de besoin, ce médicament peut être utilisé pendant la grossesse. Cependant, si vous êtes enceinte, prévenez votre médecin.
Lorsqu'un traitement par voie intraveineuse est nécessaire, l'allaitement doit être interrompu.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Sans objet.
Effets sur l'aptitude à conduire des véhicules ou à utiliser des machines
Sans objet.
Liste des excipients à effet notoire
Sodium
3. COMMENT UTILISER ZOVIRAX 250 mg, poudre pour solution injectable (IV) ?
Instructions pour un bon usage
Sans objet.
Posologie, Mode et/ou voie(s) d'administration, Fréquence d'administration et Durée du traitement
Posologie
Dans tous les cas se conformer strictement à l'ordonnance de votre médecin.
La posologie est déterminée en fonction de la maladie traitée, de l'âge, et du poids du patient:
· chez l'adulte: 5 à 10 mg/kg toutes les 8 heures.
· chez l'enfant de plus de 3 mois: la posologie sera calculée en fonction de la surface du corps, soit 250 à 500 mg/m2 toutes les 8 heures.
· chez le nouveau-né: 20 mg/kg toutes les 8 heures.
En cas d'insuffisance rénale, la posologie doit être adaptée.
Mode d'administration
Voie intra-veineuse stricte.
La stabilité du produit à température ambiante et à l'abri de la lumière a été vérifiée pour les liquides de perfusions suivants:
· solution de chlorure de sodium (0,45 et 0,9%)
· solution de chlorure de sodium (0,18%) et de glucose (4%)
· solution de chlorure de sodium (0,45%) et de glucose (2,5%)
· solution de lactate de sodium (solution de Hartmann).
La reconstitution et la dilution de l'aciclovir doivent avoir lieu juste avant l'injection. Les solutions reconstituées, partiellement utilisées lors d'une administration, ne doivent pas être réemployées lors des injections suivantes.
La solution ne sera pas utilisée en cas d'apparition d'un trouble ou d'une cristallisation.
Elle ne doit pas être réfrigérée.
Mode d'utilisation du flacon standard (sans le système de transfert)
Reconstituer le contenu du flacon de Zovirax 250 mg avec 10 ml d'eau pour préparations injectables ou une solution de chlorure de sodium isotonique.
La solution une fois reconstituée a un pH compris entre 10,7 et 11,7.
Cette solution peut être administrée en I.V., en perfusion ou avec une pompe à débit constant, en 1 heure minimum.
Il est recommandé de diluer la solution dans un volume suffisant de liquide de perfusion afin de ne pas dépasser une concentration de 5 mg d'aciclovir par ml de liquide de perfusion.
Mode d'utilisation du flacon avec système de transfert:
Le système de transfert est un dispositif à usage unique, qui facilite la reconstitution et le transfert de la solution injectable de Zovirax dans une poche de perfusion avec site d'injection.
Le volume de la poche de perfusion doit être adapté au nombre de flacons de Zovirax I.V.à diluer: le but est d'obtenir une solution d'aciclovir dont la concentration est au maximum de 5 mg/ml.
|
NOMBRE MAXIMUM DE FLACONS DE ZOVIRAX I.V. 250 mg A DILUER |
VOLUME DE LA POCHE |
|
1 |
50 ml |
|
2 |
100 ml |
|
5 |
250 ml |
|
10 |
500 ml |
La solution une fois reconstituée a un pH compris entre 10,7 et 11,7. Cette solution peut être administrée en I.V., en perfusion ou avec une pompe à débit constant, en 1 heure minimum.
Pour une bonne utilisation, il est conseillé d'adopter la technique de reconstitution suivante:

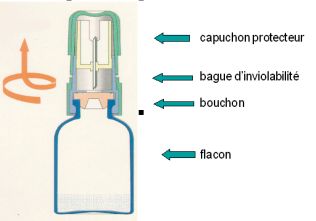
1 - Enlever le capuchon protecteur du flacon de Zovirax avec système de transfert. Pour cela, maintenir fermement d'une main le flacon et la bague blanche d'inviolabilité et tourner en tirant le capuchon vers le haut avec l'autre main.
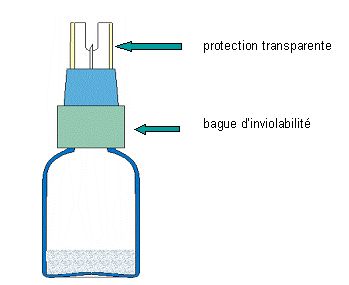
2 - Enfoncer l'aiguille dans le site d'injection de la poche de perfusion.
Puis pousser fortement en tournant vers le bas la protection transparente afin que l'aiguille perce le bouchon du flacon. La protection transparente de l'aiguille ne doit pas dépasser de plus d'un demi centimètre de la bague blanche.
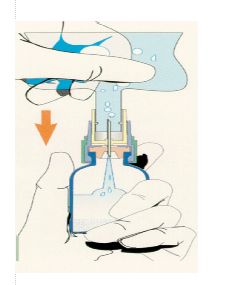
3 - Tenir le flacon droit et presser la poche de perfusion afin de remplir environ la moitié du flacon (environ 10 ml).
4 - Agiter le flacon pour reconstituer la solution. Vérifier que le lyophilisat soit totalement dissous.
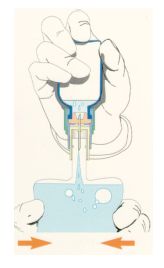
5 - Retourner l'ensemble Zovirax avec système de transfert et poche de perfusion.
Faire passer la solution de Zovirax reconstituée dans la poche de perfusion en tenant le flacon à l'envers en pressant et en relâchant la poche à plusieurs reprises afin d'aspirer le liquide.
6 - Retirer Zovirax avec système de transfert de son insertion dans l'embout de la poche de perfusion. Jeter le flacon vide.
Agiter la poche de perfusion. Vérifier la limpidité de la solution obtenue et l'étanchéité de la poche.
7 - Après reconstitution, détacher l'étiquette placée sur le bouchon. Celle-ci comprend le nom du produit et peut être collée sur la poche afin de l'identifier.
Durée du traitement
La durée du traitement sera adaptée suivant l'état du malade et sa réponse au traitement. Elle est en général de 5 à 10 jours.
Symptômes et instructions en cas de surdosage
Sans objet.
Instructions en cas d'omission d'une ou de plusieurs doses
Sans objet.
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Description des effets indésirables
Comme tous les médicaments, ZOVIRAX 250 mg, poudre pour solution injectable (IV) est susceptible d'avoir des effets indésirables, bien que tout le monde n'y soit pas sujet.
· Troubles digestifs:
Nausées, vomissements, diarrhées.
· Troubles rénaux:
Augmentation de l'urée et de la créatinine sanguines et rarement insuffisance rénale aiguë. Ces troubles sont favorisés par toute situation de surdosage et/ou de déshydratation, ou par l'association avec des médicaments toxiques pour le rein. Ces facteurs de risque doivent être recherchés, quel que soit l'âge du patient. Le risque d'insuffisance rénale peut être évité en respectant les posologies, les précautions d'emploi (notamment le maintien d'une hydratation adéquate) et une vitesse d'administration lente.
· Troubles neurologiques:
Maux de tête, sensations ébrieuses, confusion, agitation, tremblements, myoclonies (contractions musculaires involontaires), convulsions, hallucinations, psychose (troubles de la personnalité), somnolence, coma survenant plutôt chez le patient âgé ou avec une insuffisance rénale.
Une regression complète est habituelle à l'arrêt du traitement.
La présence de ces symptômes peut être due à un surdosage, parlez en rapidement à votre médecin.
· Troubles hépatiques:
Augmentation réversible des enzymes du foie.
· Manifestations allergiques:
Eruptions cutanées, urticaire, prurit (démangeaisons) et exceptionnellement dyspnées (difficultés respiratoires), œdèmes de Quincke (brusque gonflement du visage et du cou) et réactions anaphylactiques (allergie généralisée).
· Exceptionnellement, diminution de certains éléments du sang.
· Effets divers:
o Des cas de fatigue ont parfois été rapportés.
o Lésions inflammatoires de la peau à l'endroit de l'injection, pouvant parfois être sévères.
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien.
5. COMMENT CONSERVER ZOVIRAX 250 mg, poudre pour solution injectable (IV) ?
Tenir hors de la portée et de la vue des enfants.
Ne pas utiliser ZOVIRAX 250 mg, poudre pour solution injectable (IV) après la date de péremption mentionnée sur la boîte.
Ce médicament doit être conservé à l'abri de la lumière.
Si nécessaire, mises en garde contre certains signes visibles de détérioration
Les médicaments ne doivent pas être jetés au tout à l'égout ou avec les ordures ménagères. Demandez à votre pharmacien ce qu'il faut faire des médicaments inutilisés. Ces mesures permettront de protéger l'environnement.
6. INFORMATIONS SUPPLEMENTAIRES
Liste complète des substances actives et des excipients
Que contient ZOVIRAX 250 mg, poudre pour solution injectable (IV) ?
La substance active est:
Aciclovir .......................................................................................................................................... 250 mg
Pour un flacon de poudre.
L' autre composant est:
Hydroxyde de sodium.
Forme pharmaceutique et contenu
Qu'est-ce que ZOVIRAX 250 mg, poudre pour solution injectable (IV) et contenu de l'emballage extérieur ?
Ce médicament se présente sous forme de poudre pour solution pour injectable (I.V.).
Boîte de 1 flacon avec ou sans système de transfert
Laboratoire GLAXOSMITHKLINE
100, route de Versailles
78163 Marly-le-Roi Cedex
FRANCE
GLAXOSMITHKLINE
100, route de Versailles
78163 MARLY-LE-ROI CEDEX
FRANCE
ELAIAPHARM
2881, route des cretes - les bouillides
06904 SOPHIA ANTIPOLIS - VALBONNE
FRANCE
ou
GLAXOSMITHKLINE MANUFACTURING S.p.A.
Strada Provinciale Asolana 90
43056 SAN POLO DI TORRILE-PARME
ITALIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
Date d’approbation de la notice
La dernière date à laquelle cette notice a été approuvée est le {date}.
AMM sous circonstances exceptionnelles
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’Afssaps (France).
Informations réservées aux professionnels de santé
Sans objet.
Sans objet.