NOTICE
ANSM - Mis à jour le : 18/04/2012
Dénomination du médicament
TEGELINE 50 mg/ml, poudre et solvant pour solution pour perfusion
Immunoglobuline humaine normale
Encadré
Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser ce médicament.
· Gardez cette notice, vous pourriez avoir besoin de la relire.
· Si vous avez toute autre question, si vous avez un doute, demandez plus d'informations à votre médecin ou à votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez jamais à quelqu'un d'autre, même en cas de symptômes identiques, cela pourrait lui être nocif.
· Si l'un des effets indésirables devient grave ou si vous remarquez un effet indésirable non mentionné dans cette notice, parlez-en à votre médecin ou à votre pharmacien.
Sommaire notice
Dans cette notice :
1. QU'EST-CE QUE TEGELINE 50 mg/ml, poudre et solvant pour solution pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER TEGELINE 50 mg/ml, poudre et solvant pour solution pour perfusion ?
3. COMMENT UTILISER TEGELINE 50 mg/ml, poudre et solvant pour solution pour perfusion ?
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
5. COMMENT CONSERVER TEGELINE 50 mg/ml, poudre et solvant pour solution pour perfusion ?
6. INFORMATIONS SUPPLEMENTAIRES
1. QU'EST-CE QUE TEGELINE 50 mg/ml, poudre et solvant pour solution pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique
C'est une immunoglobuline humaine normale (Immunsérums et immunoglobulines ).
Indications thérapeutiques
Ce médicament est indiqué dans:
· les déficits immunitaires primitifs (insuffisances congénitales du système immunitaire) avec hypogammaglobulinémie (avec défaut de production d'anticorps) ou atteinte fonctionnelle de l'immunité humorale (anomalie du fonctionnement des anticorps),
· les infections bactériennes récidivantes chez l'enfant infecté par le VIH,
· certains déficits immunitaires secondaires (liés à une autre maladie) avec défaut de production d'anticorps et associés à des infections à répétition, allogreffe de cellules souches hématopoïétiques (greffe de cellules de moelle osseuse à l'origine des globules rouges, des globules blancs et des plaquettes) avec défaut de production d'anticorps et associée à une infection,
· le purpura thrombopénique idiopathique (PTI) (quantité insuffisante de plaquettes dans le sang) chez l'adulte et l'enfant, en cas de risque hémorragique (saignement) important ou avant une intervention chirurgicale pour corriger le taux de plaquettes,
· la rétinochoroïdite de Birdshot,
· le syndrome de Guillain et Barré de l'adulte,
· la neuropathie motrice multifocale (NMM),
· la polyradiculonévrite inflammatoire démyélinisante chronique (PIDC),
· la maladie de Kawasaki.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER TEGELINE 50 mg/ml, poudre et solvant pour solution pour perfusion ?
Liste des informations nécessaires avant la prise du médicament
Sans objet.
Contre-indications
N'utilisez jamais TEGELINE 50 mg/ml, poudre et solvant pour solution pour perfusion dans les cas suivants:
· si vous êtes allergique aux immunoglobulines humaines, en particulier chez les patients présentant un déficit en immunoglobulines A (IgA) et avec des anticorps circulants anti-IgA,
· si vous avez une allergie connue à l'un des constituants de la préparation.
Précautions d'emploi ; mises en garde spéciales
Faites attention avec TEGELINE 50 mg/ml, poudre et solvant pour solution pour perfusion en cas:
· d'insuffisance rénale, obésité et(ou) âge supérieur à 65 ans;
· de diabète latent, diabète ou régime hypoglucidique (régime pauvre en sucres).
Pour l'établissement du diagnostic de neuropathie motrice multifocale (NMM), une expertise clinique préalable devra être réalisée auprès d'un centre de référence labellisé pour les neuropathies périphériques ou les maladies neuromusculaires.
L'initiation du traitement par TEGELINE des polyradiculonévrites inflammatoires démyélinisantes chroniques (PIDC) devra être réalisée après avis d'un centre de référence labellisé pour les neuropathies périphériques ou les maladies neuromusculaires.
Certains effets indésirables peuvent être associés au débit d'administration. Le débit recommandé au paragraphe "Mode et voie d'administration" doit être scrupuleusement observé et les patients doivent rester sous surveillance pendant toute la durée de la perfusion afin de détecter d'éventuels signes d'intolérance.
Le risque d'allergie généralisée, voire d'état de choc, est plus fréquent:
· en cas de perfusion intraveineuse rapide (voir paragraphe "Mode et voie d'administration"),
· chez des patients hypo- ou agammaglobulinémiques (déficitaires en anticorps ou dont la quantité d'anticorps est insuffisante) avec ou sans déficit en IgA et plus particulièrement lors de la première perfusion de TEGELINE ou lorsque le dernier traitement par TEGELINE remonte à plus de 8 semaines.
Les vraies réponses allergiques à ce médicament sont rares. Une intolérance aux immunoglobulines peut se développer dans les très rares cas de déficit en IgA où le patient possède des anticorps anti-IgA.
Très rarement, TEGELINE peut entraîner une chute brutale de la pression artérielle associée à une allergie généralisée même chez des patients qui ont présenté une bonne tolérance à une administration précédente d'immunoglobuline humaine normale.
En cas de réactions de type allergique, il convient d'interrompre immédiatement la perfusion. En cas de choc, le traitement symptomatique de l'état de choc devra être instauré.
Le patient doit être maintenu sous observation pendant au moins 20 minutes après la fin de la perfusion. En cas de première perfusion de TEGELINE, le patient doit être maintenu sous observation pendant au moins 1 heure après la fin de la perfusion.
Ce médicament contient 8 mg de sodium pour 10 ml: en tenir compte chez les personnes suivant un régime pauvre en sel, strict.
Les complications potentielles peuvent être souvent évitées; il est souhaitable:
· de surveiller attentivement le débit des perfusions;
· de s'assurer initialement de la tolérance de l'administration de TEGELINE par une perfusion lente (1 ml/kg/h);
· de garder les patients sous surveillance pendant toute la durée de la perfusion, afin de détecter d'éventuels signes d'intolérance.
Des cas d'insuffisance rénale aiguë (altération du fonctionnement du rein) ont été rapportés chez des patients recevant de l'immunoglobuline humaine normale. Dans la plupart des cas, des facteurs de risque ont été identifiés, tels une insuffisance rénale pré-existante, un diabète, une hypovolémie (insuffisance du volume circulant), une obésité, la prise concomitante de médicaments néphrotoxiques ou un âge supérieur à 65 ans.
Chez ces patients, l'administration de TEGELINE impose:
· une hydratation correcte avant l'administration de TEGELINE,
· de surveiller la diurèse (volume d'urine émis par 24 heures),
· de doser la créatininémie (mesure du fonctionnement du rein),
· d'éviter d'associer certains diurétiques.
Bien que ces cas d'insuffisance rénale aient été associés à l'utilisation de nombreuses spécialités d'immunoglobuline humaine normale, celles contenant du saccharose comme stabilisant représentent la plus large part.
Aussi, chez les patients à risque, l'utilisation de préparations d'immunoglobuline humaine normale ne contenant pas de saccharose doit être envisagée.
Le risque de transmission d'agents infectieux, y compris ceux dont la nature est encore inconnue, ne peut pas être définitivement exclu lorsque sont administrés des médicaments préparés à partir de sang ou de plasma humain. Ce risque est cependant limité par:
· de stricts contrôles effectués lors de la sélection des dons par un entretien médical avec les donneurs et la réalisation de tests de dépistage des principaux marqueurs viraux sur chaque don,
· la recherche du matériel génomique du virus de l'hépatite C sur les pools de plasma,
· le procédé de préparation de ce produit qui inclut des étapes d'élimination et(ou) d'inactivation des virus, dont l'efficacité a été établie au moyen d'études de validation virale.
L'efficacité de l'élimination et(ou) de l'inactivation virale reste cependant limitée vis-à-vis de certains virus non enveloppés particulièrement résistants.
Interactions avec d'autres médicaments
Prise ou utilisation d'autres médicaments
Vaccins constitués de virus vivants atténués
L'administration de TEGELINE peut entraver l'efficacité des vaccins constitués de virus vivants atténués, tels que les vaccins contre la rougeole, la rubéole, les oreillons et la varicelle. Après l'injection de TEGELINE, attendre au minimum 6 semaines (de préférence 3 mois) avant d'administrer ce type de vaccins.
Si le patient a reçu des vaccins constitués de virus vivants atténués (rougeole, rubéole, oreillons, varicelle), au cours des deux semaines précédant l'injection, un contrôle des anticorps protecteurs post-vaccinaux peut être nécessaire en vue d'un éventuel rappel.
Interférence avec les tests sérologiques
Après une perfusion de TEGELINE, l'augmentation transitoire de la concentration de divers anticorps transférés peut être responsable de sérologies positives (présence d'anticorps dans le sang) temporaires.
Ce médicament contenant des anticorps anti-érythrocytaires (anticorps dirigés contre les globules rouges), son administration peut être suivie de façon transitoire d'un test de Coombs positif (test effectué pour détecter la présence de ces anticorps).
Si vous prenez ou avez pris récemment un autre médicament, y compris un médicament obtenu sans ordonnance, parlez-en à votre médecin ou à votre pharmacien.
Interactions avec les aliments et les boissons
Sans objet.
Interactions avec les produits de phytothérapie ou thérapies alternatives
Sans objet.
Utilisation pendant la grossesse et l'allaitement
Grossesse et allaitement
Grossesse
Aucune étude de reproduction chez l'animal n'a été conduite avec TEGELINE et l'expérience chez la femme enceinte est limitée. Bien qu'aucune réaction indésirable sur le ftus n'ait été observée, TEGELINE ne doit être administrée qu'en cas de nécessité bien établie.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Allaitement
Les protéines contenues dans TEGELINE sont des constituants normaux du plasma humain. Leur passage dans le lait maternel ne doit pas provoquer d'effets indésirables chez le nouveau-né.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Sportifs
Sans objet.
Effets sur l'aptitude à conduire des véhicules ou à utiliser des machines
Conduite de véhicules et utilisation de machines
Rien ne suggère que TEGELINE diminue l'aptitude à conduire des véhicules et à utiliser des machines.
Liste des excipients à effet notoire
Liste des excipients à effet notoire: sodium.
3. COMMENT UTILISER TEGELINE 50 mg/ml, poudre et solvant pour solution pour perfusion ?
Instructions pour un bon usage
Sans objet.
Posologie, Mode et/ou voie(s) d'administration, Fréquence d'administration et Durée du traitement
La posologie et l'intervalle entre les administrations dépendent de l'usage auquel est destiné le traitement (remplacement ou modulation du système immunitaire) et de la demi-vie de l'immunoglobuline humaine normale par voie intraveineuse (IgIV) in vivo chez les patients atteints de déficit immunitaire.
Les posologies suivantes sont données à titre indicatif:
Traitement de substitution en cas de déficit immunitaire primitif:
Le traitement doit avoir pour but d'assurer un taux d'immunoglobulines G résiduel (c'est-à-dire avant l'administration suivante de TEGELINE) d'au moins 6 g/l. La persistance des infections peut amener à respecter un seuil d'IgG résiduel de 8, voire 10 g/l. Après le début d'un traitement par TEGELINE, l'équilibre s'effectue en 3 à 6 mois. On peut recommander une dose de charge de 0,4 à 0,8 g/kg selon les circonstances (infection) puis une perfusion de 0,2 g/kg toutes les 3 semaines. Les doses de TEGELINE nécessaires pour atteindre un taux résiduel de 6 g/l sont de l'ordre de 0,3 g/kg/mois avec des extrêmes de 0,2 à 0,8 g/kg/mois. La fréquence de perfusion varie de 15 jours à 1 mois. La survenue d'infections peut nécessiter l'emploi temporaire de perfusions plus fréquentes. Dans le traitement substitutif des déficits immunitaires primitifs, un dosage des concentrations sériques d'immunoglobulines G avant chaque perfusion s'avère nécessaire pour contrôler l'activité du traitement et éventuellement ajuster la dose ou l'intervalle d'administration.
Traitement de substitution en cas de déficit immunitaire secondaire:
On peut recommander une dose de 0,2 à 0,4 g/kg toutes les 3 à 4 semaines afin, d'assurer un taux d'IgG résiduel (c'est-à-dire avant l'injection suivante d'IgIV) d'au moins 4 à 6 g/l.
Le traitement de substitution dans les déficits immunitaires primitifs et secondaires peut être effectué à domicile chez les patients préalablement traités par TEGELINE pendant au moins 6 mois en milieu hospitalier sans apparition d'effet indésirable. L'administration doit être initiée et surveillée par une infirmière ou une personne ayant satisfait à une formation spécifique par l'équipe hospitalière en charge du patient.
Purpura thrombopénique idiopathique (PTI):
Pour le traitement d'attaque, 0,8 à 1 g/kg/j au jour 1, éventuellement répété au jour 3, ou 0,4 g/kg/j pendant 2 à 5 jours. Ce traitement peut être renouvelé en cas de réapparition d'une thrombopénie sévère (diminution importante du nombre de plaquettes dans le sang).
Traitement de la rétinochoroïdite de Birdshot
La posologie initiale sera de 1,6 g/kg sur 2 à 4 jours toutes les 4 semaines pendant 6 mois. En entretien, 1,2 g/kg sur 2 à 4 jours, toutes les 4 à 10 semaines.
Syndrome de Guillain et Barré de l'adulte:
0,4 g/kg de poids corporel/jour pendant 5 jours.
Neuropathie motrice multifocale (NMM):
Pour le traitement d'attaque, la posologie de 2 g/kg administrés sur 2 à 5 jours et répétés toutes les 4 semaines sera maintenue pendant 6 mois.
Le traitement d'entretien est de 2 g/kg administrés sur 2 à 5 jours. L'intervalle entre les administrations de TEGELINE et la durée du traitement d'entretien seront adaptés au délai individuel de réapparition des symptômes chez les patients.
En l'absence d'effet thérapeutique, le traitement par TEGELINE pourra être arrêté après au minimum 3 mois et au maximum 6 mois de traitement.
Polyradiculonévrite inflammatoire démyélinisante chronique (PIDC):
Pour le traitement d'attaque, la posologie de 2 g/kg administrée sur 5 jours et répétée toutes les 4 semaines sera maintenue pendant 4 mois maximum, en fonction de la réponse au traitement.
L'absence d'effet thérapeutique devra être évaluée à chaque cure et l'arrêt du traitement devra être envisagé après 3 mois de traitement sans effet.
Maladie de Kawasaki:
1,6 à 2,0 g/kg administrés en plusieurs doses réparties sur 2 à 5 jours ou 2,0 g/kg en dose unique, associées à l'acide acétylsalicylique.
Posologie et mode d'administration
|
Indication
|
Posologie
|
Rythme des injections
|
Traitement associé
|
|
Traitement substitutif
|
|
|
|
|
Déficits immunitaires primitifs
|
· dose de charge:
0,4 à 0,8 g/kg
|
|
|
|
|
· dose d'entretien: 0,2 à 0,8 g/kg
|
toutes les 2 à 4 semaines pour obtenir un taux résiduel d'IgG d'au moins 6 g/l. La persistance des infections peut amener à respecter un seuil d'IgG résiduel de 8, voire 10 g/l
|
|
|
Déficits immunitaires secondaires
|
0,2 à 0,4 g/kg
|
toutes les 3 à 4 semaines pour obtenir un taux résiduel d'IgG d'au moins 4 à 6 g/l
|
|
|
Traitement immunomodulateur:
|
|
|
|
|
Purpura
thrombopénique
|
0,8 à 1 g/kg
ou
|
à J1, éventuellement répété à J3
|
|
|
idiopathique
|
0,4 g/kg/j
|
pendant 2 à 5 jours
|
|
|
Rétinochoroïdite de Birdshot
|
· dose initiale:
1,6 g/kg sur 2 à 4 j
|
toutes les 4 semaines pendant 6 mois
|
|
|
|
· dose d'entretien:
1,2 g/kg sur 2 à 4 j
|
toutes les 4 à 10 semaines
|
|
|
Syndrome de Guillain et Barré de l'adulte
|
0,4 g/kg/j
|
pendant 5 jours
|
|
|
Neuropathie motrice multifocale (NMM)
|
· dose initiale:
2 g/kg sur 2 à 5 j
|
toutes les 4 semaines pendant 6 mois
|
|
|
|
· dose d'entretien:
2 g/kg sur 2 à 5 j
|
l'intervalle entre les administrations et la durée du traitement d'entretien seront adaptés au délai individuel de réapparition des symptômes
|
|
|
Polyradiculonévrite inflammatoire démyélinisante chronique (PIDC)
|
2 g/kg sur 5 j
|
toutes les 4 semaines pendant 4 mois maximum, en fonction de la réponse au traitement
|
|
|
Maladie de Kawasaki
|
1,6 à 2,0 g/kg
ou
|
en plusieurs doses réparties sur 2 à 5 jours
|
acide acétylsalicylique
|
|
|
2 g/kg
|
en une dose unique
|
|
TEGELINE se présente sous la forme d'une poudre à reconstituer extemporanément avec de l'eau pour préparations injectables.
Respecter les règles d'asepsie habituelles.
Reconstitution:
|

|
Si nécessaire, amener les deux flacons (poudre et solvant) à température ambiante.
|
|

|
Retirer la capsule protectrice du flacon de solvant (eau pour préparations injectables) et du flacon de poudre.
Désinfecter la surface de chaque bouchon.
|
|

|
Retirer le capuchon protecteur translucide du système de transfert et insérer à fond le biseau, ainsi dégagé, au centre du bouchon du flacon de solvant en opérant simultanément un mouvement de rotation.
|
|
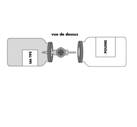
|
Retirer le deuxième capuchon protecteur de l'autre extrémité du système de transfert.
Maintenir les deux flacons dans une position horizontale (évent vers le haut) et enfoncer rapidement l'extrémité libre du biseau au centre du bouchon du flacon de poudre.
Veiller à ce que le biseau soit toujours immergé dans le solvant pour éviter un cassage précoce du vide.
|
|

|
Placer immédiatement l'ensemble dans une position verticale, flacon de solvant bien au-dessus du flacon de poudre, de façon à permettre le transfert du solvant vers la poudre.
Pendant le transfert, diriger le jet de solvant sur toute la surface de la poudre. Veiller à ce que la totalité du solvant soit transférée.
A la fin du transfert, le vide est automatiquement cassé (air stérile).
|
|

|
Retirer le flacon vide (solvant) avec le système de transfert.
Agiter modérément par un mouvement de rotation doux pour éviter la formation de mousse, jusqu'à dissolution complète de la poudre.
|
Le produit reconstitué doit être examiné à l'il, afin de s'assurer qu'il ne contient pas de particules.
La solution reconstituée présente une opalescence plus ou moins prononcée.
Ne pas utiliser de solution présentant un aspect non homogène ou contenant un dépôt.
Administration:
Présentation 10 ml: équiper une seringue avec l'aiguille-filtre et aspirer la solution reconstituée.
Présentations 50 ml, 100 ml et 200 ml: équiper le flacon contenant la solution reconstituée avec le nécessaire de perfusion muni d'un filtre non stérilisant de 15 µm.
Le débit sera adapté en fonction de la tolérance clinique, sans dépasser un débit de 1 ml/kg/h pendant la première demi-heure, puis en augmentant progressivement sans dépasser 4 ml/kg/h.
Immédiatement après reconstitution, injecter la solution par voie intraveineuse en une seule fois (à noter que compte tenu de la stabilité après reconstitution, la perfusion pourrait être effectuée dans les 24 heures).
Toute fraction de solution non utilisée doit être éliminée de manière appropriée.
Symptômes et instructions en cas de surdosage
Si vous avez utilisé plus de TEGELINE 50 mg/ml, poudre et solvant pour solution pour perfusion que vous n'auriez dû:
Bien qu'aucun cas de surdosage n'ait été rapporté avec TEGELINE, la survenue de certains effets secondaires (voir Quels sont les effets indésirables éventuels ?) dose-dépendants pourraient être favorisés: méningite, insuffisance rénale (anomalie de la fonction rénale), hyperviscosité sanguine (épaississement du sang).
Instructions en cas d'omission d'une ou de plusieurs doses
Si vous oubliez de prendre TEGELINE 50 mg/ml, poudre et solvant pour solution pour perfusion:
Ne prenez pas de dose double pour compenser la dose simple que vous avez oublié de prendre.
Risque de syndrome de sevrage
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Description des effets indésirables
Comme tous les médicaments, TEGELINE 50 mg/ml, poudre et solvant pour solution pour perfusion est susceptible d'avoir des effets indésirables, bien que tout le monde n'y soit pas sujet.
· Les effets secondaires liés à l'administration de TEGELINE sont plus fréquents chez les malades atteints de déficits immunitaires primitifs.
· Comme avec les autres immunoglobulines humaines normales, des réactions de type frissons-hyperthermie (augmentation de la température du corps) parfois accompagnées de céphalées (maux de tête), de nausées (envies de vomir), de vomissements, de manifestations allergiques, d'élévation ou de chute de la pression artérielle, d'arthralgies (douleurs au niveau des articulations), lombalgies (douleurs lombaires) et myalgies (douleurs musculaires) modérées peuvent survenir occasionnellement.
· Le risque de réaction allergique généralisée est plus élevé en cas de première perfusion ou de traitement immunomodulateur et peut survenir immédiatement, ou entre 30 et 60 minutes après la fin de la perfusion (voir Faites attention avec TEGELINE 50 mg/ml, poudre et solvant pour solution pour perfusion). En cas de choc, le traitement symptomatique de l'état de choc devra être instauré.
· De rares cas d'hypotension (pression sanguine anormalement basse) et de réaction allergique généralisée ont été rapportés même chez des patients n'ayant pas présenté de réactions d'allergie lors de perfusions antérieures.
· De rares cas de poussées hypertensives isolées (pression sanguine anormalement haute) ont été rapportés chez les patients recevant des immunoglobulines humaines normales.
· Comme avec les autres préparations d'immunoglobuline humaine normale, de rares cas de réactions cutanées surtout eczématiformes, régressives, de rares cas d'anémie hémolytique (diminution du nombre de globules rouges dans le sang par destruction) et(ou) hémolyse (destruction des globules rouges) régressive, des cas d'augmentation de la créatininémie (mesure de fonctionnement du rein), et(ou) d'insuffisance rénale aiguë (anomalie de la fonction rénale) et de très rares cas d'augmentation transitoire des transaminases ont été rapportés.
· Des cas de réaction méningée aseptique (méningite), particulièrement chez les patients présentant un purpura thrombopénique idiopathique (diminution du nombre des plaquettes dans le sang) ont été rapportés avec les préparations d'immunoglobuline humaine normale. Cette méningite est réversible en quelques jours après l'arrêt du traitement.
· De rares cas de thrombose ont été rapportés avec les immunoglobulines humaines normales en majorité chez les sujets âgés, ainsi que chez les patients présentant des risques d'ischémie (diminution de l'apport sanguin) cérébrale ou cardiaque, une surcharge pondérale ou atteints d'hypovolémie (diminution du volume sanguin circulant) sévère.
· Une leuco-neutropénie (baisse des globules blancs dans le sang) régressive en quelques jours est possible.
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien.
5. COMMENT CONSERVER TEGELINE 50 mg/ml, poudre et solvant pour solution pour perfusion ?
Tenir hors de la portée et de la vue des enfants.
Date de péremption
Ne pas utiliser TEGELINE 50 mg/ml, poudre et solvant pour solution pour perfusion après la date de péremption mentionnée sur la boîte.
Conditions de conservation
A conserver à une température ne dépassant pas + 25°C et à l'abri de la lumière. Ne pas congeler.
Si nécessaire, mises en garde contre certains signes visibles de détérioration
Les médicaments ne doivent pas être jetés au tout à l'égout ou avec les ordures ménagères. Demandez à votre pharmacien ce qu'il faut faire des médicaments inutilisés. Ces mesures permettront de protéger l'environnement.
6. INFORMATIONS SUPPLEMENTAIRES
Liste complète des substances actives et des excipients
Immunoglobuline humaine normale...................................................................................................... 50 mg*
pour 1 ml de solution reconstituée
*correspondant à une quantité totale en protéines dont le taux d'IgG n'est pas inférieur à 97 % et est en moyenne de 97,6 %.
La poudre a une teneur maximale en IgA de 17 mg/g de protéines et contient des traces de pepsine d'origine animale.
Après reconstitution:
un flacon de 10 ml contient 0,5 g d'immunoglobuline humaine normale,
un flacon de 50 ml contient 2,5 g d'immunoglobuline humaine normale,
un flacon de 100 ml contient 5 g d'immunoglobuline humaine normale,
un flacon de 200 ml contient 10 g d'immunoglobuline humaine normale.
Distribution des sous-classes d'IgG (valeurs usuelles) :
IgG1 : 50-68 %
IgG2 : 27-43 %
IgG3 : 2,6-4,2 %
IgG4 : 1,7-3,3 %
Forme pharmaceutique et contenu
Qu'est-ce que TEGELINE 50 mg/ml, poudre et solvant pour solution pour perfusion et contenu de l'emballage extérieur ?
TEGELINE se présente sous forme d'une poudre et d'un solvant pour solution pour perfusion. Flacon de 10, 50, 100 ou 200 ml.
Nom et adresse du titulaire de l'autorisation de mise sur le marché et du titulaire de l'autorisation de fabrication responsable de la libération des lots, si différent
Titulaire
LFB-BIOMEDICAMENTS
3, avenue des Tropiques
ZA de Courtaboeuf
91940 Les Ulis
Exploitant
LFB-BIOMEDICAMENTS
3, avenue des Tropiques
ZA de Courtaboeuf
91940 Les Ulis
Fabricant
LFB-BIOMEDICAMENTS
3, avenue des Tropiques
ZA de Courtaboeuf
91940 Les Ulis
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
Date dapprobation de la notice
La dernière date à laquelle cette notice a été approuvée est le {date}.
AMM sous circonstances exceptionnelles
Sans objet.
Informations Internet
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de lAfssaps (France).
Informations réservées aux professionnels de santé
Sans objet.
Autres
Sans objet.





