NOTICE
ANSM - Mis à jour le : 27/09/2012
Dénomination du médicament
GENOTONORM 5,3 mg, poudre et solvant pour solution injectable <en stylo prérempli>, <en cartouche à double compartiment>
Somatropine
Encadré
Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser ce médicament.
· Gardez cette notice, vous pourriez avoir besoin de la relire.
· Si vous avez toute autre question, si vous avez un doute, demandez plus d'informations à votre médecin ou à votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez jamais à quelqu'un d'autre, même en cas de symptômes identiques, cela pourrait lui être nocif.
· Si l'un des effets indésirables devient grave ou si vous remarquez un effet indésirable non mentionné dans cette notice, parlez-en à votre médecin ou à votre pharmacien.
Sommaire notice
Dans cette notice :
1. QU'EST-CE QUE GENOTONORM 5,3 mg, poudre et solvant pour solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER GENOTONORM 5,3 mg, poudre et solvant pour solution injectable ?
3. COMMENT UTILISER GENOTONORM 5,3 mg, poudre et solvant pour solution injectable ?
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
5. COMMENT CONSERVER GENOTONORM 5,3 mg, poudre et solvant pour solution injectable ?
6. INFORMATIONS SUPPLEMENTAIRES
1. QU'EST-CE QUE GENOTONORM 5,3 mg, poudre et solvant pour solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique
Sans objet.
Indications thérapeutiques
GENOTONORM est une hormone de croissance recombinante humaine (également appelée somatropine). Elle a une structure similaire à celle de l'hormone de croissance humaine naturelle qui est nécessaire à la croissance des os et des muscles. Elle permet aussi aux tissus graisseux et musculaire de votre organisme de se développer dans des proportions convenables. Le terme « recombinante » signifie qu'elle n'est pas fabriquée à partir d'un tissu humain ou animal.
Chez les enfants, GENOTONORM est utilisé dans le traitement des troubles suivants:
· Si vous ne grandissez pas correctement et que vous ne produisez pas assez de votre propre hormone de croissance.
· Si vous souffrez d'un syndrome de Turner. Le syndrome de Turner est une anomalie chromosomique observée chez les filles qui peut avoir des conséquences sur la croissance - votre médecin vous aura indiqué si vous en êtes atteinte.
· Si vous souffrez d'une insuffisance rénale chronique (reins). Les reins perdent leur capacité à fonctionner normalement ce qui peut avoir des conséquences sur la croissance.
· Si vous êtes atteint d'un syndrome Prader-Willi (anomalie chromosomique). L'hormone de croissance vous aidera à grandir si vous êtes encore en période de croissance et améliorera également votre composition corporelle (diminution des graisses et augmentation de la masse musculaire).
· Si vous étiez petit(e) ou d'un poids trop faible à la naissance. Si vous n'avez pas pu conserver une croissance normale ou rattraper le retard de croissance à l'âge de quatre ans ou plus, l'hormone de croissance pourra vous aider à grandir.
Chez l'adulte, GENOTONORM est indiqué en cas d'insuffisance en hormone de croissance. Celle-ci peut survenir à l'âge adulte, ou peut être acquise depuis l'enfance.
Si vous avez été traité par GENOTONORM pour insuffisance en hormone de croissance pendant votre enfance, le déficit en hormone de croissance sera réévalué lorsque la croissance staturale sera achevée. Si l'insuffisance sévère en hormone de croissance est confirmée, votre médecin vous proposera de continuer le traitement par GENOTONORM.
Ce traitement doit vous être prescrit après confirmation du diagnostic par un médecin spécialisé et expérimenté dans la prise en charge des patients souffrant d'insuffisance en hormone de croissance.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER GENOTONORM 5,3 mg, poudre et solvant pour solution injectable ?
Liste des informations nécessaires avant la prise du médicament
Sans objet
Contre-indications
N’utilisez jamais GENOTONORM 5,3 mg, poudre et solvant pour solution injectable et prévenez votre médecin si :
· vous êtes allergique (hypersensible) à la somatropine ou l’un des autres composants contenus dans GENOTONORM.
· vous avez une tumeur active (cancer). Les tumeurs doivent être inactives et vous devez avoir terminé votre traitement anti-tumoral avant de commencer votre traitement par GENOTONORM.
· vous êtes gravement malade (par exemple, si vous souffrez de complications suite à une intervention chirurgicale à cœur ouvert ou abdominale, d’insuffisance respiratoire aiguë, d’un traumatisme accidentel ou d’affections similaires). Si vous êtes sur le point de subir une intervention majeure ou que vous venez de la subir ou êtes sur le point d’aller à l’hôpital quelle qu’en soit la cause, informez-en votre médecin et rappelez aux autres médecins que vous consultez que vous prenez de l’hormone de croissance.
· GENOTONORM a été prescrit pour stimuler votre croissance mais vous avez déjà arrêté de grandir (épiphyses soudées).
Précautions d'emploi ; mises en garde spéciales
Faites attention avec GENOTONORM 5,3 mg, poudre et solvant pour solution injectable et prévenez votre médecin si vous êtes concerné par un des faits suivants :
· Si vous êtes sujet à risque de développer un diabète, votre médecin devra surveiller votre taux de glucose dans le sang (glycémie) lors du traitement par GENOTONORM.
· Si vous êtes diabétique, vous devrez contrôler votre taux de glucose dans le sang au cours du traitement par GENOTONORM et discuter des résultats avec votre médecin afin de déterminer s’il convient de changer la dose de votre traitement contre le diabète.
· Après le début du traitement par GENOTONORM, certains patients peuvent avoir besoin de débuter un traitement substitutif par des hormones thyroïdiennes.
· Si vous recevez un traitement à base d’hormones thyroïdiennes, il sera peut-être nécessaire d’adapter la posologie des hormones thyroïdiennes.
· Si vous prenez de l’hormone de croissance pour stimuler votre croissance et que vous boitez ou si vous commencez à boiter à cause de douleurs dans votre hanche au cours de votre traitement par l’hormone de croissance, vous devez en informer votre médecin.
· Si vous présentez une hypertension intracrânienne (avec des symptômes tels que des maux de tête sévères, des troubles visuels ou des vomissements) vous devez en informer votre médecin.
· Si votre médecin confirme que vous avez développé une inflammation des muscles proche du site d’injection à cause de la présence d’un conservateur, le métacrésol, vous devrez utiliser un produit GENOTONORM sans métacrésol.
· Si vous recevez un traitement par GENOTONORM pour une insuffisance en hormone de croissance suite à un ancien processus tumoral, vous devez continuer à être surveillé pour vérifier que la tumeur ne réapparaisse pas.
· L’expérience de ce traitement chez les patients âgés de plus de 80 ans est limitée. Les personnes âgées peuvent être plus sensibles à l’action de GENOTONORM, et peuvent donc être plus sujets à l’apparition d’effets indésirables.
Enfants souffrant d’insuffisance rénale chronique (rein) :
· Votre médecin devra vérifier votre fonction rénale et votre vitesse de croissance avant d’initier GENOTONORM. Le traitement que vous recevez pour votre insuffisance rénale chronique doit être poursuivi. Le traitement par GENOTONORM devra être interrompu en cas de transplantation rénale.
Enfants atteints du syndrome de Prader-Willi :
· Votre médecin vous indiquera quel est le régime hypocalorique à suivre pour contrôler votre poids.
· Votre médecin recherchera des signes d’obstruction des voies aériennes supérieures, d’apnée du sommeil (lorsque votre respiration s’interrompt au cours du sommeil), ou d’infections respiratoires avant de débuter votre traitement par GENOTONORM.
· Au cours du traitement, si vous présentez des signes d’obstruction des voies aériennes supérieures (y compris survenue ou aggravation des ronflements), votre médecin devra vous examiner et il est possible qu’il interrompe votre traitement par GENOTONORM.
· Au cours du traitement, votre médecin pratiquera un examen afin de rechercher des signes de scoliose (type de déformation de la colonne vertébrale) .
· Au cours du traitement, si vous développez une infection pulmonaire, informez-en votre médecin afin qu’il/elle puisse traiter cette infection.
Enfants nés petits pour l’âge gestationnel :
· Si vous êtes né(e) petit(e) pour l’âge gestationnel et si vous avez entre 9 et 12 ans, demandez conseil à votre médecin concernant la puberté et le traitement par ce médicament.
· Votre médecin contrôlera vos taux de glucose et d’insuline dans le sang avant de commencer le traitement puis tous les ans pendant le traitement.
· Le traitement devra être poursuivi jusqu’à l’arrêt de votre croissance staturale.
Interactions avec d'autres médicaments
Utilisation d'autres médicaments
Si vous prenez ou avez pris récemment un autre médicament, y compris un médicament obtenu sans ordonnance, parlez-en à votre médecin ou votre pharmacien.
Vous devez informer votre médecin si vous utilisez :
· des médicaments destinés à traiter le diabète,
· des hormones thyroïdiennes,
· des hormones surrénaliennes de synthèse (corticoïdes),
· des hormones sexuelles (par exemple des œstrogènes),
· de la ciclosporine cyclosporine (un médicament qui affaiblit le système immunitaire après une greffe),
· des médicaments anti-épileptiques (anticonvulsivants).
Votre médecin pourra adapter la posologie de ces médicaments ou la dose de GENOTONORM.
Interactions avec les aliments et les boissons
Sans objet
Interactions avec les produits de phytothérapie ou thérapies alternatives
Sans objet
Utilisation pendant la grossesse et l'allaitement
Grossesse et allaitement
Vous ne devez pas utiliser GENOTONORM si vous êtes enceinte ou si vous essayez de le devenir.
Demandez conseil à votre médecin avant de prendre ce médicament si vous allaitez.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Sportifs
Sportifs
L’attention des sportifs sera attirée sur le fait que cette spécialité contient un principe actif pouvant induire une réaction positive des tests pratiqués lors des contrôles antidopages.
Effets sur l'aptitude à conduire des véhicules ou à utiliser des machines
Conduite de véhicules et utilisation de machines
Ce médicament n’altère pas votre capacité à conduire des véhicules ou à utiliser des machines.
Liste des excipients à effet notoire
Informations importantes concernant certains composants de GENOTONORM 5,3 mg, poudre et solvant pour solution injectable
Ce médicament contient moins d’1 mmol de sodium (23 mg) par prise, c’est-à-dire qu’il est considéré « sans sodium ».
3. COMMENT UTILISER GENOTONORM 5,3 mg, poudre et solvant pour solution injectable ?
Instructions pour un bon usage
Sans objet.
Posologie, Mode et/ou voie(s) d'administration, Fréquence d'administration et Durée du traitement
Posologie recommandée
La dose dépend de votre taille, de l’affection pour laquelle vous êtes traité(e) et de votre réponse au traitement. Chaque personne réagit différemment. Votre médecin vous indiquera la dose de GENOTONORM qui vous est nécessaire soit en fonction de votre poids en kilogrammes (kg) soit en fonction de votre surface corporelle exprimée en mètres carrés (m2), ainsi que le calendrier de votre traitement. Ne modifiez pas la posologie et le calendrier du traitement sans consulter votre médecin.
Enfants présentant un déficit en hormone de croissance :
0,025 à 0,035 mg/kg de poids corporel par jour ou 0,7 à 1,0 mg/m2 de surface corporelle par jour. Des doses plus élevées peuvent être utilisées. Lorsque le déficit en hormone de croissance se poursuit à l’adolescence, GENOTONORM doit être continué jusqu'au développement physique complet.
Enfants atteints d’un syndrome de Turner :
0,045 à 0,050 mg/kg de poids corporel par jour ou 1,4 mg/m2 de surface corporelle par jour.
Enfants atteints d’insuffisance rénale (rein) :
0,045 à 0,050 mg/kg de poids corporel par jour ou 1,4 mg/m2 de surface corporelle par jour. Des doses plus élevées peuvent être nécessaires si le taux de croissance est trop faible. Un ajustement de la posologie peut s’avérer nécessaire après 6 mois de traitement.
Enfants atteints d’un syndrome de Prader-Willi :
0,035 mg/kg de poids corporel par jour ou 1,0 mg/m2 de surface corporelle par jour. La posologie quotidienne ne devra pas dépasser 2,7 mg. Le traitement ne devra pas être utilisé chez des enfants qui ont pratiquement arrêté de grandir après la puberté.
Enfants nés petits pour l’âge gestationnel et ayant des troubles de la croissance :
0,035 mg/kg de poids corporel par jour ou 1,0 mg/m2 de surface corporelle par jour. Il est important de continuer le traitement jusqu’à ce que la taille finale soit atteinte. Le traitement devra être arrêté au bout de la première année si vous ne répondez pas au traitement ou si vous avez atteint votre taille définitive ou arrêté de grandir.
Adultes présentant un déficit en hormone de croissance :
Si vous poursuivez GENOTONORM après un traitement durant l’enfance, le traitement doit être initié à une dose de 0,2 à 0,5 mg par jour. Ce dosage peut être augmenté ou diminué progressivement en fonction des résultats des examens sanguins ainsi que de la réponse clinique et des effets indésirables.
Si votre déficit en hormone de croissance a débuté alors que vous étiez adulte, la dose recommandée pour débuter le traitement est de 0,15 à 0,3 mg par jour. La dose peut être augmentée progressivement en fonction des résultats des examens sanguins ainsi que de la réponse clinique et des effets indésirables. La dose d’entretien quotidienne excède rarement 1,0 mg par jour. Les femmes peuvent avoir besoin de doses plus élevées que les hommes.
La posologie devra être contrôlée tous les 6 mois. Chez les patients de plus de 60 ans, le traitement doit être initié à une dose de 0,1 à 0,2 mg par jour. Cette posologie doit être augmentée progressivement en fonction des besoins individuels du patient. La dose d’entretien quotidienne chez ces patients excède rarement 0,5 mg par jour. Conformez vous aux instructions données par votre médecin.
Injections de GENOTONORM
GENOTONORM est destiné à être injecté par voie sous-cutanée. L’injection se fait à l’aide d’une aiguille courte dans le tissu graisseux juste sous la peau. Votre médecin doit vous avoir déjà montré comment utiliser GENOTONORM. Pratiquez l’injection de GENOTONORM exactement comme votre médecin vous a indiqué de l’effectuer. En cas de doute demandez conseil à votre médecin ou à votre pharmacien.
Les instructions d’utilisation du stylo prérempli GoQuick® sont fournies dans l’emballage du stylo prérempli.
Les instructions d’utilisation de GENOTONORM cartouche à double compartiment avec le GENOTONORM Pen sont fournies avec le dispositif.
Veuillez lire les instructions d’utilisation avant d’utiliser le médicament.
Lorsque vous utilisez un stylo prérempli ou un dispositif d’injection, l’aiguille doit être vissée avant de mélanger. Une nouvelle aiguille doit être utilisée à chaque injection. Les aiguilles ne doivent pas être réutilisées.
· Préparation de l’injection :
Vous pouvez sortir GENOTONORM du réfrigérateur une demi-heure avant l’heure d’injection. Ceci permet de la réchauffer légèrement et augmente le confort de l’injection.
Le stylo prérempli GoQuick® inclut une cartouche à double compartiment qui contient à la fois l’hormone de croissance et le solvant. L’hormone de croissance et le solvant sont mélangés en faisant tourner le porte-cartouche (voir les différentes étapes décrites dans les instructions d’utilisation). Un dispositif séparé n’est pas nécessaire.
GENOTONORM sous forme de cartouche à double compartiment contient à la fois l’hormone de croissance et le solvant qui doivent être utilisés dans un dispositif GENOTONORM. L’hormone de croissance et le solvant contenus dans la cartouche à double compartiment peuvent être mélangés en vissant celle-ci dans le dispositif GENOTONORM Pen.
Pour le stylo prérempli GoQuick comme pour la cartouche à double compartiment , dissoudre la poudre en l’inclinant doucement vers l’arrière 5 à 10 fois jusqu’à dissolution de la poudre.
Lorsque vous mélangez GENOTONORM, veillez à NE PAS AGITER la solution. Mélangez-la doucement. Le fait d’agiter la solution pourrait faire mousser l’hormone de croissance et endommager la substance active. Examinez la solution et n’effectuez pas l’injection si la solution est trouble ou si elle contient des particules.
· Injection de GENOTONORM :
N’oubliez pas de vous laver les mains et nettoyez votre peau en premier lieu.
Injectez l’hormone de croissance à peu près à la même heure tous les jours. Au moment du coucher est une heure qui convient car il est facile de s’en souvenir. Il est également naturel d’avoir un taux d’hormone de croissance plus élevé la nuit.
La plupart des personnes effectuent leur injection dans la cuisse ou la fesse. Faites l’injection à l’endroit que vous a indiqué votre médecin. Il peut se produire un amincissement des tissus graisseux de la peau au site de l’injection. Pour éviter cela, utilisez un endroit différent à chaque injection. Ceci donne le temps à votre peau et à la région située sous la peau de se reconstituer avant d’effectuer une autre injection au même endroit.
N’oubliez pas de remettre GENOTONORM au réfrigérateur aussitôt après l’injection.
Symptômes et instructions en cas de surdosage
Si vous avez utilisé plus de GENOTONORM 5,3 mg, poudre et solvant pour solution injectable que vous n’auriez dû :
Si vous injectez beaucoup plus d’hormone de croissance que vous n’auriez dû, prévenez immédiatement votre médecin ou votre pharmacien. Votre taux de glucose dans le sang peut chuter trop bas et ultérieurement peut remonter trop haut. Vous pouvez vous sentir faible, en sueur, endormi(e) ou ne pas vous sentir « vous-même » et il est possible que vous vous évanouissiez.
Instructions en cas d'omission d'une ou de plusieurs doses
Si vous oubliez d’utiliser GENOTONORM 5,3 mg, poudre et solvant pour solution injectable :
Ne prenez pas de dose double pour compenser la dose que vous avez oubliée de prendre.
Il est préférable d’utiliser votre hormone de croissance régulièrement. S’il vous arrive d’oublier une dose, effectuez votre injection le lendemain comme si de rien n’était. Notez toutes les injections oubliées et parlez-en à votre médecin lors du prochain bilan de santé.
Risque de syndrome de sevrage
Si vous arrêtez d’utiliser GENOTONORM 5,3 mg, poudre et solvant pour solution injectable :
Demandez conseil à votre médecin ou à votre pharmacien avant d’arrêter d’utiliser GENOTONORM.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Description des effets indésirables
Comme tous les médicaments, GENOTONORM est susceptible d’avoir des effets indésirables, bien que tout le monde n’y soit pas sujet.
Les effets indésirables fréquents (susceptibles de survenir chez moins de 1 patient sur 10) sont les suivants :
Formation d’anticorps anti-hormone de croissance il ne semble pas que ceux-ci empêchent l’hormone de croissance d’agir.
Chez les enfants :
· Rougeurs temporaires, démangeaisons ou douleurs au site d’injection.
Chez les adultes :
· Engourdissements / picotements,
· Raideur des bras et des jambes, douleurs articulaires, douleurs musculaires,
· Rétention d’eau (qui se traduit par un gonflement des doigts ou des poignets). Ces symptômes peuvent être observés pendant une courte période au début du traitement mais ils disparaissent spontanément ou lors d’une diminution de la dose.
Ces effets indésirables fréquents chez les adultes peuvent commencer dans les premiers mois de traitement et peuvent s’arrêter spontanément ou si votre dose est diminuée.
Les effets indésirables peu fréquents (susceptibles de survenir chez moins de 1 patient sur 100) sont les suivants :
Chez les enfants :
· Engourdissements / picotements,
· Raideur des bras et des jambes, douleurs articulaires, douleurs musculaires,
· Rétention d’eau (qui se traduit par un gonflement des doigts ou des poignets pendant une courte période au début du traitement).
Chez les adultes :
· Sensation de douleurs ou de brûlures sous les bras et dans les mains (connu sous le nom de syndrome du canal carpien).
Les effets indésirables rares (susceptibles de survenir chez moins de 1 patient sur 1000) sont les suivants :
· Diabète de type 2,
· Augmentation de la pression intra-crânienne (qui se traduit par des symptômes tels des maux de tête sévères, des troubles visuels ou des vomissements).
Les effets indésirables très rares (susceptibles de survenir chez moins de 1 patient sur 10 000) sont les suivants :
· Leucémie.
La peau autour du site d’injection peut devenir rugueuse ou bosselée mais ceci ne devrait pas se produire si vous effectuez les injections à un endroit différent chaque fois.
Un effet indésirable très rare pouvant survenir en raison de la présence d’un conservateur le métacrésol est une inflammation des muscles proches du site d’injection. Si votre médecin vous confirme qu’il s’agit bien de ce phénomène, vous devrez utiliser un produit GENOTONORM sans métacrésol.
De rares cas de mort subite ont été observés chez des patients atteints d’un syndrome de Prader-Willi. Aucun lien n’a néanmoins été fait entre ces observations et le traitement par GENOTONORM.
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien.
5. COMMENT CONSERVER GENOTONORM 5,3 mg, poudre et solvant pour solution injectable ?
Tenir hors de la portée et de la vue des enfants.
Date de péremption
Ne pas utiliser ce médicament après la date de péremption mentionnée sur l’emballage de la manière suivante : MM/AAAA. La date de péremption fait référence au dernier jour de ce mois.
Conditions de conservation
Avant reconstitution :
A conserver au réfrigérateur (entre 2°C et 8°C). Conserver la cartouche à double compartiment dans l’emballage extérieur à l’abri de la lumière.
Avant ouverture, le produit peut être sorti du réfrigérateur, sans y être remis, pour une durée maximale de 1 mois, à une température ne dépassant pas 25°C mais passé ce délai, il doit être jeté.
Après reconstitution :
A conserver au réfrigérateur (entre 2°C et 8°C) pendant au maximum 4 semaines. Ne pas congeler. Conserver le stylo prérempli GoQuick dans l’emballage extérieur de GoQuick ou la cartouche à double compartiment dans la boite de GENOTONORM Pen à l’abri de la lumière.
Ne pas utiliser ce médicament si vous remarquez la présence de particules ou si la solution n’est pas limpide.
Ne pas congeler ou exposer GENOTONORM au gel. S’il a été congelé, ne pas l’utiliser.
Si nécessaire, mises en garde contre certains signes visibles de détérioration
Ne jetez jamais les aiguilles ou les cartouches partiellement utilisées ou vides dans votre poubelle habituelle. Lorsque vous avez fini de vous servir d’une aiguille, vous devez la jeter de sorte que personne ne puisse l’utiliser ou se piquer. Vous devez vous procurer des poubelles spéciales pour objets pointus auprès de l’hôpital ou du centre de soins.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. INFORMATIONS SUPPLEMENTAIRES
Liste complète des substances actives et des excipients
Que contient GENOTONORM 5,3 mg, poudre et solvant pour solution injectable ?
· La substance active est la somatropine*.
· Une cartouche contient 5,3 mg de somatropine*.
· Après reconstitution, la concentration de somatropine* est de 5,3 mg par ml.
· Les autres composants de la poudre sont: glycine (E640), mannitol (E421), phosphate monosodique anhydre (E339) et phosphate disodique anhydre (E339).
· Les composants du solvant sont : eau pour préparations injectables, mannitol (E421) et métacrésol.
* Produite dans des cellules d’Escherichia coli par la technique de l’ADN recombinant
Forme pharmaceutique et contenu
Qu’est-ce que GENOTONORM 5,3 mg, poudre et solvant pour solution injectable et contenu de l’emballage extérieur ?
GENOTONORM se présente sous la forme d’une poudre et d’un solvant pour solution injectable, en cartouche à double compartiment contenant la poudre dans un des compartiments et le solvant dans l’autre (5,3 mg /ml). La cartouche peut être incluse dans un stylo prérempli. Boîte de 1 ou 5 stylo(s) préremplis, ou 1, 5 ou 20 cartouche(s).
Tous les dosages et présentations peuvent ne pas être commercialisés.
La poudre est blanche et le solvant est limpide.
Vous pouvez utiliser les cartouches dans un stylo d’injection spécifique de GENOTONORM. Les cartouches de GENOTONORM ont un code couleur et doivent être utilisées avec les GENOTONORM PEN de même code couleur afin de délivrer la dose correcte.
La cartouche de GENOTONORM Pen 5,3 (bleue) doit être utilisée avec le GENOTONORM Pen 5,3 mg (bleu).
Les instructions d’utilisation du dispositif sont incluses dans l’emballage du dispositif. Vous devez demander à votre médecin un dispositif d’injection ou de reconstitution si vous n’en avez pas déjà un.
Nom et adresse du titulaire de l'autorisation de mise sur le marché et du titulaire de l'autorisation de fabrication responsable de la libération des lots, si différent
Titulaire
PFIZER HOLDING FRANCE
23-25, AVENUE DU DOCTEUR LANNELONGUE
75014 PARIS
Exploitant
PFIZER
23-25, AVENUE DU DOCTEUR LANNELONGUE
75014 PARIS
Fabricant
PFIZER MANUFACTURING BELGIUM NV
RIJKSWEG 12
2870 PUURS
BELGIQUE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants:
Conformément à la réglementation en vigueur.
Date d’approbation de la notice
La dernière date à laquelle cette notice a été approuvée est le {date}.
AMM sous circonstances exceptionnelles
Sans objet.
Informations Internet
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’Afssaps (France).
Informations réservées aux professionnels de santé
Sans objet.
Autres
|
GOQUICK®
INSTRUCTIONS D’UTILISATION
|
|
Information importante
Lisez attentivement ces instructions avant d’utiliser GoQuick.
Si vous avez d’autres questions à propos de votre traitement GENOTONORM ou de la dose à utiliser, demandez plus d’informations à votre médecin ou à votre infirmière.
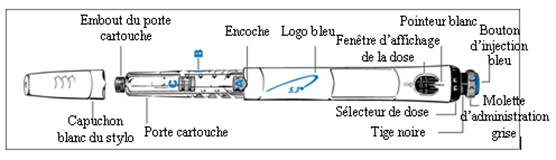
A propos du GoQuick
GoQuick est un stylo pour injection prérempli, multidose, jetable. Il contient 5,3 mg de somatropine. GENOTONORM dans le stylo est mélangé une seule fois, lorsque vous utilisez un nouveau stylo. Un même stylo peut être utilisé pendant un maximum de 28 jours après mélange. Vous n’avez jamais besoin de changer de cartouche. Quand le stylo est vide, il vous suffit d’utiliser un nouveau stylo.
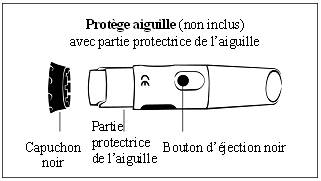
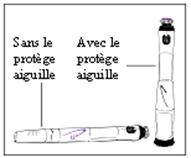
Le stylo contient un sélecteur de dose. La dose est réglée une seule fois sur un nouveau stylo. Le stylo délivre ensuite la même dose à chaque injection. Vous pouvez utiliser le stylo avec ou sans le protège-aiguille.
|
|
Avant d’utiliser GoQuick
· Faites-vous former par votre médecin ou votre infirmière.
· Prenez connaissance de votre dose.
· Assurez-vous que votre stylo a un bouton d’injection bleu.
· Lavez-vous les mains.
|
|
|
|

|
|
|
Réglage et utilisation d’un nouveau stylo GoQuick
|
|
|
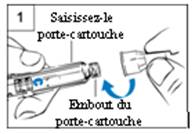
Etape 1. Fixation de l’aiguille
- Retirez le capuchon blanc du stylo.
- Retirez le film protecteur de l’aiguille neuve.
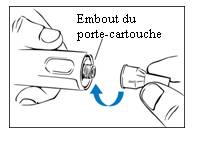
- Saisissez fermement le porte-cartouche. (Figure 1)
- Placez l’aiguille sur l’embout du porte-cartouche.
- Vissez délicatement l’aiguille sur le stylo. Ne
serrez pas trop.
- Laissez les deux capuchons sur l’aiguille.
|
|
|
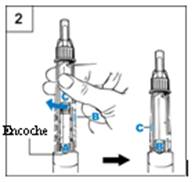
Etape 2. Mélange de GENOTONORM
- Tenez le stylo avec l’aiguille pointée vers le haut
et A face à vous (Figure 2)
- Tournez fermement le porte cartouche dans le
stylo jusqu’à ce que B clique dans l’encoche.
Inclinez doucement le stylo d’un côté puis de l’autre. Ne secouez pas le stylo. Les secousses pourraient endommager l’hormone de croissance.
- Assurez-vous que le liquide dans la cartouche est
limpide. Toute la poudre doit être dissoute.
Si elle n’est pas dissoute, inclinez doucement le stylo d’un côté puis de l’autre plusieurs fois.
- Examinez de nouveau le liquide. Assurez-vous qu’il
est limpide.
Si le liquide est limpide, passez à l’étape 3.
Si le liquide est toujours trouble ou si vous voyez de la poudre, utilisez un nouveau stylo.
|
|
|
Etape 3. Elimination de l’air
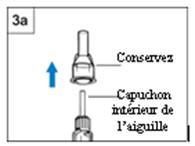
- Retirez le capuchon extérieur de l’aiguille.
Gardez-le afin de le remettre sur l’aiguille. (Figure 3a)
- Laissez le capuchon intérieur de l’aiguille.
|
|
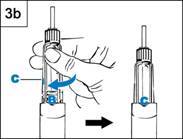
- Tenez le stylo avec l’aiguille pointée vers le haut
(Figure 3b)
- Tapotez légèrement sur le porte-cartouche pour
chasser l’air qui pourrait s’y trouver.
- Tournez fermement le porte-cartouche dans le
stylo jusqu’à ce que C clique dans l’encoche.
Du liquide peut apparaître autour du capuchon intérieur de l’aiguille.
|
|
|
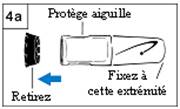
Etape 4. Fixez le protège-aiguille (en option)
- Retirez le capuchon noir du protège-aiguille. (Figure
4a)
· Si la partie protectrice de l’aiguille se déplace, remettez-la en place sur le protège aiguille jusqu’au clic.
|
|
|
|
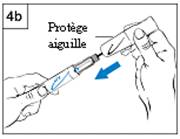
b. Tenez le stylo d’une main en dessous du logo bleu. De l’autre main, tenez le protège-aiguille en dessous de la partie protectrice de l’aiguille. (Figure 4b)
c. Alignez le logo noir du protège-aiguille avec le logo bleu du stylo. Poussez soigneusement le protège aiguille sur le stylo jusqu’à ce qu’il soit inséré correctement.
|
|
|
|
Etape 5. Amorce du stylo
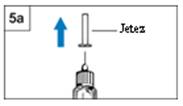
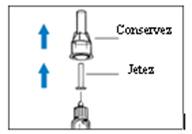
- Retirez le capuchon intérieur de l’aiguille.
Jetez-le. (Figure 5a)
|
|
|
|
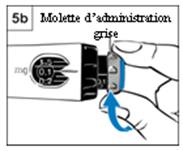
b. Vérifiez que 0.1 mg apparaît dans la fenêtre d’affichage de dose.
c. Tournez à fond la molette d’administration grise dans le sens des flèches jusqu’à ce qu’elle s’arrête de cliquer (Figure 5b).
|
|
|
|
d. Tenez le stylo l’aiguille pointée vers le haut (Figure 5c avec ou sans protège-aiguille)
e. Appuyez sur le bouton d’injection bleu jusqu’à ce que du liquide apparaisse.
f. Si le liquide ne sort pas de l’aiguille à l’étape « e », répétez une ou deux fois les étapes b-e de cette section.
g. Si le liquide ne sort toujours pas, n’utilisez pas le stylo.
Voir la liste de questions et réponses figurant à la fin de ce mode d’emploi pour plus d’informations.
|

|
|
|
h. Si vous utilisez le protège-aiguille, appuyez sur le bouton d’éjection noir afin de libérer la partie protectrice de l’aiguille. (Figure 5d)
|

|
|
|
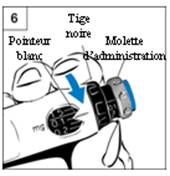
Etape 6. Réglage de la dose
Utilisez le sélecteur de dose noir. Faites attention à ne pas utiliser la molette d’administration grise en voulant sélectionner la dose.
- Tenez le sélecteur de dose noir représenté sur la
figure 6.
- Tournez le sélecteur de dose noir jusqu’à ce que la
dose s’aligne avec le pointeur blanc. Le médecin ou l’infirmière vous
aura indiqué votre dose.
- Si vous avez dépassé votre dose avec le pointeur
blanc, tournez simplement en arrière le sélecteur de dose noir pour
régler la dose correcte.
- Lorsque vous avez réglé votre dose, ne la changez plus
sauf sur avis du médecin ou de l’infirmière.
NB : Si vous ne pouvez pas tourner le sélecteur de dose noir, appuyez sur le bouton d’injection bleu jusqu’à ce qu’il s’arrête de cliquer. Puis sélectionnez votre dose en utilisant le sélecteur de dose (pour plus d’information, voir la liste de questions et réponses ci-après).
|
|
|
|
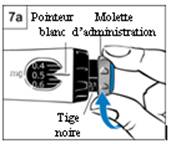
Etape 7. Prélèvement d’une dose
- Tournez à fond la molette d’administration grise dans
le sens de la flèche jusqu’à ce qu’elle s’arrête de cliquer (Figure 7a)
- La dose sur la tige noire doit être alignée sur le
pointeur blanc.
|
|
|
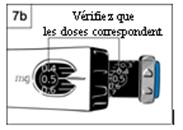
- Vérifiez que la dose que vous avez prélevée sur la
tige noire correspond à la dose que vous avez réglée dans la fenêtre
d’affichage de la dose. La figure 7b montre un exemple.
- Si les doses ne correspondent pas, assurez vous
d’avoir tourné la molette d’administration grise dans le sens de la
flèche jusqu’à ce qu’elle ne clique plus.
|
|
|
|
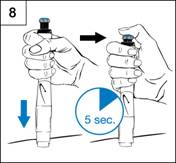
Etape 8. Injection de la dose
- Préparez le site d’injection comme recommandé par
votre médecin ou votre infirmière.
- Maintenez le stylo sur le site d’injection.
- Appuyez sur le stylo pour introduire l’aiguille dans
la peau.
- Avec le pouce, appuyez à fond sur le bouton
d’injection bleu jusqu’à ce qu’il s’arrête de cliquer. (Figure 8)
Comptez lentement 5 secondes avant de retirer l’aiguille de la peau. Maintenez une légère pression sur le bouton avec le pouce pendant que vous comptez.
- Enlevez le stylo en le retirant de la peau.
|
|
|
|
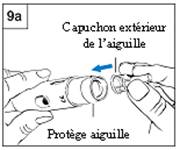
Etape 9. Retrait de l’aiguille. Rangement du stylo
Etape 9a : avec le protège-aiguille
a. Placez le capuchon extérieur de l’aiguille au niveau de la partie protectrice de l’aiguille. (Figure 9a)
b. Utilisez le capuchon de l’aiguille pour pousser la partie protectrice de l’aiguille jusqu’à ce qu’il se verrouille.
c. Utilisez le capuchon de l’aiguille pour dévisser l’aiguille et jetez-la dans un collecteur approprié pour aiguilles usagées.
d. Laissez le protège-aiguille sur le stylo.
e. Placez le capuchon noir sur le protège-aiguille. Conservez toujours le stylo au réfrigérateur.
|
|
|
|
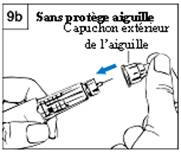
 Etape 9 b : sans le protège-aiguille Etape 9 b : sans le protège-aiguille
a. Ne touchez pas à l’aiguille.
b. Recouvrez soigneusement l’aiguille avec le capuchon extérieur de l’aiguille. (Figure 9b)
c. Utilisez le capuchon de l’aiguille pour dévisser l’aiguille et jetez-la dans un récipient approprié pour aiguilles usagées.
d. Placez le capuchon blanc sur le stylo. Conservez toujours le stylo au réfrigérateur.
|
|
|
|
Utilisation habituelle du Go Quick
|
|
|
1. Retirez le capuchon noir du protège-aiguille ou le capuchon blanc du stylo.
|
|
|
2. Fixez une nouvelle aiguille.
Avec le protège-aiguille :
- Si la partie protectrice de l’aiguille se déplace, remettez-la en place.
- Fixez une nouvelle aiguille sur l’embout du porte-cartouche.
|
|
|
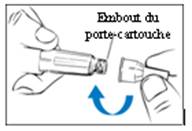
Sans le protège-aiguille :
Fixez une nouvelle aiguille sur l’embout du porte-cartouche.
|
|
|
3. Retirez les capuchons de l’aiguille. Conservez le capuchon extérieur de l’aiguille.
|
|
|
4. Si vous utilisez le protège-aiguille, appuyez sur le bouton d’éjection noir pour libérer la partie protectrice de l’aiguille.
|
|
|
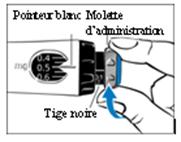
5. Pour prélever la dose, tournez la molette d’administration grise jusqu’à ce qu’elle s’arrête de cliquer.
|
|
|
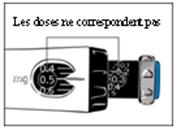
6. Vérifiez que la dose que vous avez prélevée est identique à la dose que vous avez réglée dans la fenêtre d’affichage de la dose.
· Si la dose que vous avez prélevée est plus petite, le stylo ne contient pas une dose complète de GENOTONORM.
· Suivez les instructions du médecin ou de l’infirmière quand il ne reste pas une dose complète dans le stylo.
|
|
|
7. Préparez le site d’injection comme recommandé par votre médecin ou votre infirmière.
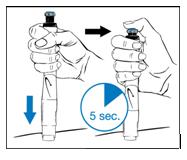
8. Injectez la dose:
· Appuyez sur le stylo pour introduire l’aiguille dans la peau.
· Appuyez à fond sur le bouton d’injection bleu jusqu’à ce qu’il se bloque.
· Comptez lentement pendant 5 secondes avant de retirer l’aiguille de la peau. Maintenez une légère pression sur le bouton avec le pouce pendant que vous comptez.
· Enlevez le stylo en le retirant de la peau.
|
|
|
9. Retirez l’aiguille.
· Avec le protège-aiguille:
· Utilisez le capuchon extérieur de l’aiguille pour pousser la partie protectrice de l’aiguille jusqu’à ce qu’elle se verrouille.
· Sans protège-aiguille:
· Recouvrez soigneusement l’aiguille avec le capuchon extérieur de l’aiguille.
· Utilisez le capuchon extérieur de l’aiguille pour dévisser l’aiguille. Jetez l’aiguille dans un récipient approprié pour aiguilles usagées.
10. Recouvrez le protège-aiguille ou le stylo et conservez-le au réfrigérateur.
|
|
INFORMATIONS COMPLEMENTAIRES
Conservation
· Voir sur la notice comment conserver GoQuick.
· Après 4 semaines, jeter le stylo même s’il contient encore du médicament.
· Ne pas exposer au gel et ne pas congeler GoQuick.
· Ne pas utiliser GoQuick après la date de péremption.
· Votre stylo doit être éliminé conformément à la réglementation en vigueur. Demandez à votre médecin ou à votre infirmière si vous ne savez pas quoi en faire.
Utilisation
· Ne mélangez pas la poudre et le liquide de GoQuick s’il n’y a pas d’aiguille sur le stylo.
· Ne conservez pas GoQuick avec une aiguille attachée. Du liquide peut fuir du stylo et des bulles d’air peuvent se former dans la cartouche. Retirez toujours l’aiguille et remettez le capuchon de l’aiguille ou le protège-aiguille avant de le ranger.
· Faites attention à ne pas laisser tomber votre GoQuick.
· Si vous laissez tomber votre stylo, veuillez réamorcer le stylo comme décrit à l’étape 5 (Etape 5 Amorce du stylo). Si un composant du stylo vous parait abimé ou cassé, n’utilisez pas le stylo. Contactez votre médecin ou votre infirmière pour obtenir un nouveau stylo.
· Nettoyez le stylo et le protège-aiguille avec un chiffon humide. Ne mettez pas le stylo sous l’eau.
Aiguilles
· Utilisez toujours une nouvelle aiguille à chaque injection.
· Jetez toutes les aiguilles usagées dans un récipient approprié pour objets piquants/tranchants. Eliminez les aiguilles conformément à la réglementation en vigueur. Demandez à votre médecin ou à votre infirmière si vous ne savez pas quoi en faire.
· Ne partagez pas votre stylo ou vos aiguilles avec quelqu’un de votre entourage.
Généralités
· Les chiffres et les traits de mesure sur le porte-cartouche peuvent vous aider à estimer la quantité de GENOTONORM restant dans le stylo.
· Dans le cadre de l’utilisation habituelle de GoQuick (étape 6) dans le cas où le stylo ne contient pas une dose complète de GENOTONORM, la tige noire vous indique la quantité de GENOTONORM restant dans le stylo.
· Les personnes aveugles ou malvoyantes ne doivent utiliser GoQuick qu’avec l’aide d’une personne sachant utiliser le stylo.
· Suivez les instructions de votre médecin ou de votre infirmière pour vous nettoyer les mains et la peau lorsque vous vous apprêtez à effectuer une injection.
· Ne jetez pas le protège-aiguille, pour le retirer du stylo, il vous suffit de le tourner. Gardez-le pour l’utiliser avec chaque nouveau stylo.
· Si vous avez des questions sur l’utilisation du GoQuick, demandez à votre médecin ou à votre infirmière.
QUESTIONS ET REPONSES
|
Question
|
Réponse
|
|
Que dois-je faire si je vois plus d’une petite goutte de liquide sur l’aiguille après avoir fait l’injection ?
|
A l’injection suivante, attendez 5 secondes complètes avant de retirer l’aiguille de la peau. Si vous voyez toujours du liquide après avoir retiré l’aiguille, laissez-la pendant un peu plus longtemps la prochaine fois.
|
|
Est-ce un problème si je vois des bulles d’air dans la cartouche ?
|
Non, un peu d’air peut être présent dans l’aiguille et la cartouche lors d’une utilisation normale.
|
|
Que dois-je faire si je vois du liquide fuir du stylo ?
|
Assurez-vous d’avoir fixé correctement l’aiguille.
|
|
Que dois-je faire si le stylo que j’utilise n’a pas été conservé au réfrigérateur pendant la nuit?
|
Jetez le stylo et utilisez un nouveau stylo.
|
|
Que dois-je faire si je ne peux pas tourner le sélecteur de dose noir ?
|
Vous avez probablement tourné la molette d’administration grise par mégarde. Si vous avez tourné la molette d’administration grise, le stylo verrouille le sélecteur de dose noir pour que la dose ne varie pas pendant l’injection.
Pour déverrouiller le sélecteur de doses noir, appuyez sur le bouton d’injection bleu. Du liquide sortira de l’aiguille. Puis réglez la dose voulue avec le sélecteur de dose noir.
|
|
Que faire si le médecin change ma dose une fois que j’ai déjà commencé à utiliser un stylo ?
|
Sélectionner la nouvelle dose avec le sélecteur de dose noir.
|
|
Que faire si j’injecte la mauvaise dose ?
|
Appelez immédiatement votre médecin ou votre infirmière et suivez ses instructions.
|
|
Que faire si je n’arrive pas à amorcer le stylo (c’est-à-dire si je ne vois pas de liquide apparaître à l’étape 5g) ?
|
Appelez votre médecin ou votre infirmière et suivez ses instructions.
|
|
Quelles sont les doses pouvant être administrées par le stylo ?
|
Le stylo peut administrer des doses allant de 0,10mg à 1,5mg de GENOTONORM. Chaque clic du sélecteur de dose noir modifie la dose par tranche de 0,05 mg.
|



























