EN MELANGEANT LES VACCINS
PRENEZ SOIN DE GARDER LA SERINGUE VERTICALE AVEC L'AIGUILLE DIRIGEE VERS LE HAUT
ANSM - Mis à jour le : 30/04/2012
VIVAXIM, suspension et solution pour suspension injectable en seringue préremplie à double compartiment. Vaccin de l'hépatite A (inactivé, adsorbé) et typhoïdique (polyosidique)
Veuillez lire attentivement l'intégralité de cette notice avant de vous faire vacciner.
· Gardez cette notice, vous pourriez avoir besoin de la relire.
· Si vous avez toute autre question, si vous avez un doute, demandez plus d'informations à votre médecin ou à votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez jamais à quelqu'un d'autre, même en cas de symptômes identiques, cela pourrait lui être nocif.
· Si l'un des effets indésirables devient grave ou si vous remarquez un effet indésirable non mentionné dans cette notice, parlez-en à votre médecin ou à votre pharmacien.
Dans cette notice :
1. QU'EST-CE QUE VIVAXIM ET DANS QUELS CAS EST-IL UTILISE ?
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER VIVAXIM ?
3. COMMENT UTILISER VIVAXIM ?
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
5. COMMENT CONSERVER VIVAXIM ?
6. INFORMATIONS SUPPLEMENTAIRES
1. QU'EST-CE QUE VIVAXIM ET DANS QUELS CAS EST-IL UTILISE ?
Sans objet.
VIVAXIM est un vaccin. Les vaccins sont utilisés pour vous protéger contre les maladies infectieuses. Ce vaccin aide à protéger contre la fièvre typhoïde ainsi que contre l'infection causée par le virus de l'hépatite A chez les personnes âgées de 16 ans et plus.
La fièvre typhoïde est une maladie infectieuse qui peut être transmise par des aliments ou boissons contenant les bactéries (appelées Salmonella enterica, sérotype typhi) qui causent la maladie. Il s'agit d'une infection grave qui peut être fatale si elle n'est pas rapidement traitée.
L'infection par l'hépatite A est due à un virus qui attaque le foie. Elle peut être transmise par des aliments ou boissons contenant le virus. La jaunisse et une sensation de malaise généralisé font partie des symptômes.
Quand vous recevez une injection de VIVAXIM, les défenses naturelles de votre corps élaborent une protection contre la fièvre typhoïde et l'infection causée par le virus de l'hépatite A.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER VIVAXIM ?
Liste des informations nécessaires avant la prise du médicament
Pour être certain que VIVAXIM vous est adapté, il est important d'indiquer à votre médecin si l'un des points ci-dessous vous concerne. Si vous ne comprenez pas quelque chose, demandez à votre médecin de vous expliquer.
· Vous avez déjà présenté une réaction allergique (hypersensible) à l'un des composants de VIVAXIM (dont la liste figure en rubrique 6).
· Vous êtes allergique (hypersensible) à la néomycine (antibiotique utilisé lors de la fabrication du vaccin et pouvant être présent dans celui-ci en petites quantités).
· Vous avez une maladie avec une température élevée. La vaccination doit être différée après la guérison.
Précautions d'emploi ; mises en garde spéciales
Faites attention avec VIVAXIM:
· Si vous avez une faible réponse immunitaire parce que vous avez pris ou vous prenez un traitement susceptible d'affaiblir votre système immunitaire, comme les corticoïdes, les médicaments cytotoxiques ou la radiothérapie. Votre médecin souhaitera peut-être attendre la fin du traitement.
· Si votre système immunitaire est déficient à cause d'une infection par le virus de l'immunodéficience humaine (VIH). Il sera possible de vous administrer VIVAXIM, mais le vaccin peut ne pas vous protéger aussi bien qu'il protège les personnes dont le système immunitaire fonctionne normalement.
VIVAXIM ne protègera pas contre d'autres virus connus pour infecter le foie (comme les virus de l'hépatite B, l'hépatite C ou l'hépatite E). De même, si vous êtes déjà infecté(e) par le virus de l'hépatite A lors de l'administration de VIVAXIM, la vaccination peut ne pas fonctionner correctement.
VIVAXIM ne protègera pas contre les infections causées par des bactéries Salmonella autres que le type particulier responsable de la fièvre typhoïde.
Le vaccin ne peut pas causer les infections contre lesquelles il protège.
Comme avec tous les vaccins, les personnes recevant VIVAXIM ne seront pas toutes protégées de façon certaine contre l'hépatite A et la fièvre typhoïde.
Interactions avec d'autres médicaments
Utilisation d'autres médicaments:
Comme VIVAXIM ne contient aucune bactérie ou aucun virus vivant, il peut, en général, être administré en même temps que d'autres vaccins, mais en un site d'injection différent (une autre partie du corps, comme l'autre bras ou une jambe). VIVAXIM ne doit pas être mélangé à un autre vaccin dans une même seringue.
La protection obtenue en administrant VIVAXIM en même temps que des immunoglobulines (anticorps obtenus à partir de dons du sang) n'a pas été évaluée. Si vous avez besoin d'une injection d'immunoglobulines, elle peut être administrée en même temps que VIVAXIM ou quelques semaines après. Cependant il se peut que vous ne produisiez pas autant d'anticorps contre le virus de l'hépatite A qu'en temps normal, mais il est probable que vous soyez toutefois protégé(e) contre l'infection.
Si vous prenez ou avez pris récemment un autre médicament, y compris un médicament obtenu sans ordonnance, parlez-en à votre médecin ou votre pharmacien.
Interactions avec les aliments et les boissons
Sans objet.
Interactions avec les produits de phytothérapie ou thérapies alternatives
Sans objet.
Utilisation pendant la grossesse et l'allaitement
Grossesse et allaitement
Prévenez votre médecin ou votre pharmacien si vous êtes enceinte, si vous pensez que vous pouvez être enceinte ou si vous allaitez. Bien que VIVAXIM ne soit pas supposé nuire au futur bébé, votre médecin ou votre pharmacien décidera si vous devez être vaccinée tout de suite ou après la naissance du bébé.
Si vous découvrez que vous êtes enceinte, consultez votre médecin, il pourra adapter le programme de vaccination à votre situation.
Sans objet.
Effets sur l'aptitude à conduire des véhicules ou à utiliser des machines
Conduite de véhicules et utilisation de machines
Des cas de vertige ayant été rapportés chez certaines personnes (moins d'1 sur 100 mais plus d'1 sur 1000) après administration de VIVAXIM, il convient donc d'être prudent si vous conduisez un véhicule ou utilisez une machine.
Liste des excipients à effet notoire
Informations importantes concernant certains composants de VIVAXIM:
Comme ce produit contient de la phénylalanine, il peut être nocif chez les personnes souffrant de phénylcétonurie.
Le vaccin contient moins d'1 mmol de sodium (23 mg) par dose c'est-à-dire est pratiquement sans sodium.
Instructions pour un bon usage
La vaccination doit être pratiquée par un professionnel de santé formé à l'utilisation des vaccins et équipé pour faire face à toute réaction allergique sévère et peu fréquente suite à l'injection.
Posologie, Mode et/ou voie(s) d'administration, Fréquence d'administration et Durée du traitement
VIVAXIM est administré en injection lente d’un millilitre de vaccin mélangé, aux personnes âgées de 16 ans et plus. La protection initiale est atteinte avec une seule dose de VIVAXIM.
VIVAXIM commencera à vous protéger contre l’hépatite A environ 14 jours après la première dose. Vous aurez besoin d’une deuxième injection (rappel) de vaccin inactivé de l’hépatite A pour obtenir une protection à long terme. Ce rappel vous protègera contre l’hépatite A au delà de dix ans. La dose de rappel devra être administrée dans les 36 mois et de préférence dans les 6 et à 12 mois après la première dose. VIVAXIM peut vous être administré pour renforcer votre immunité vis-à-vis de l’hépatite A si vous avez déjà reçu une première dose de vaccin inactivé de l'hépatite A 6 à 36 mois plus tôt, à condition que vous ayez également besoin d’une protection contre la fièvre typhoïde. Cependant, si la première dose de vaccin de l’hépatite A a été administrée sous forme d’un vaccin typhoïdique et hépatite A combinés, alors la deuxième dose de vaccin combiné est habituellement administrée environ 36 mois après la première dose.
VIVAXIM commencera à vous protéger contre la fièvre typhoïde environ 14 jours après l’injection, et la protection peut durer environ 3 ans. Si, après 3 ans, il existe toujours un risque que vous contractiez la fièvre typhoïde, vous devez faire en sorte de recevoir une autre injection de vaccin typhoïdique polyosidique Vi purifié.
Mode d'administration
Les liquides des deux compartiments doivent être mélangés dans la seringue juste avant l'injection. Une fois les liquides mélangés, votre médecin ou votre infirmier/ière agitera la seringue et s'assurera que le liquide est une suspension trouble blanchâtre et qu'aucune particule étrangère ne s'y trouve.
VIVAXIM vous sera administré en injection lente dans un muscle de la partie supérieure externe de votre bras. Votre médecin ou votre infirmier/ière évitera de vous injecter le vaccin dans la peau ou dans un vaisseau sanguin. VIVAXIM ne doit pas être administré dans la fesse.
Si vous souffrez d'hémophilie (maladie au cours de laquelle vous avez des bleus ou saignez facilement) ou de toute autre maladie qui implique que vous ne devez pas recevoir une injection dans le muscle, celle-ci peut se faire sous la peau.
Symptômes et instructions en cas de surdosage
Sans objet.
Instructions en cas d'omission d'une ou de plusieurs doses
Sans objet.
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Description des effets indésirables
Réactions allergiques graves possibles (rapportées très rarement) :
- Réaction allergique sévère (anaphylaxie), pouvant inclure un ou plusieurs des symptômes suivants :
· urticaire, éruptions cutanées,
· gonflement du visage et/ou du cou, difficulté à respirer, coloration bleue de la langue ou des lèvres,
· tension artérielle basse, fréquence cardiaque rapide et pouls faible, refroidissement de la peau, sensation vertigineuse et potentiellement collapsus.
Quand ces signes ou symptômes apparaissent, c'est en général très rapidement après l'injection alors que la personne atteinte se trouve encore à la clinique ou au cabinet du médecin. Si un de ces symptômes apparait après que vous ayez quitté le lieu où l'injection vous a été administrée, vous devez IMMEDIATEMENT consulter un médecin.
- Maladie sérique :
· douleurs articulaires, éruptions cutanées, ganglions lymphatiques augmentés et sensation de malaise général.
Quand ces symptômes apparaissent, c'est en général 2-4 semaines après avoir reçu le vaccin.
Si ces symptômes apparaissent vous devez consulter un médecin aussi vite que possible.
Réactions très fréquentes (rapportées par plus d’une personne sur 10) :
· douleur, rougeur, gonflement et durcissement de la zone où le vaccin a été injecté,
· maux de tête,
· sensation de faiblesse,
· sensation de malaise général,
· douleurs musculaires.
La douleur peut parfois durer jusqu’à trois jours ou plus. Une douleur sévère ou un gonflement au site d’injection ont été rapportés par moins d’une personne sur 10 mais plus d’une sur 100.
Réactions fréquentes (rapportées par moins d’une personne sur 10 mais par plus d’une sur 100) :
· nausées,
· diarrhée,
· douleurs articulaires,
· fièvre (température élevée).
Réactions peu fréquentes (rapportées par moins d’1 personne sur 100 mais par plus d’1 sur 1000) :
· démangeaisons de la peau,
· éruption,
· vertiges.
Réactions rares possibles (rapportées par moins d’1 personne sur 1000 mais par plus d’1 sur 10000) :
· vomissements et douleurs à l’estomac,
· modification des résultats d’analyses de sang mesurant le fonctionnement du foie.
Réactions très rares possibles (rapportées chez moins d’1 personne sur 10000) :
· aggravation de l’asthme chez les personnes qui en souffrent,
· picotements et fourmillements,
· éruptions qui sont parfois gonflées et qui démangent,
· bosse au site d’injection.
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien.
5. COMMENT CONSERVER VIVAXIM ?
Tenir hors de la portée et de la vue des enfants.
Le vaccin ne doit pas être utilisé après la date d'expiration mentionnée sur la boîte et sur l'étiquette de la seringue après EXP. La date d'expiration fait référence au dernier jour du mois. Le vaccin ne doit pas être utilisé s'il contient des particules étrangères.
A conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler. Si le vaccin a été congelé, il doit être jeté. Conserver le vaccin dans l'emballage extérieur à l'abri de la lumière.
Si nécessaire, mises en garde contre certains signes visibles de détérioration
Les médicaments ne doivent pas être jetés au tout à l'égout ou avec les ordures ménagères. Demander à votre pharmacien ce qu'il faut faire des médicaments inutilisés, ces mesures permettront de protéger l'environnement.
6. INFORMATIONS SUPPLEMENTAIRES
Liste complète des substances actives et des excipients
Veuillez noter que vous ne devez pas utiliser VIVAXIM si vous avez déjà présenté une réaction allergique à l'un des composants de VIVAXIM.
Les substances actives sont:
● Virus de l'hépatite A, souche GBM (inactivé)1,2 ................................................................ 160 unités antigène
1produit sur cellules diploïdes humaines MRC-5
2adsorbé sur de l'hydroxyde d'aluminium hydraté (0,3 milligramme d’Al)
L'hydroxyde d'aluminium est inclus dans le vaccin en tant qu'adsorbant. Les adsorbants sont des substances incluses dans certains vaccins pour accélérer, améliorer et/ou prolonger l'effet protecteur de ce vaccin.
● Polyosides capsulaires Vi de Salmonella typhi (souche Ty2) .............................................. 25 microgrammes
Les autres composants sont:
Chlorure de sodium, phosphate disodique dihydraté, phosphate monosodique dihydraté, solution de 2-phénoxyéthanol, formaldéhyde, milieu 199 Hanks sans rouge de phénol (mélange d'acides aminés comprenant phénylalanine, sels minéraux, vitamines et autres composants) supplémenté avec du polysorbate 80 et eau pour préparations injectables.
Forme pharmaceutique et contenu
Qu'est ce que VIVAXIM et contenu de l'emballage extérieur?
Le vaccin se présente sous la forme d'une suspension et solution pour suspension injectable en seringue préremplie à double compartiment (0,5 ml de vaccin de l'hépatite A (inactivé, adsorbé) dans un compartiment et de 0,5 ml de vaccin typhoïdique (polyosidique) Vi purifié dans l'autre compartiment) avec ou sans aiguille. Boîte de 1 ou 10 seringues préremplies. Toutes les présentations ne sont pas commercialisées.
Le vaccin de l'hépatite A (inactivé adsorbé) est une suspension blanche, trouble, et le vaccin typhoïdique (polyosidique) est une solution claire, incolore.
SANOFI PASTEUR
2, AVENUE PONT PASTEUR
69007 LYON
FRANCE
SANOFI PASTEUR
2, AVENUE PONT PASTEUR
69007 LYON
FRANCE
SANOFI PASTEUR
2, AVENUE PONT PASTEUR
69007 LYON
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants:
[à compléter par le titulaire]
Date d’approbation de la notice
La dernière date à laquelle cette notice a été approuvée est le {date}.
AMM sous circonstances exceptionnelles
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’Afssaps (France).
Informations réservées aux professionnels de santé
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
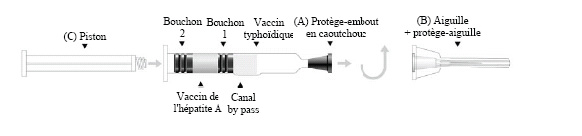
Instructions d'utilisation - seringue à double compartiment (voir le schéma ci-après).
VIVAXIM, suspension et solution pour suspension injectable en seringue préremplie à double compartiment. Vaccin de l'hépatite A (inactivé, adsorbé) et typhoïdique (polyosidique).
1. Enlever le protège embout (A).
2. Fixer l'aiguille et le protège-aiguille (B) à la seringue.
3. Visser le piston (C) dans le bouchon piston (Bouchon 2).
4. Agiter la seringue; puis mélanger les composants du vaccin en poussant lentement le piston, en gardant l'aiguille vers le haut. Le vaccin contenu dans la chambre inférieure passe dans la chambre supérieure par le canal by-pass.
5. Agiter vigoureusement jusqu'à obtenir une suspension homogène.
6. En tenant le protège-aiguille par l'extrémité, l'enlever en tirant vers le haut sans tourner.
7. Procéder immédiatement à l'injection. Un test de retour veineux peut être réalisé en tirant légèrement sur le piston. Les bouchons peuvent se séparer mais assurez-vous que le bouchon 2 n'atteigne pas le canal by pass afin d'éviter toute perte de liquide. Si un vaisseau sanguin a été pénétré, du sang sera aspiré dans la seringue.
|
EN MELANGEANT LES VACCINS |
|
|
Sans objet.