ANSM - Mis à jour le : 22/05/2013
CORDARONE 150 mg/3 ml, solution injectable en ampoule (IV)
Chlorhydrate d'amiodarone
Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser ce médicament.
· Gardez cette notice, vous pourriez avoir besoin de la relire.
· Si vous avez toute autre question, si vous avez un doute, demandez plus d'informations à votre médecin ou à votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez jamais à quelqu'un d'autre, même en cas de symptômes identiques, cela pourrait lui être nocif.
· Si l'un des effets indésirables devient grave ou si vous remarquez un effet indésirable non mentionné dans cette notice, parlez-en à votre médecin ou à votre pharmacien.
Dans cette notice :
1. QU'EST-CE QUE CORDARONE 150 mg/3 ml, solution injectable en ampoule (IV) ET DANS QUELS CAS EST-IL UTILISE ?
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER CORDARONE 150 mg/3 ml, solution injectable en ampoule (IV) ?
3. COMMENT UTILISER CORDARONE 150 mg/3 ml, solution injectable en ampoule (IV) ?
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
5. COMMENT CONSERVER CORDARONE 150 mg/3 ml, solution injectable en ampoule (IV) ?
6. INFORMATIONS SUPPLEMENTAIRES
ANTIARYTHMIQUE CLASSE III
Ce médicament est indiqué dans le traitement de certains troubles du rythme cardiaque graves et réanimation cardiorespiratoire en cas d'arrêt cardiaque lié à une fibrillation ventriculaire résistante aux chocs électriques externes.
Liste des informations nécessaires avant la prise du médicament
Sans objet.
Ce médicament NE DOIT PAS ETRE UTILISE dans les cas suivants:
· allergie connue à l'iode, à l'amiodarone ou à l'un des autres constituants du produit,
· hyperthyroïdie,
· certains troubles du rythme et/ou de la conduction cardiaque,
· malaise brutal avec chute de la pression artérielle,
· importante hypotension,
· rythme cardiaque trop lent,
· à partir du 2ème trimestre de la grossesse,
· allaitement,
· chez les enfants de moins de 3 ans, en raison de la présence d'alcool benzylique,
· en association avec les médicaments pouvant donner des torsades de pointes (troubles graves du rythme cardiaque):
o les antiarythmiques de classe Ia (quinidine, hydroquinidine, disopyramide)
o les antiarythmiques de classe III (sotalol, dofétilide, ibutilide),
o autres médicaments (arsénieux, bépridil, cisapride, diphémanil, dolasétron IV érythromycine IV, mizolastine, vincamine IV, moxifloxacine, spiramycine IV, torémifène) (voir Prise ou utilisation d'autres médicaments).
Ces contre-indications ne s'appliquent pas lorsque l'amiodarone est utilisée en réanimation cardiorespiratoire en cas d'arrêt cardiaque lié à une fibrillation ventriculaire résistante aux chocs électriques externes.
Précautions d'emploi ; mises en garde spéciales
Faites attention avec CORDARONE 150 mg/3 ml, solution injectable en ampoule (IV)
Mises en garde spéciales
· Troubles du rythme cardiaque graves lorsque la voie orale n'est pas adaptée, à l'exception de la réanimation cardiorespiratoire en cas d'arrêt cardiaque lié à une fibrillation ventriculaire résistante aux chocs électriques externes.
La spécialité ne doit jamais être administrée par voie intraveineuse périphérique.
L'administration doit être faite à l'aide d'un cathéter central.
· Réanimation cardiorespiratoire en cas d'arrêt cardiaque lié à une fibrillation ventriculaire résistante aux chocs électriques externes:
L'utilisation d'un cathéter veineux central est préconisée si celui-ci est immédiatement disponible; sinon l'administration peut être faite par voie veineuse périphérique en utilisant une veine périphérique aussi grosse et avec un flux aussi important que possible.
Ne pas ajouter d'autre produit dans la seringue.
· L'injection même très lente peut aggraver un trouble du rythme, une hypotension, une insuffisance cardiaque, ou provoquer des troubles respiratoires et/ou hépatiques (du foie). Au cours du traitement, des analyses de sang peuvent être demandées de façon à surveiller votre foie.
· La prise d'amiodarone est déconseillée avec la ciclosporine, le diltiazem (voie injectable) et le vérapamil (voie injectable), certains antiparasitaires (halofantrine, luméfantrine et pentamidine), certains neuroleptiques (amisulpride, chlorpromazine, cyamémazine, dropéridol, fluphénazine, haloperidol, lévomépromazine, pimozide, pipampérone, pipotiazine, sertindole, sulpiride, sultopride, tiapride, zuclopenthixol) et la méthadone (voir rubrique Prise ou utilisation d'autres médicaments).
Précautions d'emploi
Ce médicament doit être utilisé avec précaution en cas de perturbations électrolytiques, en particulier en cas de déficit en potassium.
Sauf en situation d'urgence menaçant le pronostic vital, il ne doit être utilisé qu'en milieu hospitalier spécialisé et sous surveillance continue.
Avant chirurgie, informez votre anesthésiste que vous êtes traité par amiodarone.
Interactions avec d'autres médicaments
Prise ou utilisation d'autres médicaments
Ce médicament NE DOIT PAS ETRE UTILISE en association avec des médicaments susceptibles de donner des torsades de pointes (troubles graves du rythme cardiaque) comme les médicaments indiqués dans le traitement des troubles du rythme (quinidine, hydroquinidine, disopyramide, dofétilide, ibutilide, sotalol) et d'autres médicaments (tels que arsénieux, bépridil, cisapride, diphémanil, dolasétron IV érythromycine IV, mizolastine, vincamine IV, moxifloxacine, spiramycine IV, torémifène ). Ces contre-indications ne s'appliquent pas en cas d'arrêt cardiaque lié à une fibrillation ventriculaire résistante aux chocs électriques externes (voir rubrique Contre-indications).
Ce médicament DOIT ETRE EVITE en association avec la ciclosporine, le diltiazem injectable, le vérapamil injectable, certains antiparasitaires (halofantrine, luméfantrine, pentamidine), certains neuroleptiques (amisulpride, chlorpromazine, cyamémazine, dropéridol, fluphénazine, halopéridol, levomépromazine, pimozide, pipampérone, pipotiazine, sertindole, sulpiride, sultopride, tiapride, zuclopenthixol) et avec la méthadone (voir rubrique Mise en garde spéciales).
AFIN D'EVITER D'EVENTUELLES INTERACTIONS ENTRE PLUSIEURS MEDICAMENTS, IL FAUT SIGNALER SYSTEMATIQUEMENT TOUT AUTRE TRAITEMENT EN COURS A VOTRE MEDECIN OU A VOTRE PHARMACIEN.
Interactions avec les aliments et les boissons
Sans objet.
Interactions avec les produits de phytothérapie ou thérapies alternatives
Sans objet.
Utilisation pendant la grossesse et l'allaitement
Grossesse et allaitement
Sauf en situation d'urgence menaçant le pronostic vital, en raison de la présence d'iode, l'utilisation de ce médicament est contre-indiquée à partir du 2ème trimestre.
L'allaitement est contre-indiqué en cas de traitement par ce médicament.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Sans objet.
Effets sur l'aptitude à conduire des véhicules ou à utiliser des machines
Sans objet.
Liste des excipients à effet notoire
Liste des excipients à effet notoire: alcool benzylique.
3. COMMENT UTILISER CORDARONE 150 mg/3 ml, solution injectable en ampoule (IV) ?
Instructions pour un bon usage
Sans objet.
Posologie, Mode et/ou voie(s) d'administration, Fréquence d'administration et Durée du traitement
L'emploi de CORDARONE 150 mg/3 ml, solution injectable en ampoule (IV) doit s'effectuer en milieu hospitalier spécialisé et sous surveillance continue de l'électrocardiogramme et de la pression artérielle sauf en situation d'urgence menaçant le pronostic vital.
Posologie
· Dans le traitement de certains troubles du rythme cardiaque graves et en dehors de la réanimation cardio-respiratoire en cas d'arrêt cardiaque lié à une fibrillation ventriculaire résistante aux chocs électriques externes.
En traitement d'attaque, la dose habituelle est de 5 mg par kg de poids corporel.
L'administration peut être répétée 2 à 3 fois par 24 heures.
En traitement d'entretien, la dose est de 10 à 20 mg par kg et par jour: administrée pendant quelques jours.
Un relais par voie orale sous forme de CORDARONE comprimés vous sera également donné à raison de 3 comprimés/jour dès le premier jour de la perfusion.
Cette posologie pourra être portée à 4 voire 5 comprimés/jour selon les cas.
· Dans la réanimation cardio-respiratoire en cas d'arrêt cardiaque lié à une fibrillation ventriculaire résistante aux chocs électriques externes.
L'utilisation d'un cathéter veineux central est préconisée si celui-ci est immédiatement disponible; sinon l'administration peut être faite par voie veineuse périphérique en utilisant une veine périphérique aussi grosse et avec un flux aussi important que possible.
La dose intraveineuse initiale est de 300 mg (ou 5 mg/kg) dilués dans 20 ml de sérum glucosé à 5 % et injectés rapidement.
Une administration intraveineuse supplémentaire de 150 mg (ou 2,5 mg/kg) pourra être envisagée en cas de persistance de la fibrillation ventriculaire.
Mode d'administration
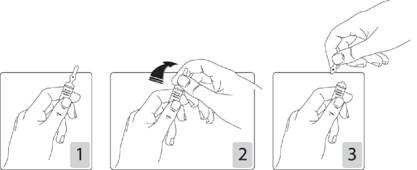
Pour ouvrir l'ampoule:
Tenir fermement l'ampoule, le point coloré face à vous (schéma 1). Saisir la tête de l'ampoule entre le pouce et l'index (le pouce sur le point coloré), puis exercer une pression vers l'arrière (schémas 2 et 3).

· Voie veineuse centrale à l'exception de la réanimation cardio-respiratoire en cas d'arrêt cardiaque lié à une fibrillation ventriculaire résistante aux chocs électriques externes.
Ce médicament s'administre uniquement en perfusion intraveineuse avec du sérum glucosé à 5 %.
L'utilisation de matériel ou de dispositifs médicaux en PVC plastifié avec du DEHP (di-2-éthylhexylphtalate) peut entraîner un relargage de DEHP en présence de la solution d'amiodarone injectable. Afin de minimiser l'exposition du patient au DEHP, il est recommandé de réaliser la dilution finale de l'amiodarone préalablement à la perfusion à l'aide de matériel ne contenant pas de DEHP tels que matériel en PVC sans DEHP, polyoléfines (polyéthylène, polypropylène), verre…
· Dans la réanimation cardio-respiratoire en cas d'arrêt cardiaque lié à une fibrillation ventriculaire résistante aux chocs électriques externes:
L'utilisation d'un cathéter veineux central est préconisée si celui-ci est immédiatement disponible; sinon l'administration peut être faite par voie veineuse périphérique en utilisant une veine périphérique aussi grosse et avec un flux aussi important que possible.
Fréquence d'administration
Lors du traitement d'attaque, l'administration peut être répétée 2 à 3 fois par jour.
Symptômes et instructions en cas de surdosage
Sans objet.
Instructions en cas d'omission d'une ou de plusieurs doses
Sans objet.
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Description des effets indésirables
Comme tous les médicaments, CORDARONE 150 mg/3 ml, solution injectable en ampoule (IV) est susceptible d'avoir des effets indésirables, bien que tout le monde n'y soit pas sujet.
Très fréquemment:
· nausées.
Fréquemment:
· baisse tensionnelle généralement modérée et transitoire;
· diminution du rythme cardiaque (bradycardie) pouvant exceptionnellement se manifester par un trouble du rythme sévère (arrêt sinusal);
· localement: possible réaction inflammatoire des veines en cas d'administration veineuse périphérique directe;
· réactions au site d'injection: douleur, rougeur, gonflement, induration, inflammation (pouvant signer une phlébite), et cellulite.
Très rarement:
· anomalie aiguë (survenant dans les 24 heures et pouvant être exceptionnellement d'évolution fatale) ou chronique du foie; augmentation modérée et transitoire de certaines enzymes hépatiques (transaminases);
· bouffées de chaleur, sueurs, chute des cheveux;
· de façon exceptionnelle, ont été observés après administration intraveineuse directe: choc de nature allergique, hypertension intracrânienne bénigne (pression excessive à l'intérieur du crâne), problèmes respiratoires (gêne respiratoire et/ou arrêt plus ou moins prolongé de la respiration en cas d'insuffisance respiratoire sévère, notamment chez les asthmatiques, détresse respiratoire aiguë pouvant être associée à une infection pulmonaire très grave voire mortelle et survenant à la suite d'un acte chirurgical);
· baisse du sodium dans le sang.
Fréquence indéterminée:
· réactions d'allergie avec gonflement du visage et du cou.
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien.
5. COMMENT CONSERVER CORDARONE 150 mg/3 ml, solution injectable en ampoule (IV) ?
Tenir hors de la portée et de la vue des enfants.
Ne pas utiliser CORDARONE 150 mg/3 ml, solution injectable en ampoule (IV) après la date de péremption mentionnée sur la boîte.
Après ouverture: le produit doit être utilisé immédiatement.
Ce médicament doit être conservé à température inférieure à 25°C.
Si nécessaire, mises en garde contre certains signes visibles de détérioration
Les médicaments ne doivent pas être jetés au tout-à-l'égout ou avec les ordures ménagères. Demandez à votre pharmacien ce qu'il faut faire des médicaments inutilisés. Ces mesures permettront de protéger l'environnement.
6. INFORMATIONS SUPPLEMENTAIRES
Liste complète des substances actives et des excipients
Que contient CORDARONE 150 mg/3 ml, solution injectable en ampoule (IV) ?
La substance active est:
Chlorhydrate d'amiodarone ................................................................................................................ 150 mg
Pour une ampoule de 3 ml.
Les autres composants sont:
Polysorbate 80, alcool benzylique, eau pour préparations injectables.
Forme pharmaceutique et contenu
Qu'est-ce que CORDARONE 150 mg/3 ml, solution injectable en ampoule (IV) et contenu de l'emballage extérieur ?
Ce médicament se présente sous forme de solution injectable. Boîte de 6 ampoules.
SANOFI-AVENTIS FRANCE
1-13, boulevard Romain Rolland
75014 PARIS
SANOFI-AVENTIS FRANCE
1-13, boulevard Romain Rolland
75014 PARIS
1, rue de la Vierge
33440 Ambares
ou
SANOFI WINTHROP INDUSTRIE
6, boulevard de l’Europe
21800 QUETIGNY
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
Date d’approbation de la notice
La dernière date à laquelle cette notice a été approuvée est le {date}.
AMM sous circonstances exceptionnelles
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’Afssaps (France).
Informations réservées aux professionnels de santé
Sans objet.
Sans objet.