ANSM - Mis à jour le : 09/03/2016
THERACAP131, Iodure (131I) de sodium pour thérapie, gélule
Iodure (131I) de sodium
CETTE NOTICE EST DESTINEE AUX PATIENTS
Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser ce médicament.
· Gardez cette notice, vous pourriez avoir besoin de la relire.
· Si vous avez toute autre question, si vous avez un doute, demandez plus d’informations à votre médecin ou/et au spécialiste de médecine nucléaire qui va pratiquer l’examen.
· Si l’un des effets indésirables devient grave ou si vous remarquez un effet indésirable non mentionné dans cette notice, parlez-en à votre médecin ou/et au spécialiste de médecine nucléaire qui a pratiqué l’examen. Voir rubrique 4.
Que contient cette notice :
1. Qu'est-ce que THERACAP131 Iodure (131I) de sodium pour thérapie, gélule et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser THERACAP131 Iodure (131I) de sodium pour thérapie, gélule ?
3. Comment utiliser THERACAP131 Iodure (131I) de sodium pour thérapie, gélule ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver THERACAP131 Iodure (131I) de sodium pour thérapie, gélule ?
6. Informations supplémentaires.
Ce médicament est un produit radiopharmaceutique.
IODURE (131I) DE SODIUM est utilisé pour traiter :
· les tumeurs de la glande thyroïde et
· l’hyperthyroïdie.
Ce médicament contient une substance radioactive qui, après administration, s’accumule dans certains organes comme la glande thyroïde.
Liste des informations nécessaires avant la prise du médicament
Il vous sera demandé de prendre une boisson tiède avant ou avec la prise de la gélule.
Ne prenez jamais THERACAP131 IODURE (131I) DE SODIUM POUR THERAPIE, gélule:
· si vous êtes enceinte ou allaitez,
· si vous avez des difficultés pour déglutir,
· si vous présentez une obstruction œsophagienne,
· si vous avez des problèmes gastriques,
· si vous souffrez de troubles du transit abdominal ou intestinal,
· si vous êtes allergique (hypersensible) à l’iodure de sodium ou à l’un des autres composants de ce médicament (voir Rubrique 6).
Ne prenez pas THERACAP131 si vous êtes dans un des cas cités ci-dessus.
En cas de doute, il est indispensable de demander l'avis de votre médecin.
Précautions d'emploi ; mises en garde spéciales
Informez le spécialiste de médecine nucléaire dans les cas suivants :
· vous présentez des troubles de la fonction rénale,
· vous êtes âgé(e) de moins de 18 ans.
· vous devez réduire votre apport alimentaire en sodium (régime sans sel).
Avant l’administration de THERACAP131 IODURE (131I) DE SODIUM POUR THERAPIE, gélule, vous devez
· boire abondamment de l’eau et être bien hydraté(e) avant le début de l’examen, afin d’uriner aussi souvent que possible pendant les heures suivant l’administration,
· être à jeun depuis au moins 2 heures,
· uriner fréquemment, afin d’éliminer le produit de votre organisme.
Il vous sera peut être demandé de consommer des bonbons ou des boisons contenant de l'acide citrique, comme du jus d'orange par exemple, afin de produire de la salive et d'arrêter le gonflement de vos glandes salivaires.
Interactions avec d'autres médicaments
Prise ou utilisation d'autres médicaments
Veuillez indiquer à votre médecin ou au spécialiste de médecine nucléaire qui va pratiquer l’examen si vous prenez ou avez pris récemment un autre médicament, même s'il s'agit d'un médicament obtenu sans ordonnance.
Veuillez informer votre médecin si vous prenez ou si vous avez reçu l’un des médicaments/substances qui suivent.
Votre médecin peut vous recommander l’arrêt des médicaments suivants avant le traitement :
a) antithyroïdiens, tels que :
§ carbimazole, thiamazole, propylthiouracile
§ perchlorate
b) salicylés : médicaments destinés à réduire la douleur, la fièvre ou l’inflammation, tels que l’aspirine
c) corticoïdes (cortisone) : médicaments anti-inflammatoires ou utilisés pour la prévention du rejet de greffe
d) nitroprussiate de sodium : antihypertenseur, également utilisé durant une opération
e) bromosulfophtaléine sodique : médicament utilisé pour tester la fonction hépatique
f) certains médicaments
§ antiparasitaires
§ antihistaminiques : utilisés pour traiter les allergies
§ pénicillines et sulfamides : antibiotiques
§ tolbutamide : hypoglycémiant (réduit le taux de sucres dans le sang)
§ thiopentone : utilisé sous anesthésie pour réduire la pression cérébrale et traiter les crises épileptiques extrêmes
g) phénylbutazone : anti-douleur et anti-inflammatoire
h) fluidifiants des sécrétions bronchiques contenant de l’iode
i) préparations vitaminiques contenant des sels iodés
j) médicaments contenant des hormones thyroïdiennes comme la thyroxine, la liothyronine, des extraits thyroïdiens
k) amiodarone : médicament utilisé pour traiter les troubles du rythme cardiaque
l) benzodiazépines : médicaments qui apaisent, induisent le sommeil et décontractent les muscles
m) lithium : médicament utilisé pour le traitement de la dépression
n) produits iodés d’application locale sur une zone limitée du corps
o) produits de contraste iodés hydrosolubles
p) produits de contraste iodés liposolubles
Avant d’utiliser THERACAP131 IODURE (131I) DE SODIUM POUR THERAPIE, gélule, vous devrez arrêter les médicaments énumérés ci-dessus en respectant les délais suivants :
a-f) : 1 semaine
g) : 1 à 2 semaines
h-i) : 2 semaines
j) : 2 à 6 semaines
k) : 3 à 6 mois
j-m) : 4 semaines
n) : 1 à 9 mois
o) : 6 à 8 semaines
p) : 1 à 6 mois
Interactions avec les aliments et les boissons
Avant la prise de THERACAP131, votre médecin ou le spécialiste de médecine nucléaire pourra vous prescrire un régime pauvre en iode.
Interactions avec les produits de phytothérapie ou thérapies alternatives
Sans objet.
Utilisation pendant la grossesse et l'allaitement
Vous devez informer le spécialiste de médecine nucléaire avant l’administration de THERACAP131 IODURE (131I) DE SODIUM POUR THERAPIE, gélule dans les situations suivantes :
· si vous êtes ou pensez être enceinte,
· si vous avez un retard de vos règles ou
· si vous allaitez.
En cas de doute, il est important de consulter le spécialiste de médecine nucléaire qui supervisera le traitement
On vous demandera d'éviter toute grossesse dans les 6 à 12 mois après le traitement par l’iode radioactif.
· Si vous êtes enceinte
Ne prenez pas THERACAP131 IODURE (131I) DE SODIUM POUR THERAPIE, gélule si vous êtes enceinte. Toute possibilité de grossesse doit être écartée avant l’utilisation de ce produit. Les femmes ne doivent pas tomber enceinte avant au moins 6 à 12 mois après l’utilisation d’Iodure (131I) de sodium.
· Si vous allaitez
Informez votre médecin si vous allaitez. Il pourra décider de retarder le traitement jusqu’à la fin de l’allaitement ou vous demander d’arrêter l’allaitement définitivement.
Sans objet.
Effets sur l'aptitude à conduire des véhicules ou à utiliser des machines
Conduite de véhicules et utilisation de machines
Il est considéré comme improbable que THERACAP131 ait une incidence sur votre capacité à conduire ou à utiliser des machines.
Liste des excipients à effet notoire
Informations importantes concernant THERACAP131.
THERACAP131 vous expose à une irradiation.
· votre médecin évaluera toujours les risques et les bénéfices potentiels du traitement dans votre cas particulier.
Liste des excipients à effet notoire: sodium.
Si vous avez d'autres questions posez-les au spécialiste de médecine nucléaire qui réalise votre traitement.
3. COMMENT UTILISER THERACAP131 Iodure (131I) de sodium pour thérapie, gélule ?
Instructions pour un bon usage
THERACAP131 est administré par un personnel spécialement formé et qualifié.
· THERACAP131 est toujours utilisé à l'hôpital ou dans une clinique.
· Il vous sera indiqué tout ce que vous devez savoir pour utiliser THERACAP131 en toute sécurité
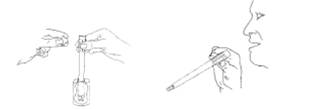
· Lorsque vous serez prêt pour l'administration de THERACAP131, le personnel qualifié vous demandera de retirer le bouchon de plastique à l'extrémité striée de l'applicateur contenant la gélule en le soulevant.

· On demandera d'avaler la gélule en portant l'extrémité striée de l'applicateur à la bouche et en inclinant doucement l'applicateur de façon à ce que la gélule glisse le long de l'applicateur et tombe librement dans la bouche.
· Veiller à ne pas croquer la gélule.
· Il vous sera demandé de prendre une boisson tiède après avoir avalé la gélule.
· Si vous avez des problèmes pour avaler ou digérer les aliments (maladie gastro-intestinale) le spécialiste de médecine nucléaire pourra vous demander de prendre d'autres médicaments pour aider la capsule à atteindre votre estomac.
La dose qui vous sera administrée et la durée du traitement dépendent de votre maladie.
Votre médecin décide de la dose la plus appropriée à votre cas.
Posologie, Mode et/ou voie(s) d'administration, Fréquence d'administration et Durée du traitement
Le spécialiste de médecine nucléaire supervisant le traitement déterminera la quantité d’Iodure (131I) de sodium pour thérapie à utiliser dans votre cas. Il s’agira de la plus petite quantité nécessaire pour obtenir l’effet souhaité.
La dose habituelle est :
Une gélule, qui a été produite à la demande pour vous.
Les doses pour les adultes sont de l’ordre de :
· 200 à 800 MBq pour le traitement de l’hyperthyroïdie
· 1 850 à 3 700 MBq en cas d’ablation partielle ou totale de la glande thyroïde et pour le traitement de la propagation à distance du cancer (les métastases)
· 3 700 à 11 100 MBq pour le traitement de suivi des métastases.
Le MBq (mégabecquerel) est l’unité utilisée pour mesurer la radioactivité et définir l’activité d’une quantité de matière radioactive.
Utilisation chez les enfants âgés de moins de 18 ans
Des doses réduites sont utilisées chez les enfants.
Administration de la gélule d’Iodure (131I) de sodium et déroulement du traitement
Tenez-vous bien droit (debout) et avalez la gélule entière avec un verre d’eau, au moins 2 heures après un repas.
Les jeunes enfants doivent pendre la gélule avec des aliments écrasés.
Buvez le plus possible pendant une journée après le traitement. Cela évitera que la substance active s’accumule dans la vessie.
Durée du traitement
Votre spécialiste de médecine nucléaire vous informera de la durée habituelle du traitement.
Symptômes et instructions en cas de surdosage
Si vous avez pris plus de THERACAP131, Iodure (131I) de sodium pour thérapie, gélule que vous n'auriez dû :
Un surdosage est pratiquement impossible car vous ne recevrez qu'une seule dose préparée et contrôlée avec précision juste avant administration.
Toutefois, en cas de surdosage, vous recevrez le traitement approprié.
Si vous avez d’autres questions sur l’utilisation de THERACAP131, Iodure (131I) de sodium pour thérapie, gélule, demandez plus d’informations au spécialiste de médecine nucléaire qui supervise le traitement.
Instructions en cas d'omission d'une ou de plusieurs doses
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Description des effets indésirables
Votre médecin a considéré que les bénéfices cliniques que vous tirerez du traitement grâce à l’administration de THERACAP131, Iodure (131I) de sodium pour thérapie, gélule, sont supérieurs aux risques liés aux rayonnements.
Des effets secondaires peuvent survenir aux fréquences suivantes et sont groupés ci-dessous, en fonction des traitements :
Traitement des affections bénignes
Très fréquents, survenant chez plus d’1 utilisateur sur 10
· Hypothyroïdie.
Fréquents, survenant chez 1 à 10 utilisateurs sur 100
· inflammation oculaire appelée orbitopathie endocrinienne (après traitement de la maladie de Basedow),
· hyperthyroïdie temporaire,
· inflammation des glandes salivaires.
Très rares, survenant chez moins d’1 utilisateur sur 10 000
· paralysie des cordes vocales.
Fréquence indéterminée, sur la base des données disponibles
· réaction allergique grave, entraînant des difficultés respiratoires ou des étourdissements,
· éruption cutanée type acné (boutons, pustules),
· crise sévère d’hyperthyroïdie,
· inflammation de la thyroïde,
· réduction de la fonction glandulaire, caractérisée par une sécheresse oculaire,
· réduction ou suppression de la production de parathormone,
· tuméfactions locales des tissus.
Traitement des affections malignes
Très fréquents, survenant chez plus d’1 utilisateur sur 10
· réduction sévère des taux de cellules sanguines, à l’origine d’une sensation de fatigue, de la formation d’hématomes ou d’une plus grande probabilité d’infection,
· carence en globules rouges,
· dysfonctionnement de la moelle osseuse,
· troubles ou perte du sens de l’odorat ou du goût,
· nausées,
· baisse de l’appétit,
· perte de fonction des ovaires,
· syndrome pseudogrippal,
· maux de tête, douleurs au cou,
· fatigue extrême ou somnolence,
· inflammation entraînant une rougeur et des démangeaisons oculaires, ainsi que des larmoiements,
· inflammation des glandes salivaires avec symptômes de type sécheresse de la bouche, du nez et des yeux ; caries dentaires, chutes des dents.
La stimulation des glandes salivaires par la consommation d’aliments ou de boissons acides permet de réduire la fréquence de cet effet secondaire.
Fréquents, survenant chez 1 à 10 utilisateurs sur 100
· augmentation anormale, prolifération maligne du taux de globules blancs,
· carence en globules blancs ou plaquettes,
· augmentation du larmoiement,
· difficultés respiratoires,
· vomissements,
· gonflement local des tissus.
Rares, survenant chez 1 à 10 utilisateurs sur 10 000
· Hyperthyroïdie sévère ou temporaire
Fréquence indéterminée, sur la base des données disponibles
· réaction allergique grave, entraînant des difficultés respiratoires ou des étourdissements,
· cancers solides par exemple de la vessie, du gros intestin, de l’estomac, suppression permanente ou sévère de la moelle osseuse,
· inflammation de la thyroïde,
· réduction ou suppression de la production de parathormone,
· hypothyroïdie,
· inflammation de la trachée et/ou rétrécissement de la gorge,
· prolifération du tissu conjonctif dans les poumons,
· difficultés respiratoires ou respiration sifflante,
· inflammation pulmonaire,
· paralysie des cordes vocales, raucité de la voix, capacité réduite à produire des sons au moyen des organes vocaux,
· douleurs de la bouche/gorge,
· accumulation intracrânienne de liquide,
· inflammation de la muqueuse gastrique,
· difficultés pour avaler,
· inflammation de la vessie,
· troubles du cycle menstruel,
· baisse de la fertilité chez les hommes,
· carence en hormone thyroïdienne.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en, au spécialiste de médecine nucléaire qui supervise le traitement. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (Ansm) et réseau des Centres Régionaux de Pharmacovigilance – Site internet : www.ansm.sante.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER THERACAP131 Iodure (131I) de sodium pour thérapie, gélule ?
Information réservée au professionnel de santé
Vous n'aurez pas à conserver ce médicament. Il est conservé par le médecin qui pratique l'examen, dans des locaux aménagés à cet effet, dans le respect de la réglementation en vigueur.
La péremption et l’heure de calibration sont indiquées sur l’étiquette du conditionnement extérieur.
Si nécessaire, mises en garde contre certains signes visibles de détérioration
Les conditions de stockage et la date limite d'utilisation du lot figurent sur le conditionnement du produit.
Le personnel hospitalier assure le stockage du produit dans des conditions appropriées et veille à ce que ce médicament ne vous soit pas administré au-delà de la date limite d'utilisation.
6. INFORMATIONS SUPPLEMENTAIRES
Liste complète des substances actives et des excipients
Que contient THERACAP131, Iodure (131I) de sodium pour thérapie, gélule ?
La substance active est :
Iodure (131I) de sodium.
Chaque gélule de THERACAP131 contient une activité comprise entre 50 et 5 500 MBq (Les Mégabecquerels et les Gigabecquerels sont des unités de radioactivité de l'Iodure (131I) de sodium mesurée à la date et à l'heure de calibration).
Les autres composants sont :
Thiosulfate de sodium pentahydraté, hydroxyde de sodium, eau pour préparation injectable, phosphate disodique anhydre, silice colloïdale anhydre, amidon de maïs.
Gélule de gélatine: oxyde de fer jaune (E172), dioxyde de titane (E171), gélatine, lauryl sulfate de sodium, acide acétique.
Forme pharmaceutique et contenu
Qu'est-ce que THERACAP131, Iodure (131I) de sodium pour thérapie, gélule et contenu de l'emballage extérieur ?
1 gélule en flacon (polycarbonate).
Titulaire de l’autorisation de mise sur le marché et fabricant
GE HEALTHCARE SAS
22/24, avenue de l'Europe
78140 VELIZY VILLACOUBLAY
GE HEALTHCARE SAS
22/24, avenue de l'Europe
78140 VELIZY VILLACOUBLAY
GE HEALTHCARE BUCHLER GMBH &CO.KG
Gieselweg 1
D-38110 Braunschweig
Germany
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Date d’approbation de la notice
La dernière date à laquelle cette notice a été approuvée est le {date}.
AMM sous circonstances exceptionnelles
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Informations réservées aux professionnels de santé
Sans objet.