NOTICE
ANSM - Mis à jour le : 26/05/2016
Dénomination du médicament
MONONINE 1000 UI/10 ml, poudre et solvant pour solution injectable ou perfusion
Facteur IX de coagulation humain
Encadré
Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser ce médicament.
· Gardez cette notice, vous pourriez avoir besoin de la relire.
· Si vous avez toute autre question, si vous avez un doute, demandez plus d'informations à votre médecin ou à votre pharmacien.
· <Ce médicament vous a été personnellement prescrit. Ne le donnez jamais à quelqu'un d'autre, même en cas de symptômes identiques, cela pourrait lui être nocif.
· Si l'un des effets indésirables devient grave ou si vous remarquez un effet indésirable non mentionné dans cette notice, parlez-en à votre médecin ou à votre pharmacien.
Sommaire notice
Dans cette notice :
1. QU'EST-CE QUE MONONINE 1000 UI/10 ml, poudre et solvant pour solution injectable ou perfusion ET DANS QUELS CAS EST-IL UTILISE ?
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER MONONINE 1000 UI/10 ml, poudre et solvant pour solution injectable ou perfusion ?
3. COMMENT UTILISER MONONINE 1000 UI/10 ml, poudre et solvant pour solution injectable ou perfusion ?
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
5. COMMENT CONSERVER MONONINE 1000 UI/10 ml, poudre et solvant pour solution injectable ou perfusion ?
6. INFORMATIONS SUPPLEMENTAIRES
1. QU'EST-CE QUE MONONINE 1000 UI/10 ml, poudre et solvant pour solution injectable ou perfusion ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique
Antihémorragiques (médicament pour arrêter un saignement): facteur IX de coagulation sanguine.
Code ATC: B02BD04
Indications thérapeutiques
MONONINE 1000 est fabriqué à partir de plasma humain (partie liquide du sang) et il contient du facteur IX de coagulation humain. Il est utilisé pour prévenir ou arrêter l'hémorragie due à un déficit congénital en facteur IX (hémophilie B) dans le sang.
Dans quelle indication MONONINE 1000 est-il utilisé ?
Le facteur IX est très important pour la formation du caillot sanguin (coagulation). Le déficit du facteur IX signifie que le sang ne coagule pas aussi vite qu'il devrait et ainsi il y a une tendance croissante à saigner. La substitution du facteur IX par MONONINE 1000 rétablie provisoirement les mécanismes de coagulation.
La solution reconstituée doit être injectée ou perfusé dans une veine.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER MONONINE 1000 UI/10 ml, poudre et solvant pour solution injectable ou perfusion ?
Liste des informations nécessaires avant la prise du médicament
Sans objet.
Contre-indications
Les rubriques suivantes contiennent des informations que vous ou votre médecin doivent considérer avant d'utiliser MONONINE 1000 UI/10 ml, poudre et solvant pour solution injectable ou perfusion.
N'utilisez jamais MONONINE 1000 UI/10 ml, poudre et solvant pour solution injectable ou perfusion:
· Si vous êtes allergique au facteur IX de coagulation humain ou à l'un des autres composants de MONONINE 1000 ou aux protéines de souris. Veuillez informer votre médecin si vous êtes allergique à un médicament ou à un aliment.
· Si vous avez un risque élevé de formation de caillots (thrombose) ou si vous êtes susceptible de former plus de caillots que la normale (coagulation intravasculaire disséminée).
Précautions d'emploi ; mises en garde spéciales
Faites attention avec MONONINE 1000 UI/10 ml, poudre et solvant pour solution injectable ou perfusion:
· Comme avec tout produit intraveineux à base de protéines, des réactions allergiques sont possibles. Les signes précoces comprennent urticaire, urticaire généralisée, oppression thoracique, respiration sifflante, hypotension, et anaphylaxie (une réaction allergique grave qui entraîne de sévères difficultés à respirer, ou des vertiges). Si ces symptômes apparaissent, vous devez immédiatement arrêter d'utiliser le produit et contacter votre médecin.
· MONONINE 1000 contient des traces de protéines murines (restes d'un procédé particulier de purification). Bien que les taux de protéines murines soient extrêmement faibles, la perfusion de telles protéines peut induire des réactions allergiques.
· La formation d'inhibiteurs (anticorps neutralisants) du facteur IX est une complication connue du traitement et il signifie que le traitement ne marche plus. Si votre saignement n'est plus contrôlé par MONONINE 1000, dites le à votre médecin immédiatement. Vous serez surveillé attentivement dans le développement d'un inhibiteur.
· Il y a un risque de formation croissante de caillots dans un vaisseau sanguin (complications thromboemboliques), particulièrement:
o dans les préparations de faible pureté (pour des concentrés hautement purifiés comme MONONINE 1000 ce risque est considéré être très faible)
o si vous présentez une affection hépatique
o si vous venez d'être opéré
o chez les nouveau-nés
o si vous avez des facteurs de risque thrombotiques supplémentaires tels que la grossesse, la contraception orale, l'obésité, le tabac.
La tolérance et l'efficacité chez les enfants n'ont pas été étudiés pour les perfusions continues, en particulier la possibilité de développer des inhibiteurs est inconnnue.
Votre médecin évaluera attentivement le bénéfice du traitement par MONONINE 1000 par rapport au risque de ces complications.
Sécurité virale
Lorsque des médicaments sont préparés à partir de sang ou de plasma humain, des mesures de prévention de la transmission d'agents infectieux sont mises en place. Celles-ci comprennent une sélection soigneuse des donneurs de sang et de plasma de façon à exclure les donneurs risquant d'être porteurs d'infections, et le contrôle de chaque don et des mélanges de plasma pour la présence de virus/d'infection.
Les fabricants de ces médicaments mettent également en œuvre dans leur procédé de fabrication des étapes capables d'éliminer ou d'inactiver les virus.
Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission de maladies infectieuses ne peut être totalement exclu. Ceci s'applique également à tous les virus inconnus ou émergents ou autres types d'agents infectieux.
Les mesures prises sont considérées comme efficaces pour lutter contre le risque d'infection par le virus de l'immunodéficience humaine (VIH), le virus de l'hépatite B (VHB), le virus de l'hépatite C (VHC), le virus de l'hépatite A et le parvovirus B19.
Une vaccination appropriée (hépatites A et B) des patients recevant des facteurs de coagulation est recommandée.
Interactions avec d'autres médicaments
Utilisation d'autres médicaments
· Veuillez indiquer à votre médecin ou à votre pharmacien si vous prenez ou avez pris récemment un autre médicament, même s'il s'agit d'un médicament obtenu sans ordonnance.
· Le facteur IX et l'acide ε-amino caproïque (médicament arrêtant la dissolution des caillots) peut être utilisé dans le traitement de saignement de la bouche, même si cela arrive après une blessure ou après une chirurgie dentaire, telles que des extractions dentaires. Cependant, Il n'existe que peu d'information sur les conséquences de l'utilisation simultanée de l'acide ε-amino caproïque et de MONONINE 1000.
· MONONINE 1000 ne doit pas être mélangé avec d'autres médicaments, diluants et solvants à l'exception de ceux recommandés par le fabricant (voir rubrique « Informations supplémentaires »).
Interactions avec les aliments et les boissons
Aliments et boissons
Sans objet.
Interactions avec les produits de phytothérapie ou thérapies alternatives
Sans objet.
Utilisation pendant la grossesse et l'allaitement
Grossesse et allaitement
· Si vous êtes enceinte ou vous allaitez, demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament
· Au cours de la grossesse et de l'allaitement, MONONINE 1000 ne doit être utilisé qu'en cas de nécessité absolue.
Sportifs
Sportifs
Sans objet.
Effets sur l'aptitude à conduire des véhicules ou à utiliser des machines
Conduite de véhicules et utilisation de machines
MONONINE 1000 ne devrait pas avoir d'effet sur l'aptitude à conduire des véhicules et à utiliser des machines.
Liste des excipients à effet notoire
Informations importantes concernant certains composants de MONONINE 1000 UI/10 ml, poudre et solvant pour solution injectable ou perfusion
Mononine 1000 contient jusqu'à 20,3 mg de sodium pour 1000 UI. Veuillez le prendre en compte si vous suivez un régime hyposodé contrôlé.
3. COMMENT UTILISER MONONINE 1000 UI/10 ml, poudre et solvant pour solution injectable ou perfusion ?
Instructions pour un bon usage
Toujours utiliser MONONINE 1000 exactement comme vous l'a prescrit votre médecin. Si vous n'êtes pas sûr(e) de vous lorsque vous prenez vos médicaments, n'hésitez pas à demander conseil à votre médecin.
Le traitement de l'hémophilie B doit être initié et surveillé par un médecin expérimenté dans le type de maladie.
Posologie, Mode et/ou voie(s) d'administration, Fréquence d'administration et Durée du traitement
Posologie
La dose de facteur IX dont vous avez besoin et la durée du traitement de substitution dépendront de plusieurs facteurs, tel que poids corporel, la sévérité de la maladie, la localisation et l'ampleur de l'hémorragie ou la nécessité de prévenir le saignement pendant une opération ou une investigation.
Si MONONINE 1000 vous a été prescrit pour un usage à domicile, votre médecin s'assurera que vous savez comment injecter ou perfuser le médicament et la quantité à utiliser.
Suivez les instructions données par votre médecin ou par les infirmières des centres d'hémophilie.
Si vous avez pris plus de MONONINE 1000 que vous n'auriez dû:
Aucun symptôme de surdosage par le facteur IX n'a été rapporté.
Reconstitution et mode d'administration
Instructions générales
· La reconstitution et le prélèvement doivent être faits sous conditions aseptiques.
· La solution reconstituée est limpide ou légèrement opalescente, c'est à dire des bulles peuvent être observée à la lumière mais elle ne doit pas contenir de particules évidentes. Après filtration/prélèvement (voir ci-dessous), la solution doit être vérifiée visuellement pour y déterminer la présence éventuelle de particules de matière ou un jaunissement. N'utilisez pas de solutions troubles ou contenant des résidus (dépôts/particules).
· Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Reconstitution:
Amener le solvant et le flacon de poudre MONONINE 1000 à température ambiante ou corporelle sans ouvrir les flacons. Ceci peut être fait soit en laissant les flacons à température ambiante environ une heure, soit en les tenant dans les mains pendant quelques minutes.
NE PAS exposer les flacons à une source de la chaleur directe. Les flacons ne doivent pas être chauffés au delà de la température du corps (37°C).
Avec précaution retirer les capsules des flacons de la poudre et du solvant, nettoyer les bouchons avec un tampon alcoolisé. Laisser sécher avant d'ouvrir l'emballage du dispositif Mix2Vial, ensuite suivre les instructions fournies ci-dessous.
|
|
1. Ouvrir l'emballage du dispositif Mix2Vial en retirant l'opercule.
|
|
|

|
2. Retirer le dispositif de l'emballage, en faisant attention de ne pas toucher les pointes situées à chaque extrémité. Placer le flacon de solvant sur une surface plane et propre et maintenir le flacon fermement. Enclencher l'extrémité bleue du dispositif Mix2Vial sur le bouchon du flacon de solvant.
|
|
|

|
3. Tout en maintenant fermement le flacon de poudre sur une surface, retourner l'ensemble flacon de solvant-dispositif et l'enclencher sur le flacon de poudre par sa partie transparente. Le solvant est automatiquement transféré dans le flacon de poudre.
|
|
|

|
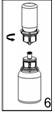
4. Alors que les flacons de solvant et de poudre sont encore reliés, agiter doucement par un mouvement circulaire pour dissoudre totalement le produit. Ne pas secouer le flacon.
|
|
|
|
5. En maintenant d'une main la partie poudre du dispositif Mix2Vial et de l'autre la partie solvant, séparer les flacons en dévissant le dispositif.
|
|
|
Remplir d'air une seringue stérile vide. Inverser le flacon de poudre et visser la seringue sur le dispositif Mix2vial. Injecter l'air dans le flacon de poudre.
|
|
Prélèvement et mode d'administration:
|
|
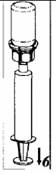
6. Tout en maintenant le piston de la seringue appuyé, retourner l'ensemble puis prélever le concentré dans la seringue en tirant doucement sur le piston.
|
|
|
|
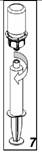
7. Une fois que le concentré a été transféré dans la seringue, séparer le dispositif Mix2vial de la seringue en la dévissant par le corps (en maintenant le piston de la seringue dirigé vers le bas).
|
|
Injection intraveineuse unique
Piquer la veine avec le nécessaire de ponction veineuse fourni. Laisser la circulation sanguine de retour à l'extrémité du tube. Fixer la seringue à l'extrémité luer-lock du dispositif.
Injecter la solution reconstituée lentement par voie intraveineuse suivant les instructions données par votre médecin. Faire attention de ne pas souiller de sang la seringue contenant la solution reconstituée.
Le débit maximum confortable d'administration est de 2 ml par minute.
Perfusion continue
MONONINE 1000 peut aussi être administré sous perfusion continue pendant plusieurs heures ou jours. Ceci doit être réalisé et contrôlé par votre médecin.
Vérifier qu'aucun des effets indésirables n'apparaissent immédiatement. Si vous avez un des effets indésirables qui pourraient être lié à l'administration de MONONINE 1000, l'injection ou la perfusion doit être arrêtée (voir rubrique « Faites attention avec MONONINE 1000 »).
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin ou à votre pharmacien.
Symptômes et instructions en cas de surdosage
Si vous avez utilisé plus de MONONINE 1000 UI/10 ml, poudre et solvant pour solution injectable ou perfusion que vous n'auriez dû:
Sans objet.
Instructions en cas d'omission d'une ou de plusieurs doses
Si vous oubliez d'utiliser MONONINE 1000 UI/10 ml, poudre et solvant pour solution injectable ou perfusion:
Sans objet.
Risque de syndrome de sevrage
Si vous arrêtez d'utiliser MONONINE 1000 UI/10 ml, poudre et solvant pour solution injectable ou perfusion:
Sans objet.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Description des effets indésirables
Comme tous les médicaments, MONONINE 1000 UI/10 ml, poudre et solvant pour solution injectable ou perfusion est susceptible d'avoir des effets indésirables, bien que tout le monde n'y soit pas sujet.
Si un des effets suivants survient, contactez immédiatement votre médecin ou allez aux urgences ou centre d'hémophilie de l'hôpital le plus proche:
· une réaction allergique soudaine (telles que éruption cutanée ou urticaire, démangeaisons, gonflement de la face, des lèvres, de la langue ou d'autres parties du corps),
· oppression thoracique, sifflement ou difficulté à respirer
· convulsions
· perte de l'effet (saignement continu).
Les autres effets indésirables sont:
· réactions allergiques, lesquelles peuvent comprendre:
o brûlure et picotement, rougeurs et gonflement de la veine au point d'injection/de perfusion
o gonflement de la face, de la gorge, ou autres parties du corps, frissons, rougeur, éruption cutanée sur tout le corps, démangeaisons
o maux de tête,
o hypotension, agitation, tachycardie (accélération du pouls), sensation d'oppression au niveau de la poitrine, sifflement
o fatigue (léthargie)
o sensation de malaise/nausée
o fourmillements
Ces effets indésirables ont été observés rarement, et peuvent dans certains cas évoluer vers des réactions allergiques sévères (anaphylaxie) incluant le choc allergique (ceci est étroitement lié avec l'apparition d'inhibiteurs du facteur IX).
· Plus rarement, des états fébriles ont été observés.
· Très rarement, une forme spéciale d'inflammation des reins (syndrome néphrotique) a été observée après le traitement de patients porteurs d'inhibiteurs du facteur IX. Ces patients étaient aussi connus pour avoir des antécédents de réactions allergiques.
· Il existe un risque potentiel de formation croissante de caillots sanguins qui peut conduire à des cas d'infarctus du myocarde, de thrombose veineuse et d'embolie pulmonaire, après administration de produits contenant du facteur IX. L'utilisation de MONONINE 1000 est rarement liée à ces effets indésirables.
· Vous pouvez développer un inhibiteur (anticorps neutralisant) dirigé contre le facteur IX, dans ce cas la réponse clinique au facteur IX ne fonctionnera plus correctement. Dans de tels cas, il est recommandé de faire appel à un centre spécialisé dans l'hémophilie.
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer <votre médecin> <ou> <votre pharmacien.>
5. COMMENT CONSERVER MONONINE 1000 UI/10 ml, poudre et solvant pour solution injectable ou perfusion ?
Tenir hors de la portée et de la vue des enfants.
Date de péremption
Ne pas utiliser MONONINE 1000 après la date de péremption mentionnée sur l'étiquette et la boîte.
Conditions de conservation
Ne pas congeler.
Conserver le flacon dans l'emballage extérieur à l'abri de la lumière.
A conserver au réfrigérateur (entre 2°C et 8°C).
Au cours de sa durée de conservation, le produit (lorsqu'il est conservé dans son emballage extérieur) peut être conservé à température ambiante (jusqu'à 25°C) jusqu'à un mois sans être réfrigéré à nouveau pendant cette période. La date de transfert à température ambiante et la fin de la période d'un mois doivent être enregistrées sur l'emballage extérieur. A la fin de cette période, le produit doit être utilisé ou éliminé.
La solution reconstituée doit être utilisée immédiatement.
Si la solution reconstituée est diluée (jusqu'à 1: 10), la solution doit être utilisée immédiatement, toutefois la stabilité a été démontrée dans les 24 heures.
Votre médecin vous indiquera comment éliminer le produit non utilisé ou les déchets.
Si nécessaire, mises en garde contre certains signes visibles de détérioration
Sans objet.
6. INFORMATIONS SUPPLEMENTAIRES
Liste complète des substances actives et des excipients
Que contient MONONINE 1000 UI/10 ml, poudre et solvant pour solution injectable ou perfusion ?
MONONINE 1000 UI/ 10 ml contient 1000 UI de facteur IX de coagulation humain par flacon.
Une fois dissoute avec 10 ml de solvant, la solution reconstituée contient approximativement 100 UI de facteur IX de coagulation humain par ml.
Les autres composants sont:
Histidine, mannitol, chlorure de sodium, acide chlorhydrique ou hydroxyde de sodium (en petites quantités pour ajustement du pH). Solvant: eau pour préparations injectables.
Forme pharmaceutique et contenu
Qu'est-ce que MONONINE 1000 UI/10 ml, poudre et solvant pour solution injectable ou perfusion et contenu de l'emballage extérieur ?
MONONINE 1000 se présente sous forme d'une poudre blanche et est fourni avec de l'eau pour préparations injectables comme solvant.
La solution reconstituée doit être limpide à légèrement opalescente, c'est à dire des bulles peuvent être observées à la lumière mais la solution ne doit pas contenir de particules visibles.
Présentations
Une boîte contenant 1000 UI:
· 1 flacon de poudre
· 1 flacon contenant 10 ml d'eau pour préparations injectables
Une boîte de dispositif:
· 1 dispositif de transfert avec filtre 20/13
· 1 seringue à usage unique de 10 ml
· 1 nécessaire de ponction veineuse
· 2 tampons alcoolisés
· 1 pansement non stérile
Nom et adresse du titulaire de l'autorisation de mise sur le marché et du titulaire de l'autorisation de fabrication responsable de la libération des lots, si différent
Titulaire
CSL BEHRING GMBH
EMIL VON BEHRING STRASSE 76
35041 MARBURG
ALLEMAGNE
Exploitant
CSL BEHRING
7 / 11 QUAI ANDRE CITROËN
tour cristal
75015 PARIS
Fabricant
CSL BEHRING GMBH
EMIL VON BEHRING STRASSE 76
35041 MARBURG
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants:
Conformément à la réglementation en vigueur.
Date d’approbation de la notice
La dernière date à laquelle cette notice a été approuvée est le {date}.
AMM sous circonstances exceptionnelles
Sans objet.
Informations Internet
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’Afssaps (France).
Informations réservées aux professionnels de santé
Les informations suivantes sont destinées exclusivement aux professionnels de santé:
Posologie
Le nombre d'unités de facteur IX administrées est exprimé en Unités Internationales (UI), calculées en accord avec la norme OMS pour le facteur IX. L'activité plasmatique du facteur IX est exprimée soit en pourcentage (par rapport au plasma humain normal), soit en Unités Internationales (par rapport à la norme internationale pour le facteur IX plasmatique).
Une Unité Internationale (UI) d'activité facteur IX correspond à la quantité de facteur IX présente dans un ml de plasma humain normal.
Le calcul de la dose nécessaire de facteur IX repose sur l'observation empirique selon laquelle 1 UI de facteur IX par kg de poids corporel fait augmenter l'activité plasmatique du facteur IX plasmatique de 1,0 % par rapport à l'activité de la valeur normale. La dose requise est calculée au moyen de la formule suivante:
Nombre d'unités requises = poids corporel [kg] x augmentation souhaitée en de facteur IX souhaitée [% ou UI/dl] x 1,01
(1: inverse de la récupération observée)
Important:
La quantité à administrer, le mode ainsi que la fréquence d'administration doivent toujours être déterminés en fonction de l'efficacité clinique dans chaque cas individuel. Les produits contenant du facteur IX exigent rarement d'être administrés plus d'une fois par jour lorsqu'ils sont administrés sous forme de bolus.
Dans le cas des accidents hémorragiques suivants, l'activité du facteur IX plasmatique ne doit pas descendre sous le taux d'activité plasmatique indiquée (en % par rapport à la normale ou UI/dl) pour la période correspondante. Les tableaux suivants fournissent des indications concernant le dosage en cas d'hémorragies et de chirurgie:
|
Tableau 1: Injection Intraveineuse Unique
|
|
|
Ampleur de l'hémorragie/ Type de procédure chirurgicale
|
Niveau de facteur IX requis
(% ou UI/dl)
|
Fréquence des injections (heures)/Durée de la thérapie (jours)
|
|
|
Hémorragie
|
|
|
|
|
Hémarthrose précoces, hémorragie musculaire ou buccale.
|
20 - 40
|
Répéter toutes les 24 heures. Au moins 1 jour, jusqu'à l'arrêt de l'épisode hémorragique, représenté par l'arrêt des douleurs ou la cicatrisation.
|
|
|
Hémarthrose étendue, hémorragies musculaires ou hématome
|
30 - 60
|
Répéter la perfusion toutes les 24 heures pendant 3 - 4 jours ou davantage, jusqu'à disparition de l'invalidité et de la douleur.
|
|
|
Hémorragies menaçant le pronostic vital
|
60 - 100
|
Répéter la perfusion toutes les 8 à 24 heures jusqu'à disparition de la menace.
|
|
|
Chirurgie
|
|
|
|
|
Mineure, y compris extraction dentaire
|
30 - 60
|
Toutes les 24 heures, au minimum pendant 1 jour, jusqu'à cicatrisation
|
|
|
Majeure
|
80 - 100
(pré- et postopératoire)
|
Répéter la perfusion toutes les 8 à 24 heures jusqu'à cicatrisation adéquate de la plaie, puis poursuivre la thérapie au moins 7 jours supplémentaires pour maintenir une activité du facteur IX entre 30 % et 60 % (UI/dl).
|
|
|
Tableau 2: Perfusion Continue en Chirurgie
|
|
|
Niveau de facteur IX souhaité pour l'hémostase
|
40 - 100 % (ou UI/dl)
|
|
|
Dose de charge initiale pour atteindre le niveau souhaité
|
Bolus unique de 90 UI par kg (intervalle 75 - 100 UI/kg) de poids corporel ou posologie déterminée par la pharmacocinétique
|
|
|
Fréquence d'administration
|
Perfusion IV continue, en fonction de la clairance et des taux de facteur IX mesurés
|
|
|
Durée du traitement
|
Jusqu'à 5 jours, un traitement supplémentaire peut être nécessaire en fonction de la nature de la chirurgie
|
|
Pendant la durée du traitement, il est recommandé d'effectuer des dosages du facteur IX plasmatique afin d'ajuster les doses à administrer et la fréquence des perfusions. Une surveillance étroite du traitement de substitution au moyen de bilans de la coagulation (activité plasmatique du facteur IX) est indispensable, en particulier dans le cas d'interventions chirurgicales majeures. La réponse à l'administration de facteur IX peut varier selon les patients, avec des valeurs différentes de la récupération in vivo et avec différentes valeurs de la demi-vie.
Pour la prophylaxie anti-hémorragique à long terme chez les patients atteints d'une forme sévère d'hémophilie B, les doses habituelles sont de 20 à 40 UI de facteur IX par kg de poids corporel, à intervalles de 3 à 4 jours. Dans certains cas, en particulier chez les sujets jeunes, il peut être nécessaire d'envisager des intervalles d'administration plus rapprochés ou des doses supérieures.
Les patients doivent être surveillés à la recherche de l'apparition d'inhibiteurs du facteur IX. Dans les cas où les taux d'activité plasmatique du facteur IX prévus ne sont pas atteints, ou lorsque l'hémorragie n'est pas maîtrisée après une dose pourtant appropriée, un test devra être effectué afin de déterminer la présence d'un inhibiteur du facteur IX. Chez les patients présentant un titre élevé d'inhibiteur, la thérapie par le facteur IX peut ne pas être efficace et d'autres alternatives thérapeutiques doivent être envisagées.
La prise en charge de tels patients nécessite l'intervention de médecins spécialistes expérimentés dans les soins aux patients atteints d'hémophilie.
Mode d'administration
Mononine 1000 doit être administré soit par voie intraveineuse (voir instructions rubrique 3), ou soit par perfusion continue (voir instructions ci-dessous)
Perfusion continue
Mononine 1000 doit être reconstitué avec de l'eau pour préparations injectables comme décrit dans la rubrique « Reconstitution et mode d'administration ». Après reconstitution, Mononine 1000 peut être administré sous perfusion continue soit non dilué soit dilué à l'aide d'une seringue électrique ou set de perfusion approuvé.
Une solution diluée peut être obtenue de la façon suivante:
· Diluer la solution reconstituée et filtrée par transfert d'une quantité appropriée de Mononine dans le volume souhaité de sérum physiologique de manière aseptique.
· Pour les dilutions jusqu'à 1: 10 (concentration de 10 UI de facteur IX/ml), l'activité du facteur IX reste stable jusqu'à 24 heures.
· Une diminution de l'activité facteur IX peut apparaître pour des facteurs de dilution plus importants. L'activité facteur IX doit être surveillée afin de maintenir le taux sanguin souhaité.
Exemple pour diluer 1000 UI de solution Mononine reconstituée:
|
Activité souhaitée après dilution
|
10 UI/ml
|
20 UI/ml
|
|
|
Volume de solution reconstituée de Mononine
|
10,0 ml
|
10,0 ml
|
|
|
Volume de sérum physiologique nécessaire
|
90,0 ml
|
40,0 ml
|
|
|
Facteur de dilution
|
1: 10
|
1: 5
|
|
· L'utilisation de poches et de tubulures IV en chlorure de polyvinyle (PVC) est recommandée.
· Mélanger soigneusement et vérifier l'absence de fuites au niveau de la poche.
· Il est recommandé de remplacer les poches par une nouvelle solution diluée de MONONINE toutes les 12 - 24 heures.
Le débit recommandé pour la perfusion continue de MONONINE 1000 destinée à maintenir un niveau stable de facteur IX d'environ 80 % est de 4 UI/kg de poids corporel/heure, mais il peut varier en fonction du profil pharmacocinétique du patient et du niveau du facteur IX que l'on souhaite atteindre. Chez les patients dont la clairance du facteur IX est connue, le débit de perfusion peut être calculé pour un patient donné.
Débit (UI/kg de poids corporel/h) = Clairance (ml/h/kg de poids corporel) × augmentation souhaitée du facteur IX (UI/ml)
La tolérance et l'efficacité chez les enfants n'ont pas été étudiés pour les perfusions continues. C'est pourquoi, chez l'enfant et l'adolescent, la perfusion continue de Mononine 1000 sera envisagée seulement si les données pharmacocinétiques pré-chirurgicales (à savoir récupération progressive et clairance) sont disponibles pour le calcul de la dose et si les taux sont soigneusement surveillés en péri-opératoire.
Autres
Sans objet.



![]()

