ANSM - Mis à jour le : 10/01/2019
GAMUNEX 100 mg/mL, solution pour perfusion
Immunoglobuline humaine normale (IgIV)
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que GAMUNEX 100 mg/mL, solution pour perfusion et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser GAMUNEX 100 mg/mL, solution pour perfusion ?
3. Comment utiliser GAMUNEX 100 mg/mL, solution pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver GAMUNEX 100 mg/mL, solution pour perfusion ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE GAMUNEX 100 mg/mL, solution pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
Qu’est-ce que GAMUNEX 100 mg/mL, solution pour perfusion ?
Ce médicament est une immunoglobuline G (IgG) humaine non modifiée qui présente un large spectre d’anticorps contre divers agents infectieux.
Dans quel cas est-il utilisé ?
Traitement des adultes et des enfants et adolescents (âgés de 0 à 18 ans) n’ayant pas suffisamment d’anticorps (traitement de substitution), notamment :
· Patients atteints de déficit immunitaire primitif (déficit congénital en anticorps)
· Hypogammaglobulinémie (trouble se caractérisant par de faibles taux d’immunoglobulines dans le sang) et infections bactériennes récurrentes chez les patients atteints de leucémie lymphoïde chronique (cancer du sang avec production excessive de globules blancs), chez lesquels l’antibiothérapie prophylactique a échoué.
· Hypogammaglobulinémie et infections bactériennes récurrentes chez les patients atteints d’un myélome (tumeur composée de cellules provenant de la moelle osseuse) n’ayant pas répondu au vaccin anti-pneumococcique.
· Hypogammaglobulinémie chez les patients ayant bénéficié d’une greffe de cellules souches (allogreffe de cellules souches hématopoïétiques, c’est-à-dire recevant des cellules souches d’une autre personne).
· Infection congénitale par le VIH avec infections bactériennes récurrentes.
Traitement des adultes et des enfants et adolescents (âgés de 0 à 18 ans) présentant certains troubles auto-immuns (immunomodulation). Il y a quatre groupes :
· Thrombopénie immune primaire, trouble caractérisé par une diminution importante du nombre de plaquettes dans la circulation sanguine. Les plaquettes jouent un rôle important dans le processus de coagulation et une réduction de leur nombre est susceptible de provoquer des hémorragies et des ecchymoses (bleus). Le médicament est également utilisé chez les patients présentant un risque hémorragique élevé ou avant une intervention chirurgicale afin de corriger le taux de plaquettes.
· Syndrome de Guillain-Barré, maladie dans laquelle le système immunitaire attaque les nerfs et les empêche de fonctionner correctement.
· Polyradiculonévrite inflammatoire démyélinisante chronique (PIDC)
· Maladie de Kawasaki (dans ce cas en association avec un traitement par acide acétylsalicylique), maladie survenant chez l’enfant et se caractérisant par une dilatation des vaisseaux sanguins (artères).
N’utilisez jamais GAMUNEX 100 mg/mL, solution pour perfusion :
· si vous êtes allergique aux immunoglobulines humaines.
· si vous êtes allergique au principe actif ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
· si vous n’avez pas assez d’immunoglobulines de type IgA dans votre sang et si votre organisme a développé des anticorps anti-IgA.
Avertissements et précautions
Certains effets indésirables peuvent être attribués au débit de la perfusion. Le débit de perfusion recommandé (voir « 3. Comment utiliser GAMUNEX ») doit être attentivement surveillé.
Certains effets indésirables peuvent se produire plus fréquemment :
· si la perfusion intraveineuse est administrée à un débit élevé.
· chez les patients avec un déficit total en immunoglobulines ou avec des taux sanguins bas en gammaglobulines (agammaglobulinémie ou hypogammaglobulinémie), avec ou sans déficit en IgA.
· chez les patients recevant pour la première fois des immunoglobulines humaines normales ou, dans de rares cas, lorsqu’il y a substitution d’une préparation d’immunoglobulines par une autre, ou après une longue période sans traitement.
Des complications peuvent souvent être évitées en s’assurant que :
· vous n’êtes pas hypersensible aux immunoglobulines humaines, en perfusant la première fois GAMUNEX lentement (0,1 mL/kg/h)
· vous êtes étroitement surveillé afin de détecter tout symptôme pendant toute la durée de la perfusion. En particulier, si vous recevez des immunoglobulines humaines pour la première fois, si vous avez changé d’immunoglobulines ou si vous n’avez pas été traité depuis un certain temps, vous devez être étroitement surveillé pendant la première perfusion et une heure après la fin de la perfusion, afin de détecter d’éventuels effets indésirables.
En cas d’effets indésirables, le débit de perfusion doit être réduit ou la perfusion doit être arrêtée jusqu’à disparition des symptômes. Si les symptômes persistent même après l’arrêt de la perfusion, un traitement adéquat sera instauré. En cas de choc (choc anaphylactique avec chute sévère de la tension artérielle), le traitement doit être arrêté immédiatement et le traitement médical standard de choc doit être instauré. Des cas de troubles rénaux et d’insuffisance rénale aigue ont été rapportés suite à l’administration intraveineuse d’immunoglobulines. Les patients à haut risque sont ceux présentant des facteurs de risque tels qu’altération préexistante de la fonction rénale (insuffisance rénale), diabète (diabète sucré), ou volume sanguin réduit (hypovolémie). Parmi les autres facteurs de risque on peut citer l’obésité, l’utilisation de médicaments nocifs pour les reins ou un âge supérieur à 65 ans.
Dans tous les cas, vous devez prendre vous-même les précautions suivantes :
· Boire suffisamment pour assurer un apport hydrique suffisant avant le début du traitement.
· Votre médecin devrait contrôler votre débit urinaire et mesurer la fonction rénale.
· Ne pas utiliser de manière concomitante certains médicaments qui augmentent la production d’urine (diurétiques de l’anse).
Si des troubles rénaux se manifestent, votre médecin peut considérer l’arrêt du traitement par immunoglobulines. Bien que des cas de troubles de la fonction rénale et d’insuffisance rénale aiguë aient été associés à l’utilisation de nombreuses spécialités d’immunoglobulines, celles contenant du saccharose (sucre commun) comme stabilisant étaient majoritaires. Si vous courez un risque accru lié aux facteurs susmentionnés, vous devez utiliser un produit sans sucre. GAMUNEX ne contient pas de sucre. De plus, le débit de perfusion, dans votre cas spécifique, devra être le plus faible possible et la spécialité d’immunoglobulines sélectionnée devra être la moins concentrée possible.
Le fait que les immunoglobulines augmentent le risque de destruction de globules rouges (anémie hémolytique) est souvent rapporté, aussi bien chez les adultes que chez les enfants. Si vous avez reçu une forte dose d'IgIV, qu’elle soit administrée en une seule journée ou répartie sur plusieurs jours, et que vous êtes du groupe sanguin A, B ou AB et/ou si vous avez une maladie inflammatoire sous-jacente, vous pouvez avoir un risque accru de destruction de globules rouges (anémie hémolytique).
Dans des rapports de post-commercialisation il a été observé que les indications IgIV à forte dose chez les enfants, en particulier dans la maladie de Kawasaki, sont associées à une augmentation du nombre de cas rapportés d'anémie hémolytique par rapport à d'autres indications IgIV chez les enfants.
Vous devez consulter un médecin si vous développez une pâleur (vous devenez pâle), une léthargie (sensation de faiblesse), une urine de couleur foncée, un essoufflement ou des palpitations (tachycardie).
Des cas isolés de troubles rénaux ou d’insuffisance rénale liés à une hémolyse, avec issue fatale ont été rapportés.
Ce médicament contient moins de 1 mmol (23 mg) de sodium jusqu’à 2 g/kg par dose maximale, c’est-à-dire qu’il est essentiellement ‘sans sodium’.
Pendant la fabrication de médicaments dérivés du sang ou du plasma humain, plusieurs précautions sont prises pour éviter la transmission d’infections aux patients. Celles-ci comprennent :
· une sélection rigoureuse des donneurs de sang ou de plasma, afin d’exclure les porteurs potentiels d’infections
· la réalisation de tests spécifiques sur chaque don et sur les pools (mélanges) de plasma afin de dépister des virus/agents infectieux
· Mise en œuvre d’étapes d’inactivation et/ou d’élimination de virus durant les procédés de fabrication.
Malgré toutes ces précautions, lors de l’administration de produits préparés à partir de sang ou de plasma humain, le risque de transmission d’agents infectieux ne peut pas être totalement exclu. Ceci s’applique également aux agents infectieux ou virus inconnus ou émergents ou aux autres types d’agents infectieux.
Ces mesures sont considérées comme efficaces pour éliminer les virus enveloppés, tels que les virus d’immunodéficience humaine (VIH), d’hépatite B et d’hépatite C. Ces mesures peuvent être de valeur limitée contre les virus non enveloppés, tels que l’hépatite A et/ou le parvovirus B19. Les immunoglobulines n’ont pas été associées à des infections par le virus de l’hépatite A ou le parvovirus B19, probablement en raison du rôle protecteur des anticorps dirigés contre ces virus, présents dans le produit.
Il est fortement recommandé que chaque fois que vous recevez une dose de ce médicament, le nom et le numéro de lot du produit soient enregistrés afin d’assurer une traçabilité des lots utilisés.
Autres médicaments et GAMUNEX 100 mg/mL, solution pour perfusion
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament même s'il s'agit de médicaments obtenus sans ordonnance.
Effets sur les vaccins : GAMUNEX est susceptible de diminuer l’efficacité de certains types de vaccins (vaccins à virus vivants atténués) tels que ceux contre la rougeole, la rubéole, les oreillons ou la varicelle.
GAMUNEX 100 mg/mL, solution pour perfusion avec des aliments et boissons
A ce jour, aucune interaction cliniquement pertinente avec les aliments et les boissons n'a été observée lors de l'utilisation concomitante de GAMUNEX.
Si vous êtes enceinte ou que vous allaitez, vous devez en informer votre médecin. C’est votre médecin qui décidera si GAMUNEX peut être utilisé pendant votre grossesse ou l’allaitement.
Demandez conseil à votre médecin ou votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
Des vertiges peuvent parfois survenir, ce qui risque d’affecter l’aptitude à conduire un véhicule ou à utiliser une machine.
3. COMMENT UTILISER GAMUNEX 100 mg/mL, solution pour perfusion ?
Si vous avez l’impression que l’effet de GAMUNEX est trop fort ou trop faible, parlez-en avec votre médecin ou votre pharmacien.
Si vous arrêtez d’utiliser GAMUNEX 100 mg/mL, solution pour perfusion
Lorsque le traitement avec ce médicament est arrêté, votre état clinique peut s’aggraver. Veuillez consulter votre médecin traitant lorsque vous désirez arrêter le traitement avec ce médicament plus tôt que prévu.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Des effets secondaires tels que frissons, maux de tête, vertiges, fièvre, vomissements, réactions allergiques (telles que urticaires, éruptions cutanées (rash) et prurit), nausées, arthralgies (douleurs articulaires), baisse de la tension artérielle et douleurs lombaires modérées peuvent apparaître occasionnellement.
Dans de rares cas, l’immunoglobuline humaine normale peut provoquer une baisse soudaine de la tension artérielle, et dans des cas isolés, un choc anaphylactique, même si vous n’avez montré aucune hypersensibilité lors d’administrations précédentes.
Des cas de méningite aseptique réversible (avec des symptômes tels que céphalées sévères, nausées, vomissements, fièvre, raideur de la nuque ou diminution de la conscience), et des cas rares de réactions cutanées transitoires ont été observés avec les immunoglobulines humaines normales.
Des réactions hémolytiques réversibles (destruction de globules rouges) ont été observées, principalement chez des patients avec les groupes sanguins A, B et AB. Dans de rares cas, une anémie hémolytique nécessitant une transfusion peut se développer après de fortes doses d’immunoglobuline humaine normale.
Une augmentation du taux sérique de la créatinine (paramètre de laboratoire pour la fonction rénale), et/ou une insuffisance rénale aiguë ont été observées.
Très rarement : des réactions thromboemboliques (blocage des vaisseaux sanguins) tels qu’infarctus du myocarde, accident vasculaire cérébral, embolie pulmonaire, thrombose veineuse profonde.
Dans des études cliniques réalisées avec GAMUNEX, les effets indésirables suivants ont été observés :
Les effets indésirables suivants ont été rapportés fréquemment (pouvant affecter jusqu’à 1 personne sur 10) :
· maux de tête
· pyrexie (fièvre)
Les effets indésirables suivants ont été rapportés peu fréquemment (pouvant affecter jusqu’à 1 personne sur 100) :
· diminution du nombre de globules blancs
· vertiges
· urticaire
· dermatite (inflammation de la peau)
· prurit (démangeaisons)
· éruption cutanée
· douleurs abdominales
· diarrhée
· nausées
· vomissements
· hypertension (tension artérielle élevée)
· hypotension (tension artérielle basse)
· pharyngite (inflammation de la gorge)
· toux
· congestion nasale
· respiration sifflante
· arthralgie (douleurs articulaires)
· douleurs dorsales
· douleurs dans le cou
· douleurs à l’épaule
· douleur thoracique
· syndrome pseudo-grippal
· malaise
· fatigue
· frissons
· asthénie (faiblesse)
· réaction au site de l’injection
Les effets indésirables suivants ont été rapportés rarement (pouvant affecter jusqu’à 1 personne sur 1000) :
· anémie hémolytique (destruction de globules rouges)
· dyspnée (essoufflement)
· sinusite
· desquamation de la peau
· anxiété
· myalgies (douleurs musculaires)
· diminution du taux d’hémoglobine
· dyspepsie (troubles de la digestion)
· contusions
· rougeur du visage
· raideur musculosquelettique
· érythème palmaire (rougeur des paumes)
· aphonie (perte de la voix)
Quelles sont les mesures à prendre en cas d’effets indésirables ?
En cas d’apparition d’effets indésirables, le débit de perfusion doit être réduite, voir même arrêtée, jusqu’à disparition des symptômes. Si les symptômes persistent encore après l’arrêt de la perfusion, un traitement approprié sera instauré.
En cas de réaction d’hypersensibilité sévère, avec chute de la tension artérielle et dyspnée, menant même à une réaction allergique sévère généralisée (choc anaphylactique), l’administration de ce médicament doit être arrêtée immédiatement. Des mesures appropriées doivent être instaurées.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance, Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER GAMUNEX 100 mg/mL, solution pour perfusion ?
Tenir ce médicament hors de la vue et de la portée des enfants.
A conserver au réfrigérateur (entre 2 °C et 8 °C). Ne pas congeler. A conserver dans l’emballage d’origine.
N’utilisez pas ce médicament après la date de péremption indiquée sur le carton et sur le flacon. La durée de conservation est de 3 ans.
Le produit peut être conservé dans son emballage extérieur d’origine à température ambiante (ne dépassant pas 25°C), pendant une période unique de 6 mois maximum. Dans ce cas, la nouvelle date de péremption est la fin de cette période de 6 mois, indépendamment de la date de péremption originale. La nouvelle date de péremption doit être notée sur la boîte et sur l’étiquette du flacon. Néanmoins, la nouvelle date de péremption ne peut excéder la date de péremption originale. Une nouvelle conservation au réfrigérateur n’est pas autorisée.
Les flacons entamés doivent être utilisés immédiatement et tout reste doit être jeté. La conservation de flacons entamés, même au réfrigérateur, n’est pas possible, à cause des risques de contamination microbienne.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient GAMUNEX 100 mg/mL, solution pour perfusion
· La substance active est l’immunoglobuline humaine normale (IgIV). Un mL de ce médicament contient 100 mg de protéines, dont au minimum 98 % d’IgG dans de l’eau pour préparations injectables.
Un flacon de 10 mL contient : 1 g d’immunoglobuline humaine normale
Un flacon de 50 mL contient : 5 g d’immunoglobuline humaine normale
Un flacon de 100 mL contient : 10 g d’immunoglobuline humaine normale
Un flacon de 200 mL contient : 20 g d’immunoglobuline humaine normale
Un flacon de 400 mL contient : 40 g d’immunoglobuline humaine normale
Le pourcentage des sous-classes d’IgG est d’environ : 62,8 % (IgG1), 29,7 % (IgG2), 4,8 % (IgG3), 2,7 % (IgG4).
La teneur maximale en IgA est de 84 microgrammes/mL.
· Les autres composants sont la glycine et l’eau pour préparations injectables.
Qu’est-ce que GAMUNEX 100 mg/mL, solution pour perfusion et contenu de l’emballage extérieur
GAMUNEX est disponible en flacons de 10 mL, 50 mL, 100 mL, 200 mL et 400 mL. La boîte contient un flacon en verre avec bouchon en caoutchouc, une étiquette étrier détachable, ainsi qu’une notice.
Titulaire de l’autorisation de mise sur le marché
COLMARER STRASSE 22
60528 FRANCFORT
ALLEMAGNE
Exploitant de l’autorisation de mise sur le marché
GRIFOLS France
24 RUE DE PRONY
75017 PARIS
INSTITUTO GRIFOLS, S.A.
C/CAN GUASCH 2
POL.IND. LEVANTE
PARETS DEL VALLES
08150 BARCELONA
ESPAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{MM/AAAA} {mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
----------------------------------------------------------------------------------------------------------------------------------------
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
N’utiliser que les solutions pour perfusion limpides – Ne pas agiter. Avant la perfusion, porter GAMUNEX à température ambiante ou à température corporelle (par exemple au bain-marie ne dépassant pas les 37°C).
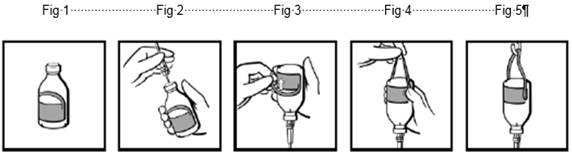
Les flacons sont fournis avec une étiquette étrier (Fig.1). Après insertion du système de perfusion (Fig.2), le flacon est inversé et l’étrier de l’étiquette est replié sur soi (Fig.3). Une forte pression avec les doigts sert à créer un pli de chaque côté de l’étrier (Fig.4). Le flacon peut être suspendu par l’étrier au support de perfusion (Fig.5)

Ce médicament doit être administré initialement à un débit de perfusion de 0,6-1,2 ml/kg/h (ce qui correspond à 45 - 90 ml/h pour un patient de 75 kg). Si le produit est bien toléré, le débit de perfusion peut être accéléré après 30 minutes avec un maximum de 4,8 - 8,4 ml/kg/h (ce qui correspond à 360 - 630 ml/h pour un patient de 75 kg). Chez les enfants et les patients présentant un risque d’insuffisance rénale, le débit de perfusion ne peut être supérieur à 4,8 ml/kg/h.
Veuillez consulter le Résumé des Caractéristiques du Produit (RCP) pour les recommandations détaillées concernant les posologies.
GAMUNEX ne doit pas être mélangé avec d’autres solutions pour perfusion ou d’autres médicaments. S’il est nécessaire de procéder à une dilution préalablement à la perfusion, une solution glucosé à 50 mg/ml peut être utilisée. Ne pas mélanger avec des solutions salines.
L’administration simultanée de GAMUNEX et d’héparine à l’aide d’un dispositif d’injection à lumière simple doit être évitée.
Les lignes de perfusion de GAMUNEX peuvent être rincées à l’aide d’une solution de glucose à 50 mg/ml ou d’une solution de chlorure de sodium (9 mg/ml) et ne peuvent pas être rincées avec de l’héparine.
Les verrous héparine par lesquelles GAMUNEX a été administré peuvent être rincées à l’aide d’une solution de glucose à 50 mg/ml ou d’une solution de chlorure de sodium (9 mg/ml) et ne peuvent pas être rincées avec de l’héparine.