NOTICE
ANSM - Mis à jour le : 14/12/2018
Dénomination du médicament
OLEUNOR N7E, émulsion pour perfusion
Encadré
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre infirmier/ère.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
Le nom de votre médicament est OLEUNOR N7E, émulsion pour perfusion.
Dans le reste de cette notice, le médicament sera appelé OLEUNOR N7E.
Que contient cette notice ?
1. Qu'est-ce que OLEUNOR N7E, émulsion pour perfusion et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de recevoir OLEUNOR N7E, émulsion pour perfusion ?
3. Comment utiliser OLEUNOR N7E, émulsion pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver OLEUNOR N7E, émulsion pour perfusion ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE OLEUNOR N7E, émulsion pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
Groupe de médicaments : Solutions pour nutrition parentérale, associations – Classe du médicament : B05BA10.
OLEUNOR N7E, émulsion pour perfusion est une émulsion pour perfusion. Il est conditionné dans une poche à 3 compartiments. Un compartiment contient une solution de glucose avec du calcium, le deuxième une émulsion lipidique et le troisième une solution d’acides aminés avec d’autres électrolytes.
OLEUNOR N7E, émulsion pour perfusion est destinée à alimenter des adultes et des enfants de plus de deux ans au moyen d’une tubulure veineuse lorsque le patient ne peut pas s'alimenter normalement par la bouche.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE RECEVOIR OLEUNOR N7E, émulsion pour perfusion ?
N’utilisez jamais OLEUNOR N7E, émulsion pour perfusion :
· chez les nouveau-nés prématurés, les nourrissons et chez les enfants âgés de moins de 2 ans.
· si vous êtes allergique aux protéines d’œuf, de soja, d’arachide, ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
· si votre corps réagit mal à certains acides aminés.
· si votre sang contient un taux particulièrement élevé de graisses (hyperlipidémie).
· si vous souffrez d’hyperglycémie (trop de sucre dans le sang).
· si vous avez une quantité anormalement élevée de l’un des électrolytes (sodium, potassium, magnésium, calcium et/ou phosphore) dans le sang contenus dans OLEUNOR N7E.
· si avez une maladie grave du foie ;
· si vous avez une maladie grave des reins sans possibilité de dialyse ;
· si vous êtes en état de choc aigu ;
· si vous avez du liquide dans les poumons (œdème pulmonaire aigu) ou trop de liquide dans votre organisme (hyperhydration) ;
· si vous êtes dans un état instable, par exemple après un traumatisme grave ou en cas de diabète non contrôlé, de crise cardiaque aiguë, d’accident vasculaire cérébral, de caillot sanguin (embolie), d’acidose métabolique (trouble résultant d’une trop grande quantité d’acide dans le sang), d’infection grave (sepsis sévère) ou de coma ou si votre organisme ne contient pas assez de liquide (déshydratation hypotonique) ;
· si vous avez une insuffisance cardiaque non traitée ;
· si vous avez une anomalie de la coagulation sanguine (syndrome hémophagocytaire).
Dans tous les cas, votre médecin décidera de vous prescrire ce médicament en tenant compte de critères tels que l’âge, le poids, l’état de santé, et éventuellement des résultats des tests réalisés.
Avertissements et précautions
Adressez-vous à votre médecin ou votre infirmier/ère avant de recevoir OLEUNOR N7E.
Si vous recevez des solutions de nutrition parentérale totale (NPT) trop rapidement, il existe un risque de lésions ou de décès.
Prévenez immédiatement le professionnel de santé si vous ressentez l’un des troubles suivants pendant la perfusion : fièvre, éruption, gonflement, difficulté à respirer, frissons, sueurs, nausées ou vomissements, car il peut s’agir de manifestations d’une réaction allergique ou de signes indiquant que vous avez reçu une trop grande quantité du médicament.
Ce médicament contient des phosphatides d'œuf et de l’huile de soja. Les protéines d'œuf et de soja peuvent entraîner des réactions d'hypersensibilité. Des réactions d’allergie croisée ont été observées entre les protéines de soja et d'arachide.
Les difficultés à respirer peuvent également être le signe que de petites particules se sont formées, bloquant ainsi les vaisseaux sanguins dans les poumons (précipités vasculaires pulmonaires). Si vous éprouvez des difficultés à respirer, informez votre médecin ou votre infirmier/ère. Ils décideront des actions à entreprendre.
L’antibiotique appelé ceftriaxone ne doit pas être mélangé ou administré simultanément avec une autre solution contenant du calcium (dont OLEUNOR N7E) qui vous est administré par une perfusion goutte-à-goutte veineuse.
Ces médicaments ne doivent pas vous être administrés ensemble, même par une ligne de perfusion différente ou un site de perfusion différent. Cependant, vous pouvez recevoir OLEUNOR N7E et de la ceftriaxone l’un à la suite de l’autre si des lignes de perfusion sur des sites de perfusion différents sont utilisées ou si les lignes de perfusion sont remplacées, ou encore si elles ont été bien rincées avec une solution saline physiologique entre les perfusions pour éviter toute précipitation (formation de particules de ceftriaxone-sel de calcium).
Certains médicaments et maladies peuvent augmenter le risque d’apparition d’une infection ou septicémie (présence de bactéries dans le sang). Il existe un risque particulièrement élevé d'infection ou de sepsis lorsqu'une tubulure (cathéter intraveineux) est placée dans une veine. Votre médecin vous examinera attentivement pour détecter tout signe d'infection. Les patients nécessitant une nutrition parentérale (par le biais d'une tubulure placée dans une veine) sont plus susceptibles de développer une infection suite à leurs pathologies. L'utilisation de techniques aseptiques (« sans germes ») lors de la mise en place et de l'entretien du cathéter et lors de la préparation de la formulation nutritionnelle (NPT) peut réduire le risque d'infection.
Si vous êtes sévèrement dénutris au point d’avoir besoin de recevoir une alimentation par une veine, votre médecin doit débuter le traitement lentement. Votre médecin doit aussi vous surveiller attentivement afin d’empêcher des modifications soudaines de vos taux de liquide, vitamines, d'électrolytes, de glucose (sucre dans le sang) et minéraux.
Votre équilibre en eau et en sel ainsi que les perturbations du métabolisme seront corrigés avant de débuter la perfusion. Les enfants et les patients avec une sensibilité aux médicaments pouvant diminuer les taux de sodium (par exemple en cas d’affections aiguës, de traumatisme, de stress postopératoire, de pathologies du système nerveux central) pourraient présenter une diminution soudaine de la concentration de sodium dans l’organisme, pouvant conduire à un œdème cérébral soudain et des lésions cérébrales engageant le pronostic vital. Votre médecin surveillera votre état pendant toute la durée du traitement et pourra modifier la posologie ou prescrire des nutriments supplémentaires, notamment des vitamines, des électrolytes et des oligo-éléments, si cela est nécessaire.
Votre médecin contrôlera régulièrement votre formule sanguine afin de vérifier votre fonction hépatique et les autres éléments du sang.
Votre médecin doit être informé si :
· vous souffrez d'un problème rénal grave. Vous devez aussi avertir votre médecin si vous êtes sous dialyse (rein artificiel) ou si vous avez un autre type de traitement de purification du sang ;
· vous souffrez d'un problème hépatique grave ;
· vous avez des problèmes de coagulation ;
· vos glandes surrénales ne fonctionnent pas correctement (insuffisance surrénalienne). Les glandes surrénales sont des glandes triangulaires situées au-dessus des reins ;
· vous souffrez d’hypothyroïdie (problèmes à la thyroïde) ;
· vous souffrez de pancréatite (inflammation du pancréas) ;
· vous souffrez de défaillance du cœur ;
· vous avez une maladie des poumons ;
· de l'eau s'accumule dans votre organisme (hyperhydratation) ;
· votre organisme manque d'eau (déshydratation) ;
· vous présentez une glycémie élevée (diabète) non traitée ;
· vous présentez une crise cardiaque ou un choc dû à une défaillance cardiaque soudaine ;
· vous souffrez d'une acidose métabolique grave (sang trop acide) ;
· vous souffrez d'une infection généralisée (septicémie) ;
· vous êtes dans le coma.
Pour contrôler l’efficacité et la sécurité continue de l’administration, votre médecin effectuera des examens cliniques et de laboratoire pendant que vous recevez ce médicament. Si vous recevez ce médicament pendant plusieurs semaines, votre sang sera contrôlé régulièrement.
Une capacité réduite de l'organisme à éliminer les graisses contenues dans ce médicament peut entraîner un « syndrome de surcharge graisseuse » (voir rubrique 4 – Quels sont les effets indésirables éventuels ?).
Pendant la perfusion, si vous constatez une douleur, une sensation de brûlure ou un gonflement au site de perfusion ou une fuite de la perfusion, informez-en le médecin ou l'infirmier/ère. L'administration sera immédiatement interrompue et recommencée dans une autre veine.
Si votre glycémie devient trop élevée, votre médecin doit régler la vitesse d'administration d’OLEUNOR N7E ou vous administrer des médicaments de contrôle de la glycémie (insuline).
OLEUNOR N7E peut uniquement être administré via un tube (cathéter) dans une grande veine du thorax (veine centrale).
Enfants et adolescents
OLEUNOR N7E n’est pas indiqué chez le nouveau-né ni chez l’enfant de moins de 2 ans.
OLEUNOR N7E peut être administré chez l’enfant âgé de 2 à 16/18 ans. Si votre enfant a moins de 18 ans, le dosage sera adapté avec le plus grand soin en raison du risque infectieux plus élevé chez l'enfant. Une supplémentation en vitamines et en oligo-éléments est toujours nécessaire. Des formules pédiatriques doivent être utilisées.
Autres médicaments et OLEUNOR N7E, émulsion pour perfusion
Informez votre médecin si vous prenez ou utilisez, avez récemment pris ou utilisé ou pourriez prendre ou utiliser tout autre médicament. Médicaments pouvant diminuer les taux de sodium dans le sang, à savoir diurétiques, anti-inflammatoires non stéroïdiens (AINS), antipsychotiques, inhibiteurs sélectifs de la recapture de la sérotonine, opioïdes, antiépileptiques, ocytocine et chimiothérapie.
La prise simultanée d’autres médicaments n’est généralement pas contre-indiquée. Si vous prenez d’autres médicaments, délivrés avec ou sans ordonnance, vous devez en informer votre médecin à l’avance afin qu’il vérifie la compatibilité.
OLEUNOR N7E ne doit pas être administré simultanément avec du sang par la même tubulure de perfusion.
OLEUNOR N7E contient du calcium. Il ne doit pas être administré de manière concomitante avec ou via la même tubulure que l'antibiotique ceftriaxone en raison du risque de formation de particules. Si le même dispositif est utilisé pour vous administrer successivement ces médicaments, il doit être rincé en profondeur.
En raison du risque de précipitation, OLEUNOR N7E ne doit pas être administré par la même ligne de perfusion que l’antibiotique ampicilline ou l’antiépileptique fosphénytoïne ni mélangé à ces deux produits.
· Les huiles d'olive et de soja présentes dans OLEUNOR N7E contiennent de la vitamine K. Cela n’influence normalement pas les médicaments fluidifiant le sang (anticoagulants) tels que la coumarine. Néanmoins, si vous prenez des anticoagulants, vous devez en avertir votre médecin.
· Les lipides contenus dans cette émulsion peuvent interférer avec les résultats de certains examens de laboratoire si le prélèvement sanguin a été réalisé avant l’élimination des lipides de la circulation sanguine (ceux-ci sont normalement éliminés après 5 à 6 heures sans apport de lipides).
· OLEUNOR N7E contient du potassium. Il convient d'être particulièrement prudent chez les patients sous diurétiques, inhibiteurs de l’ECA ou antagonistes du récepteur de l’angiotensine II (médicaments pour l’hypertension) ou immunosuppresseurs (utilisés au moment d’une greffe d’organes). Ces types de médicaments peuvent augmenter les taux de potassium dans votre sang.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de recevoir ce médicament.
Il n’existe pas de données ou il existe des données limitées sur l’utilisation d’OLEUNOR N7E chez la femme enceinte ou qui allaite.
OLEUNOR N7E ne doit être administré au cours de la grossesse et de l’allaitement qu’en cas d’absolue nécessité. OLEUNOR N7E ne doit être administrée aux femmes enceintes qu’après une évaluation soigneuse. Si OLEUNOR N7E est administré à des femmes enceintes avec de l’ocytocine, elle peut diminuer la concentration de sodium dans l’organisme.
L’allaitement est déconseillé chez les mères recevant une nutrition parentérale.
3. COMMENT UTILISER OLEUNOR N7E, émulsion pour perfusion ?
Posologie
Ce médicament doit être uniquement administré aux adultes et aux enfants âgés de plus de 2 ans.
OLEUNOR N7E est une émulsion pour perfusion à administrer par une tubulure (cathéter) dans une large veine de votre poitrine.
OLEUNOR N7E doit être à température ambiante avant utilisation.
Ce médicament est seulement à usage unique.
La perfusion de 1 poche dure généralement entre 12 et 24 heures.
Utilisation chez les adultes
Votre médecin vous précisera un débit de perfusion adapté à vos besoins et à votre état clinique.
La prescription peut être prolongée aussi longtemps que vous en avez besoin, selon votre état clinique.
Utilisation chez les enfants et les adolescents
Posologie – Enfants de plus de deux ans et adolescents
Le médecin déterminera la dose et la durée d'administration du médicament. Elles dépendront de l'âge, du poids, de la taille, de l'état de santé et de la capacité de l'organisme à dégrader et utiliser les composants d’OLEUNOR N7E.
Si vous avez reçu plus d’OLEUNOR N7E, émulsion pour perfusion que vous n’auriez dû :
Si la dose qui vous a été donnée est trop élevée ou la perfusion trop rapide, les acides aminés risquent de rendre votre sang trop acide et des signes d’hypervolémie (augmentation du volume du sang circulant) peuvent être observés. Votre taux de glucose dans le sang et l’urine peut augmenter, un syndrome hyperosmolaire (augmentation de la viscosité du sang) peut apparaître et le contenu en lipides peut augmenter le taux de triglycérides dans votre sang. L’administration d’un volume trop important d’OLEUNOR N7E peut provoquer des nausées, des vomissements, des frissons, des maux de têtes, des bouffées de chaleur, une sudation excessive (hyperhidrose) et des perturbations électrolytiques. Dans ce cas, la perfusion doit être immédiatement interrompue.
Dans quelques cas sévères, votre médecin peut vous soumettre à une dialyse rénale à titre temporaire pour aider vos reins à éliminer l’excès de produit.
Pour éviter que ces situations ne surviennent, votre médecin surveillera régulièrement votre état et contrôlera vos paramètres sanguins.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Si vous constatez un changement dans votre état pendant ou après le traitement, informez-en immédiatement votre médecin ou le personnel infirmier.
Les contrôles que votre médecin effectue pendant le traitement devraient réduire le risque de survenue des effets indésirables.
Si des signes inhabituels ou des symptômes d’une réaction allergique se manifestent, tels que des sueurs, de la fièvre, des frissons, des maux de tête, des rougeurs de la peau ou des difficultés à respirer, la perfusion doit être immédiatement arrêtée.
Les effets indésirables suivants ont été rapportés avec la substance active de ce médicament :
Fréquent (pouvant affecter jusqu’à 1 personne sur 10) :
· Fréquence cardiaque rapide (tachycardie)
· Diminution de l'appétit (anorexie)
· Augmentation du taux de graisse dans le sang (hypertriglycéridémie)
· Douleur abdominale (maux d’estomac)
· Diarrhée
· Nausées
· Pression artérielle augmentée (hypertension)
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
· Fuite de la perfusion dans les tissus environnants (extravasion) pouvant entraîner une douleur au point de perfusion, une irritation, un gonflement/œdème, une rougeur (érythème)/chaleur, la mort des cellules tissulaires (nécrose de la peau) ou des ampoules/vésicules
· Taux anormalement bas de sodium dans le sang (hyponatrémie)
· associés à des maux de tête, des nausées, des vomissements et une léthargie (encéphalopathie hyponatrémique)
Les effets indésirables suivants ont été rapportés avec des produits de nutrition parentérale similaires :
Très rare (pouvant affecter jusqu’à 1 personne sur 10 000) :
· Réduction de la capacité d'élimination des lipides (syndrome de surcharge graisseuse) associée à une aggravation soudaine et abrupte de l'état de santé du patient. Les symptômes suivants de ce syndrome sont généralement réversibles à l'arrêt de la perfusion de l'émulsion lipidique :
o Fièvre
o Réduction de la numération des globules rouges, ce qui peut augmenter la pâleur de la peau et entraîner une faiblesse ou un essoufflement (anémie)
o Réduction de la numération des globules blancs, ce qui peut accroître le risque d'infection (leucopénie)
o Réduction du nombre de plaquettes, ce qui peut accroître le risque de bleus et/ou de saignement (thrombopénie)
o Troubles de coagulation du sang
o Taux élevé de graisses dans le sang (hyperlipidémie)
o Stéatose par infiltration graisseuse (hépatomégalie)
o Aggravation de la fonction hépatique
o Manifestations au niveau du système nerveux central (p. ex. coma).
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· Réactions allergiques
· Résultats anormaux des examens sanguins de la fonction hépatique.
· Problèmes d'élimination de la bile (cholestase)
· Augmentation de la taille du foie (hépatomégalie)
· Ictère (jaunisse)
· Baisse du nombre de plaquettes (thrombopénie)
· Hausse du taux d’azote dans le sang (azotémie)
· Enzymes hépatiques élevés
· Formation de petites particules qui peuvent engendrer le blocage des vaisseaux sanguins dans les poumons (précipités vasculaires pulmonaires) et provoquer ainsi une embolie vasculaire pulmonaire et des difficultés à respirer (détresse respiratoire).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER OLEUNOR N7E, émulsion pour perfusion ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage extérieur après EXP. La date de péremption fait référence au dernier jour de ce mois.
Ce médicament ne nécessite pas de précautions particulières de conservation concernant la température.
Ne pas congeler.
A conserver dans le suremballage.
N’utilisez pas ce médicament si vous remarquez des signes visibles de détérioration.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
Il est recommandé d’utiliser le produit immédiatement après l’ouverture des soudures pelables entre les 3 compartiments. Toutefois, la stabilité physique de l’émulsion reconstituée a été démontrée pendant 7 jours (à une température comprise entre 2°C et 8°C) suivis de 48 heures à une température ne dépassant pas 25°C.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient OLEUNOR N7E, émulsion pour perfusion
· Les substances actives de chaque poche de l’émulsion reconstituée sont :
Solution d’acides aminés L (alanine, arginine, glycine, histidine, isoleucine, leucine, lysine (sous forme d’acétate de lysine), méthionine, phénylalanine, proline, sérine, thréonine, tryptophane, tyrosine, valine, acide aspartique, acide glutamique) à 11,1 % (correspondant à 11,1 g/100 mL) avec des électrolytes (sodium, potassium, magnésium, phosphate, acétate, chlorure),
Emulsion lipidique (huile d’olive raffinée et huile de soja raffinée) à 20 % (correspondant à 20 g/100 mL)
Solution de glucose (sous forme de glucose monohydraté) à 35 % (correspondant à 35 g/100 mL) avec du calcium.
· Les autres composants sont :
|
Compartiment de l'émulsion lipidique
|
Compartiment de la solution d'acides aminés avec des électrolytes
|
Compartiment de la solution de glucose avec du sodium
|
|
Phospholipides d’œuf purifiés, glycérol, oléate de sodium B, hydroxyde de sodium (pour ajustement du pH), eau pour préparations injectables
|
Acide acétique glacial (pour ajustement du pH), eau pour préparations injectables
|
Acide chlorhydrique (pour ajustement du pH), eau pour préparations injectables
|
Qu’est-ce que OLEUNOR N7E, émulsion pour perfusion et contenu de l’emballage extérieur
OLEUNOR N7E est une émulsion pour perfusion conditionnée dans une poche à 3 compartiments. L’un des compartiments contient une émulsion lipidique, un autre une solution d’acides aminés avec des électrolytes et le troisième une solution de glucose avec du calcium. Ces compartiments sont séparés par des soudures non permanentes. Avant l’administration, le contenu des compartiments doit être mélangé en enroulant la poche sur elle-même en commençant par le haut pour rompre les soudures.
Aspect avant reconstitution
· Les solutions d’acides aminés et de glucose sont claires, incolores ou légèrement jaunes, pratiquement exemptes de particules visibles.
· L’émulsion lipidique est homogène et d’aspect laiteux, dépourvue de tout aspect de séparation de phase.
Aspect après reconstitution:
Emulsion laiteuse et homogène dépourvue de tout aspect de séparation de phase. La poche à 3 compartiments est une poche en plastique multicouches avec des soudures pelables, adaptée aux solutions de nutrition parentérale, permettant le mélange des trois solutions avant l’administration après rupture des soudures. Pour empêcher tout contact avec l’oxygène contenu dans l’air, la poche est conditionnée dans un suremballage étanche à l’oxygène incluant un sachet absorbeur d’oxygène placé entre le suremballage et la poche de manière à garantir l’absence totale d’oxygène.
Présentations :
Poche de 1000 mL : 1 boîte de 6 poches
Poche de 1500 mL : 1 boîte de 4 poches
Poche de 2000 mL : 1 boîte de 4 poches
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
NORIDEM ENTREPRISES LimiTeD
MAKARIOU AND EVAGOROU, 1
MITSI BUILDING 3, 1st floor, flat/OFFICE 115
1065 NICOSIA
CHYPRE
Exploitant de l’autorisation de mise sur le marché
MACO PHARMA
RUE LORTHIOIS
59420 MOUVAUX
Fabricant
DEMO SA PHARMACEUTICAL INDUSTRY
21ST KM NATIONAL ROAD ATHENS - LAMIA
145 68 KRIONERI, ATTIKI
GRÈCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Autres
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de la santé.
Classe pharmacothérapeutique : Solutions pour nutrition parentérale, associations, Code ATC : B05BA10
A. COMPOSITION QUALITATIVE ET QUANTITATIVE
OLEUNOR N7E se présente sous la forme d’une poche à 3 compartiments.
Chaque poche contient une solution de glucose avec du calcium, une émulsion lipidique et une solution d’acides aminés avec d’autres électrolytes.
|
|
Contenu par poche
|
|
1000 mL
|
1500 mL
|
2000 mL
|
|
Solution de glucose à 35 % (correspondant à 35 g/100 mL)
|
400 mL
|
600 mL
|
800 mL
|
|
Solution d’acides aminés à 11,1 % (correspondant à 11,1 g/100 mL)
|
400 mL
|
600 mL
|
800 mL
|
|
Émulsion lipidique à 20 % (correspondant à 20 g/100 mL)
|
200 mL
|
300 mL
|
400 mL
|
Composition de l’émulsion reconstituée, après mélange des contenus des 3 compartiments :
|
Substances actives
|
Contenu par poche
|
|
1000 mL
|
1500 mL
|
2000 mL
|
|
Huile d’olive raffinée + huile de soja raffinéea
|
40,00 g
|
60,00 g
|
80,00 g
|
|
L-Alanine
|
6,41 g
|
9,61 g
|
12,82 g
|
|
L-Arginine
|
4,34 g
|
6,51 g
|
8,68 g
|
|
Acide L-aspartique
|
1,28 g
|
1,92 g
|
2,56 g
|
|
Acide L-glutamique
|
2,21 g
|
3,32 g
|
4,42 g
|
|
Glycine
|
3,07 g
|
4,60 g
|
6,14 g
|
|
L-Histidine
|
2,64 g
|
3,97 g
|
5,29 g
|
|
L-Isoleucine
|
2,21 g
|
3,32 g
|
4,42 g
|
|
L-Leucine
|
3,07 g
|
4,60 g
|
6,14 g
|
|
Acétate de L-lysine (correspondant à la lysine)
|
4,88 g (3,48 g)
|
7,31 g (5,23 g)
|
9,75 g (6,97 g)
|
|
L-Méthionine
|
2,21 g
|
3,32 g
|
4,42 g
|
|
L-Phénylalanine
|
3,07 g
|
4,60 g
|
6,14 g
|
|
L-Proline
|
2,64 g
|
3,97 g
|
5,29 g
|
|
L-Sérine
|
1,75 g
|
2,62 g
|
3,50 g
|
|
L-Thréonine
|
2,21 g
|
3,32 g
|
4,42 g
|
|
L-Tryptophane
|
0,74 g
|
1,10 g
|
1,47 g
|
|
L-Tyrosine
|
0,11 g
|
0,17 g
|
0,22 g
|
|
L-Valine
|
2,83 g
|
4,25 g
|
5,66 g
|
|
Acétate de sodium, trihydraté
|
1,50 g
|
2,24 g
|
2,99 g
|
|
Glycérophosphate de sodium, hydraté
|
3,67 g
|
5,51 g
|
7,34 g
|
|
Chlorure de potassium
|
2,24 g
|
3,35 g
|
4,47 g
|
|
Chlorure de magnésium, hexahydraté
|
0,81 g
|
1,22 g
|
1,62 g
|
|
Chlorure de calcium, dihydraté
|
0,52 g
|
0,77 g
|
1,03 g
|
|
Glucose monohydraté (correspondant au glucose anhydre)
|
154,00 g (140,00 g)
|
231,00 g (210,00 g)
|
308,00 g (280,00 g)
|
a : Mélange d’huile d’olive raffinée (environ 80 %) et d’huile de soja raffinée (environ 20 %) correspondant à un ratio acides gras essentiels/acides gras totaux de 20 %.
Les excipients sont :
|
Compartiment de l'émulsion lipidique
|
Compartiment de la solution d'acides aminés avec des électrolytes
|
Compartiment de la solution de glucose avec du calcium
|
|
Phospholipides d’œuf purifiés, glycérol, oléate de sodium B, hydroxyde de sodium (pour ajustement du pH), eau pour préparations injectables
|
Acide acétique glacial (pour ajustement du pH), eau pour préparations injectables
|
Acide chlorhydrique (pour ajustement du pH), eau pour préparations injectables
|
Apports nutritionnels de l’émulsion reconstituée pour chaque volume de poche :
|
|
Contenus par poche
|
|
1000 mL
|
1500 mL
|
2000 mL
|
|
Lipides
|
40 g
|
60 g
|
80 g
|
|
Acides aminés
|
44,3 g
|
66,4 g
|
88,6 g
|
|
Azote
|
7,0 g
|
10,5 g
|
14,0 g
|
|
Glucose
|
140,0 g
|
210,0 g
|
280,0 g
|
|
Énergie :
|
|
|
|
|
Apport calorique total approximatif
|
1140 kcal
|
1710 kcal
|
2270 kcal
|
|
Apport calorique non protéique
|
960 kcal
|
1440 kcal
|
1920 kcal
|
|
Apport calorique glucidique
|
560 kcal
|
840 kcal
|
1120 kcal
|
|
Apport calorique lipidiquea
|
400 kcal
|
600 kcal
|
800 kcal
|
|
Ratio apport calorique non protéique/azote
|
137 kcal/g
|
137 kcal/g
|
137 kcal/g
|
|
Ratio apport calorique glucidique/lipidique
|
58/42
|
58/42
|
58/42
|
|
Ratio apport calorique lipidique/apport calorique total
|
35%
|
35%
|
35%
|
|
Électrolytes :
|
|
|
|
|
Sodium
|
35,0 mmol
|
52,5 mmol
|
70,0 mmol
|
|
Potassium
|
30,0 mmol
|
45,0 mmol
|
60,0 mmol
|
|
Magnésium
|
4,0 mmol
|
6,0 mmol
|
8,0 mmol
|
|
Calcium
|
3,5 mmol
|
5,3 mmol
|
7,0 mmol
|
|
Phosphateb
|
15,0 mmol
|
22,5 mmol
|
30,0 mmol
|
|
Acétate
|
45 mmol
|
67 mmol
|
89 mmol
|
|
Chlorure
|
45 mmol
|
68 mmol
|
90 mmol
|
|
pH
|
5,8 – 6,8
|
5,8 – 6,8
|
5,8 – 6,8
|
|
Osmolalité
|
1225 – 1495 mosm/kg
|
1225 – 1495 mosm/kg
|
1225 – 1495 mosm/kg
|
a : Inclut les calories des phospholipides d’œuf purifiés.
b : Inclut le phosphate apporté par l’émulsion lipidique.
B. POSOLOGIE ET MODE D'ADMINISTRATION
Posologie
L’utilisation d’OLEUNOR N7E n’est pas recommandée chez les enfants âgés de moins de 2 ans, la composition et le volume n’étant pas appropriés (voir rubriques 4.4, 5.1 et 5.2 du RCP).
La capacité du patient à éliminer les lipides et à métaboliser l’azote et le glucose ainsi que ses besoins nutritionnels doivent déterminer la posologie et le débit de perfusion.
La dose doit être adaptée à chaque patient en fonction de son état clinique et son poids corporel (pc).
La posologie maximale journalière varie en fonction de l’état clinique du patient et peut même changer d’un jour à l’autre. La dose quotidienne maximale mentionnée ci-dessous ne doit pas être dépassée.
Etant donné la composition statique de la poche multi-compartiments, il se peut qu’il ne soit pas possible de répondre en même temps à tous les besoins nutritionnels du patient. Dans certaines situations cliniques, la quantité de nutriments nécessaire aux patients peut ne pas correspondre à la composition de la poche statique. Dans ce cas, tout ajustement de volume (dosage) doit tenir compte de l’effet que ce changement aura sur le dosage de tous les autres composants nutritionnels contenus dans OLEUNOR N7E. Par exemple, les patients pédiatriques peuvent avoir besoin de plus de 0,2 mmol/kg/jour de phosphate. Dans ce cas, les professionnels de santé peuvent envisager un ajustement du volume (dosage) d’OLEUNOR N7E afin de répondre à ces besoins différents.
Chez les adultes
La posologie dépend de la dépense énergétique, de l’état clinique, du poids corporel du patient et de sa capacité à métaboliser les constituants de OLEUNOR N7E, ainsi que du supplément d’énergie ou de protéines administré par voie orale/entérale ; le volume de la poche doit donc être choisi en conséquence.
Les besoins journaliers moyens sont :
· Les besoins sont de 0,10 à 0,15 g d’azote/kg pc/jour (0,6 à 0,9 g d’acides aminés/kg pc/jour) quand l’état nutritionnel est normal ou en présence d’un léger stress catabolique. Chez les patients en état de stress métabolique modéré à élevé avec ou sans malnutrition, les besoins sont de l’ordre de 0,15 à 0,25 g d’azote/kg pc/jour (0,9 à 1,6 g d’acides aminés/kg pc/jour). Les besoins azotés peuvent même être plus importants dans certaines situations très particulières (par exemple, brûlures ou anabolisme important).
· De 20 à 40 kcal/kg.
· De 20 à 40 mL de liquide/kg ou de 1 à 1,5 mL par kcal consommée.
Chez les patients obèses, la dose doit être déterminée en fonction du poids idéal estimé.
Pour OLEUNOR N7E, émulsion pour perfusion, la dose quotidienne maximale est déterminée par l’apport calorique total, 40 kcal/kg fournies dans un volume de 35 mL/kg, correspond à 1,5 g/kg d’acides aminés, 4,9 g/kg de glucose, 1,4 g/kg de lipides, 1,2 mmol/kg de sodium et 1,1 mmol/kg de potassium. Pour un patient de 70 kg, cela équivaut à 2450 mL d’OLEUNOR N7E, émulsion pour perfusion par jour, soit un apport de 108 g d’acides aminés, 343 g de glucose et 98 g de lipides (c’est-à-dire, 2352 kcal non protéiques et 2793 kcal totales).
Le débit d’administration doit normalement être augmenté progressivement au cours de la première heure et ajusté ensuite en fonction de la dose à administrer, de l’apport volumique journalier et de la durée de la perfusion. Le débit maximal de perfusion est de 0,25 g/kg pc/h pour le glucose, 0,1 g/kg pc/h pour les acides aminés et 0,15 g/kg pc/h pour les lipides.
Pour OLEUNOR N7E, le débit maximal de perfusion est de 1,7 mL/kg/heure, ce qui correspond à 0,08 g/kg/heure d’acides aminés, 0,24 g/kg/heure de glucose et 0,07 g/kg/heure de lipides. La durée recommandée de perfusion est de 14 à 24 heures.
Chez les enfants âgés de plus de 2 ans
L’administration d’OLEUNOR N7E n’est pas recommandée chez l’enfant. Aucune étude n’a été réalisée dans la population pédiatrique.
La posologie dépend de la dépense énergétique, de l’état clinique, du poids corporel du patient et de sa capacité à métaboliser les constituants d’OLEUNOR N7E, ainsi que du supplément d’énergie ou de protéines administré par voie orale/entérale; le volume de la poche doit donc être choisi en conséquence.
Par ailleurs, les besoins quotidiens en liquide, en azote et en énergie diminuent continuellement avec l’âge. Deux groupes, âgés de 2 à 11 ans et de 12 à 18 ans, sont pris en considération.
Pour OLEUNOR N7E, les facteurs limitants pour le groupe d’âge de 2 à 11 ans sont la concentration en phosphate pour la dose journalière (0,2 mmol/kg/jour)a et la concentration en lipides pour le débit par heure. Les facteurs limitants pour le groupe d’âge de 12 à 18 ans sont la concentration en phosphate pour la dose journalière (0,2 mmol/kg/jour)a et la concentration en acides aminés pour le débit par heure. Il en résulte les apports suivants :
|
Composant
|
de 2 à 11 ans
|
de 12 à 18 ans
|
|
Recommandéea
|
Volume maximal de OLEUNOR N7E
|
Recommandéea
|
Volume maximal de OLEUNOR N7E
|
|
|
Dose journalière maximale
|
|
|
Liquides (mL/kg/jour)
|
60 – 120
|
13
|
50 – 80
|
13
|
|
|
Acides aminés (g/kg/jour)
|
1 – 2 (jusqu’à 3)
|
0,6
|
1 – 2
|
0,6
|
|
|
Glucose (g/kg/jour)
|
12 – 14 (jusqu’à 18)
|
1,9
|
3 – 10 (jusqu’à 14)
|
1,9
|
|
|
Lipides (g/kg/jour)
|
0,5 – 3
|
0,5
|
0,5 – 2 (jusqu’à 3)
|
0,5
|
|
|
Énergie totale (kcal/kg/jour)
|
60 – 90
|
15
|
30 – 75
|
15
|
|
|
Débit maximal par heure
|
|
|
OLEUNOR N7E (mL/kg/h)
|
-
|
3,3
|
-
|
2,7
|
|
Acides aminés (g/kg/h)
|
0,20
|
0,15
|
0,12
|
0,12
|
|
|
Glucose (g/kg/h)
|
1,2
|
0,46
|
1,2
|
0,38
|
|
|
Lipides (g/kg/h)
|
0,13
|
0,13
|
0,13
|
0,11
|
|
|
|
|
|
|
|
|
|
|
a : valeurs recommandées par les recommandations 2005 ESPGHAN- ESPEN
Le débit d’administration doit normalement être augmenté progressivement au cours de la première heure et ajusté ensuite en fonction de la dose à administrer, de l’apport volumique journalier et de la durée de la perfusion.
De manière générale, il est recommandé de débuter la perfusion chez les jeunes enfants par une dose journalière faible et de l’augmenter progressivement jusqu’à la dose maximale (voir ci-dessus).
Mode et durée d’administration
A usage unique. En perfusion intraveineuse par veine centrale.
Une fois la poche ouverte, il est recommandé d'utiliser immédiatement son contenu et de ne pas la conserver pour une perfusion ultérieure.
Après reconstitution, le mélange est une émulsion homogène et d’aspect laiteux, dépourvue de tout aspect de séparation de phase.
Pour les instructions concernant la préparation et la manipulation de l’émulsion pour perfusion, voir la rubrique 6.6.
En raison de son osmolarité élevée, OLEUNOR N7E ne peut être administré que par une veine centrale.
La durée de perfusion recommandée pour une poche de nutrition parentérale est comprise entre 12 et 24 heures.
La nutrition parentérale peut être poursuivie aussi longtemps que l’état clinique du patient l’exige.
C. INCOMPATIBILITÉS
Ne pas ajouter d’autres médicaments ou substances à tout composant de la poche ou à l’émulsion reconstituée sans vérifier préalablement leur compatibilité et la stabilité de la préparation obtenue (notamment, la stabilité de l’émulsion lipidique).
Des incompatibilités peuvent se produire par exemple avec une acidité excessive (pH faible) ou une teneur non appropriée en cations divalents (Ca2+ et Mg2+), ce qui peut déstabiliser l’émulsion lipidique.
Comme avec tous les mélanges pour nutrition parentérale, il convient de tenir compte des taux de calcium et de phosphate. Un ajout excessif de calcium et de phosphate, en particulier sous forme de sels minéraux, peut entraîner la formation de précipités de phosphate de calcium.
OLEUNOR N7E contient des ions calcium qui constituent un risque de coagulation supplémentaire en cas de précipitation dans du sang ou des composants sanguins contenant un agent conservateur/anticoagulant citrate.
La ceftriaxone ne doit pas être mélangée ni administrée simultanément par voie intraveineuse avec des solutions contenant du calcium, dont OLEUNOR N7E, à l'aide de la même ligne de perfusion (p. ex., raccord en Y) en raison du risque de précipitation entre le sel de calcium et la ceftriaxone (voir rubriques 4.4 et 4.5 du RCP).
En raison du risque de précipitation, OLEUNOR N7E ne doit pas être administré par la même ligne de perfusion que l’ampicilline ou la fosphénytoïne ni mélangé à ces deux produits
La ceftriaxone et les solutions contenant du calcium peuvent être administrées de manière séquentielle, l’une après l’autre, si des lignes ou des sites de perfusion différents sont utilisés ou si les lignes de perfusion sont remplacées ou ont été soigneusement rincées entre les perfusions à l’aide d’un liquide compatible.
Vérifier la compatibilité avec les solutions administrées simultanément par le même set d’administration, cathéter ou canule.
Ne pas administrer avant, pendant ou après une perfusion de sang en utilisant le même équipement en raison du risque de pseudo-agglutination.
D. PRÉCAUTIONS PARTICULIÈRES D’ÉLIMINATION ET DE MANIPULATION
Pour les instructions concernant les étapes de préparation pour l’administration d’OLEUNOR N7E, voir figure 1.
Pour ouvrir
· Retirer le suremballage de protection.
· Jeter le sachet absorbeur d’oxygène.
· Vérifier l’intégrité de la poche et des soudures non permanentes. Utiliser uniquement si la poche n’est pas endommagée, si les soudures non permanentes sont intactes (c'est-à-dire, sans mélange des contenus des 3 compartiments) ; si la solution d’acides aminés et la solution glucidique sont limpides, incolores ou légèrement jaunes, et pratiquement exemptes de particules visibles ; et si l’émulsion lipidique est un liquide homogène d’aspect laiteux, dépourvu de tout aspect de séparation de phase.
Mélange des solutions et de l’émulsion
· S’assurer que le produit est à température ambiante avant de rompre les soudures non permanentes.
· Enrouler manuellement la poche sur elle–même en commençant par le haut de la poche (côté œillet de suspension). Les soudures non permanentes disparaîtront du côté des embouts. Continuer d’enrouler la poche jusqu’à ce que les soudures soient ouvertes sur environ la moitié de leur longueur.
· Mélanger en retournant la poche au moins 3 fois.
· Après reconstitution, le mélange est un liquide homogène d’aspect laiteux, dépourvu de tout aspect de séparation de phase.
Supplémentations
La capacité de la poche est suffisante pour permettre des supplémentations telles que des vitamines, des électrolytes et des oligo-éléments.
Toute supplémentation (y compris de vitamines) peut être faite dans le mélange reconstitué (après ouverture des soudures non permanentes et mélange du contenu des 3 compartiments).
Des vitamines peuvent également être ajoutées au compartiment de glucose avant reconstitution du mélange (avant rupture des soudures non permanentes et mélange des 3 compartiments).
Pour les ajouts aux formules contenant des électrolytes, les électrolytes déjà présents dans la poche doivent être pris en compte.
Les supplémentations doivent se faire dans des conditions d’asepsie et par un personnel qualifié.
Des électrolytes peuvent être ajoutés à OLEUNOR N7E, dans les limites du tableau ci-dessous :
|
Pour 1000 mL
|
|
|
Quantité présente
|
Addition supplémentaire maximale
|
Quantité totale maximale
|
|
Sodium
|
35 mmol
|
115 mmol
|
150 mmol
|
|
Potassium
|
30 mmol
|
120 mmol
|
150 mmol
|
|
Magnésium
|
4,0 mmol
|
1,6 mmol
|
5,6 mmol
|
|
Calcium
|
3,5 mmol
|
1,5 (0,0a) mmol
|
5,0 (3,5a) mmol
|
|
Phosphate inorganique
|
0 mmol
|
3,0 mmol
|
3,0 mmol
|
|
Phosphate organique
|
15 mmolb
|
10 mmol
|
25 mmol b
|
a : Valeur correspondant à l’ajout de phosphate inorganique.
b : Inclut les phosphates provenant de l’émulsion lipidique
Oligo-éléments et vitamines :
Pour effectuer un ajout :
· Respecter les conditions d’asepsie.
· Préparer le site d’injection de la poche.
· Ponctionner le site d’injection et injecter les additifs à l’aide d’une aiguille pour injection ou d'un dispositif de reconstitution.
· Mélanger le contenu de la poche et les additifs.
Préparation de la perfusion
· Respecter les conditions d’asepsie.
· Suspendre la poche.
· Retirer le protecteur en plastique de l’embout d’administration.
· Insérer fermement le perforateur du set de perfusion dans l’embout d’administration.
Figure 1 : Étapes de préparation avant l’administration d’OLEUNOR N7E :
|
1.
 Déchirer depuis le haut pour ouvrir le suremballage. Déchirer depuis le haut pour ouvrir le suremballage.
|
2.
 Détacher le devant du suremballage pour sortir la poche de nutrition parentérale. Jeter le suremballage et le sachet absorbeur d’oxygène. Détacher le devant du suremballage pour sortir la poche de nutrition parentérale. Jeter le suremballage et le sachet absorbeur d’oxygène.
|
3.
 Poser la poche à plat sur une surface horizontale et propre avec la poignée face à vous. Poser la poche à plat sur une surface horizontale et propre avec la poignée face à vous.
|
|
4.
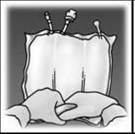 Soulever la zone de l’œillet pour retirer la solution de la partie supérieure de la poche. Rouler fermement la partie supérieure de la poche jusqu’à ce que les soudures pelables soient complètement ouvertes (environ sur la moitié de la longueur). Soulever la zone de l’œillet pour retirer la solution de la partie supérieure de la poche. Rouler fermement la partie supérieure de la poche jusqu’à ce que les soudures pelables soient complètement ouvertes (environ sur la moitié de la longueur).
|
5.
 Mélanger en retournant la poche à l’envers au moins 3 fois. Mélanger en retournant la poche à l’envers au moins 3 fois.
|
6.
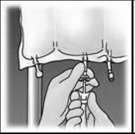 Suspendre la poche. Tourner et retirer le protecteur du site d’administration. Insérer fermement le perforateur du perfuseur. Suspendre la poche. Tourner et retirer le protecteur du site d’administration. Insérer fermement le perforateur du perfuseur.
|
Administration
A usage unique.
· Administrer uniquement le médicament après avoir rompu les soudures non permanentes entre les 3 compartiments et mélanger le contenu des 3 compartiments.
· Vérifier qu’il n’y a pas de séparation des phases dans l’émulsion finale à perfuser.
· Une fois la poche ouverte, utiliser immédiatement son contenu. Ne jamais conserver la poche ouverte pour une perfusion ultérieure. Ne pas reconnecter des poches partiellement utilisées.
· Ne pas connecter de poches en série afin d’éviter tout risque d’embolie gazeuse due à l’air contenu dans la première poche.
· Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Extravasion
Le site du cathéter doit être régulièrement contrôlé pour détecter les signes d'extravasion.
En cas d’extravasion, l’administration doit être interrompue immédiatement, tout en maintenant en place la canule ou le cathéter inséré pour un traitement immédiat du patient. Si possible, une aspiration doit être pratiquée à travers la canule/le cathéter inséré afin de réduire la quantité de liquide présent dans les tissus avant de retirer la canule/le cathéter.
Si une extrémité est atteinte, le membre concerné doit être surélevé.
Selon le produit extravasé (y compris les produits mélangés avec OLEUNOR N7E le cas échéant) et le stade/l’étendue des lésions éventuelles, des mesures appropriées doivent être prises. Les options thérapeutiques peuvent inclure des interventions non pharmacologiques, pharmacologiques et/ou chirurgicales. En cas d'extravasion importante, un chirurgien esthétique doit être consulté dans les 72 heures.
Le site d'extravasion doit être contrôlé au moins toutes les 4 heures pendant les premières 24 heures, puis une fois par jour.
La perfusion ne doit pas être recommencée dans la même veine centrale.
 Déchirer depuis le haut pour ouvrir le suremballage.
Déchirer depuis le haut pour ouvrir le suremballage. Détacher le devant du suremballage pour sortir la poche de nutrition parentérale. Jeter le suremballage et le sachet absorbeur d’oxygène.
Détacher le devant du suremballage pour sortir la poche de nutrition parentérale. Jeter le suremballage et le sachet absorbeur d’oxygène. Poser la poche à plat sur une surface horizontale et propre avec la poignée face à vous.
Poser la poche à plat sur une surface horizontale et propre avec la poignée face à vous. Soulever la zone de l’œillet pour retirer la solution de la partie supérieure de la poche. Rouler fermement la partie supérieure de la poche jusqu’à ce que les soudures pelables soient complètement ouvertes (environ sur la moitié de la longueur).
Soulever la zone de l’œillet pour retirer la solution de la partie supérieure de la poche. Rouler fermement la partie supérieure de la poche jusqu’à ce que les soudures pelables soient complètement ouvertes (environ sur la moitié de la longueur). Mélanger en retournant la poche à l’envers au moins 3 fois.
Mélanger en retournant la poche à l’envers au moins 3 fois. Suspendre la poche. Tourner et retirer le protecteur du site d’administration. Insérer fermement le perforateur du perfuseur.
Suspendre la poche. Tourner et retirer le protecteur du site d’administration. Insérer fermement le perforateur du perfuseur.