RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 19/10/2005
UMULINE ZINC COMPOSE 100 UI/ml, suspension injectable en flacon
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 ml contient:
Insuline humaine (produite par la technique dite de l'ADN recombinant sur souche d'Escherichia coli) ....... 100 UI*
*Insuline humaine zinc amorphe 30 %, Insuline humaine zinc cristallisée 70 %.
Un flacon contient 10 ml correspondant à 1000 UI d'insuline humaine.
Pour la liste complète des excipients, voir rubrique 6.1.
Suspension injectable en flacon de 10 ml à utiliser avec une seringue appropriée marquée 100 UI/ml.
Umuline Zinc Composé est une suspension stérile d'insuline humaine zinc, contenant 30 % de forme amorphe et de 70 % de forme cristallisée, amenée à un pH compris entre 7,0 et 7,8.
Umuline Zinc Composé est une préparation d'insuline d'action intermédiaire.
4.1. Indications thérapeutiques
Traitement des patients atteints de diabète nécessitant un traitement par insuline pour maintenir un équilibre glycémique normal. Umuline est également indiqué pour la stabilisation initiale du diabète et pour le traitement du diabète au cours de la grossesse.
4.2. Posologie et mode d'administration
La posologie est déterminée par le médecin, selon les besoins du patient.
Umuline Rapide doit être administré par injection sous-cutanée mais peut également, bien que ce ne soit pas conseillé, être administré par injection intramusculaire. Umuline Rapide peut également être administré par voie intraveineuse.
Umuline Zinc composé doit être administré par injection sous-cutanée mais peut également, bien que ce ne soit pas conseillé, être administré par injection intramusculaire. Umuline Zinc composé ne doit pas être administré par voie intraveineuse.
Umuline NPH, Profil Zinc et Zinc Composé en Flacons et Umuline NPH et Profil en cartouches doivent être injectées par voie sous-cutanée, mais peuvent également, bien que cela ne soit pas recommandé, être injectées par voie intramusculaire. Ces spécialités ne doivent pas être administrées par voie intraveineuse.
L'administration sous-cutanée doit être effectuée dans les bras, les cuisses, les fesses ou l'abdomen. Les points d'injection doivent varier afin de ne pas utiliser le même point d'injection plus d'une fois par mois environ.
Lors de l'injection de toute préparation d'insuline Umuline, s'assurer que l'aiguille n'a pas pénétré dans un vaisseau sanguin. Après l'injection, ne pas masser le point d'injection. Les patients doivent être éduqués pour utiliser une technique d'injection correcte.
Umuline NPH, Umuline Zinc Composé et Umuline Zinc peuvent être administrés en association avec Umuline Rapide (voir rubrique 6.6 Instructions pour l'utilisation, la manipulation et l'élimination - Mélanges d'insuline).
Les formulations Umuline Profil sont des mélanges préétablis et prêts à l'emploi contenant de l'insuline sous forme d'Umuline Rapide et d'Umuline NPH, spécialement conçus pour que le patient n'ait pas à préparer son mélange d'insulines. Le schéma thérapeutique de chaque patient doit être établi en fonction de ses besoins métaboliques propres.
Hypoglycémie.
Hypersensibilité à Umuline ou à l'un de ses composants, sauf dans le cadre d'un programme de désensibilisation.
Les préparations d'Umuline ne doivent en aucun cas être administrées par voie intraveineuse, à l'exception d'Umuline Rapide.
4.4. Mises en garde spéciales et précautions d'emploi
Le transfert à un autre type d'insuline ou à une autre marque chez un patient doit se faire sous strict contrôle médical. Le changement de concentration, de marque (fabricant), de type (Rapide, NPH, lente, etc.), d'espèce (animale, humaine, analogue de l'insuline humaine) et/ou de méthode de fabrication (ADN recombinant versus l'insuline d'origine animale) peut nécessiter une modification de posologie.
Les patients recevant de l'insuline humaine peuvent nécessiter un changement de posologie par rapport à leurs insulines d'origine animale. Si une adaptation posologique est nécessaire, elle peut être faite lors de la première administration ou au cours des premières semaines ou des premiers mois.
Quelques patients ayant présenté des réactions hypoglycémiques après transfert d'une insuline d'origine animale à une insuline humaine ont signalé que les symptômes précurseurs d'hypoglycémie étaient moins prononcés ou différents de ceux ressentis lors de leur traitement antérieur par l'insuline animale. Les patients dont la glycémie s'est améliorée de façon importante, par exemple grâce à l'insulinothérapie intensifiée, peuvent voir disparaître certains ou tous les symptômes précurseurs d'hypoglycémie et doivent donc en être informés. La modification ou la diminution des symptômes précurseurs d'hypoglycémie peut également survenir chez les patients présentant un diabète de longue durée, une neuropathie diabétique ou prenant simultanément d'autres médicaments tels que les bêta-bloquants. L'hypoglycémie non corrigée ou les réactions d'hyperglycémie peuvent entraîner une perte de connaissance, un coma ou le décès.
L'utilisation de posologies mal adaptées ou l'arrêt du traitement, en particulier chez les diabétiques insulino-dépendants, peuvent entraîner une hyperglycémie et une acido-cétose diabétique, dont le pronostic peut être fatal.
Le traitement par insuline humaine peut provoquer la formation d'anticorps, mais leurs taux sont inférieurs à ceux observés avec l'insuline animale purifiée.
Les besoins en insuline peuvent changer de façon significative en cas de maladies surrénalienne, hypophysaire ou thyroïdienne et d'insuffisance rénale ou hépatique.
Les besoins en insuline peuvent augmenter au cours d'une maladie ou de perturbations affectives.
L'adaptation posologique peut être nécessaire si le patient modifie l'intensité de son activité physique ou modifie son régime alimentaire habituel.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Un certain nombre de médicaments sont connus pour interagir avec le métabolisme du glucose. Le médecin doit considérer toute possibilité d'interaction et demander aux patients s'ils prennent d'autres médicaments.
Les besoins en insuline peuvent être augmentés par les substances à effet hyperglycémiant, telles que les glucocorticoïdes, les hormones thyroïdiennes, l'hormone de croissance, le danazol, les bêta-2 mimétiques (tels que ritodrine, salbutamol, terbutaline), les thiazidiques.
Les besoins en insuline peuvent être diminués en présence de substances à effet hypoglycémiant, telles que les hypoglycémiants oraux (ADO), les salicylés (par exemple l'acide acétylsalicylique), certains antidépresseurs (les inhibiteurs de la monoamine oxydase: IMAO) certains inhibiteurs de l'enzyme de conversion de l'angiotensine (IEC) (captopril, enalapril), les agents bêta-bloquants non sélectifs et l'alcool.
Les analogues de la somatostatine (octréotide, lanréotide) peuvent réduire ou accroître les besoins en insuline.
Il est essentiel de maintenir un bon équilibre glycémique chez la patiente traitée par l'insuline (diabète insulino-dépendant ou gestationnel) durant la grossesse. Les besoins en insuline chutent habituellement au cours du premier trimestre et augmentent au cours des deuxième et troisième trimestres.
Les patientes diabétiques doivent informer leur médecin si elles sont enceintes ou si elles envisagent une grossesse.
Une surveillance attentive de la glycémie ainsi que de l'état de santé général est primordiale pendant la grossesse chez les patientes diabétiques.
Les patientes diabétiques allaitant peuvent nécessiter une adaptation de la dose d'insuline, de leur régime alimentaire ou des deux.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les capacités de concentration et les réflexes peuvent être diminués en cas d'hypoglycémie. Ceci représente un risque pour le patient dans des situations où ces facultés sont de première importance comme la conduite automobile ou l'utilisation de machines.
Les patients doivent être informés des précautions à prendre avant de conduire pour éviter une hypoglycémie, en particulier chez ceux chez qui les symptômes précurseurs d'hypoglycémie sont absents ou diminués ou chez ceux qui ont de fréquents épisodes d'hypoglycémie. La capacité à conduire un véhicule doit être réévaluée dans ces circonstances.
L'hypoglycémie est l'effet indésirable le plus fréquent lors du traitement insulinique chez le patient diabétique. L'hypoglycémie sévère peut entraîner la perte de connaissance allant dans des cas extrêmes jusqu'à la mort.
Une allergie locale peut survenir et se manifester par une rougeur, un œdème et des démangeaisons au point d'injection. Cette réaction disparaît habituellement en quelques jours voire quelques semaines. Dans certains cas, cette réaction peut être liée à des facteurs autres que l'insuline, tels que des produits irritants contenus dans le désinfectant cutané ou une mauvaise technique d'injection.
L'allergie systémique, moins fréquente mais potentiellement plus grave, correspond à une allergie généralisée à l'insuline. Elle peut entraîner une éruption généralisée sur tout le corps, une dyspnée, une respiration sifflante, une baisse de la pression artérielle, une accélération du pouls ou des sueurs. Les cas sévères d'allergie généralisée peuvent menacer le pronostic vital. Dans les rares cas d'allergie sévère à Umuline, un traitement doit être instauré immédiatement. Un changement d'insuline ou une désensibilisation peut être nécessaire.
Des lipodystrophies peuvent apparaître au site d'injection.
Il n'existe aucune définition spécifique du surdosage insulinique. En effet, la glycémie résulte d'interactions complexes entre les concentrations d'insuline, la disponibilité du glucose et d'autres facteurs métaboliques. L'hypoglycémie peut être due à un excès d'insuline par rapport à l'apport alimentaire et à la dépense énergétique.
L'hypoglycémie peut être associée à une apathie, une confusion, des palpitations, des céphalées, des sueurs et des vomissements.
Les épisodes d'hypoglycémie légère seront compensés par l'administration orale de glucose ou d'autres produits sucrés.
Une hypoglycémie modérément sévère peut être corrigée par l'administration intramusculaire ou sous -cutanée de glucagon, suivie d'une prise orale d'hydrates de carbone lorsque le patient sera suffisamment rétabli. Les patients qui ne répondent pas au glucagon doivent recevoir une solution de sérum glucosé par voie intraveineuse.
En cas de coma hypoglycémique, le glucagon devra être administré par voie intramusculaire ou sous-cutanée. Cependant, s'il n'y pas de glucagon disponible ou si le patient n'y répond pas, on injectera du sérum glucosé par voie intraveineuse. Dès que le patient aura repris connaissance, un repas lui sera donné.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmaco-thérapeutique:
INSULINE HUMAINE D'ACTION INTERMEDIAIRE, Code ATC: A10AE01.
L'activité principale de l'insuline est la régulation du métabolisme glucidique.
D'autre part, l'insuline possède plusieurs actions anaboliques et anticataboliques dans différents tissus. Dans le muscle, ces effets comprennent une augmentation de la synthèse du glycogène, des acides gras, du glycérol, des protéines et une augmentation de la fixation des acides aminés, ainsi qu'une diminution de la glycogénolyse, de la néoglucogénèse, de la cétogénèse, de la lipolyse, du catabolisme protéique et de l'élimination des acides aminés.
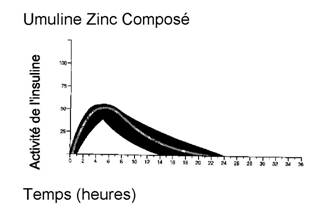
Le profil d'activité-type (courbe d'utilisation du glucose) après injection sous-cutanée est représenté sur la courbe ci-dessous par la ligne épaisse. Les variations en durée et/ou intensité d'activité de l'insuline chez les patients sont représentées par la zone sombre. La variabilité individuelle dépend de facteurs tels que la dose, le site d'injection, la température et l'activité physique du patient.

5.2. Propriétés pharmacocinétiques
La pharmacocinétique de l'insuline ne constitue pas un reflet de l'action métabolique de cette hormone. Il est donc plus approprié d'examiner les courbes correspondant à l'utilisation du glucose (voir rubrique 5.1) afin de déterminer l'activité de l'insuline.
5.3. Données de sécurité préclinique
Umuline est une insuline humaine obtenue par la technologie d'ADN recombinant. Aucun effet secondaire grave n'a été observé lors des études de toxicité clinique et aucun effet mutagène n'a été mis en évidence dans une série de tests de genotoxicité réalisés in vitro et in vivo.
Acétate de sodium, chlorure de sodium, parahydroxybenzoate de méthyle, eau pour préparations injectables et oxyde de zinc.
Peuvent être utilisés pour ajuster le pH: acide chlorhydrique et/ou hydroxyde de sodium.
Les préparations d'umuline ne doivent pas être mélangées avec les insulines produites par d'autres fabricants ou avec des préparations d'insuline d'origine animale.
18 mois.
Après première utilisation, la durée de conservation est de 28 jours.
6.4. Précautions particulières de conservation
A conserver entre +2 et +8°C (au réfrigérateur).
Ne pas congeler. Ne pas exposer à une chaleur excessive ou au soleil.
Conserver le flacon dans le carton d'emballage.
Après première utilisation, les flacons peuvent être utilisés pendant 28 jours. Ne pas utiliser au-delà de cette période.
En cours d'utilisation, les flacons doivent être conservés à une température ne dépassant pas +30°C.
6.5. Nature et contenu de l'emballage extérieur
La suspension est contenue dans des flacons (verre de Type I) munis d'un bouchon (caoutchouc) et sertis par une capsule (aluminium) et une capsule (plastique).
1 flacon de 10 ml; boîte de 1 ou 2.
Toutes les conditionnements peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Avant utilisation, faire rouler plusieurs fois entre la paume des mains les flacons contenant Umuline Zinc Composé afin de remettre l'insuline en suspension, jusqu'à ce qu'elle prenne un aspect uniformément trouble ou laiteux. Si cet aspect n'est pas obtenu, répéter la procédure ci-dessus jusqu'à ce que le contenu du flacon soit bien mélangé. Ne pas agiter vigoureusement car la formation d'une mousse pourrait gêner la mesure exacte de la dose.
Examinez les flacons régulièrement et ne pas les utiliser si la suspension présente des floculations ou si des particules blanches restent collées au fond ou sur les parois du flacon, lui donnant un aspect givré.
Mélange d'insulines: Commencer par aspirer l'insuline à action rapide dans la seringue, afin d'éviter la contamination du flacon par la préparation à durée d'action plus longue. Il est conseillé de réaliser l'injection immédiatement après le mélange. Toutefois, si un délai est nécessaire, procéder toujours de la même façon.
Préparer votre seringue avant l'injection, en suivant les instructions du médecin ou de l'infirmier.
Utiliser une seringue à insuline graduée, adaptée à la concentration de l'insuline à administrer.
b) Injection d'une dose
Injecter la dose correcte d'insuline en suivant les instructions de votre médecin ou de votre infirmier.
Les points d'injection doivent varier afin de ne pas utiliser le même point d'injection plus d'une fois par mois environ.
Chaque boîte contient une notice d'information contenant des instructions pour pratiquer l'injection d'insuline.
c) Elimination des récipients et des aiguilles usagés
N'utiliser les aiguilles qu'une fois. Les jeter de manière à ne pas provoquer d'accident. Les aiguilles ne doivent pas être partagées. Les flacons peuvent être utilisés jusqu'à ce qu'ils soient vides, puis doivent être convenablement jetés.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
LILLY FRANCE SAS
13, RUE PAGES
92158 SURESNES CEDEX
FRANCE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 335 233-7: 10 ml de suspension injectable en flacon (verre de Type I) munis d'un bouchon (caoutchouc); boîte de 1
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste II.