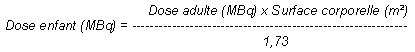
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 28/06/1999
XENON (133 Xe) 7,4 GBq, gaz pour inhalation en récipient multidose, CIS BIO INTERNATIONAL [Référence: XE-133-G-3-B]
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Le xénon (133Xe), gaz pour inhalation en récipient multidose, CIS bio international, est un mélange gazeux, incolore, composé de xénon (133Xe) et d'air filtré.
Xénon (133Xe) ............................................................................................... 7,4 GBq (à la date de calibration)
Pour 1 récipient multidose.
Le xénon-133 (numéro atomique: 54; nombre de masse: 133) est un isotope radioactif du xénon, obtenu par séparation à partir des produits de fission de l'uranium. Il décroît en césium-133 stable avec une période de 5,24 jours en émettant des rayonnements bêta moins (énergies maximales: 266 keV, probabilité d'émission 0,7 % et 346 keV, probabilité d'émission 99,3 %), gamma (énergie 81 keV, probabilité d'émission 37 %) et X (énergie 30-35 keV, probabilité d'émission 47 %).
Pour la liste complète des excipients, voir rubrique 6.1.
Gaz pour inhalation.
4.1. Indications thérapeutiques
· Etude de la ventilation pulmonaire.
· Etude de la perfusion cérébrale.
4.2. Posologie et mode d'administration
La préparation est administrée par inhalation.
Etude de la ventilation pulmonaire:
L'examen peut être réalisé chez le patient assis ou en décubitus dorsal. Les différentes phases de l'examen doivent être effectuées dans la même position. Le xénon 133 est inhalé par l'intermédiaire d'un embout buccal et d'un pince nez ou d'un masque avec un spiromètre en circuit fermé.
L'activité à administrer chez l'adulte est de 370 à 1100 MBq.
Le patient respire normalement un mélange d'air et de xénon 133 contenu dans le spiromètre en circuit fermé jusqu'à ce que l'équilibre entre l'activité pulmonaire et l'activité présente dans le spiromètre soit atteint (phase d'équilibre). La réalisation d'images au xénon 133 nécessite l'inhalation du mélange gazeux pendant un temps suffisamment long (4-5 minutes) pour permettre la diffusion du radionucléide dans les zones hypoventilées. La distribution de l'activité pulmonaire observée à la phase d'équilibre reflète plus le volume pulmonaire régional que la ventilation.
Ultérieurement, le patient respire en circuit ouvert (inspiration de l'air ambiant et expiration dans le spiromètre). La ventilation pulmonaire, globale et régionale est évaluée à partir de la courbe d'élimination et visualisée lors d'acquisitions dynamiques. Le xénon 133 réside plus longtemps (3-5 minutes) dans les régions pulmonaires hypoventilées lors de cette phase d'élimination.
Etude de la perfusion cérébrale:
Le xénon 133 gazeux est inhalé pendant 5 minutes environ. La perfusion cérébrale régionale est quantifiée par déconvolution de la courbe d'activité vasculaire (déterminé en regard du cœur ou de l'aorte).
L'activité à administrer chez l'adulte est de 300 à 1100 MBq.
Chez l'enfant, l'activité administrée est une fraction de celle utilisée chez l'adulte, fraction obtenue par application des coefficients ci-dessousf en fonction de la masse corporelle selon l'EANM (European Association of Nuclear Medicine):
|
3 kg |
= |
0,10 |
22 kg |
= |
0,50 |
42 kg |
= |
0,78 |
|
4 kg |
= |
0,14 |
24 kg |
= |
0,53 |
44 kg |
= |
0,80 |
|
6 kg |
= |
0,19 |
26 kg |
= |
0,56 |
46 kg |
= |
0,82 |
|
8 kg |
= |
0,23 |
28 kg |
= |
0,58 |
48 kg |
= |
0,85 |
|
10 kg |
= |
0,27 |
30 kg |
= |
0,62 |
50 kg |
= |
0,88 |
|
12 kg |
= |
0,32 |
32 kg |
= |
0,65 |
52-54 kg |
= |
0,90 |
|
14 kg |
= |
0,36 |
34 kg |
= |
0,68 |
56-58 kg |
= |
0,92 |
|
16 kg |
= |
0,40 |
36 kg |
= |
0,71 |
60-62 kg |
= |
0,96 |
|
18 kg |
= |
0,44 |
38 kg |
= |
0,73 |
64-66 kg |
= |
0,98 |
|
20 kg |
= |
0,46 |
40 kg |
= |
0,76 |
68 kg |
= |
0,99 |
La dose à administrer chez l'enfant est le plus souvent calculée en fonction de la surface corporelle par application de la formule suivante:
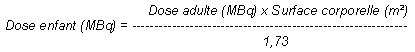
Dans certains cas, le calcul en fonction de la masse corporelle est plus approprié:
![]()
Aucune connue à ce jour.
4.4. Mises en garde spéciales et précautions d'emploi
Les produits radiopharmaceutiques ne doivent être réceptionnés, utilisés et administrés que par des personnes autorisées dans les services agréés. Leur réception, leur stockage, leur utilisation, leur transfert et leur élimination sont soumis aux réglementations et aux autorisations appropriées des autorités compétentes.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
La stéatose hépatique peut majorer l'activité hépatique lors de la phase d'élimination pulmonaire.
Un traitement par des hypolipémiants tels que le clofibrate et ses dérivés ou par des médicaments analogues peut majorer la fixation hépatique.
La distribution du xénon 133 au niveau pulmonaire peut être modifiée en cas de prise simultanée de benzodiazépines ou d'anesthésiques généraux.
Lorsqu'il est nécessaire d'administrer des produits radiopharmaceutiques à la femme en âge de procréer, toute suspicion de grossesse doit être écartée. Toute femme n'ayant pas eu ses règles doit être considérée comme enceinte jusqu'à preuve du contraire. Dans le doute, il est important que l'exposition aux radiations soit réduite au minimum pour obtenir les informations cliniques souhaitées. D'autres techniques, n'impliquant pas l'emploi de radiations ionisantes, peuvent être envisagées si elles n'altèrent pas la qualité diagnostique.
Les examens utilisant des radionucléides chez la femme enceinte entraînent également l'irradiation du fœtus. Il ne faut réaliser au cours de la grossesse que les seules investigations absolument nécessaires lorsque le bénéfice probable dépasse les risques encourus par la mère et le fœtus.
Avant d'administrer un produit radiopharmaceutique à une femme en période d'allaitement, il faut envisager si on peut repousser raisonnablement l'examen jusqu'à la fin de l'allaitement ou s'assurer dans le cas contraire que le radiopharmaceutique choisi est le plus approprié compte tenu de l'éventuel passage de la radioactivité dans le lait. Si l'administration en est indispensable, l'allaitement doit être arrêté pendant 12 heures et le lait écarté. L'allaitement peut être repris quand la dose de radioactivité ingérée au cours de l'allaitement conduit à un équivalent de dose, délivré à l'enfant, inférieur à 1 mSv.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Aucun connu à ce jour.
Aucun connu à ce jour.
Pour tout patient, l'exposition aux radiations ionisantes doit être justifiée par le bénéfice diagnostique attendu. La radioactivité administrée doit être telle que l'irradiation qui en découle soit aussi faible que possible, en gardant à l'esprit la nécessité d'obtenir le diagnostic requis.
L'exposition aux radiations ionisantes peut potentiellement induire des cancers ou développer des déficiences héréditaires. L'expérience montre que, pour les examens diagnostiques en médecine nucléaire, la fréquence de ces effets indésirables est très faible en raison des faibles activités utilisées.
Pour la plupart des examens de médecine nucléaire, la dose de radiations délivrée (dose efficace) est inférieure à 20 mSv. L'utilisation d'activités plus élevées peut se justifier dans certains cas.
En cas d'administration d'une activité excessive de xénon 133, la dose absorbée délivrée au patient doit être réduite en lui faisant respirer de l'air ambiant.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Produit radiopharmaceutique à usage diagnostique.
(V: DIVERS)
Le xénon est un gaz inerte. Il n'est pas métabolisé. Aux concentrations utilisées, le xénon 133 ne semble pas avoir d'effet pharmacodynamique.
Il est établi que des concentrations élevées de xénon induisent une anesthésie chez l'homme et chez l'animal.
5.2. Propriétés pharmacocinétiques
Les propriétés pharmacocinétiques du xénon 133 reposent essentiellement sur sa solubilité dans les milieux biologiques et sa vitesse élevée de diffusion. Le xénon 133 traverse facilement les membranes cellulaires et est échangé librement entre les compartiments sanguin et tissulaire.
Lors de l'inhalation de xénon 133, une petite fraction seulement de l'activité inhalée est retenue dans le compartiment vasculaire par suite de la diffusion pulmonaire.
Après inhalation de xénon 133 en circuit fermé pendant environ 10 minutes, 68 % de l'activité inhalée sont retrouvés dans les poumons, 11 % dans les muscles et 4 % dans le tissu adipeux.
Après équilibration, le xénon 133 est ensuite éliminé du compartiment extravasculaire en retournant vers le sang et plus de 95 % de l'activité inhalée sont exhalés par ventilation pulmonaire.
La vitesse d'élimination du xénon 133 est essentiellement fonction du débit sanguin régional.
La solubilité du xénon 133 dans le tissu adipeux est 10 à 15 fois plus élevée que dans l'eau ou le sang. Le calcul des débits sanguins régionaux doit donc prendre en compte la teneur en tissu adipeux des organes et le coefficient de solubilité du xénon.
Au niveau des muscles squelettiques et myocardique, la solubilité du xénon 133 est comprise entre 0,70 et 0,73 ml de xénon par gramme de tissu; au niveau cérébral, elle est de 0,8-1,0 ml de xénon par gramme de tissu pour la substance grise et de 1,25-1,64 ml de xénon par gramme de tissu pour la substance blanche.
La solubilité du xénon 133 dans le sang est également fonction de la valeur de l'hématocrite.
La vitesse d'élimination du xénon 133 au niveau de différents organes est caractérisée par les périodes biologiques suivantes: 10-40 secondes au niveau pulmonaire, 3 minutes dans le sang, 0,4 heure dans le muscle et environ 7,6 à 17 heures dans le tissu adipeux.
Au niveau cérébral, les périodes d'élimination du xénon 133 pour un modèle à trois compartiments sont (temps d'acquisition de 40 minutes environ): 0,7 minute, 4,4 minutes et 21 minutes. Pour un modèle à deux compartiments, les périodes d'élimination sont 1,5 minutes et 10,9 minutes. Pour un modèle à un compartiment, la période d'élimination est de 5 minutes.
Du fait de sa liposolubilité, le xénon 133 est supposé traverser la barrière placentaire et passer dans le lait maternel
5.3. Données de sécurité préclinique
Le xénon 133 n'est pas destiné à être administré de façon régulière ou continue.
Il n'existe pas d'étude concernant la toxicité par administration unique ou par administration réitérée.
Les études de la reproduction chez le rat n'ont pas mis en évidence d'effet embryotoxique du xénon. Il n'existe pas d'étude concernant la mutagénicité ni la carcinogénicité.
Aux concentrations utilisées pour les examens de diagnostic, des effets toxiques sont improbables.
Aucune connue à ce jour.
22 jours à compter de la date de fabrication.
La date de péremption est indiquée sur chaque récipient.
6.4. Précautions particulières de conservation
Le produit doit être conservé à une température comprise entre +15°C et +25°C dans son conditionnement d'origine.
Le stockage doit être effectué conformément aux réglementations nationales relatives aux produits radioactifs.
6.5. Nature et contenu de l'emballage extérieur
Le récipient multidose se présente comme un réservoir constitué d'un blindage plombé et contenant un récipient déformable constitué d'une feuille de polyester/polyéthylène métallisée.
Au récipient est adapté un tube de sortie comportant un site d'injection en polyéthylène obturé par un joint de fermeture en caoutchouc et serti par une capsule en aluminium.
6.6. Précautions particulières d’élimination et de manipulation
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
CIS BIO INTERNATIONAL
RN 306
BP 32
91192 Gif-sur-Yvette Cedex
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 561 235-7: 20 ml (7,4 GBq) en récipient multidose (polyester/polyéthylène).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
Selon la CIPR 60 (Commission Internationale pour la Protection Radiologique), les doses de radiation absorbées sont les suivantes:
· Inspiration unique avec apnée de 30 secondes
|
Doses absorbées par unité d'activité administrée (mGy/MBq) |
|||||
|
Organe |
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Poumons |
7,7 . 10-4 |
1,2 . 10-3 |
1,7 . 10-3 |
2,6 . 10-3 |
5,3 . 10-3 |
|
Surfaces osseuses |
1,2 . 10-4 |
1,4 . 10-4 |
2,4 . 10-4 |
4,0 . 10-4 |
8,2 . 10-4 |
|
Seins |
1,2 . 10-4 |
1,2 . 10-4 |
2,1 . 10-4 |
3,4 . 10-4 |
6,9 . 10-4 |
|
Moelle hématopoïétique |
1,2. 10-4 |
1,5 . 10-4 |
2,5 . 10-4 |
4,1 . 10-4 |
8,2 . 10-4 |
|
Intestin grêle |
1,1. 10-4 |
1,3 . 10-4 |
2,2 . 10-4 |
3,6 . 10-4 |
7,3 . 10-4 |
|
Paroi du côlon supérieur |
1,1 . 10-4 |
1,3 . 10-4 |
2,2 . 10-4 |
3,6 . 10-4 |
7,3 . 10-4 |
|
Paroi du côlon inférieur |
1,1 . 10-4 |
1,3 . 10-4 |
2,2 . 10-4 |
3,6 . 10-4 |
7,3 . 10-4 |
|
Foie |
1,1. 10-4 |
1,3 . 10-4 |
2,2 . 10-4 |
3,6 . 10-4 |
7,3 . 10-4 |
|
Pancréas |
1,1 . 10-4 |
1,3 . 10-4 |
2,2 . 10-4 |
3,7 . 10-4 |
7,4 . 10-4 |
|
Rate |
1,1 . 10-4 |
1,3 . 10-4 |
2,2 . 10-4 |
3,6 . 10-4 |
7,3 . 10-4 |
|
Utérus |
1,1 . 10-4 |
1,3 . 10-4 |
2,2 . 10-4 |
3,6 . 10-4 |
7,3 . 10-4 |
|
Surrénales |
1,0 . 10-4 |
1,3 . 10-4 |
2,2 . 10-4 |
3,7 . 10-4 |
7,4 . 10-4 |
|
Paroi vésicale |
1,0 . 10-4 |
1,3 . 10-4 |
2,2 . 10-4 |
3,6 . 10-4 |
7,3 . 10-4 |
|
Paroi de l'estomac |
1,0 . 10-4 |
1,3 . 10-4 |
2,2 . 10-4 |
3,6 . 10-4 |
7,3 . 10-4 |
|
Reins |
1,0 . 10-4 |
1,3 . 10-4 |
2,1 . 10-4 |
3,6 . 10-4 |
7,2 . 10-4 |
|
Ovaires |
1,0 . 10-4 |
1,3 . 10-4 |
2,2 . 10-4 |
3,6 . 10-4 |
7,3 . 10-4 |
|
Autres tissus |
1,0 . 10-4 |
1,2 . 10-4 |
2,1 . 10-4 |
3,5 . 10-4 |
7,0 . 10-4 |
|
Testicules |
9,9 . 10-5 |
1,2 . 10-4 |
2,0 . 10-4 |
3,4 . 10-4 |
6,9 . 10-4 |
|
Thyroïde |
9,9 . 10-5 |
1,3 . 10-4 |
2,2 . 10-4 |
3,6 . 10-4 |
7,3 . 10-4 |
|
Dose efficace (mSv/MBq) |
1,9 . 10-4 |
2,7 . 10-4 |
4,2 . 10-4 |
6,7 . 10-4 |
1,4 . 10-3 |
La dose efficace résultant de l'administration d'une activité de 1100 MBq (inspiration unique avec apnée de 30 secondes) est d'environ 0,21 mSv (pour un individu de 70 kg).
· Inhalation pendant 5 minutes
|
Doses absorbées par unité d'activité administrée (mGy/MBq) |
|||||
|
Organe |
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Poumons |
1,1 . 10-3 |
1,7. 10-3 |
2,4 . 10-3 |
3,7 . 10-3 |
7,5 . 10-3 |
|
Moelle hématopoïétique |
8,4 . 10-4 |
1,0 . 10-3 |
1,7 . 10-3 |
2,8 . 10-3 |
5,6 . 10-3 |
|
Seins |
8,3 . 10-4 |
8,3 . 10-4 |
1,4 . 10-3 |
2,3 . 10-3 |
4,7 . 10-3 |
|
Surfaces osseuses |
8,0 . 10-4 |
9,9 . 10-4 |
1,7 . 10-3 |
2,8 . 10-3 |
5,6 . 10-3 |
|
Intestin grêle |
7,4 . 10-4 |
9,0 . 10-4 |
1,5 . 10-3 |
2,5 . 10-3 |
5,1 . 10-3 |
|
Paroi du côlon supérieur |
7,4 . 10-4 |
9,1 . 10-4 |
1,5 . 10-3 |
2,5 . 10-3 |
5,0 . 10-3 |
|
Paroi du côlon inférieur |
7,4 . 10-4 |
9,0 . 10-4 |
1,5 . 10-3 |
2,5 . 10-3 |
5,1 . 10-3 |
|
Pancréas |
7,4 . 10-4 |
9,1 . 10-4 |
1,5 . 10-3 |
2,5 . 10-3 |
5,1 . 10-3 |
|
Utérus |
7,4 . 10-4 |
9,1 . 10-4 |
1,5 . 10-3 |
2,5 . 10-3 |
5,1 . 10-3 |
|
Paroi vésicale |
7,3 . 10-4 |
9,1 . 10-4 |
1,5 . 10-3 |
2,5 . 10-3 |
5,1 . 10-3 |
|
Foie |
7,3 . 10-4 |
8,9 . 10-4 |
1,5 . 10-3 |
2,5 . 10-3 |
5,0 . 10-3 |
|
Ovaires |
7,3 . 10-4 |
9,1 . 10-4 |
1,5 . 10-3 |
2,5 . 10-3 |
5,1 . 10-3 |
|
Rate |
7,3 . 10-4 |
8,9 . 10-4 |
1,5 . 10-3 |
2,5 . 10-3 |
5,0 . 10-3 |
|
Paroi de l'estomac |
7,2 . 10-4 |
9,0 . 10-4 |
1,5 . 10-3 |
2,5 . 10-3 |
5,0 . 10-3 |
|
Reins |
7,2 . 10-4 |
8,8 . 10-4 |
1,5 . 10-3 |
2,5 . 10-3 |
5,0 . 10-3 |
|
Surrénales |
7,1 . 10-4 |
9,0 . 10-4 |
1,5 . 10-3 |
2,5 . 10-3 |
5,0 . 10-3 |
|
Autres tissus |
7,0 . 10-4 |
8,6 . 10-4 |
1,4 . 10-3 |
2,4 . 10-3 |
4,8 . 10-3 |
|
Testicules |
6,9 . 10-4 |
8,5 . 10-4 |
1,4 . 10-3 |
2,4 . 10-3 |
4,8 . 10-3 |
|
Thyroïde |
6,9 . 10-4 |
8,8 . 10-4 |
1,5 . 10-3 |
2,5 . 10-3 |
5,0 . 10-3 |
|
Dose efficace (mSv/MBq) |
7,4 . 10-4 |
9,9 . 10-4 |
1,6 . 10-3 |
2,7 . 10-3 |
5,3 . 10-3 |
La dose efficace résultant de l'administration d'une activité de 1100 MBq (inhalation pendant 5 minutes) est d'environ 0,81 mSv (pour un individu de 70 kg).
· Inhalation pendant 10 minutes
|
Doses absorbées par unité d'activité administrée (mGy/MBq) |
|||||
|
Organe |
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Moelle hématopoïétique |
1,4 . 10-3 |
1,7 . 10-3 |
2,8 . 10-3 |
4,7. 10-3 |
9,3 . 10-3 |
|
Seins |
1,4 . 10-3 |
1,4 . 10-3 |
2,3 . 10-3 |
3,8 . 10-3 |
7,8 . 10-3 |
|
Surfaces osseuses |
1,3 . 10-3 |
1,6 . 10-3 |
2,8 . 10-3 |
4,6 . 10-3 |
9,2 . 10-3 |
|
Surrénales |
1,2 . 10-3 |
1,5 . 10-3 |
2,5 . 10-3 |
4,2 . 10-3 |
8,4 . 10-3 |
|
Paroi vésicale |
1,2 . 10-3 |
1,5 . 10-3 |
2,5 . 10-3 |
4,1 . 10-3 |
8,5 . 10-3 |
|
Paroi de l'estomac |
1,2 . 10-3 |
1,5 . 10-3 |
2,5 . 10-3 |
4,1 . 10-3 |
8,3 . 10-3 |
|
Intestin grêle |
1,2 . 10-3 |
1,5 . 10-3 |
2,5 . 10-3 |
4,2 . 10-3 |
8,4 . 10-3 |
|
Paroi du côlon supérieur |
1,2 . 10-3 |
1,5 . 10-3 |
2,5 . 10-3 |
4,2 . 10-3 |
8,4 . 10-3 |
|
Paroi du côlon inférieur |
1,2 . 10-3 |
1,5 . 10-3 |
2,5 . 10-3 |
4,2 . 10-3 |
8,4 . 10-3 |
|
Reins |
1,2 . 10-3 |
1,5 . 10-3 |
2,5 . 10-3 |
4,1 . 10-3 |
8,2 . 10-3 |
|
Foie |
1,2 . 10-3 |
1,5 . 10-3 |
2,5 . 10-3 |
4,1 . 10-3 |
8,3 . 10-3 |
|
Poumons |
1,2 . 10-3 |
1,8 . 10-3 |
2,5 . 10-3 |
3,9 . 10-3 |
7,8 . 10-3 |
|
Ovaires |
1,2 . 10-3 |
1,5 . 10-3 |
2,5 . 10-3 |
4,2 . 10-3 |
8,4 . 10-3 |
|
Pancréas |
1,2 . 10-3 |
1,5 . 10-3 |
2,5 . 10-3 |
4,2 . 10-3 |
8,4 . 10-3 |
|
Rate |
1,2 . 10-3 |
1,5 . 10-3 |
2,5 . 10-3 |
4,1 . 10-3 |
8,3 . 10-3 |
|
Utérus |
1,2 . 10-3 |
1,5 . 10-3 |
2,5 . 10-3 |
4,2 . 10-3 |
8,4 . 10-3 |
|
Autres tissus |
1,2 . 10-3 |
1,4 . 10-3 |
2,4 . 10-3 |
4,0. 10-3 |
8,0 . 10-3 |
|
Testicules |
1,1 . 10-3 |
1,4 . 10-3 |
2,4 . 10-3 |
4,0. 10-3 |
8,0 . 10-3 |
|
Thyroïde |
1,1 . 10-3 |
1,5 . 10-3 |
2,5 . 10-3 |
4,2. 10-3 |
8,3 . 10-3 |
|
Dose efficace (mSv/MBq) |
1,1 . 10-3 |
1,5 . 10-3 |
2,5. 10-3 |
4,1 . 10-3 |
8,2 . 10-3 |
La dose efficace résultant de l'administration d'une activité de 1100 MBq (inhalation pendant 10 minutes) est d'environ 1,21 mSv (pour un individu de 70 kg).
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Les précautions appropriées d'asepsie et de radioprotection doivent être respectées.
Avant l'utilisation, le conditionnement, l'activité et le spectre gamma doivent être vérifiés.
Le récipient multidose se présente comme un réservoir à partir duquel des aliquotes de gaz xénon (133Xe) peuvent être transférées dans un spiromètre. Le récipient déformable garantit que les doses prélevées n'affectent en rien la concentration radioactive du gaz restant. L'activité nécessaire pour l'examen peut donc être extraite en calculant simplement le volume de gaz xénon (133Xe) à prélever, à partir de l'activité volumique corrigée de la décroissance radioactive.
L'activité volumique à calibration est de 370 MBq/ml.
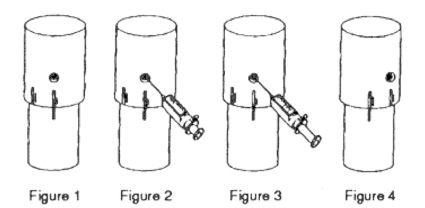
Pour prélever un volume de gaz:
1. Retirer l'étiquette circulaire noire entourant le récipient de protection en plomb et tourner le couvercle du récipient pour aligner l'ouverture avec la flèche située sur la partie inférieure du récipient (figure 1).
2. Calculer le volume de gaz désiré à partir de l'activité volumique à calibration corrigée de la décroissance radioactive.
3. A l'aide d'une seringue munie d'une aiguille de diamètre inférieur à 5/10ème de mm, piquer dans le septum, au milieu du cercle en relief (figure 2).
Attention: l'introduction d'air dans le récipient modifie la concentration radioactive du gaz.
4. Prélever le volume de gaz désiré (figure 3).
5. Retirer l'aiguille, puis tourner le couvercle du récipient jusqu'à ce que le septum soit de nouveau masqué, afin de le protéger pendant la durée du stockage (figure 4).
L'administration de xénon (133Xe), gaz pour inhalation, présente des risques pour l'entourage du patient en raison de l'irradiation externe. Par conséquent il faut prendre des mesures de protection contre les radiations conformément aux réglementations nationales. Des précautions particulières doivent être prises pour piéger et éliminer le xénon (133Xe) exhalé par le patient afin d'éviter toute exposition des utilisateurs (techniciens et toute autre personne susceptible d'être exposée aux radiations).
Le xénon (133Xe) pouvant être retenu au niveau de certains éléments en plastique ou en caoutchouc des appareils (appareils de ventilation, spiromètres ...), il convient d'éviter tout contact prolongé avec ces éléments.
L'élimination des déchets radioactifs doit se faire en accord avec les réglementations nationales et internationales.
Liste I.
Prescription réservée à l'usage hospitalier.
Les produits radiopharmaceutiques ne doivent être utilisés que par des personnes qualifiées. Ils ne peuvent être délivrés qu'à des praticiens ayant obtenu l'autorisation spéciale prévue à l'article R.5234-6 du Code de la Santé Publique.