RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 26/09/2008
1. DENOMINATION DU MEDICAMENT
FLOLAN 0,5 mg, poudre et solvant pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Epoprosténol sodique .................................................................................................................... 0,531 mg
Quantité correspondant à époprosténol ............................................................................................ 0,500 mg
Pour un flacon.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre et solvant pour solution injectable.
4. DONNEES CLINIQUES
4.1. Indications thérapeutiques
Flolan est indiqué dans le traitement au long cours, en perfusion continue, de l'hypertension artérielle pulmonaire (HTAP):
· hypertension artérielle pulmonaire idiopathique - familiale ou sporadique,
· hypertension artérielle pulmonaire associée à une collagénose systémique.
Chez les patients en stade clinique fonctionnel III ou IV (de l'échelle de sévérité de New York Heart Association).
A titre indicatif, avant d'envisager la mise en route d'un traitement au long cours par Flolan, les patients potentiellement répondeurs aux vasodilatateurs oraux pourront être identifiés par un test de vasodilatation en aigu qui sera au mieux réalisé à l'aide du monoxyde d'azote par voie inhalée.
Flolan ne doit être prescrit que dans des services spécialisés en pneumologie disposant d'une unité de soins intensifs et d'une unité d'exploration cardiologiqueinvasive afin d'assurer un bilan spécialisé et la surveillance par une équipe formée à la prise en charge des patients atteints d'hypertension artérielle pulmonaire et à l'utilisation de Flolan.
4.2. Posologie et mode d'administration
Posologie préconisée chez l'adulte:
· Test de vasodilatation en aigu:
Ce test n'a pour seul intérêt que de dépister les patients répondeurs aux vasodilatateurs oraux (tels que les inhibiteurs calciques) et en aucun cas les répondeurs à l'époprosténol en administration au long cours (dont l'indication ne se justifie que chez des sujets non répondeurs au test en aigu). Il peut aisément être remplacé par un test au monoxyde d'azote (NO) inhalé, plus simple et sans retentissement systémique.
Le produit pourra être administré soit par voie périphérique soit par voie centrale.
La perfusion sera débutée à raison de 2 ng/kg/min, puis augmentée par paliers de 2 ng/kg/min toutes les 15 minutes ou moins fréquemment, jusqu'à l'apparition d'effets pharmacologiques limitants dont les plus fréquents sont des nausées, des vomissements, des céphalées, une hypotension ou une tachycardie.
A titre indicatif, au cours des essais cliniques, la dose maximale administrée en aigu n'entraînant pas de tels effets a été en moyenne de 8,6 ± 0,3 ng/kg/min.
· Perfusion continue au long cours:
Pour une perfusion au long cours, le produit dilué sera administré au moyen d'un cathéter veineux central. Le débit de perfusion d'époprosténol sera ajusté sous contrôle médical.
o Dose initiale:
La perfusion sera débutée à raison de 1 ng/kg/min puis augmentée par palier de 1 ng/kg/min toutes les 12 à 24 heures selon la tolérance, jusqu'à une posologie de 10 ng/kg/min. La posologie sera ensuite augmentée de 1 ng/kg/min tous les 15 jours jusqu'à la dose de 16 ng/kg/min.
o Ajustement des doses perfusées lors du traitement au long cours:
Les doses d'époprosténol seront augmentées en fonction des récidives ou des aggravations des symptômes de l'hypertension artérielle pulmonaire, sur l'objectivation d'une baisse de la tolérance à l'exercice sur les tests de marche (6 min) répétés et sur les paramètres hémodynamiques.
La survenue d'évènements indésirables liés à un surdosage devra faire envisager la diminution de doses d'époprosténol.
o Modalités et conditions d'augmentation de la dose lors de la perfusion au long cours:
Les symptômes de l'hypertension artérielle pulmonaire peuvent revenir graduellement en cours de traitement. En général, ils répondent bien à de faibles augmentations de dose d'époprosténol.
Lorsque les signes d'hypertension artérielle pulmonaire se majorent, la dose perfusée sera augmentée par paliers de 1 ng/kg/min en respectant des intervalles de temps suffisamment longs (1 à 4 semaines) pour permettre l'évaluation de la réponse clinique.
Les débits de perfusion doivent être réévalués à intervalles réguliers. A titre indicatif, lors des essais cliniques, l'augmentation de la dose a été en moyenne de 1 ng/kg/min par mois, mais la variabilité était considérable.
o Modalités et conditions de diminution de la dose lors de la perfusion au long cours:
La survenue de signes cliniques témoignant d'un surdosage ou d'une élévation trop importante du débit cardiaque (dyspnée, fatigue, perte de poids, tachycardie, vomissements…) peut obliger à réduire la dose d'époprosténol perfusé. Ce phénomène disparaît parfois sans ajustement de posologie et il est souvent difficile de différencier ces symptômes de signes évoquant une insuffisance de traitement, d'où la nécessité d'une surveillance clinique et hémodynamique.
La diminution de dose doit se faire progressivement, par paliers de 2 ng/kg/min, toutes les 15 minutes ou plus, jusqu'à disparition des effets limitants en rapport avec la dose administrée.
|
La diminution de dose doit se faire progressivement par paliers.
L'interruption brusque de la perfusion d'époprosténol ou une réduction importante et/ou brutale du débit de perfusion doivent être évitées en raison du risque de survenue d'effet rebond pouvant menacer le pronostic vital.
|
· Utilisation chez le sujet âgé:
Les études cliniques menées avec Flolan n'ont pas inclu un effectif suffisant de patients âgés de plus de 65 ans pour déterminer si, chez eux, l'efficacité et la tolérance de Flolan différaient de celles observées chez des sujets plus jeunes.
Néanmoins, dans cette population, le choix d'une posologie doit être prudent, en raison d'un plus grand risque de dysfonctionnement hépatique, rénal, cardiaque, ainsi que de pathologies ou de traitements associés.
Chez l'enfant: en l'absence de donnée suffisante concernant le traitement de l'HTAP de l'enfant par Flolan, il appartient au médecin de peser le bénéfice escompté du traitement par Flolan et le risque encouru par le patient en l'absence de ce traitement.
Chez le nouveau né: en l'absence de donnée suffisante concernant le traitement du nouveau né par Flolan, il appartient au médecin de peser le bénéfice escompté de Flolan face au risque encouru par le patient en l'absence de ce traitement et aux alternatives thérapeutiques existantes.
Mode d'administration:
Perfusion intraveineuse.
Pour une perfusion intraveineuse au long cours, Flolan sera administré via un cathéter central à l'aide d'une pompe pour perfusion ambulatoire.
· La pompe ambulatoire doit:
o être de petite taille et de faible poids;
o permettre des ajustements de débit par palier de 1 ng/kg/min;
o posséder une alarme pour les obstructions, les fins de perfusion et le déchargement de la pile;
o permettre une précision d'au moins 6 % par rapport au débit programmé;
o fonctionner par pression positive (continue ou pulsatile); l'intervalle entre les poussées ne doit pas dépasser 3 minutes aux débits utilisés pour l'administration de Flolan.
Le réservoir doit être en chlorure de polyvinyle, en polypropylène ou en verre.
A titre indicatif, les pompes à perfusion utilisées au cours des essais cliniques ont été les suivantes: CADD-1 HFX 5 100 (Pharmacia Deltec), Walk-Med 410 C (Medfusion, Inc.) et Auto Syringe AS2F (Baxter Healthcare) et Graseby MS32.
Afin d'éviter d'éventuelles interruptions dans l'administration du médicament, le patient doit pouvoir avoir accès à une pompe de secours et à un matériel pour perfusion intraveineuse.
Les solutions de Flolan ne devant pas être mélangées avec d'autres solutés, un cathéter à plusieurs lumières doit être utilisé si d'autres traitements intraveineux sont administrés régulièrement.
· Préparation d'une solution de Flolan pour perfusion:
Les solutions reconstituées, préparées en temps réel, ne doivent pas être utilisées sur plus de 12 heures lorsqu'elles sont administrées à température ambiante (entre + 15°C et + 25°C). Elles ne doivent pas être exposées à des températures supérieures à 25°C et doivent être maintenues à l'abri de la lumière.
Avant utilisation à température ambiante, les solutions reconstituées de Flolan peuvent être stockées au réfrigérateur entre + 2°C et + 8°C pour une durée qui ne saurait excéder 40 heures. Dans ce cas, elles ne doivent pas être utilisées ensuite sur plus de 8 heures lorsqu'elles sont administrées à température ambiante.
Avant administration, la solution reconstituée sera inspectée. Une décoloration ou la présence de particules doit interdire son administration.
· Calcul du débit de perfusion:
Le débit de perfusion Δ(ml/h) sera calculé au moyen de la formule suivante:
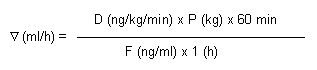
D représente la dose prescrite d'époprosténol exprimée en ng/kg/min.
P représente le poids corporel du patient exprimé en kg.
F représente la concentration d'époprosténol exprimée en ng/ml et calculée sur la base de la formule suivante: F (ng/ml) = Q (ng)/VD(ml) où VD représente le volume de dilution du solvant exprimé en ml et Q la quantité d'époprosténol exprimée en ng.
A titre indicatif, les concentrations (F) d'époprosténol les plus fréquemment utilisées dans le traitement de l'HTAPP sont:
o 10 000 ng/ml = 1 flacon dosé à 0,5 mg d'époprosténol, reconstitué et dilué dans 50 ml;
o 20 000 ng/ml = 2 flacons dosés à 0,5 mg d'époprosténol, reconstitués et dilués dans 50 ml;
o 30 000 ng/ml = 3 flacons dosés à 0,5 mg d'époprosténol ou 1 flacon dosé à 1,5 mg d'époprosténol, reconstitués et dilués dans 50 ml;
o 40 000 ng/ml = 4 flacons dosés à 0,5 mg d'époprosténol ou 1 flacon dosé à 1,5 mg d'époprosténol + 1 flacon dosé à 0,5 mg d'époprosténol, reconstitués et dilués dans 50 ml.
4.3. Contre-indications
Ce médicament est contre-indiqué:
· en cas d'hypersensibilité à l'époprosténol ou à l'un des excipients;
· chez les patients ayant une insuffisance cardiaque congestive due à un dysfonctionnement sévère du ventricule gauche;
· en cas de suspicion de maladie veino-occlusive sur les données de l'anamnèse, de l'examen clinique, de la tomodensitométrie thoracique, et du lavage broncho-alvéolaire, ou en cas de survenue d'un œdème pulmonaire (clinique ou radiologique) lors de la mise en route du traitement par époprosténol.
4.4. Mises en garde spéciales et précautions d'emploi
Conditions d'initiation du traitement :
Le traitement par Flolan sera initié lorsque le diagnostic des pathologies suivantes aura été éliminé au préalable :
· hypertension pulmonaire liée à des pathologies du cœur gauche,
· hypertension pulmonaire secondaire aux maladies respiratoires chroniques et/ou à une hypoxémie,
· hypertension pulmonaire d'origine thromboembolique chronique.
Flolan doit être reconstitué comme indiqué plus haut en utilisant uniquement le solvant stérile d'accompagnement. Ce solvant ne contenant pas de conservateur, il devra être utilisé en une seule fois. Tout solvant inutilisé sera jeté. Flolan ne doit pas être reconstitué ou mélangé avec aucune autre médication ou solution pour usage parentéral.
La décision d'entreprendre un traitement par Flolan doit prendre en considération la probabilité élevée de devoir maintenir le traitement intraveineux pendant une longue période, éventuellement plusieurs années. Ainsi, il convient d'évaluer soigneusement l'aptitude du patient à accepter et surveiller un cathéter et une pompe de perfusion à demeure. Les risques inhérents aux cathéters veineux centraux devront être prévenus et il conviendra de prévoir des précautions d'asepsie strictes lors des manipulations.
Flolan est un puissant vasodilatateur pulmonaire et systémique.
Flolan est un puissant inhibiteur de l'agrégation plaquettaire. Par conséquent, un risque accru de complications hémorragiques devra être pris en considération, en particulier pour les patients ayant d'autres facteurs de risque de saignement (voir rubrique 4.5).
L'ajustement posologique de ce médicament doit se faire dans un milieu doté d'un personnel suffisant et d'équipements nécessaires pour une surveillance intensive et des soins de réanimation adaptés. Après un ajustement de posologie, il est recommandé de surveiller la fréquence cardiaque et la pression artérielle en position debout et couchée pendant plusieurs heures.
L'apparition d'une hypotension excessive pendant l'administration de Flolan nécessite une réduction de la posologie voire l'arrêt de la perfusion. Un surdosage en époprostenol peut induire une hypotension profonde et entraîner une perte de connaissance. La diminution ou l'arrêt du traitement par Flolan devront être réalisés sous surveillance médicale. L'arrêt brutal doit être évité, sauf dans les situations menaçant le pronostic vital (ex : collapsus..). Un arrêt brutal (notamment une panne du système d'administration ou une réduction importante et soudaine des doses de Flolan) peut provoquer un rebond de l'hypertension pulmonaire se manifestant par des étourdissements, une asthénie et une augmentation de la dyspnée, et pouvant conduire au décès.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Associations à prendre en compte
+ Diurétiques, antihypertenseurs ou autres vasodilatateurs tels que les inhibiteurs calciques ou les inhibiteurs de l'enzyme de conversion:
Majoration du risque d'hypotension.
+ Anti-agrégants plaquettaires, anticoagulants ou anti-inflammatoires non stéroïdiens:
Majoration du risque de saignement.
4.6. Grossesse et allaitement
Grossesse
Les études de reproduction réalisées chez le rat et le lapin, en bolus par voie S.C. n'ont pas mis en évidence d'effet tératogène de l'époprosténol, ni d'effet sur la fertilité. Toutefois, aucune étude de reproduction n'a été effectuée en perfusion intraveineuse continue.
Une contraception est préférable pendant le traitement par Flolan.
Chez la femme enceinte, il n'existe pas d'étude adéquate contrôlée. Flolan ne doit être utilisé chez la femme enceinte que si les bénéfices attendus contrebalancent les risques potentiels pour le fœtus.
Travail et accouchement: que ce soit pendant le travail ou l'accouchement par voie vaginale ou par césarienne, l'utilisation de Flolan n'a pas fait l'objet d'études adéquates.
Allaitement
En l'absence de données concernant le passage de Flolan dans le lait maternel, l'allaitement est déconseillé lors du traitement par ce médicament.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Sans objet.
4.8. Effets indésirables
Les effets indésirables rapportés sont classés ci-dessous par classe d'organe. Les fréquences sont définies comme : très fréquent (> 1/10), fréquent (> 1/100, < 1/10), peu fréquent (> 1/1 000, < 1/100), rare (> 1/10 000, < 1/1 000), très rare (< 1/10 000), y compris les cas isolés.
Les évènements mentionnés avec une fréquence indéterminée correspondent à ceux rapportés par notification spontanée depuis la commercialisation.
Infections et infestations
Fréquent : Sepsis, septicémie.
Affections hématologiques et du système lymphatique
Fréquent : Thrombopénies, saignements divers.
Troubles du métabolisme et de la nutrition
Fréquence indéterminée:
Augmentation de la glycémie.
Affections psychiatriques
Fréquent : Anxiété, nervosité.
Fréquence indéterminée : Agitation.
Affections du système nerveux
Très fréquent : Céphalées.
Affections cardiaques
Fréquent : Tachycardie (des cas ont été rapportés en réponse à l'administration d'époprosténol à des doses ≤ à 5 nanogrammes/kg/min).
Bradycardie, parfois accompagnée d'hypotension orthostatique, des cas se sont produits chez des volontaires sains à des doses > à 5 nanogrammes/kg/min.
Hypotension.
Affections vasculaires
Très fréquent : flush facial.
Affections gastro-intestinales
Très fréquent : Nausée, vomissement, diarrhée.
Fréquent : Colique abdominale, parfois rapportée comme une gêne abdominale.
Affections de la peau et du tissu sous-cutané
Fréquent : Eruption cutanée.
Fréquence indéterminé : Photosensibilité.
Affections musculo-squelettiques et systémiques
Très fréquent : Douleur de la mâchoire.
Fréquent : Arthralgie.
Fréquence indéterminée : Douleurs des membres inférieurs.
Troubles généraux et anomalies au site d'administration
Très fréquent : Douleur (site non précisé)
Fréquent : Œdèmes des membres inférieurs souvent associés à une ascite dont l'origine n'est pas toujours clairement établie, douleur thoracique, douleur au site d'injection.
Rare : Infection locale.
Très rare : Oppression thoracique, rougeur au niveau du site d'administration, occlusion du cathéter intraveineux, sensation de lassitude.
Fréquence indéterminée : Syndrome pseudo-grippal, gêne respiratoire, étourdissement, vertige.
4.9. Surdosage
En général, les symptômes d'un surdosage en époprosténol consistent en une exagération des effets pharmacologiques du médicament, à savoir: flush, tachycardie, hypotension, céphalées, nausées, vomissements et diarrhées.
Conduite à tenir: traitement symptomatique et réduction progressive de la posologie de Flolan. Il peut être nécessaire d'interrompre la perfusion de Flolan et d'envisager dans certains cas un remplissage vasculaire et/ou un ajustement du débit de la pompe.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
VASODILATATEURS/AUTRES VASODILATATEURS
(C: SYSTEME CARDIO-VASCULAIRE)
Code ATC: C01D.
L'époprosténol est une prostacycline. Elle a deux actions pharmacologiques principales: vasodilatation directe des lits vasculaires artériels pulmonaires et systémiques, et inhibition de l'agrégation plaquettaire.
Chez l'animal, les effets vasodilatateurs réduisent la post-charge des ventricules droit et gauche tout en augmentant le débit cardiaque et le volume d'éjection systolique. Chez l'animal, l'effet de l'époprosténol sur le rythme cardiaque dépend de la dose. A faible dose, on observe une bradycardie d'origine vagale. Mais à plus fortes doses, il apparaît une tachycardie réflexe en réponse à la vasodilatation directe et à l'hypotension. Il n'a pas été observé d'effet notable sur la conduction cardiaque.
D'autres actions pharmacologiques ont été mises en évidence chez l'animal: bronchodilatation, inhibition de la sécrétion d'acide gastrique et réduction de la vidange gastrique.
Un effet bénéfique du Flolan a pu être observé en pratique clinique dans les hypertensions artérielles pulmonaires associées à un shunt cardiaque gauche-droit, une hypertension portale, une infection par le VIH ou à la prise de certaines substances toxiques et médicamenteuses. Cependant, les données sont limitées pour documenter l'utilisation de Flolan dans ces situations cliniques.
5.2. Propriétés pharmacocinétiques
A pH neutre, l'époprosténol est rapidement hydrolysé dans le sang, tout en subissant une dégradation enzymatique. Les études chez l'animal, à fortes doses, ont montré une clairance élevée (93 ml/min/kg), un faible volume de distribution (357 ml/kg) et une demi-vie très brève (2,7 min). Lors de perfusions chez l'animal, l'état d'équilibre pour les concentrations plasmatiques d'époprosténol au tritium marqué est atteint en 15 minutes; il se prolonge en proportion avec le débit de perfusion.
Il n'existe pas actuellement de méthode de sensibilité et de spécificité suffisante pour évaluer in vivo la pharmacocinétique de l'époprosténol chez l'Homme.
In vitro, la demi-vie de l'époprosténol dans le sang humain est d'environ 6 minutes à la température de 37°C et au pH de 7,4. Sur la base de l'inhibition de l'agrégation plaquettaire, la demi-vie fonctionnelle de l'époprosténol a été évaluée à 10,6 minutes chez l'homme et à 10,8 minutes chez la femme.
De l'époprosténol au tritium marqué a été administré chez l'homme afin d'en identifier les métabolites. L'époprosténol est d'abord transformé en deux métabolites principaux: le 6 -céto-PGF1α (formé par dégradation spontanée) et le 6,15-dicéto-13, 14-dihydro-PGF1α (formé par dégradation enzymatique). Sur les modèles animaux de référence, ces deux métabolites ont une activité pharmacologique inférieure à celle de l'époprosténol. Après une semaine, 82 % et 4 % de la dose radioactive administrée sont retrouvés respectivement dans les urines et dans les fèces. Quatorze autres métabolites mineurs ont été identifiés dans les urines, attestant d'une métabolisation importante de l'époprosténol chez l'homme.
5.3. Données de sécurité préclinique
Pouvoir mutagène: l'époprosténol ne s'est pas montré mutagène lors du test sur micronucléus chez le rat, lors du test d'Ames et du test d'élution de l'A.D.N.
Pouvoir carcinogène: le pouvoir carcinogène du Flolan n'a pas été étudié.
Pouvoir tératogène: l'époprosténol administré par voie sous-cutanée pendant les périodes critiques de l'organogenèse ne s'est pas révélé tératogène chez la rate ou la lapine.
Néanmoins, la durée moyenne de gestation est apparue significativement allongée chez des rates gestantes. La parturition et le nursing des portées n'ont pas été modifiés.
6. DONNEES PHARMACEUTIQUES
6.1. Liste des excipients
Flacon de poudre: glycine, chlorure de sodium, mannitol, hydroxyde de sodium.
Flacon de solvant: glycine, chlorure de sodium, hydroxyde de sodium, eau pour préparations injectables.
6.2. Incompatibilités
La stabilité des solutions de Flolan est pH dépendante. Pour cette raison, Flolan ne doit être reconstitué qu'avec le solvant stérile d'accompagnement. Une fois reconstituées, les solutions de Flolan ne doivent être ni diluées, ni administrées avec d'autres solutions ou médications à usage parentéral.
6.3. Durée de conservation
3 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
La solution reconstituée se conserve 24 heures à une température comprise entre 2°C et 8°C (au réfrigérateur) et à l'abri de la lumière.
Ne pas congeler les solutions reconstituées de Flolan.
Jeter toute solution reconstituée préalablement congelée.
6.5. Nature et contenu de l'emballage extérieur
Poudre en flacon (verre de type I).
50 ml de solvant en flacon (verre de type I).
Filtre.
6.6. Précautions particulières d’élimination et de manipulation
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Laboratoire GLAXOSMITHKLINE
100, route de Versailles
78163 Marly-le-Roi Cedex
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 561 400-8: poudre en flacon (verre) + 1 flacon (verre) de 50 ml de solvant + filtre.
· 562 858-8: poudre en flacon (verre) + 2 flacons (verre) de 50 ml de solvant + filtre.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
11. DOSIMETRIE
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I.
Médicament soumis à prescription hospitalière réservée aux spécialistes et/ou aux services spécialisés en pneumologie ou en cardiologie.