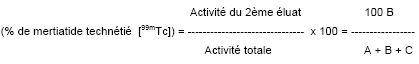

 Résultats
RésultatsRÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 08/07/2009
TECHNESCAN MAG 3, poudre pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Benzoyl mercaptoacétyltriglycine (bétiatide) ........................................................................................... 1 mg
Pour un flacon.
Ce produit ne contient pas d'agent conservateur.
A utiliser avec du pertechnétate (99mTc) de sodium pour la préparation de mertiatide technétié.
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre pour solution injectable.
4.1. Indications thérapeutiques
Ce médicament est à usage diagnostique uniquement.
Le TechneScan MAG3, après reconstitution et marquage par une solution injectable de pertechnétate (99mTc) de sodium, est destiné à l'exploration scintigraphique des troubles néphrologiques et urologiques en particulier lors des études de la perfusion et de la fonction rénale, ou du transit intra rénal et urétéral.
4.2. Posologie et mode d'administration
Adulte: 40 à 200 MBq en fonction de la pathologie à étudier et de la technique utilisée.
Les études de perfusion rénale ou du transit urétéral nécessitent généralement l'administration d'une activité plus élevée que celle utilisée pour les études du transit intra-rénal.
Chez l'enfant, l'activité administrée est une fraction de celle utilisée chez l'adulte, fraction obtenue par application des cfficients ci-dessous en fonction de la masse corporelle selon l'EANM (European Association of Nuclear Medicine):
|
3 kg = 0,1 |
22 kg = 0,50 |
42 kg = 0,78 |
|
4 kg = 0,14 |
24 kg = 0,53 |
44 kg = 0,80 |
|
6 kg = 0,19 |
26 kg = 0,56 |
46 kg = 0,82 |
|
8 kg = 0,23 |
28 kg = 0,58 |
48 kg = 0,85 |
|
10 kg = 0,27 |
30 kg = 0,62 |
50 kg = 0,88 |
|
12 kg = 0,32 |
32 kg = 0,65 |
52-54 kg = 0,90 |
|
14 kg = 0,36 |
34 kg = 0,68 |
56-58 kg = 0,92 |
|
16 kg = 0,40 |
36 kg = 0,71 |
60-62 kg = 0,96 |
|
18 kg = 0,44 |
38 kg = 0,73 |
64-66 kg = 0,98 |
|
20 kg = 0,46 |
40 kg = 0,76 |
68 kg = 0,99 |
Le TechneScan MAG3 est administré par voie intraveineuse.
La scintigraphie est habituellement réalisée immédiatement après l'administration.
Dans certaines indications, l'examen peut nécessiter l'administration d'un diurétique ou d'un inhibiteur de l'enzyme de conversion de l'angiotensine.
Aucune connue à ce jour.
4.4. Mises en garde spéciales et précautions d'emploi
Il est recommandé au patient de boire abondamment avant un examen.
Les produits radiopharmaceutiques ne doivent être manipulés que par un personnel qualifié ayant reçu l'autorisation d'utilisation et de manipulation des radionucléides.
Les produits radiopharmaceutiques ne doivent être réceptionnés, utilisés et administrés que par des personnes autorisées dans les services agréés. Leur réception, leur stockage, leur utilisation, leur transfert et leur élimination sont soumis aux réglementations et aux autorisations appropriées des autorités compétentes.
Les produits radiopharmaceutiques doivent être préparés de façon à satisfaire à la fois aux exigences de sécurité, de radioprotection et de qualité pharmaceutique. Des précautions particulières d'asepsie doivent être prises, conformément aux Bonnes Pratiques de Fabrication des produits pharmaceutiques.
De même que pour l'ortho-iodohippurate, la détermination de l'ERPF (effective renal plasma flow) ou de l'ERBF (effective renal blood flow) à partir des clairances plasmatique ou rénale du TechneScan MAG3 n'a de signification que dans la mesure où la fraction d'extraction rénale du traceur est connue en la circonstance clinique considérée. En effet, cette fraction d'extraction peut varier de manière importante au cours de certaines pathologies (néphropathies diverses, états démateux, hypoalbuminémie notamment) et lors de certaines prises médicamenteuses.
De faibles quantités d'impuretés marquées au technétium-99m peuvent être présentes. La fixation hépatique de ces impuretés, qui s'accumulent dans le parenchyme et sont éliminées par voie biliaire dans l'intestin, est d'autant plus importante que l'insuffisance rénale est avancée. Ceci peut influer la phase finale de la scintigraphie rénale en raison de la superposition partielle du foie et du rein droit (après 30 minutes).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Le mertiatide technétié ne présente pas d'interaction connue avec les médicaments habituellement prescrits aux patients qui nécessitent ce type d'examen (par exemple les antihypertenseurs ou les médicaments utilisés pour traiter ou prévenir le rejet de greffes rénales).
L'administration d'un produit de contraste radiologique peut modifier l'excrétion tubulaire rénale et donc influer le transit urinaire du mertiatide technétié.
Une dose unique de diurétique ou d'inhibiteur de l'enzyme de conversion de l'angiotensine est parfois utilisée pour le diagnostic différentiel de certaines maladies néphrologiques ou urologiques.
Lorsqu'il est nécessaire d'administrer un produit radioactif à des femmes en âge de procréer, toute suspicion de grossesse doit être écartée. Toute femme n'ayant pas eu ses règles doit être considérée comme enceinte jusqu'à preuve du contraire. Dans le doute, il est important que l'exposition aux radiations soit réduite au minimum pour obtenir les informations cliniques souhaitées. D'autres techniques alternatives n'impliquant pas l'emploi de radiations ionisantes devraient être envisagées.
Les examens utilisant des radionucléides chez la femme enceinte entraînent également l'irradiation du ftus. Il ne faut réaliser au cours de la grossesse que les seules investigations absolument nécessaires lorsque le bénéfice probable dépasse les risques encourus par la mère et le ftus.
Avant d'administrer un produit radiopharmaceutique à une mère souhaitant poursuivre l'allaitement maternel, il convient d'estimer si l'examen peut être différé jusqu'à la fin de l'allaitement et si le choix des radiopharmaceutiques est le plus approprié gardant à l'esprit que le produit est excrété dans le lait maternel. Si l'administration du produit est vraiment nécessaire, le lait sera tiré avant l'injection et conservé pour être utilisé ultérieurement. L'allaitement doit être suspendu pendant au moins 8 heures après l'injection et le lait produit pendant cette période doit être éliminé. L'allaitement peut être repris lorsque l'activité dans le lait ne risque pas d'entraîner une dose de radiation pour l'enfant supérieure à 1 mSv.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Aucun effet connu à ce jour.
Quelques réactions anaphylactiques classées de généralement légères à rarement sévères ont été rapportées. Bien que la probabilité de ce type de réaction soit faible, 0,0003 %, on doit disposer d'adrénaline, de corticostéroïdes et d'antihistaminiques.
Des réactions vagales de faible intensité ont occasionnellement été rapportées.
Pour chaque patient, l'exposition aux rayonnements ionisants doit être justifiée par le bénéfice attendu. L'activité administrée doit être telle que la dose absorbée qui en découle soit aussi faible que possible, en gardant à l'esprit la nécessité d'obtenir le diagnostic recherché.
L'exposition aux rayonnements ionisants peut potentiellement induire des cancers ou développer des anomalies héréditaires. L'expérience montre que pour les examens diagnostiques de médecine nucléaire, la fréquence des effets secondaires est très faible en raison des faibles activités utilisées.
Pour la plupart des examens de médecine nucléaire à des fins de diagnostic, la dose de radiation délivrée (DE: dose efficace) est inférieure à 20 mSv. Des doses plus élevées peuvent être justifiées dans certaines circonstances.
En cas de surdosage de mertiatide technétié (99mTc), la dose délivrée au patient peut être diminuée en favorisant l'élimination du radionucléide par augmentation de la diurèse avec mictions fréquentes.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique: Produit radiopharmaceutique à usage diagnostique, Code ATC: V09BA03.
Aux concentrations envisagées, le mertiatide technétié n'a pas d'action pharmacodynamique connue.
Le produit est éliminé dans les urines en fonction du flux sanguin, de l'excrétion et du temps de transit tubulaires de chacun des deux reins.
5.2. Propriétés pharmacocinétiques
Après injection intraveineuse, (99mTc) MAG3 est rapidement éliminé du sang par le rein. Le (99mTc) MAG3 a une fixation relativement forte aux protéines plasmatiques (66 %). Lorsque la fonction rénale est normale, 70 % de l'activité administrée est excrétée après 30 minutes, plus de 95 % après 3 heures. Ces pourcentages sont modifiés en cas de pathologies rénales et/ou urologiques. L'excrétion se fait de façon prédominante par sécrétion tubulaire, la filtration glomérulaire ne représentant que 10 % de la clairance totale.
5.3. Données de sécurité préclinique
Des études de toxicité aiguë, subaiguë (8 jours) et chronique (13 semaines) ainsi que des études de mutagénicité ont été réalisées. Aux concentrations étudiées, allant jusqu'à 1000 fois la concentration humaine maximale, aucun effet toxique n'a été observé. De même, il n'a pas été rapporté d'effet mutagène.
Chlorure stanneux, tartrate disodique.
Aucune connue à ce jour.
Cependant, afin de ne pas compromettre la stabilité du mertiatide technétié, les préparations ne devront pas être administrées en même temps que d'autres médicaments par voie intraveineuse et/ou qu'une nutrition parentérale.
1 an à partir de la date de fabrication pour la poudre lyophilisée.
Après marquage, le TechneScan MAG3 est stable pendant 4 heures sous un volume de 10 mL, ou 1 heure sous un volume de 4 mL.
6.4. Précautions particulières de conservation
La trousse et la solution marquée doivent être conservées entre +2ºC et +8ºC.
6.5. Nature et contenu de l'emballage extérieur
Flacon multidose de 10 mL en verre de type I (Ph. Eur.) fermé par un bouchon en bromobutyle et serti par une capsule d'aluminium.
Boîte de 5 flacons.
6.6. Précautions particulières délimination et de manipulation
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en rigueur.
7. TITULAIRE DE LAUTORISATION DE MISE SUR LE MARCHE
COVIDIEN IMAGING FRANCE
2, rue Diderot
La Clef de Saint Pierre
78990 ELANCOURT
8. NUMERO(S) DAUTORISATION DE MISE SUR LE MARCHE
· 556 933-1: 18 mg de poudre lyophilisée en flacons de 10 mL (verre) - boîte de 5 flacons.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE LAUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
Selon la CIPR 80, les doses absorbées (calculées selon la méthode MIRD) sont estimées pour une fonction rénale et des voies urinaires normales.
Fonction rénale normale
99mTc-MAG3 Doses absorbées par unité d'activité administrée (mGy/MBq)
|
Organe |
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Surrénales |
3,9E-04 |
5,1E-04 |
8,2E-04 |
1,2E-03 |
2,5E-03 |
|
Vessie |
1,1E-01 |
1,4E-01 |
1,7E-01 |
1,8E-01 |
3,2E-01 |
|
Surf. osseuses |
1,3E-03 |
1,6E-03 |
2,1E-03 |
2,4E-03 |
4,3E-03 |
|
Cerveau |
1,0E-04 |
1,3E-04 |
2,2E-04 |
3,5E-04 |
6,1E-04 |
|
Seins |
1,01E-04 |
1,4E-04 |
2,4E-04 |
3,9E-04 |
8,2E-04 |
|
Vésicule |
5,7E-04 |
8,7E-04 |
2,0E-03 |
1,7E-03 |
2,8E-03 |
|
Tube digestif |
|
||||
|
Paroi gastrique |
3,9E-04 |
4,9E-04 |
9,7E-04 |
1,3E-03 |
2,5E -03 |
|
Intestin grêle |
2,3E-03 |
3,0E-03 |
4,2E-03 |
4,6E -03 |
7,8E -03 |
|
Côlon |
3,4E-03 |
4,3E-03 |
5,9E-03 |
6,0E -03 |
9,8E -03 |
|
(Côlon supérieur |
1,7E-03 |
2,3E-03 |
3,4E-03 |
4,0E -03 |
6,7E -03 |
|
(Côlon inférieur |
5,7E-03 |
7,0E-03 |
9,2E-03 |
8,7E -03 |
1,4E -02 |
|
|
|||||
|
Cur |
1,8E-04 |
2,4E-04 |
3,7E-04 |
5,7E -04 |
1,2E -03 |
|
Reins |
3,4E-03 |
4,2E-03 |
5,9E-03 |
8,4E -03 |
1,5E -02 |
|
Foie |
3,1E-04 |
4,3E-04 |
7,5E-04 |
1,1E -03 |
2,1E -03 |
|
Poumons |
1,5E-04 |
2,1E-04 |
3,3E-04 |
5,0E -04 |
1,0E -03 |
|
Muscles |
1,4E-03 |
1,7E-03 |
2,2E-03 |
2,4E -03 |
4,1E -03 |
|
|
|||||
|
sophage |
1,3E-04 |
1,8E-04 |
2,8E-04 |
4,4E -04 |
8,2E -04 |
|
Ovaires |
5,4E-03 |
6,9E-03 |
8,7E-03 |
8,7E -03 |
1,4E -02 |
|
Pancréas |
4,0E-04 |
5,0E-04 |
9,3E-04 |
1,3E -03 |
2,5E -03 |
|
Moelle osseuse |
9,3E-04 |
1,2E-03 |
1,6E-03 |
1,5E -03 |
2,1E -03 |
|
Peau |
4,6E-04 |
5,7E-04 |
8,3E-04 |
9,7E -04 |
1,8E -03 |
|
|
|||||
|
Rate |
3,6E-04 |
4,9E-04 |
7,9E-04 |
1,2E -03 |
2,3E -03 |
|
Testicules |
3,7E-03 |
5,3E-03 |
8,1E-03 |
8,7E -03 |
1,6E -02 |
|
Thymus |
1,3E-04 |
1,8E-04 |
2,8E-04 |
4,4E -04 |
8,2E -04 |
|
Thyroïde |
1,3E-04 |
1,6E-04 |
2,7E-04 |
4,4E -04 |
8,2E -04 |
|
Utérus |
1,2E-02 |
1,4E-02 |
1,9E-02 |
1,9E -02 |
3,1E -02 |
|
Autres organes |
1,3E-03 |
1,6E-03 |
2,1E-03 |
2,2E -03 |
3,6E -03 |
|
Dose efficace (mSv/MBq) |
|
|
|
|
|
|
Vidange 2 heures après admin |
7,0E-03 |
9,0E-03 |
1,2E-02 |
1,2E -02 |
2,2E -02 |
|
1 heure après admin |
2,5E-03 |
3,1E-03 |
4,5E-03 |
6,4E -03 |
6,4E -03 |
|
30 minutes après admin |
1,7E-03 |
2,1E-03 |
2,9E-03 |
3,9E -03 |
6,8E -03 |
Les parois de la vessie contribuent jusqu'à 80 % de la dose efficace.
La dose efficace résultant de l'administration d'une activité de 200 MBq à un individu de 70 kg est de 1,4 mSv, quand la vessie est vidée 2 heures après l'administration.
Fonction rénale anormale
(10% de la fonction normale)
99mTc-MAG3 Doses absorbées par unité d'activité administrée (mGy/MBq)
|
Organe |
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Surrénales |
1,6E-03 |
2,1E-03 |
3,2E-03 |
4,8E-03 |
8,6E-03 |
|
Vessie |
8,3E-02 |
1,1E-01 |
1,3E-01 |
1,3E-01 |
2,3E-01 |
|
Surf. osseuses |
2,2E-03 |
2,7E-03 |
3,8E-03 |
5,0E-03 |
9,1E-03 |
|
Cerveau |
6,1E-04 |
7,7E-04 |
1,3E-03 |
2,0E-03 |
3,6E-03 |
|
Seins |
5,4E-04 |
7,0E-04 |
1,1E-03 |
1,7E-03 |
3,2E-03 |
|
Vésicule |
1,6E-03 |
2,2E-03 |
3,8E-03 |
4,6E-03 |
6,4E-03 |
|
Tube digestif |
|
|
|
|
|
|
Paroi gastrique |
1,2E-03 |
1,5E-03 |
2,6E-03 |
3,5E-03 |
6,1E-03 |
|
Intestin grêle |
2,7E-03 |
3,5E-03 |
5,0E-03 |
6,0E-03 |
1,0E-02 |
|
Côlon |
3,5E-03 |
4,4E-03 |
6,1E-03 |
6,9E-03 |
1,1E-02 |
|
(Côlon supérieur |
2,2E-03 |
3,0E-03 |
4,3E-03 |
5,6E-03 |
9,3E-03) |
|
(Côlon inférieur |
5,1E-03 |
6,3E-03 |
8,5E-03 |
8,6E -03 |
1,4E -02) |
|
|
|||||
|
Cur |
9,1E-04 |
1,2E-03 |
1,8E-03 |
2,7E -03 |
4,8E -03 |
|
Reins |
1,4E-02 |
1,7E-02 |
2,4E-02 |
3,4E -02 |
5,9E -02 |
|
Foie |
1,4E-03 |
1,8E-03 |
2,7E-03 |
3,8E -03 |
6,6E -03 |
|
Poumons |
7,9E-04 |
1,1E-03 |
1,6E-03 |
2,4E -03 |
4,5E -03 |
|
Muscles |
1,7E-03 |
2,1E-03 |
2,9E-03 |
3,6E -03 |
6,4E -03 |
|
|
|||||
|
sophage |
7,4E-04 |
9,7E-04 |
1,5E-03 |
2,3E -03 |
4,1E -03 |
|
Ovaires |
4,9E-03 |
6,3E-03 |
8,1E-03 |
8,7E -03 |
1,4E -02 |
|
Pancréas |
1,5E-03 |
1,9E-03 |
2,9E-03 |
4,3E -03 |
7,4E -03 |
|
Moelle osseuse |
1,5E-03 |
1,9E-03 |
2,6E-03 |
3,1E -03 |
5,0E -03 |
|
Peau |
7,8E-04 |
9,6E-04 |
1,5E-03 |
2,0E -03 |
3,8E -03 |
|
|
|||||
|
Rate |
1,5E-03 |
1,9E-03 |
2,9E-03 |
4,3E -03 |
7,4E -03 |
|
Testicules |
3,4E-03 |
4,7E-03 |
7,1E-03 |
7,8E -03 |
1,4E -02 |
|
Thymus |
7,4E-04 |
9,7E-04 |
1,5E-03 |
2,3E -03 |
4,1E -03 |
|
Thyroïde |
7,3E-04 |
9,5E-04 |
1,5E-03 |
2,4E -03 |
4,4E -03 |
|
Utérus |
1,0E-02 |
1,2E-02 |
1,6E-02 |
1,6E -02 |
2,7E -02 |
|
Autres organes |
1,7E-03 |
2,1E-03 |
2,8E-03 |
3,4E -03 |
6,0E -03 |
|
Dose efficace (mSv/MBq) |
6,1E-03 |
7,8E-03 |
1,0E-02 |
1,1E-02 |
1,9E-02 |
La dose efficace résultant de l'administration d'une activité de 200 MBq à un individu de 70 kg est de 1,22 mSv, quand la vessie est vidée 2 heures après l'administration.
Obstruction aigue unilatérale
99mTc-MAG3 Doses absorbées par unité d'activité administrée (mGy/MBq)
|
Organe |
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Surrénales |
1,1E-02 |
1,4E-02 |
2,2E-02 |
3,2E-02 |
5,5E-02 |
|
Vessie |
5,6E-02 |
7,1E-02 |
9,1E-02 |
9,3E-02 |
1,7E-01 |
|
Surfaces osseuses |
3,1E-03 |
4,0E-03 |
5,8E-03 |
8,4E-03 |
1,7E-02 |
|
Cerveau |
1,1E-04 |
1,4E-04 |
2,3E-04 |
3,9E-04 |
7,5E-04 |
|
Seins |
3,8E-04 |
5,1E-04 |
1,0E-03 |
1,6E-03 |
3,0E-03 |
|
Vésicule |
6,2E-03 |
7,3E-03 |
1,0E-02 |
1,6E-02 |
2,3E-02 |
|
Tube digestif |
|
||||
|
Paroi gastrique |
3,9E-03 |
4,4E-03 |
7,0E-03 |
9,3E-03 |
1,2E-02 |
|
Intestin grêle |
4,3E-03 |
5,5E-03 |
8,5E-03 |
1,2E-02 |
1,9E-02 |
|
Côlon |
3,9E-03 |
5,0E-03 |
7,2E-03 |
9,2E-03 |
1,5E-03 |
|
(Côlon supérieur |
4,0E-03 |
5,1E-03 |
7,6E-03 |
1,0E-02 |
1,6E-02) |
|
(Côlon inférieur |
3,8E-03 |
4,8E-03 |
6,7E-03 |
8,2E-03 |
1,3E-02) |
|
|
|||||
|
Cur |
1,3E-03 |
1,6E-03 |
2,7E-03 |
4,0E-03 |
6,1E-03 |
|
Reins |
2,0E-01 |
2,4E-01 |
3,3E-01 |
4,7E-01 |
8,1E-01 |
|
Foie |
4,4E-03 |
5,4E-03 |
8,1E-03 |
1,1E-02 |
1,7E-02 |
|
Poumons |
1,1E-03 |
1,6E-03 |
2,5E-03 |
3,9E-03 |
7,2E-03 |
|
Muscles |
2,2E-03 |
2,7E-03 |
3,7E-03 |
5,1E-03 |
8,9E-03 |
|
|
|||||
|
sophage |
3,8E-04 |
5,4E-04 |
8,5E-04 |
1,5E-03 |
2,3E-03 |
|
Ovaires |
3,8E-03 |
5,1E-03 |
7,1E-03 |
9,2E-03 |
1,5E-02 |
|
Pancréas |
7,4E-03 |
9,0E-03 |
1,3E-02 |
1,8E-02 |
2,9E-02 |
|
Moelle osseuse |
3,0E-03 |
3,6E-03 |
5,0E-03 |
6,0E-03 |
8,3E-03 |
|
Peau |
8,2E-04 |
1,0E-03 |
1,5E-03 |
2,2E-03 |
4,2E-03 |
|
|
|||||
|
Rate |
9,8E-03 |
1,2E-02 |
1,8E-02 |
2,6E-02 |
4,0E-02 |
|
Testicules |
2,0E-03 |
2,9E-03 |
4,5E-03 |
5,0E-03 |
9,8E-03 |
|
Thymus |
3,8E-04 |
5,4E-04 |
8,5E-04 |
1,5E-03 |
2,3E-03 |
|
Thyroïde |
1,7E-04 |
2,3E-04 |
4,5E-04 |
9,2E-04 |
1,6E-03 |
|
Utérus |
7,2E-03 |
8,7E-03 |
1,2E-02 |
1,3E-02 |
2,2E-02 |
|
|
|||||
|
Autres organes |
2,1E-03 |
2,6E-03 |
3,6E-03 |
4,7E-03 |
8,0E-03 |
|
|
|||||
|
Dose Efficace (mSv/MBq) |
1,0E-02 |
1,2E-02 |
1,7E-02 |
2,2E-02 |
3,8E-02 |
La dose efficace résultant de l'administration d'une activité de 200 MBq à un individu de 70 kg est de 2 mSv, quand la vessie est vidée 2 heures après l'administration.
PEDIATRIE
Estimation dose d'irradiation d'après le CIPR 30: doses absorbées en mGy/MBq
|
Organe |
Nouveau-né |
1 an |
5 ans |
10 ans |
15 ans |
Adulte |
|
Reins |
0,041 |
0,016 |
0,0097 |
0,0067 |
0,0049 |
0,0041 |
|
Ovaires |
0,013 |
0,0069 |
0,0083 |
0,0058 |
0,0085 |
0,0067 |
|
Surf. osseuses |
0,0053 |
0,0027 |
0,0022 |
0,0015 |
0,0019 |
0,0015 |
|
Moelle osseuse |
0,0027 |
0,0014 |
0,0015 |
0,0011 |
0,0015 |
0,0011 |
|
Testicules |
0,014 |
0,0078 |
0,0082 |
0,0054 |
0,0066 |
0,0046 |
|
Paroi vésicale |
0,37 |
0,15 |
0,17 |
0,11 |
0,17 |
0,14 |
|
Dose Efficace (mSv/MBq) |
0,032 |
0,014 |
0,015 |
0,010 |
0,015 |
0,012 |
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
1. Le contenu du flacon doit être marqué avec une solution injectable de pertechnétate de sodium, Pharmacopée Européenne. Après reconstitution par une solution de pertechnétate de sodium, le mertiatide technétié (99mTc) est obtenu après ébullition.
2. Pour le marquage, utiliser un éluat d'une concentration radioactive la plus élevée possible, car la formation d'impuretés marquées est d'autant plus faible que le volume de l'éluat est faible. De plus, seuls les éluats obtenus à partir d'un générateur de (99mTc) en service depuis moins d'une semaine doivent être utilisés. Il est également recommandé d'utiliser les éluats obtenus à partir d'un générateur de (99mTc) ayant été élué une fois au cours des précédentes 24 heures.
3. La dilution de la préparation doit être faite avec une solution injectable isotonique de NaCl. Après reconstitution et marquage, la solution pourra être utilisée pour une ou plusieurs administrations.
Mode de marquage
Utiliser une solution de pertechnétate (99mTc) de sodium fraîchement éluée (moins d'une heure).
Utiliser un volume d'éluat de 3 mL. L'activité choisie de (99mTc) (maximum 1100 MBq), doit être diluée sous un volume de 10 mL avec du soluté injectable de chlorure de sodium à 0,9 pour cent. Ajouter ce volume au contenu d'un flacon de TechneScan MAG3. Utiliser une aiguille fine (G 20 ou plus) pour empêcher l'entrée d'eau dans le flacon au cours des étapes de chauffage et de refroidissement.
Placer immédiatement pendant 10 minutes dans de l'eau bouillante.
Pendant le chauffage, vérifier que le flacon reste en position verticale pour éviter que des traces de métaux provenant du bouchon en caoutchouc n'altèrent la qualité du marquage.
Refroidir le flacon à température ambiante dans de l'eau froide. La préparation est alors prête pour l'injection.
La préparation marquée au (99mTc) peut être utilisée jusqu'à quatre heures après la fin de l'étape de chauffage. Au-delà de quatre heures, une pureté radiochimique de 95 pour cent ne peut plus être garantie.
Pour obtenir une préparation plus concentrée, utiliser 1 mL d'éluat (activité maximale 925 MBq) et diluer sous un volume de 4 mL avec du soluté injectable de chlorure de sodium à 0,9 pour cent. La technique de marquage à suivre est ensuite identique à celle indiquée ci-dessus. Cette préparation n'est stable qu'une heure après la fin de l'étape de chauffage.
Précautions lors du marquage
Pour vérifier qu'il n'y a pas contamination du contenu du flacon pendant le chauffage et le refroidissement de la préparation, il est recommandé d'ajouter au bain marie un indicateur coloré (bleu de méthylène à 1% ou fluorescéine à 0,1 %).
Utiliser une protection contre les rayonnements ionisants.
Mode de contrôle qualité
Méthode HPLC
La pureté radiochimique de la substance marquée est vérifiée par chromatographie liquide haute performance (HPLC) en utilisant un détecteur de radioactivité adapté, une colonne chrompack Lischrosorb 10 RP 18 (ou équivalent) de 25 cm et un débit de 1 mL/minute.
On utilise 2 phases mobiles: la phase A est un mélange éthanol/ tampon phosphate et la phase B est constituée de méthanol à 90%.
Préparation de la phase A: Mélanger 1000 mL de phosphate monosodique 0,01 M; 114 mL de phosphate disodique 0,01 M; ajuster le pH de cette solution à 6 avec l'une ou l'autre des solutions phosphates. Mélanger 950 mL de cette solution à 50 mL d'éthanol. Filtrer et dégazer.
Préparation de la phase B: Mélanger 900 mL de méthanol et 100 mL d'eau. Filtrer et dégazer.
Utiliser un gradient d'élution selon les paramètres suivants:
|
Temps (en min) |
Débit (mL/min) |
% A |
% B |
|
10 |
1 |
100 |
0 |
|
7 |
1 |
0 |
100 |
|
4 |
2 |
100 |
0 |
Le pic de mertiatide technétié apparaît à la fin du passage de la phase mobile A.
Injecter 5 μl d'échantillon. Suivre le programme d'élution. Le pourcentage de coups totaux par canal ne doit pas excéder 30 000/mn.
Normes
|
|
T = 0 |
Après 4 heures |
|
Mertiatide |
≥96,0 % |
≥95,0 % |
|
Fraction totale avant mertiatide |
≤3,0 % |
≤3,0 % |
|
Fraction méthanolique lipophile |
≤4,0 % |
≤4,0 % |
Méthode simplifiée
Matériel
1 Colonne d'alumine (SEP PAK C18 de WATERS ou équivalent)
2 Ethanol absolu
3 Solution d'acide chlorhydrique 0.001 M
4 Tampon phosphate 0,01 M; pH 6
5 Seringues jetables: 10 mL (sans aiguille), 1 mL (avec aiguille).
6 Tubes ou flacons jetables (capacité: 15 mL minimum)
7 Activimètre.
Préparation des colonnes SEP PAK
1 Utiliser une seringue de 10 mL, pousser 10 mL d'éthanol absolu jusqu'à l'imprégnation complète de la colonne, puis 10 mL d'acide chlorhydrique 0,001 M. Jeter l'éluat.
2 Purger la colonne en poussant 5 mL d'air à travers la colonne avec la seringue. Jeter l'éluat.
Analyse des échantillons
1 Déposer 0,1 mL de solution injectable de mertiatide technétié (99mTc) sur le haut de la colonne puis éluer avec 5 mL d'acide chlorhydrique 0,001 M et recueillir l'éluat.
Attention: la colonne et toute solution éluée à partir de cette étape seront radioactives.
2 Eluer avec 5 mL de tampon phosphate (0,01 M; pH 6) contenant 0.5 % d'éthanol et ajouter l'éluat au premier éluat obtenu. On obtient la somme des impuretés hydrophiles (fraction A).
3 Pousser avec une seringue jetable 10 mL de tampon phosphate pH 6 contenant 7 % d'éthanol, afin qu'il traverse toute la colonne. S'assurer que cette solution est poussée lentement à travers la colonne de telle sorte que l'élution se réalise goutte à goutte.
4 Recueillir l'éluat qui contient le mertiatide technétié (99mTc) dans un tube ou un flacon pour comptage (fraction B).
5 Eluer lentement de la même façon, la colonne avec 10 mL d'éthanol absolu. Ce troisième éluat contient les impuretés lipophiles (fraction C).
Comptage
1. Compter l'activité du second éluat. Cette fraction B contient le complexe mertiatide technétié (99mTc)
2. Compter l'activité de la première élution. Cette fraction A contient les impuretés hydrophiles
3. Compter l'activité de la troisième élution qui contient les impuretés lipophiles (fraction C).
4. La radioactivité de l'ensemble A+B+C est de 100%.
Calculs
1. Pureté radiochimique
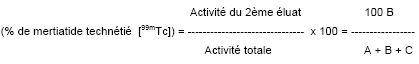

 Résultats
Résultats
Les résultats doivent respecter les spécifications suivantes:
(99mTc) MAG 3 (B) ≥ 90 %
Composants hydrophiles (A) ≤ 5 %
Impuretés lipophiles (C) ≤ 5 %
Propriété du produit marqué
Solution aqueuse, limpide ou légèrement opalescente, incolore
|
pH |
5,0 - 6,0 |
|
rendement de marquage |
≥ 95 % |
L'administration de produits radiopharmaceutiques présente des risques pour l'entourage du patient en raison de l'irradiation externe ou de la contamination par les urines, les vomissements, les expectorations. Par conséquent, il faut prendre les mesures de protection contre les radiations conformément aux réglementations nationales.
Mode de destruction des déchets
Le technétium (99mTc) ou le TechneScan MAG3 non utilisé doivent être stockés pour décroissance jusqu'à un niveau d'activité tel que, selon les réglementations nationales, les produits ne soient plus considérés comme radioactifs. Ils peuvent alors être éliminés avec les déchets ordinaires. Les flacons de TechneScan MAG3 non marqué peuvent être considérés comme des déchets ordinaires.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Liste I.
Médicament réservé à l'usage hospitalier.
Les produits radiopharmaceutiques ne doivent être utilisés que par des personnes qualifiées. Ils ne peuvent être délivrés qu'à des praticiens ayant obtenu l'autorisation spéciale prévue à l'article R 1333-24 du Code de la Santé Publique.