RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 14/10/2009
ZOFENILDUO 30 mg/12,5 mg, comprimé pelliculé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Zofénopril calcique ......................................................................................................................... 30,00 mg
Hydrochlorothiazide ....................................................................................................................... 12,50 mg
Pour un comprimé pelliculé.
Pour la liste complète des excipients, voir rubrique 6.1.
Comprimé pelliculé.
Comprimé rouge pâle, rond, légèrement biconvexe, portant une barre de sécabilité sur une des faces.
4.1. Indications thérapeutiques
Traitement de l'hypertension essentielle légère à modérée.
Cette association à dose fixe est indiquée chez les patients dont la pression artérielle n'est pas suffisamment contrôlée avec le Zofénopril seul.
4.2. Posologie et mode d'administration
Cas général
ZOFENILDUO 30 mg/12,5 mg comprimé pelliculé doit être utilisé à raison d'une seule prise par jour au moment ou en dehors des repas.
Il est recommandé, avant de passer à l'association à dose fixe, d'augmenter progressivement les doses des deux composants individuellement (c'est à dire le zofénopril et l'hydrochlorothiazide).
Si cela s'avère utile d'un point de vue clinique, il pourra être envisagé de passer directement d'un traitement en monothérapie à l'association fixe.
En cas de difficulté à avaler des comprimés, les comprimés pourront être fractionnés en deux et chaque moitié avalée l'une après l'autre au moment prescrit.
Adultes (de 18 à 65 ans)
Patients ne présentant pas de déplétion hydrosodée
La posologie habituelle efficace est de un comprimé par jour.
Patients susceptibles d'avoir une déplétion hydrosodée
L'emploi de ZOFENILDUO 30 mg/12,5 mg comprimé pelliculé n'est pas recommandé.
Sujets âgés (au-dessus de 65 ans)
Chez le sujet âgé présentant une clairance de la créatinine normale, aucune adaptation posologique n'est nécessaire.
Chez le sujet âgé présentant une clairance de la créatinine réduite (inférieure à 45 ml/min), l'emploi de ZOFENILDUO 30 mg/12,5 mg comprimé pelliculé n'est pas recommandé.
La clairance de la créatinine peut être calculée à partir des taux de la créatinine sérique à l'aide de la formule de Cockroft-Gault:
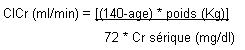
La méthode de calcul indiquée ci-dessus permet de calculer la clairance de la créatinine chez l'homme. Chez la femme, la valeur obtenue doit être multipliée par 0, 85.
Enfants et adolescents (moins de 18 ans)
La tolérance et l'efficacité de ZOFENILDUO 30 mg/12,5 mg comprimé pelliculé n'ont pas été évaluées chez les enfants et les adolescents.
En conséquence, son emploi n'est pas recommandé.
Insuffisants rénaux et patients dialysés
Les patients hypertendus, présentant une insuffisance rénale légère (clairance de la créatinine > 45 ml/min), pourront être traités avec la même posologie. Le schéma d'administration quotidien en une prise par jour pourra être conservé.
Chez les patients présentant une insuffisance rénale modérée à sévère (clairance de la créatinine < 45 ml/min), son emploi n'est pas recommandé (voir rubrique 4.4).
Chez les patients présentant une insuffisance rénale sévère (clairance de la créatinine <30 ml/min) ZOFENILDUO 30 mg/12,5 mg comprimé pelliculé est contre-indiqué (voir rubrique 4.3).
Chez les patients hypertendus sous dialyse, l'utilisation de ZOFENILDUO 30 mg/12,5 mg comprimé pelliculé n'est pas recommandée.
Insuffisants hépatiques
Chez les patients hypertendus présentant une insuffisance hépatique légère à modérée, chez lesquels la dose de 30 mg de Zofénopril seul a été atteinte, le même schéma posologique que celui utilisé chez des patients présentant une fonction hépatique normale, peut être utilisé.
ZOFENILDUO 30 mg/12,5 mg comprimé pelliculé est contre-indiqué chez les patients hypertendus présentant une insuffisance hépatique sévère.
· Deuxième et troisième trimestres de la grossesse (voir rubrique 4.6).
· Allaitement (voir rubrique 4.6).
· Hypersensibilité au zofénopril ou à tout autre IEC.
· Hypersensibilité à l'hydrochlorothiazide ou à tout autre sulfamide.
· Hypersensibilité à l'un des excipients.
· Antécédent d'dème de Quincke associé à la prise d'un traitement par un IEC.
· dème angioneurotique héréditaire/idiopathique.
· Atteinte hépatique sévère.
· Atteinte rénale sévère (clairance de la créatinine < 30 ml/min)
· Sténose bilatérale de l'artère rénale ou sténose unilatérale de l'artère rénale en cas de rein unique.
4.4. Mises en garde spéciales et précautions d'emploi
Hypotension: comme avec les autres IEC et diurétiques, une hypotension symptomatique peut être observée chez certains patients.
Elle est davantage susceptible de se produire dans les cas suivants: chez des patients ayant présenté une déplétion hydrosodée lors d'un traitement par des diurétiques, régime hyposodé, dialyse, diarrhée ou vomissements. Une hypotension a été principalement rapportée chez des patients atteints d'insuffisance cardiaque sévère associée ou non à une insuffisance rénale. Ceci est davantage susceptible de se produire avec des fortes doses de diurétiques de l'anse ou chez ceux présentant une hyponatrémie ou une insuffisance rénale. Chez ces patients, le traitement devra être débuté sous contrôle médical, de préférence en milieu hospitalier, avec des doses plus faibles et l'augmentation progressive de la posologie devra être effectuée prudemment.
Cette recommandation vaut également pour les patients souffrant d'angine de poitrine ou de pathologies vasculaires cérébrales chez lesquels une hypotension sévère peut déclencher un infarctus du myocarde ou un accident vasculaire cérébral.
Si une hypotension survient, le patient doit être allongé sur le dos. Une correction de la déplétion volémique avec un soluté isotonique de chlorure de sodium par voie intraveineuse peut s'avérer nécessaire. Une hypotension survenant dès l'instauration du traitement (première dose) n'exclut pas une adaptation posologique ultérieure, à doses progressives, effectuée prudemment avec chacun des principes actifs du médicament, une fois que l'incident a été traité.
Hypertension rénovasculaire: chez les patients souffrant d'une sténose bilatérale de l'artère rénale ou de sténose de l'artère rénale en cas de rein unique, il existe un risque accru d'hypotension sévère et d'insuffisance rénale lors d'un traitement avec des IEC. Le traitement concomitant avec des diurétiques peut être un facteur aggravant. L'insuffisance rénale peut survenir même si les valeurs de la créatinine sont très peu modifiées et ce, même chez des patients souffrant de sténose unilatérale de l'artère rénale.
Chez ces patients, le traitement devra être instauré sous surveillance médicale étroite, avec des doses faibles, une titration prudente et un suivi de la fonction rénale.
Insuffisance rénale: une surveillance étroite de la fonction rénale au cours du traitement sera effectuée, si elle s'avère nécessaire. Une insuffisance rénale liée aux IEC a été observée, principalement chez les patients souffrant d'insuffisance cardiaque sévère ou de pathologies rénales sous-jacentes y compris une sténose de l'artère rénale. Chez quelques patients chez lesquels aucune pathologie rénale n'était préalablement connue, une augmentation des concentrations plasmatiques d'urée et de créatinine ont été observées, particulièrement lors de l'administration concomitante de diurétiques. Une diminution de la posologie de chacun des principes actifs peut s'avérer nécessaire. Il est recommandé de surveiller attentivement la fonction rénale pendant les premières semaines du traitement.
Dialyse: chez les patients traités par les IEC et qui sont dialysés avec des membranes de haute perméabilité en polyacrylonitrile, des réactions anaphylactoïdes telles que gonflement facial, bouffées vasomotrices, hypotension et dyspnée peuvent survenir quelques minutes après le début de l'hémodialyse. Il est recommandé d'utiliser une autre membrane de dialyse ou un autre hypotenseur.
L'efficacité et la tolérance du zofénopril dans l'infarctus du myocarde chez des patients hémodialysés n'a pas été établie. Par conséquent, le zofénopril ne devra pas être utilisé chez ces patients.
Aphérèse de LDL: Les patients traités avec des IEC et soumis à une aphérèse de LDL avec du dextran sulfate peuvent réagir en développant des réactions anaphylactoïdes similaires à celles des patients sous hémodialyse utilisant des membranes de haute perméabilité (voir ci-dessus). Chez ces patients, il est recommandé d'utiliser un antihypertenseur d'une autre classe.
Réactions anaphylactiques au cours d'une désensibilisation ou après une piqûre d'insecte: dans de rares cas, des réactions anaphylactoïdes mettant en jeu le pronostic vital peuvent survenir chez des patients traités avec un IEC lors d'un traitement de désensibilisation ou après une piqûre d'insecte. Ces réactions seront évitées en arrêtant temporairement le traitement par l'IEC avant chaque traitement de désensibilisation. La prudence s'impose donc chez des patients traités par un IEC et soumis à ce type de traitement de désensibilisation.
Transplantation rénale: il n'existe pas de données concernant l'utilisation de ZOFENILDUO 30 mg/12,5 mg comprimé pelliculé chez des patients ayant subi une transplantation rénale récente. Son utilisation chez les transplantés rénaux n'est donc pas recommandée.
Aldostéronisme primaire: les patients atteints d'aldostéronisme primaire ne répondent habituellement pas à un traitement par des antihypertenseurs agissant via le système rénine-angiotensine. L'utilisation de ZOFENILDUO 30 mg/12,5 mg comprimé pelliculé n'est donc pas recommandée.
dème de Quincke: sous traitement avec les IEC, en particulier au cours des premières semaines de traitement, un angio-dème du visage, des membres, des lèvres, des muqueuses, de la langue, de la glotte et/ou du larynx peut survenir. Dans de rares cas cependant, des angio-dèmes sévères peuvent survenir après un traitement à long terme avec un inhibiteur de l'enzyme de conversion de l'angiotensine. Le traitement par les IEC doit être immédiatement interrompu et remplacé par un antihypertenseur appartenant à une autre classe pharmacologique.
Un angio-dème de la langue, de la glotte ou du larynx peut être mortel. Le traitement d'urgence doit au moins comprendre l'administration immédiate par voie sous-cutanée d'une solution d'adrénaline à 1/1000 (0,3 à 0,5 ml) ou l'administration intraveineuse lente d'adrénaline à 1 mg/ml (à diluer selon les instructions) sous surveillance ECG et de la pression artérielle. Le patient doit être hospitalisé et placé en observation pendant au moins 12 à 24 heures et il ne doit pas sortir de l'hôpital avant la disparition complète des symptômes.
Toux: pendant le traitement avec des IEC, une toux sèche non productive peut survenir.
Elle disparaît après l'arrêt du traitement.
Insuffisance hépatique: dans de rares cas, les IEC ont été associés à un syndrome qui débute par un ictère cholestatique et qui évolue jusqu'à la nécrose hépatique fulminante et parfois la mort. Le mécanisme sous-jacent à ce syndrome n'est pas connu. Les patients recevant des IEC et développant un ictère ou une élévation marquée des enzymes hépatiques devront interrompre ce traitement et être suivis en conséquence.
Hyperkaliémie: au cours d'un traitement par les IEC, une hyperkaliémie peut survenir. Cet effet est habituellement atténué par l'effet hypokaliémiant des diurétiques thiazidiques. Les patients atteints d'une insuffisance rénale, d'un diabète sucré ou ceux utilisant simultanément des diurétiques d'épargne potassique, des suppléments potassiques ou des sels de substitution à base de sels de potassium ou les patients prenant des produits connus pour entraîner une élévation des taux de potassium sérique (par ex. l'héparine) risquent de développer une hyperkaliémie. Si l'utilisation concomitante de ces produits s'avère nécessaire, une surveillance régulière des taux de la kaliémie doit être effectuée (voir rubrique 4.5).
Chirurgie/Anesthésie: au cours d'opérations importantes ou au cours d'une anesthésie, les IEC peuvent entraîner une hypotension voire un choc hypotensif. Si l'arrêt préalable de l'IEC n'est pas possible, les volumes intravasculaires et plasmatiques devront être étroitement surveillés.
Sténose aortique/cardiomyopathie hypertrophique: les IEC doivent être utilisés avec prudence chez les patients présentant des obstacles sur la voie d'éjection du ventricule gauche. Les IEC doivent être évités en cas de choc cardiogénique et d'obstruction hémodynamiquement significative.
Neutropénie/Agranulocytose: neutropénies/agranulocytoses, thrombopénies et anémies ont été rapportées chez des patients recevant des IEC. Le risque de développer une neutropénie semble lié à la posologie et dépendant de l'état clinique du patient. Il est rarement observé chez des patients ne présentant pas de complications, mais peut survenir chez des patients souffrant de troubles de la fonction rénale, en particulier lorsque sont associés des troubles vasculaires collagèniques tels que lupus érythémateux disséminé, sclérodermie, et des traitements par des immunosuppresseurs, l'allopurinol ou le procaïnamide ou en cas d'association de ces facteurs aggravants. Certains de ces patients ont développé des affections graves qui, dans quelques cas, n'ont pas répondu à un traitement intensif par des antibiotiques.
Si le zofénopril est utilisé chez ce type de patients, il est conseillé d'effectuer une numération des globules blancs et de la formule leucocytaire avant le début du traitement, puis toutes les 2 semaines au cours des trois premiers mois de traitement avec le zofénopril et périodiquement par la suite. Pendant le traitement, les patients devront être informés de la nécessité de rapporter tout signe d'infection (par ex. maux de gorge, fièvre) et une numération de la formule leucocytaire doit être effectuée. Le zofénopril et les autres médicaments concomitants (voir rubrique 4.5) devront être arrêtés en cas de neutropénie suspectée ou avérée (neutrophiles inférieurs à 1000/mm3). Elle est réversible à l'arrêt de l'IEC.
Psoriasis: les IEC doivent être utilisés avec précaution chez les patients souffrant de psoriasis.
Protéinurie: elle peut survenir en particulier chez les patients présentant une insuffisance rénale ou lorsque les IEC sont utilisés à des doses relativement élevées. Chez les patients présentant des antécédents d'affection rénale, une évaluation des protéines doit être effectuée (bandelettes réactives sur la première urine du matin) avant le traitement puis périodiquement.
Patients diabétiques: la glycémie doit être étroitement surveillée chez les patients diabétiques traités antérieurement avec des antidiabétiques oraux ou par l'insuline au cours du premier mois de traitement avec un IEC (voir rubrique 4.5).
Origine ethnique: comme les autres inhibiteurs de l'enzyme de conversion de l'angiotensine, le zofénopril peut avoir une moindre action antihypertensive chez les patients de race noire que chez les autres.
HYDROCHLOROTHIAZIDE
Insuffisance rénale: chez les patients présentant des affections rénales, les diurétiques thiazidiques peuvent provoquer une augmentation de l'urémie. Les effets cumulés de ce principe actif peuvent survenir chez des patients présentant une insuffisance rénale. En cas de survenue d'une insuffisance rénale évolutive, révélée par une augmentation de l'urémie, il conviendra de réévaluer le bien fondé du traitement, en envisageant un arrêt du diurétique.
Insuffisance hépatique: les diurétiques thiazidiques doivent être utilisés avec précaution chez les patients présentant une insuffisance hépatique ou une hépatopathie évolutive, étant donné que des modifications mineures de l'équilibre hydro-électrolytique peuvent précipiter le coma hépatique.
Effets métaboliques et endocriniens: un traitement avec des diurétiques thiazidiques est susceptible de diminuer la tolérance au glucose. Il peut être nécessaire d'adapter la posologie de l'insuline et des antidiabétiques oraux (voir rubrique 4.5). Un diabète sucré latent peut se révéler lors d'un traitement par des diurétiques thiazidiques.
Des augmentations des taux du cholestérol et des triglycérides ont été associées à un traitement avec des diurétiques thiazidiques. Un traitement par des diurétiques thiazidiques peut précipiter une hyperuricémie et/ou une goutte chez certains patients.
Déséquilibre électrolytique: comme chez tout patient recevant un traitement par des diurétiques, il convient d'effectuer un dosage des électrolytes sériques à intervalles appropriés.
Les diurétiques thiazidiques, y compris l'hydrochlorothiazide peuvent entraîner des déséquilibres hydro-électrolytiques (hypokaliémie, hyponatrémie et alcalose hypochlorémique). Les signes d'alerte d'un déséquilibre hydro-électrolytique sont les suivants: sécheresse de la bouche, soif, faiblesse, léthargie, somnolence, agitation, douleurs musculaires ou crampes, fatigue musculaire, hypotension, oligurie, tachycardie et troubles gastro-intestinaux à type de nausées ou vomissements.
Bien qu'une hypokaliémie puisse survenir au cours d'un traitement avec des diurétiques thiazidiques, le traitement simultané avec le zofénopril peut diminuer l'hypokaliémie induite par le diurétique. Le risque d'hypokaliémie est plus important chez les patients souffrant d'une cirrhose du foie, chez les patients présentant une diurèse importante, chez ceux ayant pris par voie orale une quantité insuffisante d'électrolytes et chez les patients traités simultanément par des corticoïdes ou de l'ACTH (voir rubrique 4.5).
Une hyponatrémie de dilution peut survenir chez des patients présentant un dème par temps chaud. La déplétion chlorée est habituellement légère et ne nécessite pas de traitement.
Les diurétiques thiazidiques peuvent diminuer l'excrétion urinaire du calcium et entraîner une légère élévation transitoire de la calcémie, en l'absence de troubles connus du métabolisme calcique. Une hypercalcémie importante peut révéler une hyperparathyroidie sous-jacente. Le traitement par diurétiques thiazidiques doit être interrompu avant d'effectuer les tests d'exploration de la fonction parathyroidienne.
Il a été démontré que les diurétiques thiazidiques augmentent l'excrétion urinaire du magnesium, pouvant conduire à une hypomagnésémie.
Lupus érythémateux: une exacerbation ou activation d'un lupus érythémateux disséminé a été rapportée lors d'un traitement avec des diurétiques thiazidiques.
Tests anti-dopage: l'hydrochlorothiazide contenu dans ce médicament pourrait conduire à des résultats positifs lors de tests anti-dopage.
Autres: des réactions d'hypersensibilité peuvent survenir chez des patients présentant ou non des antécédents d'allergie ou d'asthme bronchique.
ASSOCIATION ZOFENOPRIL/HYDROCHLOROTHIAZIDE
Outre les mises en garde propres à chacun des produits, il conviendra de tenir compte des mises en garde suivantes:
Grossesse: ZOFENILDUO 30 mg/12,5 mg comprimé pelliculé n'est pas recommandé au cours du premier trimestre de la grossesse (voir rubrique 4.6).
Insuffisance rénale: compte tenu de l'effet du zofénopril et de l'hydrochlorothiazide chez les patients présentant une insuffisance rénale, ZOFENILDUO 30 mg/12,5 mg comprimé pelliculé ne doit pas être administré à des patients présentant une insuffisance rénale modérée à sévère (clairance de la créatinine < 45 ml/min).
Risque d'hypokaliémie: l'association d'un IEC et d'un diurétique thiazidique ne permet pas d'exclure la survenue d'une hypokaliémie. Il convient d'effectuer une surveillance régulière de la kaliémie.
Intolérance au galactose, syndrome de malabsorption du glucose et du galactose, déficit en lactase de Lapp: ce produit contient du lactose. Par conséquent, les patients souffrant d'une intolérance héréditaire rare au galactose, de syndrome de malabsorption du glucose et du galactose ou de déficit en lactase ne doivent pas prendre ce médicament.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Associations non recommandées
+ Diurétiques épargneurs de potassium ou suppléments en potassium:
Les IEC atténuent la perte potassique induite par les diurétiques. Les diurétiques d'épargne potassique tels que la spironolactone, le triamtérène ou l'amiloride, les suppléments potassiques, ou des substituts du sel contenant du potassium, peuvent conduire à une augmentation significative de la kaliémie. Si une utilisation concomitante est indiquée en raison d'une hypokaliémie documentée, ces diurétiques doivent être utilisés avec précaution et un contrôle fréquent de la kaliémie et de l'ECG est nécessaire (voir rubrique 4.4.).
Associations faisant l'objet de précautions demploi
+ Diurétiques (thiazidiques ou diurétiques de l'anse):
Un traitement antérieur avec des diurétiques à fortes doses peut entraîner une déplétion volémique et un risque d'hypotension lors de l'initiation du traitement avec le zofénopril (Cf. 4.4). Les effets hypotenseurs peuvent être diminués par l'arrêt du diurétique, par l'augmentation de l'absorption de liquides ou de sels ou en instaurant un traitement à une faible dose de zofénopril.
+ Anesthésiques:
Les IEC peuvent augmenter les effets hypotenseurs de certains anesthésiques.
+ Narcotiques/ Antidépresseurs tricycliques/Antipsychotiques/Barbituriques:
Une hypotension orthostatique peut survenir.
+ Autres agents antihypertenseurs (par exemple: béta-bloquants, alpha- bloquants, antagonistes calciques):
Il peut survenir des effets hypotenseurs ou une potentialisation de leurs effets. Un traitement concomitant avec de la trinitrine ou d'autres dérivés nitrés doit être administré avec prudence.
+ Cimétidine:
La cimétidine peut augmenter le risque d'effet hypotenseur.
+ Ciclosporine:
La ciclosporine peut augmenter le risque de dysfonction rénale lors d'un traitement simultané avec des IEC.
+ Allopurinol, procainamide, cytostatiques ou immunosuppresseurs:
Risque accru de réactions d'hypersensibilité lors de l'utilisation simultanée d'IEC. Les données provenant d'autres IEC montrent un risque accru de leucopénie lors d'une utilisation simultanée.
+ Antidiabétiques:
Dans de rares cas, les IEC peuvent potentialiser les effets hypoglycémiants de l'insuline et des antidiabétiques oraux tels que les sulfonylurées chez les diabétiques. Dans ce cas, il peut être nécessaire de diminuer la dose de l'antidiabétique lors du traitement simultané avec les IEC.
+ Hémodialyse utilisant des membranes de haute perméabilité:
Risque accru de réactions anaphylactoïdes en cas d'utilisation simultanée d'IEC.
+ Sympathomimétiques:
Ils peuvent diminuer les effets antihypertenseurs des IEC; les patients devront être surveillés attentivement afin de s'assurer que l'effet souhaité a été atteint.
+ Anti-acides:
Ils diminuent la biodisponibilité des IEC.
+ Prise de nourriture:
Elle peut diminuer la vitesse d'absorption mais pas l'importance de l'absorption du zofénopril.
Autres interactions
+ Enzymes du CYP:
Il n'existe pas de données cliniques directes sur l'interaction du zofénopril avec d'autres principes actifs qui sont métabolisés par les enzymes du CYP.
Cependant, des études métaboliques in vitro conduites avec le zofénopril ont montré l'absence d'interactions potentielles avec des principes actifs qui sont métabolisés par les enzymes du CYP.
HYDROCHLOROTHIAZIDE
Associations faisant l'objet de précautions demploi
+ Résines de cholestyramine et de colestipol:
L'absorption de l'hydrochlorothiazide est altérée en présence de résines échangeuses d'anions. Des doses uniques soit de résines de cholestyramine ou de colestipol se fixent à l'hydrochlorothiazide et diminuent son absorption au niveau de tractus gastro-intestinal de respectivement 85% et 43%.
Les sulfamides diurétiques doivent être pris au moins une heure avant ou 4 à 6 heures après ces médicaments.
+ Corticoïdes, ACTH, amphotéricine B (voie parentérale), carbénoxolone, laxatifs stimulants:
Il peut survenir une déplétion électrolytique en particulier une hypokaliémie lors de l'administration simultanée avec l'hydrochlorothiazide.
+ Sels de calcium:
Une augmentation de la calcémie en raison d'une diminution de l'excrétion peut survenir lors d'une l'administration simultanée avec des diurétiques thiazidiques.
+ Glucosides cardiotoniques:
Une hypokaliémie ou une hypomagnésémie induite par des diurétiques thiazidiques favorisent la survenue d'arythmie cardiaque induite par les digitaliques.
+ Médicaments donnant des torsades de pointes:
En raison du risque de survenue d'une hypokaliémie, des précautions s'imposent lors de l'administration simultanée d'hydrochlorothiazide et de médicaments donnant des torsades de pointes, comme par exemple certains antiarythmiques, certains antipsychotiques et d'autres médicaments connus pour induire des torsades de pointes.
+ Amines pressives (par ex. adrénaline):
Diminution possible de la réponse aux amines pressives mais qui n'est pas suffisante pour en exclure leur emploi avec l'hydrochlorothiazide.
+ Myorelaxants du muscle squelettique, non-dépolarisants (par ex. tubocurarine):
Possible augmentation de la réactivité au myorelaxant lors d'une utilisation avec l' hydrochlorothiazide.
+ Amantadine:
Les diurétiques thiazidiques peuvent augmenter le risque de survenue des effets indésirables causés par l'amantadine.
+ Médicaments utilisés dans le traitement de la goutte (probénecide, sulfinpyrazone, allopurinol):
Une adaptation de la posologie des médicaments uricosuriques peut s'avérer nécessaire car l'hydrocholorothiazide peut augmenter les taux sériques d'acide urique.
L'augmentation de la posologie du probénecide ou de la sulfinpyrazone peut être nécessaire. L'administration simultanée de diurétiques thiazidiques peut augmenter l'incidence des réactions d'hypersensibilité à l'allopurinol.
Autres interactions
+ Interactions avec les paramètres biologiques:
En raison de leurs effets sur le métabolisme calcique, les diurétiques thiazidiques peuvent interférer avec les tests d'exploration de la fonction parathyroidienne.
ASSOCIATION ZOFENOPRIL/HYDROCHLOROTHIAZIDE
Outre les interactions liées à chacun des composants actifs seuls, les précautions suivantes doivent être respectées:
Associations non recommandées
+ Lithium:
L'administration simultanée de diurétiques thiazidiques peut entraîner une augmentation du risque d'intoxication au lithium et augmenter le risque d'intoxication au lithium déjà présent avec les IEC.
Par conséquent, la prise simultanée de ZOFENILDUO 30 mg/12,5 mg comprimé pelliculé et de lithium n'est pas recommandée; si une telle association est nécessaire, une surveillance attentive de la lithémie s'impose.
+ Biochimie:
Les diurétiques thiazidiques peuvent diminuer les taux sanguins d'iode lié aux protéines sans apparition de signes de dysfonctionnement tyroïdien.
Associations faisant l'objet de précautions demploi
+ Anti-inflammatoires non stéroïdiens (y compris l'acide acétylsalicylique ≥ 3 g/jour):
L'administration d'anti-inflammatoires non stéroïdiens peut entraîner une diminution des effets antihypertenseurs des IEC et des diurétiques. En outre, il a été rapporté que les AINS et les IEC exercent un effet additif sur l'augmentation de la kaliémie alors que la fonction rénale peut diminuer. Ces effets sont en principe réversibles et surviennent en particulier chez des patients présentant une altération de la fonction rénale. Dans de rares cas, une insuffisance rénale aiguë peut survenir, en particulier chez des patients ayant une fonction rénale compromise comme les sujets âgés ou déshydratés.
+ Alcool:
L'alcool augmente l'effet hypotenseur des IEC et de l'hydrochlorothiazide.
+ Triméthoprime:
L'administration simultanée d'IEC et de diurétiques thiazidiques avec le triméthoprime augmente les risque d'hypercalcémie.
ZOFENILDUO 30 mg/12,5 mg comprimé pelliculé ne doit pas être utilisé durant le premier trimestre de la grossesse. Lorsqu'une grossesse est planifiée ou confirmée, un traitement alternatif doit être initié le plus tôt possible. Aucune étude contrôlée avec les IEC n'a été effectuée chez l'homme, mais un nombre limité de cas d'exposition lors du premier trimestre n'a pas montré de malformations (voir rubrique 5.3).
ZOFENILDUO 30 mg/12,5 mg comprimé pelliculé est contre indiqué pendant les deuxième et troisième trimestres de la grossesse (voir rubrique 4.3).
Une exposition du ftus aux IEC au cours des deuxième et troisième trimestres de la grossesse a été associée à une hypotension in utero, à une insuffisance rénale, à des malformations du visage et du crâne et/ou la mort. Chez la mère, des cas d'oligohydramnios, traduisant une diminution de la fonction rénale du ftus ont été rapportés. Des contractures des membres, des malformations crâniennes et faciales, le développement d'une hypoplasie pulmonaire et un retard de croissance in utero ont été rapportés en association avec un oligohydramnios.
Dans le cas d'une exposition au ZOFENILDUO 30 mg/12,5 mg comprimé pelliculé à partir du deuxième trimestre de la grossesse, une surveillance échographique de la fonction rénale et de la boîte crânienne est recommandée.
Après une exposition in utero aux IEC, il convient de surveiller attentivement la survenue d'une hypotension, d'une oligurie et d'une hyperkaliémie.
Les diurétiques thiazidiques passent la barrière placentaire et sont retrouvés dans le sang du cordon ombilical. Ils peuvent entraîner des troubles électrolytiques chez le ftus, et éventuellement d'autres réactions survenant chez l'adulte. Des cas de thrombopénie du ftus ou un ictère néonatal ont été rapportés lors d'un traitement de la mère avec des diurétiques thiazidiques.
ZOFENILDUO 30 mg/12,5 mg comprimé pelliculé est contre-indiqué pendant l'allaitement (voir rubrique 4.3). Le zofénopril et les diurétiques thiazidiques sont excrétés dans le lait maternel. Les thiazidiques ont été associés à une diminution ou même une suppression de la sécrétion de lait durant l'allaitement. Une hypersensibilité aux dérivés sulfonamides, une hypokaliémie et un ictère nucléaire peuvent survenir.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Aucune étude portant sur la capacité à conduire des véhicules ou d'utiliser des machines n'a été réalisée. Il convient de rappeler aux personnes conduisant des véhicules ou utilisant des machines, qu'une somnolence, des vertiges ou de la fatigue peuvent parfois survenir.
Au cours d'études cliniques contrôlées portant sur 597 patients randomisés pour recevoir le zofénopril plus l'hydrochlorothiazide, aucune réaction indésirable spécifique à cette association n'a été observée. Les réactions indésirables ont été limitées à celles rapportées antérieurement avec le zofénopril calcium seul ou l'hydrochlorothiazide seul. L'incidence des effets indésirables n'a pas montré de corrélation avec le sexe ou l'âge des patients.
Le tableau ci-dessous indique toutes les réactions indésirables rapportées au cours des études cliniques considérées comme ayant un lien de causalité au moins probable ou possible avec l'association zofénopril/hydrochlorothiazide dans un rapport de doses de 30/12,5. Ils sont indiqués par système d'organe et classés par fréquence selon la convention suivante: très fréquents (≥1/10); fréquents (≥1/100, < 1/10); peu fréquents (≥ 1/1,000, <1/100); rares (≥1/10,000, <1/1,000); très rares (<1/10,000).
|
Infections et infestations |
|
|
Peu fréquents: |
Infections, Bronchites, Angines |
|
Troubles du métabolisme et de la nutrition |
|
|
Peu fréquents: |
Hypercholestérolémie, Hyperglycémie, Hyperlipémie, Hypokaliémie, Hyperkaliémie, Hyperuricémie. |
|
Troubles psychiatriques |
|
|
Peu fréquents: |
Insomnie |
|
Troubles du système nerveux |
|
|
Fréquents: |
Vertiges, Maux de tête |
|
Peu fréquents: |
Somnolence, Syncope, Hypertonie |
|
Troubles Cardiaques |
|
|
Peu fréquents: |
Angine de poitrine, fibrillation auriculaire, Infarctus du myocarde, Palpitations |
|
Troubles Vasculaires |
|
|
Peu fréquents: |
Bouffées vasomotrices, Hypotension, Hypertension |
|
Troubles Respiratoires |
|
|
fréquents: |
Toux |
|
Peu fréquents: |
Dyspnée |
|
Troubles Gastro-intestinaux |
|
|
Peu fréquents: |
Nausées, Dyspepsie, Gastrite, Gingivite, Sécheresse de la bouche, Douleurs abdominales |
|
Troubles cutanés |
|
|
Peu fréquents: |
dème de Quincke, Psoriasis, Acné, sécheresse cutanée, Prurit, Urticaire |
|
Troubles musculosquelletiques |
|
|
Peu fréquents: |
Douleurs dorsales |
|
Troubles rénaux et urinaires |
|
|
Peu fréquents: |
Polyurie |
|
Troubles généraux |
|
|
Peu fréquents: |
Asthénie, symptômes pseudo-grippaux, dème périphérique. |
|
Troubles du système reproductif et des seins |
|
|
Peu fréquents: |
Dysfonction érectile |
|
Examens biologiques |
|
|
Peu fréquents: |
Augmentation de la créatinine, augmentations des valeurs des paramètres de la fonction hépatique |
Informations complémentaires sur chacun des composants:
Les réactions susceptibles de survenir avec chacun des composants donnés en monothérapie au cours d'un traitement avec ZOFENILDUO 30 mg/12,5 mg comprimé pelliculé sont les suivantes:
Zofénopril
Les effets indésirables les plus fréquents, caractéristiques des IEC, survenus au cours d'études cliniques conduites chez des patients traités avec le zofénopril, ont été les suivantes:
Troubles du système nerveux: fréquents: vertiges, maux de tête;
Troubles du système respiratoire: fréquents: toux;
Troubles du système gastro-intestinal: fréquents: nausées/vomissements;
Troubles cutanés et sous-cutanés: peu fréquents: éruptions; rares: dème de Quincke
Troubles musculoskelletiques: peu fréquents: crampes musculaires;
Troubles généraux: fréquents: fatigue, asthénie.
Les réactions indésirables suivantes ont été observées lors d'un traitement avec des IEC:
Troubles du système sanguin et lymphatique: chez quelques patients, une diminution du taux de l'hémoglobine, de l'hématocrite, du nombre de plaquettes et des globules blancs ont été rapportés y compris agranulocytose et pancytopénie. Il a été fait état d'anémie hémolytique chez des patients présentant un déficit en glucose-6-phosphate deshydrogénase.
Troubles nerveux/psychiatriques: parfois maux de tête, vertiges, dans de rares cas dépression, troubles de l'humeur, troubles du sommeil, paresthésies, dysfonction érectile, troubles de l'équilibre, confusion, bourdonnements d'oreilles, vision trouble et dysgueusie.
Troubles cardiovasculaires: Une hypotension sévère a été observée au début du traitement ou en cas d'augmentation de la posologie, en particuliers chez certains groupes à risques (voir rubrique 4.4). Des symptômes tels que vertiges, sensation de faiblesse, troubles de la vue, rarement accompagnés de troubles de la conscience (syncope) peuvent survenir.
Quelques cas isolés de tachycardie, palpitations, arythmie, angine de poitrine, infarctus du myocarde, accidents ischémiques transitoires et hémorragies cérébrales ont été rapportés lors d'un traitement par des IEC accompagné d'hypotension.
Dans de rares cas des bouffées vasomotrices ont été observées.
Exceptionnellement, un dème périphérique, une hypotension orthostatique et des douleurs de la poitrine ont été observées.
Troubles respiratoires: Les IEC peuvent entraîner de la toux chez un nombre notable de patients, rarement des dyspnées, sinusites, rhinites, bronchites et bronchospasmes. Des cas isolés d'dème de Quincke touchant les voies aériennes supérieures ont entraîné une obstruction mortelle des voies respiratoires.
Troubles gastro-intestinaux/hépatobiliaires: des glossites, parfois des nausées, douleurs abdominales, vomissements, diarrhées, constipation, sécheresse de la bouche peuvent être observées dans de rares cas.
Des cas isolés d'ictère cholestatique, d'hépatite, de pancréatite et d'iléus ont été décrits lors de traitements avec les IEC.
Troubles cutanés et cutanéo-muqueux: Les IEC ont été associés à l'apparition d'dème de Quincke du visage et des tissus rhino-pharyngés chez un petit nombre de sujets. Des réactions allergiques et d'hypersensibilité peuvent parfois être observées telles que éruption, prurit, urticaire, érythème multiforme, syndrome de Stevens-Johnson, nécro-épidermolyse aiguë, efflorescences de type psoriasis, alopécie. Ces symptômes peuvent être accompagnés de fièvre, myalgies, arthralgies, éosinophilie et/ou d'une augmentation des taux des anticorps antinucléaires (AAN). De rares cas de sueurs abondantes ont été rapportés.
Troubles musculosquelletiques: quelquefois des myalgies et des crampes musculaires peuvent être observées.
Troubles rénaux: Une insuffisance rénale peut survenir ou s'aggraver. Une insuffisance rénale aiguë a été rapportée (voir rubrique 4.4). Des troubles de la miction sont survenus dans de rares cas.
Troubles généraux: de la fatigue a quelquefois été rapportée.
Examens biologiques: une augmentation des taux de l'urée sanguine et de la créatinine plasmatique, réversible à l'arrêt du traitement, peut survenir, en particulier en cas d'insuffisance rénale, d'insuffisance cardiaque sévère et d'hypertension rénovasculaire. Des augmentations des taux sériques des enzymes hépatiques et de la bilirubine ont été rapportées.
Hydrochlorothiazide
Les événements indésirables rapportés au cours d'un traitement avec l'hydrochlorothiazide seul sont les suivants:
Troubles du système sanguin et lymphatique: leucopénie, neutropénie/agranulocytose, thrombopénie, anémie aplasique, anémie hémolytique, dépression de la moelle osseuse.
Troubles psychiatriques: troubles du sommeil, dépression.
Troubles du système nerveux: agitation, étourdissements, vertiges, paresthésies.
Troubles oculaires: xanthopsie, vison trouble passagère.
Troubles cardiaques: arythmie cardiaque
Troubles vasculaires: hypotension orthostatique
Troubles respiratoires: détresse respiratoire (y compris pneumonie et dème pulmonaire).
Troubles gastro-intestinaux: anorexie, perte d'appétit, irritation gastrique, diarrhées, constipation, sialite, pancréatite.
Troubles hépatobiliaires: ictère (ictère intrahépatique cholestatique).
Troubles cutanéo-muqueux: réactions de photosensibilité, éruptions, réactions cutanées de type lupus érythémateux, réactivation d'un lupus érythémateux, urticaire, angéite nécrosante (vascularite, vascularite cutanée ), réactions anaphylactiques, nécrolyse épidermique toxique.
Troubles musculo-squelletiques: spasmes et faiblesse musculaires.
Troubles rénaux et urinaires: dysfonction rénale, néphrite interstitielle.
Troubles généraux: fièvre
Examens biologiques: Hyperglycémie, glycosurie, hyperuricémie, troubles électrolytiques (y compris hyponatrémie et hypokaliémie), augmentation des taux du cholestérol et des triglycérides.
Les symptômes de surdosage sont les suivants: hypotension sévère, choc, stupeur, bradycardie, troubles électrolytiques et insuffisance rénale.
Le traitement est symptomatique et consiste à maintenir les fonctions vitales. Après surdosage, les patients seront surveillés attentivement de préférence dans une unité de soins intensifs. Le taux sérique des électrolytes et de la créatinine doit être fréquemment contrôlé. Les mesures thérapeutiques à prendre sont fonction de la nature et de la sévérité des symptômes. S'il s'agit d'une ingestion récente, des mesures visant à empêcher l'absorption, telles qu'un lavage gastrique et l'administration d'adsorbants et de sulfate de sodium seront mises en place. Si une hypotension survient, le patient doit être placé en position de choc et l'emploi judicieux de solutés à effet d'expansion volémique et/ou d'un traitement avec de l'angiotensine II sera envisagé. Les bradycardies ou les réactions vagales sévères doivent être traitées par administration d'atropine. Le recours à un stimulateur cardiaque peut être envisagé. Les IEC peuvent être éliminés de la circulation générale par hémodialyse. L'utilisation de membranes de haute perméabilité en polyacrylonitrile doit être évitée.
Hydrochlorothiazide: les signes et symptômes sont ceux entraînés par la déplétion hydroélectrolytique (hypokaliémie, hypochlorémie) et la déshydratation due à la diurèse excessive. Les signes et symptômes les plus fréquents de surdosage sont les nausées et la somnolence. Dans le cas où un digitalique ou certains anti-arythmiques sont co-administrés, une hypokaliémie peut entraîner des spasmes musculaires et/ou accentuer les troubles du rythme cardiaque.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Groupe pharmaco-thérapeutique: Inhibiteurs de l'enzyme de conversion de l'angiotensine (IEC) et diurétiques
Code ATC: C09BA
Comprimés associant le zofénopril et l'hydrochlorothiazide
ZOFENILDUO 30 mg/12,5 mg comprimé pelliculé est l'association à doses fixes du zofénopril, un inhibiteur de l'enzyme de conversion de l'angiotensine (IEC) et de l'hydrochlorthiazide, un diurétique thiazidique. Ces deux composants ont des modes d'action complémentaires et ont un effet antihypertenseur additif.
Le zofénopril est un IEC possédant un groupement sulfhydryle capable d'inhiber l'enzyme de conversion de l'angiotensine, enzyme impliquée dans la conversion de l'angiotensine I en angiotensine II, peptide vasoconstricteur. En inhibant cette enzyme de conversion, il entraîne une diminution de l'activité vasopressive et une réduction de la sécrétion d'aldostérone. Cette réduction peut entraîner une augmentation des concentrations sériques en potassium avec pertes hydrosodées. La suppression du rétrocontrôle négatif de angiotensine II sur la sécrétion de rénine entraîne une augmentation de l'activité rénine plasmatique. Le mécanisme de l'action anti-hypertensive paraît essentiellement en rapport avec une inhibition du système rénine-angiotensine-aldostérone. L'IEC est identique à la kininase II, une enzyme qui dégrade la bradykinine, peptide vasodilatateur puissant qui semble jouer un rôle dans l'effet thérapeutique des inhibiteurs de l'enzyme de conversion de l'angiotensine.
L'hydrochlorothiazide est un diurétique et un antihypertenseur. Il intervient au niveau du mécanisme de réabsorption des électrolytes dans le tubule contourné distal.
L'hydrochlorothiazide augmente l'excrétion ionique du sodium et du chlore en quantités à peu près équivalentes. La natriurèse peut s'accompagner de certaines pertes en potassium et en bicarbonates. La co-administration du zofénopril, vraisemblablement via un blocage du système rénine-angiotensine-aldostérone tend à inverser la perte de potassium associée à l'utilisation des diurétiques. Lors de l'administration d'hydrochlorothiazide, la diurèse commence dans les deux heures de la prise. Son effet diurétique atteint son maximum à la quatrième heure et se prolonge pendant 6 à 12 heures.
5.2. Propriétés pharmacocinétiques
L'administration simultanée du zofénopril et d'hydrochlorothiazide a peu, voire pas, d'effet sur la biodisponibilité de chacun des deux principes actifs. Il y a bioéquivalence entre le comprimé associant les deux principes actifs et l'administration simultanée des deux principes actifs pris séparément.
ZOFENOPRIL
Le zofénopril est un précurseur (prodrogue), la forme active étant le composé sulfhydrylé libre, le zofénoprilate, résultant d'une hydrolyse du thio-ester.
Absorption
Le zofénopril est rapidement et complètement absorbé par voie orale et il est quasi-totalement hydrolysé en zofénoprilate. Les concentrations plasmatiques maximales sont atteintes 1,5 heures après l'administration orale de zofénopril. La cinétique après dose unique est linéaire entre 10 et 80 mg de zofénopril et aucune accumulation ne se produit après l'administration de 15 à 60 mg de zofénopril pendant 3 semaines. La présence de nourriture dans le tractus digestif diminue la vitesse mais pas la quantité absorbée et l'AUC du zofénoprilate est quasiment identique à jeun ou après la prise d'aliments.
Distribution
Environ 88% de la radioactivité circulante mesurée ex-vivo suite à l'administration d'une dose de zofénopril radiomarquée est fixée aux protéines plasmatiques et à l'état d'équilibre, le volume de distribution est d'environ 96 litres.
Métabolisme
Huit métabolites, correspondant à 76% de la radioactivité urinaire ont été identifiés chez l'homme suite à l'administration d'une dose de zofénopril radiomarqué. Le métabolite principal est le zofénoprilate (22%), qui est métabolisé via différentes voies métaboliques incluant la glucurono-conjugaison (17%), cyclisation et glucurono-conjugaison (13%), la conjugaison à la cystéine (9%) et la S-méthylation du groupement thiol (8%).
Excrétion
Le zofénoprilate radiomarqué administré par voie intraveineuse est éliminé par les urines (76%) et les fécès (16%) alors que suite à l'administration de zofénopril radiomarqué, respectivement 69% et 26% de la radioactivité est retrouvée dans les urines et les fécès, indiquant une double voie d'élimination (rein et foie). La demie vie du zofénoprilate est de 5,5 heures et sa clairance totale est de 1300 ml/mn suite à l'administration orale de zofénopril.
Pharmacocinétique chez le sujet âgé
Chez le sujet âgé, si la fonction rénale est normale, il n'est pas nécessaire d'adapter la posologie.
Pharmacocinétique en cas d'insuffisance rénale
En comparant les paramètres pharmacocinétiques clés du zofénoprilate mesurés après administration orale de zofénopril radiomarqué, chez les patients présentant une insuffisance rénale légère (clairance de la créatinine >45 et <90 ml/min), la vitesse d'élimination du zofénopril est la même que celle des patients dont la fonction rénale est normale (clairance de la créatinine > 90 ml/min).
Les patients présentant une insuffisance rénale modérée à sévère (7- 44 ml/mn), éliminent le zofénopril deux fois plus lentement que les patients dont la fonction rénale est normale (vitesse d'élimination diminuée d'environ 50%).
Chez les patients au stade terminal de l'insuffisance rénale et sous dialyse (hémodialyse, dialyse péritonéale), la vitesse d'élimination est réduite de 25 % par rapport à la normale.
Pharmacocinétique en cas d'altération de la fonction hépatique
Les valeurs de la Cmax et de la Tmax chez les patients présentant une insuffisance hépatique légère à modérée et ayant reçu des doses uniques de zofénopril radiomarqué, sont comparables à celles observées chez des sujets normaux. L'AUC chez des patients atteints de cirrhose était cependant deux fois plus élevée que chez les sujets normaux. De ce fait, la dose initiale de zofénopril, chez les patients souffrant d'insuffisance hépatique légère à modérée doit être réduite de moitié par rapport à celle de patients ayant une fonction hépatique normale.
Il n'existe pas de données pharmacocinétiques du zofénopril et du zofénoprilate chez des patients présentant une insuffisance hépatique sévère. Le zofénopril est, par conséquent, contre-indiqué chez ces patients.
HYDROCHLOROTHIAZIDE
Absorption
Après administration orale, l'hydrochlorothiazide est bien absorbé (65 à 75 %). Les concentrations plasmatiques sont dose-dépendantes. L'absorption d'hydrochlorothiazide est fonction de la vitesse du transit intestinal; elle est augmentée lorsque la vitesse est lente, par exemple lors d'une administration avec de la nourriture. L'observation des taux plasmatiques pendant au moins 24 heures a montré que la demi-vie varie entre 5,6 et 14,8 heures et les concentrations plasmatiques maximales sont atteintes entre 1 et 5 heures après la prise.
Distribution
Les diurétiques thiazidiques sont largement distribués dans les liquides de l'organisme et sont fortement fixés aux protéines plasmatiques (92 %), en particulier à l'albumine, les molécules substituées étant les plus fortement fixées. Ceci conduit à une clairance rénale plus faible que celle des molécules précédentes et à une durée d'action plus longue. Il n'a pas été démontré de lien entre les taux plasmatiques d'hydrochlorothiazide et le niveau de réduction de la pression artérielle.
Excrétion
L'hydrochlorothiazide est essentiellement éliminée par le rein. Il est principalement excrété sous forme inchangée, plus de 95 % de l'hydrochlorothiazide étant retrouvé sous forme libre dans les urines 3 à 6 heures après une prise orale. Chez les patients souffrant d'une affection rénale, les concentrations plasmatiques d'hydrochlorothiazide sont augmentées et la demi-vie d'élimination allongée. L'hydrochlorothiazide passe la barrière placentaire mais pas la barrière hémato-cérébrale.
5.3. Données de sécurité préclinique
Les études de toxicité aiguë, à doses réitérées et les études de génotoxicité réalisées avec l'association fixe zofénopril/hydrochlorothiazide n'ont pas démontré de risques particuliers pour un emploi chez l'homme.
La toxicité de la reproduction conduite avec l'association a été étudiée chez le rat et le lapin; le zofénopril et l'hydrochlorothiazide n'ont pas démontré de potentiel tératogène. Néanmoins, chez les rates et les lapines gravides, l'association a augmenté de manière importante la toxicité maternelle par rapport à celle induite par le zofénopril seul.
Des études de carcinogenicité n'ont pas été conduites avec l'association zofénopril/ hydrochlorothiazide.
Des études de carcinogenicité conduites chez la souris et le rat avec le zofénopril seul n'ont pas démontré de potentiel carcinogène.
Comprimé nu: Cellulose microcristalline, lactose monohydraté, amidon de maïs, hypromellose, silice colloïdale anhydre, stéarate de magnésium
Pelliculage: OPADRY rose 02B24436 (hypromellose, dioxyde de titane (E 171), macrogol 400, oxyde de fer rouge (E 172), macrogol 6000.
Sans objet.
3 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 30° C.
6.5. Nature et contenu de l'emballage extérieur
14, 28, 30, 50, 56, 90 ou 100 comprimés sous plaquettes thermoformées (PVDC/PVC/Aluminium).
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières délimination et de manipulation
Pas d'exigences particulières.
7. TITULAIRE DE LAUTORISATION DE MISE SUR LE MARCHE
LABORATOIRES MENARINI INTERNATIONAL OPERATIONS LUXEMBOURG SA
1 AVENUE DE LA GARE
1611 LUXEMBOURG
LUXEMBOURG
8. NUMERO(S) DAUTORISATION DE MISE SUR LE MARCHE
· 366 900-5: 14 comprimés sous plaquettes thermoformées (PVDC/PVC/Aluminium).
· 366 901-1: 28 comprimés sous plaquettes thermoformées (PVDC/PVC/Aluminium).
· 366 902-8: 30 comprimés sous plaquettes thermoformées (PVDC/PVC/Aluminium).
· 374 212-7: 90 comprimés sous plaquettes thermoformées (PVDC/PVC/Aluminium).
· 566 562-6: 50 comprimés sous plaquettes thermoformées (PVDC/PVC/Aluminium).
· 566 563-2: 56 comprimés sous plaquettes thermoformées (PVDC/PVC/Aluminium).
· 566 564-9: 100 comprimés sous plaquettes thermoformées (PVDC/PVC/Aluminium).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE LAUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I