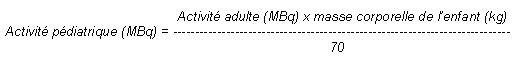
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 08/07/2009
IODURE (131 I) DE SODIUM POUR THERAPIE MALLINCKRODT FRANCE, gélule
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Iodure (131I) de sodium, .......................................................... 37 à 7 400 MBq à la date et l'heure de calibration
Pour une gélule.
L'iode-131 est soit extrait des produits de fission de l'uranium-235, soit produit par bombardement neutronique de tellure stable dans un réacteur nucléaire.
L'iode-131 a une période de 8,04 jours. Il décroît en Xénon-131 par émission de rayonnement gamma de 365 keV (81 %), 637 keV (7,3 %) et 284 keV (6,0 %) et de rayonnement béta-moins d'énergie maximale 606 keV.
Pour la liste complète des excipients, voir rubrique 6.1.
Gélule.
4.1. Indications thérapeutiques
L'iode-131 est indiqué pour le traitement des affections thyroïdiennes suivantes:
· Hyperthyroïdie: maladie de Basedow, goitre multinodulaire toxique ou nodules autonomes.
· Carcinome thyroïdien vésiculaire et/ou papillaire, y compris en cas de métastases et de tissus thyroidiens résiduels.
Le traitement par l'iodure (131I) de sodium est fréquemment associé à une intervention chirurgicale ou aux anti-thyroïdiens de synthèse.
4.2. Posologie et mode d'administration
L'activité à administrer est appréciée par le clinicien. L'effet thérapeutique n'apparaît qu'au bout de plusieurs mois.
· Traitement de l'hyperthyroïdie
L'activité administrée se situe généralement entre 200 et 800 MBq, mais il peut être nécessaire de répéter le traitement jusqu'à une activité cumulée maximale de 5000 MBq. L'activité nécessaire dépend de la cause de l'hyperthyroïdie, de la taille de la thyroïde, de la fixation thyroïdienne et de la clairance de l'iode. Dans la mesure du possible, il faut s'efforcer d'obtenir une euthyroïdie par des moyens pharmacologiques avant d'administrer l'iode radioactif pour traiter l'hyperthyroïdie.
· Thyroïdectomie et traitement des métastases
Après une thyroïdectomie totale ou partielle, l'activité administrée en vue d'éliminer le reliquat de tissu thyroïdien est comprise entre 1 850 et 3 700 MBq. Cette activité est fonction de l'importance du reliquat et de la fixation de l'iode-131. Pour le traitement ultérieur des métastases, l'activité administrée varie entre 3 700 et 11 000 MBq.
Chez l'enfant et l'adolescent, l'activité administrée est une fraction de celle utilisée chez l'adulte. Elle est calculée en fonction de la masse ou de la surface corporelle selon les formules ci-dessous:
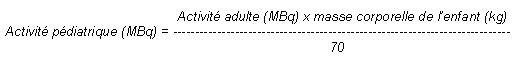
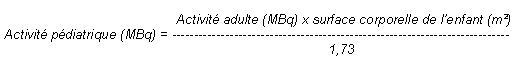
L'activité à administrer chez l'enfant peut aussi être calculée par application des coefficients suivants (selon E.A.N.M.: European Association of Nuclear Medicine):
|
3 kg = 0,10 |
22 kg = 0,50 |
42 kg = 0,78 |
|
4 kg = 0,14 |
24 kg = 0,53 |
44 kg = 0,80 |
|
6 kg = 0,19 |
26 kg = 0,56 |
46 kg = 0,82 |
|
8 kg = 0,23 |
28 kg = 0,58 |
48 kg = 0,85 |
|
10 kg = 0,27 |
30 kg = 0,62 |
50 kg = 0,88 |
|
12 kg = 0,32 |
32 kg = 0,65 |
52-54 kg = 0,90 |
|
14 kg = 0,36 |
34 kg = 0,68 |
56-58 kg = 0,92 |
|
16 kg = 0,40 |
36 kg = 0,71 |
60-62 kg = 0,96 |
|
18 kg = 0,44 |
38 kg = 0,73 |
64-66 kg = 0,98 |
|
20 kg = 0,46 |
40 kg = 0,76 |
68 kg = 0,99 |
La gélule est administrée par voie orale avec une boisson. Elle doit être avalée entière.
Pour favoriser le passage de la gélule dans l'sophage et créer dans l'estomac un milieu favorable à sa dissolution, il est recommandé au patient de boire une boisson chaude rapidement après l'ingestion de la gélule.
Chez les patients présentant une pathologie digestive, les gélules d'iode-131 doivent être administrées avec prudence. Les gélules doivent être avalées entières avec une quantité suffisante de liquide pour garantir leur transit dans l'estomac et la partie proximale de l'intestin grêle. Il est recommandé d'associer un traitement par des antihistaminiques H2 ou des inhibiteurs de la pompe à protons.
Au cours de l'administration d'activités élevées, dans le cadre du traitement d'un carcinome thyroïdien par exemple, il est recommandé au patient de boire abondamment et de limiter l'irradiation vésicale par des mictions fréquentes.
· Grossesse.
· Patients présentant une dysphagie, une sténose sophagienne, une gastrite évolutive, des lésions gastriques érosives ou un ulcère gastroduodénal.
· Patients présentant une suspicion de ralentissement de la motricité gastrointestinale.
4.4. Mises en garde spéciales et précautions d'emploi
Les produits radiopharmaceutiques ne doivent être réceptionnés, utilisés et administrés que par des personnes autorisées dans des services agréés. Leur réception, leur stockage, leur utilisation, leur transfert et leur élimination sont soumis aux réglementations et aux autorisations appropriées des autorités compétentes.
Les produits radiopharmaceutiques doivent être préparés de manière à satisfaire à la fois aux normes de radioprotection et de qualité pharmaceutique. Les précautions appropriées d'asepsie doivent être prises afin de satisfaire aux exigences des Bonnes Pratiques de Fabrication pharmaceutique.
L'administration de ce produit entraîne généralement des doses d'irradiation élevées (voir rubrique 4.8 et 11).
L'administration d'activités élevées d'iode-131 présente des risques pour l'environnement. Selon l'activité administrée, ces risques peuvent être importants pour l'entourage immédiat du patient ou pour le public. Il convient de prendre les mesures appropriées afin d'éviter toute contamination par l'activité éliminée par le patient.
Chez les patients traités par l'iode-131 pour une affection thyroïdienne bénigne, il n'existe que peu d'arguments en faveur d'une fréquence plus élevée de cancers, de leucémies ou de mutations, malgré une large utilisation de l'iode-131. Chez l'enfant et l'adulte jeune, il convient toutefois de prendre en compte la sensibilité plus importante des structures tissulaires et l'espérance de vie plus longue dans cette classe d'âge. Les risques doivent également être comparés avec ceux des autres traitements possibles.
Dans le cas du traitement d'une pathologie thyroïdienne maligne, une étude a fait état d'une fréquence plus élevée de cancers vésicaux chez des malades ayant reçu des activités d'iode-131 supérieures à 3 700 MBq. Dans une autre étude, une légère augmentation des cas de leucémies a été observée chez des patients ayant reçu des activités très élevées. Il est donc recommandé de ne pas dépasser une activité totale cumulée de 26 000 MBq.
La prudence s'impose en particulier chez les patients insuffisants rénaux. Chez ces patients, un ajustement de la posologie est nécessaire.
Pour éviter la survenue d'une sialadénite, complication classique du traitement par l'iode-131 à forte activité, il est conseillé au patient de prendre des sucreries ou des boissons contenant de l'acide citrique afin de stimuler la sécrétion salivaire.
Un régime pauvre en iode avant le traitement permet d'augmenter la fixation de l'iode-131 par le tissu thyroïdien fonctionnel.
En cas de carcinome thyroïdien, le traitement substitutif doit être arrêté avant l'administration d'iode-131 afin de garantir une fixation suffisante. Il doit être arrêté 10 jours avant pour la tri-iodothyronine et 6 semaines avant pour la thyroxine. Le traitement substitutif sera repris 2 semaines après l'administration d'iode-131. De même, il convient d'arrêter les traitements par carbimazole ou propylthiouracil une semaine avant l'administration d'iode-131 pour traiter l'hyperthyroïdie, et de ne les reprendre éventuellement que plusieurs jours après.
En cas d'hypersensibilité connue à la gélatine ou à ses métabolites, le traitement par la solution d'iodure (131I) de sodium doit être préféré.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
De nombreuses substances pharmacologiques interagissent avec l'iode radioactif. Les mécanismes de ces interactions sont variés et peuvent reposer sur une modification de la liaison aux protéines, ou sur une modification des propriétés pharmacocinétiques ou pharmacodynamiques. Il est donc indispensable d'interroger soigneusement le patient afin d'identifier tous les médicaments dont la prise doit être suspendue avant l'administration de la gélule d'iodure (131I) de sodium.
A titre d'exemple, les médicaments suivants doivent être arrêtés:
· en général 1 semaine avant le traitement: antithyroïdiens (carbimazole ou autres dérivés imidazolés tels que propylthiouracil), salicylés, corticoïdes, nitroprussiate de sodium, bromosulfophthaléine sodique, perchlorate, ainsi que divers autres médicaments (anticoagulants, antihistaminiques, antiparasitaires, pénicillines, sulfamides, tolbutamide, thiopentane);
· 1 à 2 semaines avant le traitement: phénylbutazone;
· 2 semaines avant le traitement: certaines préparations vitaminées et fluidifiants bronchiques;
· 2 à 6 semaines avant le traitement: produits de substitution hormonale de synthèse ou naturels à visée thyroïdienne (thyroxine sodique, liothyronine sodique, extrait thyroïdien);
· 4 semaines avant le traitement: amiodarone, benzodiazépines et lithium;
· 1 à 9 mois avant le traitement: produits iodés pour application locale;
· enfin jusqu'à 1 an avant le traitement: produits de contraste par voie orale pour cholécystographie et produits de contraste iodés.
L'iodure (131I) de sodium est contre-indiqué en cas de grossesse, de suspicion de grossesse, ou lorsque cette éventualité n'a pas été exclue (la dose de radiations absorbée au niveau de l'utérus pour ce produit se situe vraisemblablement entre 11 et 511 mGy; de plus, la thyroïde ftale présente une avidité particulière pour l'iode au cours des 2ème et 3ème trimestres).
Lorsqu'il est nécessaire d'administrer des produits radiopharmaceutiques à la femme en âge de procréer, toute éventualité de grossesse doit être écartée. Toute femme n'ayant pas eu ses règles doit être considérée comme enceinte jusqu'à preuve du contraire. D'autres techniques n'impliquant pas l'emploi de radiations ionisantes peuvent être envisagées. Si le diagnostic d'un carcinome thyroïdien différencié est posé au cours de la grossesse, il convient donc de reporter le traitement par l'iode-131 après le terme de la grossesse. Il doit être recommandé aux femmes traitées par l'iodure (131I) de sodium d'éviter d'être enceinte pendant les 4 mois suivant le traitement.
Avant d'administrer un produit radiopharmaceutique à une femme souhaitant poursuivre l'allaitement maternel, il convient d'estimer si ce traitement peut être différé jusqu'à la fin de l'allaitement. Après l'administration d'iodure (131I) de sodium, l'allaitement sera arrêté définitivement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Aucun connu à ce jour.
Pour chaque patient, l'exposition aux radiations ionisantes doit être justifiée par le bénéfice attendu. L'activité administrée doit correspondre à la plus faible dose de radiations possible compatible avec le résultat thérapeutique escompté.
L'exposition aux radiations ionisantes peut théoriquement induire des cancers et/ou des anomalies héréditaires. La dose de radiations résultant de l'irradiation thérapeutique peut augmenter l'incidence de cancers ou de mutations. Dans tous les cas, il convient de s'assurer que les risques liés à l'irradiation sont inférieurs à ceux qu'entraîne la maladie. La dose efficace après l'administration d'iodure (131I) de sodium à des doses thérapeutiques est supérieure à 20 mSv.
Quelques effets indésirables, consécutifs à l'administration d'iodure (131I) de sodium, ont été signalés: nausées, vomissements et troubles non spécifiques peut-être de nature allergique. Les nausées et les vomissements sont plus fréquents après administration par voie orale, en particulier aux doses thérapeutiques, et présentent un risque de contamination à ne pas négliger.
Quelques cas de manifestations allergiques ont été signalés après l'administration d'iodure (131I) de sodium. Ces réactions sont vraisemblablement liées à une hypersensibilité vis-à-vis de la gélatine constituant les gélules ou vis-à-vis de ses métabolites.
Effets précoces
Les activités thérapeutiques d'iodure (131I) de sodium peuvent entraîner une aggravation transitoire de l'hyperthyroïdie.
Les activités élevées peuvent entraîner des troubles digestifs qui apparaissent généralement au cours des premières heures ou des premiers jours après l'administration. L'incidence des troubles digestifs peut atteindre 67 %. Ces manifestations sont aisément prévenues ou contrôlées par un traitement symptomatique.
Avec les activités élevées d'iode-131, le patient peut présenter de façon transitoire une thyroïdite et une trachéite inflammatoires entre le 1er et le 3ème jour après l'administration, avec possibilité de constriction trachéale sévère, notamment en cas de sténose trachéale.
Une sialadénite peut survenir, s'accompagnant d'un dème et de douleurs au niveau des glandes salivaires, d'une agueusie partielle et d'une sécheresse de la bouche: l'incidence varie entre 10 % (lorsque des précautions sont prises) et 60 % (sans précaution). La sialadénite est généralement résolutive, soit spontanément, soit après traitement anti-inflammatoire, mais, des cas occasionnels d'agueusie et de sécheresse de la bouche persistantes et dose-dépendantes, suivies de la perte des dents, ont été observés. L'exposition des glandes salivaires aux rayonnements doit être limitée en stimulant la sécrétion salivaire à l'aide de substances acides.
Une fixation importante de l'iode-131 peut entraîner des douleurs locales, une gêne et des dèmes au niveau des tissus fixant le radionucléide.
Pour le traitement des cancers thyroïdiens avec des métastases au niveau du système nerveux central, il convient de prendre en compte l'éventualité d'dème cérébral et/ou l'aggravation d'un dème pré-existant.
Effets tardifs
Le traitement de l'hyperthyroïdie par l'iode radioactif peut entraîner une hypothyroïdie tardive dont la sévérité est dose-dépendante. Cette complication peut se manifester de quelques semaines à plusieurs années après le traitement et nécessite une surveillance de la fonction thyroïdienne à intervalles réguliers ainsi qu'un traitement substitutif hormonal approprié. L'hypothyroïdie consécutive à un traitement par l'iode radioactif n'apparaît généralement pas avant 6 à 12 semaines et l'incidence observée est très variable (2 à 70 %).
Une hypoparathyroïdie transitoire a été observée occasionnellement à la suite d'un traitement par l'iode radioactif: elle doit faire l'objet d'une surveillance et d'un traitement appropriés.
L'administration unique d'une activité supérieure à 5 000 MBq, ou la répétition de l'administration moins de 6 mois après le premier traitement, augmente la probabilité d'apparition tardive d'une insuffisance médullaire transitoire ou, très rarement, persistante, qui se traduit par une thrombopénie ou une érythropénie isolées, et qui peut entraîner le décès.
Une leucocytose transitoire est fréquente.
Des études épidémiologiques portant sur la période de 1950 à 1975 ont montré une augmentation de la fréquence du cancer de l'estomac chez les malades traités par l'iode-131.
Avec les activités élevées, correspondant aux activités utilisées dans le traitement des affections thyroïdiennes malignes, une augmentation de la fréquence des cas de leucémie a été observée. Il existe également des éléments en faveur d'une légère augmentation de la fréquence des cancers vésicaux et mammaires
Ce produit doit être utilisé par des personnes compétentes en milieu hospitalier. Le risque de surdosage reste donc théorique.
Les risques éventuels sont liés à l'administration accidentelle d'une activité trop élevée. La dose délivrée au patient peut être diminuée en administrant un inhibiteur de la fixation thyroïdienne, tel que le perchlorate de potassium, en administrant des émétiques et en favorisant l'élimination du radionucléide par une augmentation de la diurèse et de la fréquence des mictions.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Produit radiopharmaceutique à usage thérapeutique.
(V:DIVERS).
Aux concentrations chimiques et activités administrées pour l'utilisation thérapeutique, l'iode-131 n'a aucun effet pharmacodynamique.
Les effets de l'irradiation sont dus à plus de 90 % aux rayonnements bêta moins dont le parcours moyen dans les tissus est de 0,5 mm.
5.2. Propriétés pharmacocinétiques
Après administration orale, l'iodure (131I) de sodium est rapidement absorbé au niveau de la partie proximale du tube digestif (90 % en 60 minutes). La pharmacocinétique est identique à celle de l'iodure non radioactif. L'iodure circulant se distribue dans le compartiment extra-thyroïdien, à partir duquel il est essentiellement fixé par la thyroïde ou éliminé par voie rénale. De petites quantités d'iodure (131I) sont fixées par les glandes salivaires, la muqueuse gastrique et peuvent également être retrouvées dans le lait maternel, le placenta et les plexus choroïdes. La période effective de l'iode radioactif est de l'ordre de 12 heures dans le plasma et d'environ 6 jours dans la thyroïde. Après administration d'iodure (131I) de sodium, la période effective est 0,4 jour pour 40 % environ de l'activité administrée, et 8 jours pour les 60 % restants. L'élimination est urinaire à 37-75 %, l'excrétion fécale est de 10 % environ, et l'excrétion par voie sudorale est pratiquement négligeable.
5.3. Données de sécurité préclinique
En raison des faibles quantités d'iode administrées par rapport aux apports iodés d'une alimentation normale (40-500 µg/jour), une toxicité aiguë est peu probable et n'a jamais été observée.
Il n'existe pas de données concernant la toxicité par administration réitérée d'iodure de sodium. Aucune étude des effets sur la reproduction chez l'animal, de mutagénicité à long terme ou du pouvoir carcinogène n'a été effectuée.
Corps et coiffe: gélatine
Aucune connue à ce jour
6 semaines après libération.
La date de péremption et l'heure de calibration sont imprimés sur l'étiquette du conditionnement extérieur.
6.4. Précautions particulières de conservation
La préparation doit être conservée entre +15°C et +25 °C, soit dans sa protection de plomb original, soit dans une protection ayant une épaisseur appropriée.
Le stockage doit être effectué conformément aux réglementations nationales relatives aux produits radioactifs.
6.5. Nature et contenu de l'emballage extérieur
1 gélule en flacon (polyéthylène) avec fermeture à vis. Boîte de 1.
6.6. Précautions particulières délimination et de manipulation
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE LAUTORISATION DE MISE SUR LE MARCHE
COVIDIEN IMAGING FRANCE
2, rue Diderot
La Clef Saint Pierre
78990 ELANCOURT
8. NUMERO(S) DAUTORISATION DE MISE SUR LE MARCHE
· 561 228-0: 1 gélule en flacon (polyéthylène).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE LAUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
Les données sur la dose absorbée, qui sont présentées dans les tableaux ci-dessous, ont été établies dans la publication n° 60 de la CIPR (Commission Internationale de Protection Radiologique).
Le modèle retenu par la CIPR repose sur une administration par voie intraveineuse. L'absorption de l'iodure radioactif étant rapide et complète, ce modèle s'applique également au cas de l'administration par voie orale. Cependant la voie orale entraîne la délivrance à la paroi gastrique d'une dose de radiation supplémentaire, qui s'ajoute à celle liée aux sécrétions salivaire et gastrique. Le temps de résidence dans l'estomac étant en moyenne de 0,5 heure, la dose absorbée par la paroi gastrique est augmentée d'environ 30 %.
Les doses de rayonnements délivrées aux différents organes qui ne sont pas forcément l'organe-cible du traitement, peuvent être influencées de manière significative par les modifications physiopathologiques induites par la maladie.
Pour évaluer le rapport bénéfice-risque, il est recommandé de calculer la dose efficace et les doses absorbées au niveau de chaque organe cible avant l'administration. L'activité pourra ainsi être ajustée en fonction de la taille de la thyroïde, de la période biologique et de facteurs prenant en compte l'état physiologique du malade (y compris une éventuelle carence en iode) et sa pathologie.
Fixation thyroïdienne bloquée (fixation: 0 %)
|
Organe |
DOSE ABSORBEE PAR UNITE D'ACTIVITE ADMINISTREE |
||||
|
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Paroi vésicale |
0,61 |
0,75 |
1,1 |
1,8 |
3,4 |
|
Reins |
0,065 |
0,080 |
0,12 |
0,17 |
0,31 |
|
Utérus |
0,054 |
0,067 |
0,11 |
0,17 |
0,30 |
|
Parois du côlon inf. |
0,043 |
0,052 |
0,082 |
0,13 |
0,23 |
|
Ovaires |
0,042 |
0,054 |
0,084 |
0,13 |
0,24 |
|
Intestin grêle |
0,038 |
0,047 |
0,075 |
0,12 |
0,22 |
|
Surrénales |
0,037 |
0,042 |
0,067 |
0,11 |
0,20 |
|
Paroi du côlon sup. |
0,037 |
0,045 |
0,070 |
0,12 |
0,21 |
|
Testicules |
0,037 |
0,045 |
0,075 |
0,12 |
0,23 |
|
Moelle rouge |
0,035 |
0,042 |
0,065 |
0,10 |
0,19 |
|
Pancréas |
0,035 |
0,043 |
0,069 |
0,11 |
0,21 |
|
Paroi gastrique |
0,034 |
0,040 |
0,064 |
0,10 |
0,19 |
|
Rate |
0,034 |
0,040 |
0,065 |
0,10 |
0,20 |
|
Seins |
0,033 |
0,033 |
0,052 |
0,085 |
0,17 |
|
Foie |
0,033 |
0,040 |
0,065 |
0,10 |
0,20 |
|
Surfaces osseuses |
0,032 |
0,038 |
0,061 |
0,097 |
0,19 |
|
Poumons |
0,031 |
0,038 |
0,060 |
0,096 |
0,19 |
|
Thyroïde |
0,029 |
0,038 |
0,063 |
0,10 |
0,20 |
|
Autres tissus |
0,032 |
0,039 |
0,062 |
0,10 |
0,19 |
|
Dose efficace (mSv/MBq) |
0,064 |
0,081 |
0,126 |
0,198 |
0,374 |
La paroi vésicale contribue pour 47,6 % de la dose efficace.
Blocage incomplet
Dose efficace (mSv/MBq) pour une fixation thyroïdienne faible
|
Fixation: 0,5 % |
0,50 |
0,79 |
1,20 |
2,60 |
4,90 |
|
Fixation: 1,0 % |
0,90 |
1,42 |
2,10 |
4,70 |
9,30 |
|
Fixation: 2,0 % |
1,60 |
2,60 |
4,20 |
9,30 |
17 |
Fixation thyroïdienne: 15 %
|
Organe |
DOSE ABSORBEE PAR UNITE D'ACTIVITE ADMINISTREE |
||||
|
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Thyroïde |
210 |
340 |
510 |
1100 |
2000 |
|
Paroi vésicale |
0,52 |
0,64 |
0,98 |
1,5 |
2,9 |
|
Paroi gastrique |
0,46 |
0,58 |
0,84 |
1,5 |
2,9 |
|
Intestin grêle |
0,28 |
0,35 |
0,62 |
1,0 |
2,0 |
|
Reins |
0,060 |
0,075 |
0,11 |
0,17 |
0,29 |
|
Paroi du côlon sup. |
0,059 |
0,065 |
0,10 |
0,16 |
0,28 |
|
Moelle rouge |
0,054 |
0,074 |
0,099 |
0,14 |
0,24 |
|
Utérus |
0,054 |
0,068 |
0,11 |
0,17 |
0,31 |
|
Poumons |
0,053 |
0,071 |
0,12 |
0,19 |
0,33 |
|
Pancréas |
0,052 |
0,062 |
0,10 |
0,15 |
0,27 |
|
Surfaces osseuses |
0,047 |
0,067 |
0,094 |
0,14 |
0,24 |
|
Seins |
0,043 |
0,043 |
0,081 |
0,13 |
0,25 |
|
Ovaires |
0,043 |
0,059 |
0,092 |
0,14 |
0,26 |
|
Rate |
0,042 |
0,051 |
0,081 |
0,12 |
0,23 |
|
Paroi du côlon inf. |
0,042 |
0,053 |
0,082 |
0,13 |
0,23 |
|
Surrénales |
0,036 |
0,043 |
0,071 |
0,11 |
0,22 |
|
Foie |
0,032 |
0,041 |
0,068 |
0,11 |
0,22 |
|
Testicules |
0,028 |
0,035 |
0,058 |
0,094 |
0,18 |
|
Autres tissus |
0,065 |
0,089 |
0,14 |
0,22 |
0,40 |
|
Dose efficace (mSv/MBq) |
11,1 |
17,9 |
26,8 |
58,7 |
107 |
Fixation thyroïdienne: 35 %
|
Organe |
DOSE ABSORBEE PAR UNITE D'ACTIVITE ADMINISTREE |
||||
|
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Thyroïde |
500 |
790 |
1200 |
2600 |
4700 |
|
Paroi gastrique |
0,46 |
0,59 |
0,85 |
1,5 |
3,0 |
|
Paroi vésicale |
0,40 |
0,50 |
0,76 |
1,2 |
2,3 |
|
Intestin grêle |
0,28 |
0,35 |
0,62 |
1,0 |
2,0 |
|
Poumons |
0,090 |
0,12 |
0,21 |
0,33 |
0,56 |
|
Moelle rouge |
0,086 |
0,12 |
0,16 |
0,22 |
0,35 |
|
Surfaces osseuses |
0,076 |
0,12 |
0,16 |
0,23 |
0,35 |
|
Seins |
0,067 |
0,066 |
0,13 |
0,22 |
0,40 |
|
Paroi du côlon sup. |
0,058 |
0,065 |
0,10 |
0,17 |
0,30 |
|
Reins |
0,056 |
0,072 |
0,11 |
0,17 |
0,29 |
|
Pancréas |
0,054 |
0,069 |
0,11 |
0,18 |
0,32 |
|
Utérus |
0,050 |
0,063 |
0,10 |
0,16 |
0,30 |
|
Rate |
0,046 |
0,059 |
0,096 |
0,15 |
0,28 |
|
Surrénales |
0,042 |
0,050 |
0,087 |
0,14 |
0,28 |
|
Ovaires |
0,042 |
0,057 |
0,090 |
0,14 |
0,27 |
|
Paroi du côlon inf. |
0,040 |
0,051 |
0,080 |
0,13 |
0,24 |
|
Foie |
0,037 |
0,049 |
0,082 |
0,14 |
0,27 |
|
Testicules |
0,026 |
0,032 |
0,054 |
0,089 |
0,18 |
|
Autres tissus |
0,11 |
0,16 |
0,26 |
0,41 |
0,71 |
|
Dose efficace (mSv/MBq) |
25,6 |
41,5 |
62,3 |
137 |
248 |
Fixation thyroïdienne: 55 %
|
Organe |
DOSE ABSORBEE PAR UNITE D'ACTIVITE ADMINISTREE |
||||
|
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Thyroïde |
790 |
1200 |
1900 |
4100 |
7400 |
|
Paroi gastrique |
0,46 |
0,59 |
0,86 |
1,5 |
3,0 |
|
Paroi vésicale |
0,29 |
0,36 |
0,54 |
0,85 |
1,6 |
|
Intestin grêle |
0,28 |
0,35 |
0,62 |
1,0 |
2,0 |
|
Poumons |
0,13 |
0,18 |
0,30 |
0,48 |
0,80 |
|
Moelle rouge |
0,12 |
0,18 |
0,22 |
0,29 |
0,46 |
|
Surfaces osseuses |
0,11 |
0,17 |
0,22 |
0,32 |
0,48 |
|
Seins |
0,091 |
0,089 |
0,19 |
0,31 |
0,56 |
|
Paroi du côlon sup. |
0,058 |
0,067 |
0,11 |
0,18 |
0,32 |
|
Pancréas |
0,058 |
0,076 |
0,13 |
0,21 |
0,38 |
|
Rate |
0,051 |
0,068 |
0,11 |
0,17 |
0,33 |
|
Reins |
0,051 |
0,068 |
0,10 |
0,17 |
0,29 |
|
Surrénales |
0,049 |
0,058 |
0,11 |
0,17 |
0,34 |
|
Utérus |
0,046 |
0,060 |
0,099 |
0,16 |
0,30 |
|
Foie |
0,043 |
0,058 |
0,097 |
0,17 |
0,33 |
|
Ovaires |
0,041 |
0,056 |
0,090 |
0,15 |
0,27 |
|
Paroi du côlon inf. |
0,039 |
0,049 |
0,078 |
0,13 |
0,24 |
|
Testicules |
0,026 |
0,031 |
0,052 |
0,087 |
0,17 |
|
Autres tissus |
0,16 |
0,24 |
0,37 |
0,59 |
1,0 |
|
Dose efficace (mSv/MBq) |
40,2 |
65,0 |
100 |
214 |
391 |
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Gélules sont prêtes à l'emploi.
Le protocole d'administration
1- Sortir la boîte en fer blanc du colis et prendre le pot de plomb.
2- Tourner doucement le couvercle dans le sens des aiguilles d'une montre jusqu'à ce que vous rencontriez une légère résistance. Puis, soulevez le couvercle du pot de plomb qui reste solidaire du flacon intérieur.
3- Placer le flacon contenant la capsule dans l'activimètre pour déterminer la radioactivité.
4- Replacer le flacon dans le pot de plomb et remettre le couvercle du pot sans tourner.
5- Demander au patient de dévisser le couvercle du pot de plomb en tournant 3 fois dans le sens contraire des aiguilles d'une montre, ce qui dévissera simultanément la capsule du flacon.
6- Le patient enlève le couvercle de plastique du flacon avec le couvercle de plomb, soulève le pot de plomb contenant la gélule dans le flacon ouvert, et s'en sert comme d'un verre pour avaler la gélule.
Liste I
Prescription réservée à l'usage hospitalier.