RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 12/04/2010
ORALAIR 300 IR, comprimé sublingual
Traitement d'entretien
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Extrait allergénique de pollens des graminées suivantes: dactyle aggloméré (Dactylis glomerata L.), flouve odorante (Anthoxanthum odoratum L.), ivraie vivace (Lolium perenne L.), pâturin des prés (Poa pratensis L.) et fléole des prés (Phleum pratense L.) ................................................................................................. 300 IR* par comprimé sublingual
*IR (Indice de Réactivité):
L'unité IR a été définie pour mesurer l'allergénicité d'un extrait allergénique. Un extrait allergénique titre 100 IR/mL lorsque, utilisé en prick-test à l'aide d'une lancette standardisée (Stallerpoint), il provoque une papule d'un diamètre de 7 mm (moyenne géométrique) chez 30 sujets sensibilisés à cet allergène. La réactivité cutanée de ces sujets est simultanément démontrée par la positivité d'un prick-test au phosphate de codéine à 9 % ou d'histamine à 10 mg/mL. L'unité IR de Stallergenes n'est pas comparable aux unités utilisées par d'autres fabricants d'allergènes.
Excipient: lactose monohydraté
Un comprimé sublingual de 300 IR contient 81,8 à 83,1 mg de lactose monohydraté.
Pour la liste complète des excipients, voir rubrique 6.1.
Comprimé sublingual.
Les comprimés de 300 IR sont légèrement tachetés blancs à beiges avec « 300 » gravé sur les deux faces.
4.1. Indications thérapeutiques
Traitement de la rhinite allergique, avec ou sans conjonctivite, aux pollens de graminées, chez les adultes, les adolescents et les enfants (à partir de 5 ans) ayant une symptomatologie clinique significative avec confirmation diagnostique par un test cutané positif aux pollens de graminées et/ou la présence d'IgE spécifiques aux pollens de graminées.
4.2. Posologie et mode d'administration
Un traitement par Oralair ne doit être prescrit et initié que par des médecins formés et expérimentés dans le traitement des maladies allergiques. Le traitement chez l'enfant devra être conduit par un médecin formé et expérimenté dans le traitement des maladies allergiques de l'enfant.
La première prise du comprimé Oralair sera effectuée sous surveillance médicale pendant 30 minutes afin de prévoir la conduite à tenir en cas de survenue d'effets indésirables.
Posologie chez l'adulte, l'adolescent et l'enfant (à partir de 5 ans)
La thérapie se compose d'un traitement d'initiation (incluant une augmentation progressive de la dose sur une durée de 3 jours) et d'un traitement d'entretien.
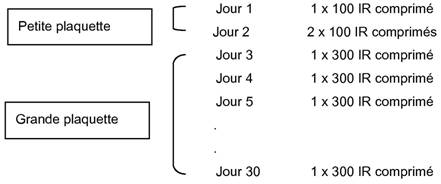
La boîte d'Oralair destinée au traitement en phase d'initiation contient les médicaments pour le premier mois de traitement incluant des comprimés Oralair 100 IR et Oralair 300 IR en 2 plaquettes différentes:

La boîte d'Oralair destinée au traitement d'entretien ne contient que des comprimés Oralair 300 IR et sera utilisée à partir du 2e mois en poursuivant par un comprimé sublingual Oralair 300 IR par jour. Cette posologie sera maintenue jusqu'à la fin de la saison pollinique.
Le comprimé sublingual doit être placé sous la langue jusqu'à sa dissolution complète (pendant au moins 1 minute) avant d'avaler. Pour le deuxième jour du traitement, les 2 comprimés 100 IR seront placés simultanément sous la langue avant d'avaler.
Il est recommandé de prendre le comprimé le matin, à jeun.
Le traitement doit être initié environ 4 mois avant le début estimé de la saison pollinique et poursuivi pendant toute la saison pollinique.
Aucune donnée n'est disponible actuellement concernant l'efficacité d'Oralair au-delà d'une saison pollinique. Lorsqu'il n'y a pas d'amélioration significative des symptômes au cours de la première saison pollinique, la poursuite du traitement n'est pas justifiée.
Il n'y a pas d'expérience clinique concernant l'immunothérapie spécifique par Oralair chez le jeune enfant (< 5 ans) et chez les patients âgés de plus de 45 ans.
· Hypersensibilité (allergie) à l'un des excipients;
· Traitement simultané par bêtabloquants;
· Asthme sévère et/ou instable (VEMS < 70 % de la valeur théorique);
· Déficit immunitaire sévère ou maladie auto-immune;
· Affections malignes (par ex. cancer);
· Inflammations de la muqueuse buccale (notamment lichen plan, ulcération ou mycose).
4.4. Mises en garde spéciales et précautions d'emploi
En cas de chirurgie bucco-dentaire, y compris d'extraction dentaire, le traitement par Oralair doit être arrêté pendant 7 jours afin de permettre la cicatrisation de la muqueuse buccale. Le traitement peut ensuite être repris à la dose d'entretien. En cas d'interruption du traitement pendant une durée plus longue, la reprise du traitement peut se faire avec la dose d'entretien mais sous surveillance médicale.
En cas de réactions allergiques sévères, l'utilisation d'adrénaline peut être nécessaire. Chez les patients traités par des anti-dépresseurs tricycliques et par les inhibiteurs de la monoamine oxydase (IMAO), les effets de l'adrénaline peuvent être potentialisés jusqu'à mettre en jeu le pronostic vital. Ce risque devra être pris en considération avant de commencer une immunothérapie spécifique chez ces patients.
Aucune donnée clinique n'est disponible concernant la vaccination au cours d'une immunothérapie spécifique par Oralair. La vaccination pourra être envisagée sans interrompre le traitement par Oralair, seulement après un examen médical évaluant l'état général du patient.
Ce médicament contient du lactose. Son utilisation est déconseillée chez les patients présentant une intolérance au galactose, un déficit en lactase de Lapp ou un syndrome de malabsorption du glucose ou du galactose (maladies héréditaires rares).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune interaction n'a été rapportée lors des études cliniques menées avec Oralair et au cours desquelles les patients pouvaient prendre des médicaments pour traiter les symptômes de l'allergie (antihistaminiques, stéroïdes).
Aucune donnée n'est disponible sur les risques éventuels de l'association d'une immunothérapie avec d'autres allergènes administrée au cours du traitement par Oralair.
Pour Oralair, il n'existe pas de donnée clinique concernant des grossesses exposées.
Il n'est pas recommandé d'initier une immunothérapie au cours de la grossesse. En cas de survenue de grossesse en cours de traitement, le traitement peut être poursuivi sous étroite surveillance.
Aucune donnée clinique n'est disponible concernant l'utilisation d'Oralair au cours de l'allaitement. Il n'est pas attendu d'effet spécifique sur le nourrisson. Néanmoins, il est préférable de ne pas initier une immunothérapie au cours de l'allaitement. Si la patiente est toutefois sous traitement au moment de l'accouchement, elle peut allaiter sous étroite surveillance.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Oralair n'a pas d'effet connu sur l'aptitude à conduire des véhicules et à utiliser des machines.
Lors d'un traitement par Oralair, le patient est exposé à des allergènes pouvant provoquer des réactions allergiques locales et/ou systémiques. Des réactions allergiques locales légères à modérées peuvent donc apparaître au cours du traitement (tel que: gonflement ou gêne buccale). Dans 50% des cas, ces réactions apparaissent au cours des trois premiers jours du traitement (augmentation de la dose). Il peut être nécessaire d'envisager un traitement symptomatique (ex: antihistaminiques) si des réactions locales sévères gênant le patient apparaissent.
Dans de très rares cas, des réactions allergiques plus importantes peuvent apparaître telles que: sensation de gonflement dans la gorge, troubles de la déglutition ou gêne respiratoire, et dysphonie. Le patient doit alors consulter immédiatement et le traitement doit être impérativement arrêté. Il ne devra pas être repris sans avis médical.
Les effets indésirables sont classés selon la classification MedDRA par système et par fréquence:
· Très fréquent (≥ 1/10);
· Fréquent (≥ 1/100, < 1/10);
· Peu fréquent (≥ 1/1 000, < 1/100);
· Rare (≥ 1/10 000, < 1/1 000);
· Très rare (< 1/10 000), fréquence indéterminée (la fréquence ne peut être estimée sur la base des données disponibles).
Expérience clinique chez les adultes (étude VO34.04):
Au cours d'une étude clinique menée chez des patients adultes présentant une rhinoconjonctivite allergique et recevant une dose de 300 IR par jour, 97/155 patients (63 %) ont rapporté des événements indésirables, comparés à 76/156 patients (49 %) recevant un placebo.
L'effet indésirable rapporté le plus fréquemment par les patients traités par la dose de 300 IR a été un prurit buccal chez 26 % des patients (5 % dans le groupe placebo).
6/155 patients (4 %) dans le groupe traité et 0/156 patients dans le groupe placebo ont arrêté prématurément leur traitement en raison d'un effet indésirable.
Les effets indésirables suivants ont été rapportés chez les patients adultes:
|
Système |
Fréquence |
Effet indésirable |
|
|
Troubles du système nerveux |
Fréquent |
Céphalée, paresthésie |
|
|
Troubles oculaires |
Fréquent |
Conjonctivite, prurit oculaire |
|
|
Troubles au niveau de l'oreille et du labyrinthe |
Fréquent |
Prurit de l'oreille |
|
|
Troubles respiratoires, thoraciques et médiastinaux |
Très fréquent |
Irritation de la gorge |
|
|
|
Fréquent |
Dyspnée, gonflement oropharyngé, congestion nasale, rhinorrhée, rhinite, sècheresse de la gorge, éternuement, gêne nasale. |
|
|
|
Peu fréquent |
Sensation de gorge serrée, douleur pharyngo-laryngée, irritation du larynx, sécheresse nasale |
|
|
Troubles gastro-intestinaux |
Très fréquent |
Prurit oral |
|
|
|
Fréquent |
Epigastralgie, nausées, dyspepsie, glossite, glossodynie, gonflement de la langue, dème de la langue, vésicules buccales, paresthésie orale, dème buccal, douleur buccale, gêne buccale, sècheresse buccale. |
|
|
|
Peu fréquent |
Colite, stomatite, sophagite, gastrite, dysphagie, hyperchlorhydrie, ptyalisme, gêne abdominale, diarrhée, éructation, hypoesthésie buccale, dème palatin, vésicules linguales, sensations anormales au niveau de la langue, vésicule labiale. |
|
|
Affections de la peau et du tissu sous-cutané |
Fréquent |
dème de la face, gonflement du visage, prurit, urticaire |
|
|
Infection et infestations Fréquent |
Fréquent |
Rhinite |
|
|
Troubles généraux et anomalies au site d'administration |
Fréquent |
Fatigue, sensation de corps étranger dans la bouche |
|
|
|
Peu fréquent |
Douleur au point d'application, tuméfaction locale, gêne thoracique, dèmes périphériques |
|
|
Troubles du système immunitaire |
Peu fréquent |
Hypersensibilité |
|
|
Troubles psychiatriques |
Peu fréquent |
Anxiété |
|
Ces réactions sont généralement apparues au cours des trois premiers jours de traitement (augmentation de la dose) et ont toutes été réversibles.
Expérience clinique chez les enfants et adolescents (étude VO52.06):
Au cours d'une étude clinique menée chez des enfants et adolescents (âgés de 5 à 17 ans) présentant une rhinoconjonctivite allergique et recevant une dose de 300 IR par jour, 118/139 patients (85 %) ont rapporté des évènements indésirables, comparés à 114/139 patients (82 %) recevant un placebo.
L'effet indésirable décrit le plus souvent chez les enfants et adolescents traités par la dose de 300 IR a été un prurit buccal chez 32 % des patients (1 % dans le groupe placebo).
6/139 patients (4 %) dans le groupe traité à la dose de 300 IR et 1/139 patients (1,5 %) dans le groupe placebo ont arrêté prématurément leur traitement en raison d'un effet indésirable.
Les effets indésirables suivants ont été rapportés par les enfants et adolescents (5 à 17 ans):
|
Système |
Fréquence |
Effet indésirable |
|
|
Troubles du système nerveux |
Peu fréquent |
Céphalée |
|
|
Troubles oculaires |
Fréquent |
Prurit oculaire |
|
|
Troubles au niveau de l'oreille et du labyrinthe |
Fréquent |
Prurit de l'oreille |
|
|
Congestion de l'oreille, gêne au niveau de l'oreille |
|
||
|
Troubles respiratoires, thoraciques et médiastinaux |
Fréquent |
Irritation de la gorge, congestion nasale, asthme, éternuement, gêne nasale, dyspnée, irritation du larynx, sensation de gorge serrée |
|
|
|
Peu fréquent |
Toux, rhinorrhée, dysphonie, dème laryngé, dème pharyngien |
|
|
Troubles gastro-intestinaux |
Très fréquent |
Prurit oral, dème buccal |
|
|
|
|
|
|
|
|
|
|
|
|
|
Fréquent |
Gonflement des lèvres et de la langue, vésicules buccales, stomatite, vomissement, chéilite, glossite, gêne buccale |
|
|
|
Peu fréquent |
Douleur abdominale, épigastralgie, nausées, dyspepsie, dysphagie, hypoesthésie buccale, odynophagie, douleur buccale, dème de la langue |
|
|
Affections de la peau et du tissu sous-cutané |
Fréquent |
Dermatite atopique, prurit |
|
|
Troubles musculo-squelettiques et systémiques |
Peu fréquent |
Douleurs de croissance |
|
|
Infections et infestations |
Peu fréquent |
Nasopharyngite, angine, bronchite, grippe |
|
|
Troubles généraux et anomalies au site d'administration |
Fréquent |
Gêne thoracique |
|
|
Troubles du système immunitaire |
Peu fréquent |
Hypersensibilité |
|
Aucun cas de surdosage n'a été rapporté.
Le risque d'effets indésirables, incluant réactions systémiques ou locales sévères, augmente si la dose journalière administrée est supérieure à celle qui est recommandée. En cas de symptômes annonçant une réaction sévère tels que: angio-dème, difficultés de déglutition, dyspnée, dysphonie ou sensation de gonflement dans la gorge, un avis médical immédiat est requis.
En cas de surdosage, le traitement des effets indésirables est symptomatique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique: EXTRAITS ALLERGENIQUES, POLLEN DE GRAMINEES, Code ATC: V01AA02.
Mécanisme d'action:
Oralair est utilisé pour traiter des patients ayant des symptômes d'allergie médiée par des IgE spécifiques tels qu'une rhinite et/ou une conjonctivite provoquée par les pollens de graminées.
Le système immunitaire est la cible de l'effet pharmacodynamique. L'objectif est d'induire une réponse immunitaire contre l'allergène avec lequel est traité le patient. Le mode d'action complet et exact de l'immunothérapie spécifique n'est pas entièrement connu et documenté. Le traitement par Oralair a montré qu'il induit une réponse systémique compétitive des anticorps anti-graminées et une augmentation des IgG spécifiques. La signification clinique de ces résultats n'a pas été établie.
Expérience clinique chez les adultes (étude VO34.04):
Une étude européenne multicentrique multinationale, randomisée, en double aveugle et contrôlée contre placebo a été menée. L'étude a inclus 628 patients présentant une rhinite et/ou rhinoconjonctivite allergique saisonnière aux pollens de graminées, confirmée par des tests cutanés et/ou la présence d'IgE spécifiques aux pollens de graminées.
Les patients ont été randomisés dans 4 groupes: placebo (n = 156), Oralair 100 IR/jour (n = 157), Oralair 300 IR/jour (n = 155) et Oralair 500 IR/jour (n = 160).
Chaque patient a reçu une dose sublinguale, quotidienne, pendant environ 4 mois avant le début de la saison pollinique et pendant toute une saison pollinique. L'analyse des résultats était basée sur 569 patients évaluables (placebo: n = 148; Oralair 100 IR: n = 142; Oralair 300 IR: n = 136; Oralair 500 IR: n = 143). L'efficacité a été déterminée en fonction du score total de symptômes de rhinoconjonctivite (voir détail du score plus bas) durant cette saison pollinique unique.
Les résultats de cette étude ont montré une efficacité comparable des doses 500 IR et 300 IR, avec des données de sécurité en faveur de la dose 300 IR, établissant ainsi la posologie préconisée à 300 IR par jour.
Les résultats concernant l'efficacité de la dose 300 IR par rapport au groupe placebo (le nombre de sujets inclus dans la population en Intention de Traiter (ITT) était de 136 pour Oralair et 148 pour le placebo) ont été les suivants:
Etude VO34.04: résultats sur les critères d'efficacité (au cours d'une seule saison pollinique)
Critère de jugement principal:
|
Etude VO34.04 |
ORALAIR 300IR |
Placebo |
Diff. absolue ajustée |
Diff. relative |
Valeur de p** |
|
Médiane |
Médiane |
% |
|||
|
Score des symptômes de rhinoconjonctiviteA |
3,58 (2,98) |
4,93 (3,23) |
-1,39 [-2,09; -0,69] |
27,3% |
0,0001 |
*Différence relative moyenne: Différence absolue / Placebo
**ANCOVA
AScore des symptômes: Moyenne des scores totaux de symptômes de rhinoconjonctivite quotidiens pour chaque patient au cours de la saison pollinique. Les symptômes de rhinoconjonctivite incluaient éternuements, rhinorrhée, prurit nasal, congestion nasale, larmoiement et prurit oculaire (échelle du score: 0 à 18, la valeur la plus élevée de 18 correspond au niveau de présence permanent très sévère pour les six symptômes).
Critères de jugement secondaires:
|
Etude VO34.04 |
ORALAIR 300 IR |
Placebo |
Diff. absolue ajustée |
Diff. relative |
Valeur de p** |
|
Médiane |
Médiane |
% |
|||
|
Utilisation de médicaments symptomatiques de secours B |
19,7% (24,8) |
27,9 % (29,3) |
- |
- |
- |
|
Score de qualité de vie C |
1,15 (0,99) |
1,45 (1,04) |
-0,26 [-0,36; -0,16] |
20,7% |
<0,0001 |
* Différence relative moyenne: Différence absolue / Placebo
** ANCOVA
B Utilisation de médicaments symptomatiques de secours: pourcentage de jours par patient avec au moins une prise d'un médicament de secours, valeur de p 0,0194 NS (test de Wilcoxon).
C Qualité de vie évaluée au moment du pic pollinique à l'aide du questionnaire Qualité de vie de la rhinoconjonctivite (RQLQ) (échelle de scores de 0 à 7, la valeur la plus élevée du score reflète la qualité de vie la plus mauvaise).
Evaluation globale de l'efficacité du traitement par le patient: 119 patients (88%) du groupe Oralair 300 IR et 108 patients (73%) du groupe placebo ont noté une amélioration légère à modérée ou bonne à excellente par rapport à leurs souvenirs de la saison pollinique précédente.
Les résultats de l'analyse ANCOVA des scores moyens pour chacun des six symptômes individuels de rhinoconjonctivite, cotés de 0 à 3, ont montré une différence en faveur des comprimés 300 IR comparés au placebo pour les éternuements (-0,19), rhinorrhée (-0,23), prurit nasal (-0,23), congestion nasale (-0,28), prurit oculaire (-0,24) et larmoiement (-0,21).
La proportion de patients n'utilisant pas de médicaments de secours était de 35,3% dans le groupe 300 IR et de 27,0% dans le groupe placebo (NS).
Analyses post-hoc (réalisées après la levée du double aveugle):
|
Etude VO34.04 |
ORALAIR 300IR |
Placebo |
Diff. absolue ajustée |
Diff. relative |
Valeur de p |
|
Médiane |
Médiane |
% |
|||
|
Score moyen ajusté des symptômesD |
4,17 (3,39) |
5,88 (3,82) |
-1,84 [-2,66; -1,02] |
29,1% |
<0,0001** |
|
Score moyen de médicaments symptomatiques de secours E |
0,31 (0,43) |
0,48 (0,53) |
-0,17 [-0,29; -0,05] |
35,0% |
0,0047** |
|
PSCD2-0 F |
43,5% (33,8) |
28,7% (30,7) |
- |
- |
0,0001*** |
|
PSFD G |
25,3% (30,2) |
14,9% (23,6) |
- |
- |
0,0006*** |
* Différence relative moyenne: Différence absolue / Placebo
** ANCOVA
*** test de Wilcoxon
D Score moyen ajusté des symptômes (AASS): score moyen des symptômes quotidiens, ajusté en fonction de la consommation de médicaments (pour chaque patient, utilisant les scores quotidiens des symptômes et le score quotidien d'utilisation des médicaments symptomatiques de secours).
E Score moyen de médicaments symptomatiques de secours: moyenne des scores quotidiens de médicaments symptomatiques de secours consommés pour chaque patient au cours de la saison pollinique. La consommation de médicaments a été pondérée comme suit: pas de médicaments symptomatiques de secours = 0, antihistamines (oral et/ou oculaire) = 1, corticostéroïdes nasaux = 2 et corticostéroïdes oraux = 3.
F Pourcentage des jours avec symptômes contrôlés (PSCD2-0): pourcentage des jours avec un score des symptômes inférieur ou égal à 2 et sans médicament symptomatique de secours.
G Proportion des jours sans symptôme et sans médicament de secours (PSFD): pourcentage des jours sans symptôme et sans prise de médicament symptomatique de secours.
Soixante et un patients (45%) du groupe 300 IR ont présenté plus de 50% de jours avec contrôle des symptômes (score des symptômes inférieur ou égal à 2 et pas de prise de médicaments symptomatiques de secours) sur l'ensemble de la saison pollinique, contre 40 patients (27%) dans le groupe Placebo.
Expérience clinique chez les enfants et adolescents (étude VO52.06):
Une étude européenne multicentrique multinationale, randomisée, en double aveugle et contrôlée contre placebo a été menée.
L'étude incluait 278 patients âgés de 5 à 17 ans présentant une rhinite et/ou une rhinoconjonctivite allergique saisonnière aux pollens de graminées, confirmée par des tests cutanés et/ou la présence d'IgE spécifiques aux pollens de graminées.
Les patients ont été randomisés en 2 groupes: placebo (n = 139) ou Oralair 300 IR/jour (n = 139). Chaque patient a reçu une dose sublinguale, quotidienne, pendant environ 4 mois avant le début de la saison pollinique ainsi que pendant toute une saison pollinique. Un schéma posologique croissant a été suivi pendant les 3 premiers jours du traitement, partant d'une dose initiale de 100 IR le premier jour, puis une dose de 200 IR le 2ème jour puis 300 IR au troisième jour. L'analyse des résultats est basée sur 266 patients évaluables (placebo, n = 135; Oralair 300 IR, n = 131). L'efficacité a été déterminée en fonction du score total de symptômes de rhinoconjonctivite (voir détails du score plus bas) durant cette saison pollinique unique.
Les résultats concernant l'efficacité de la dose 300 IR par rapport au groupe placebo (le nombre de sujets inclus dans la population en Intention de Traiter (ITT) était respectivement de 131 pour Oralair et 135 pour le placebo) ont été les suivants:
Etude VO52.06: résultats obtenus sur les critères d'efficacité (au cours d'une seule saison pollinique):
Critère de jugement principal:
|
Etude VO52.06 |
ORALAIR 300IR |
Placebo |
Diff. absolue ajustée |
Diff. relative |
Valeur de p** |
|
Médiane |
Médiane |
% |
|||
|
Score des symptômes de rhinoconjonctivite A |
3,25 (2,86) |
4,51 (2,93) |
-1,13 [-1,80; -0,46] |
28,0% |
0,001 |
* Différence relative moyenne: Différence absolue / Placebo
** ANCOVA
A Score des symptômes: Moyenne des scores totaux de symptômes de rhinoconjonctivite quotidiens pour chaque patient au cours de la saison pollinique. Les symptômes de rhinoconjonctivite incluaient éternuements, rhinorrhée, prurit nasal, congestion nasale, larmoiement et prurit oculaire (échelle du score: 0 à 18, la valeur la plus élevée de 18 correspond au niveau de présence permanent très sévère pour les six symptômes).
Critères de jugement secondaires:
|
Etude VO52.06 |
ORALAIR 300IR |
Placebo |
Diff. absolue ajustée |
Diff. relative |
Valeur de p** |
|
Médiane |
Médiane |
% |
|||
|
Score moyen ajusté de médicaments symptomatiques de secours B |
0,60 (0,61) |
0,79 (0,65) |
-0,20 [-0,34; -0,06] |
24,1% |
0,0064 |
|
Utilisation de médicaments symptomatiques de secours C |
35,4% (33,2) |
46,5% (34,6) |
- |
- |
- |
* Différence relative moyenne: Différence absolue / Placebo
** ANCOVA
B Score moyen de médicaments symptomatiques de secours: moyenne des scores quotidiens de médicaments symptomatiques de secours consommés pour chaque patient au cours de la saison pollinique. La consommation de médicaments a été pondérée comme suit: pas de médicaments symptomatiques de secours = 0, antihistamines (oral et/ou oculaire) = 1, corticostéroïdes nasaux = 2 et corticostéroïdes oraux = 3.
C Utilisation de médicaments symptomatiques de secours: pourcentage de jours par patients avec au moins une prise d'un médicament symptomatique de secours, valeur de p 0,0194 NS (test de Wilcoxon).
Scores des symptômes individuels: les résultats de l'analyse ANCOVA des scores moyens pour chacun des six symptômes individuels de rhinoconjonctivite, cotés de 0 à 3, ont montré une différence en faveur des comprimés 300 IR comparés au placebo pour la rhinorrhée (-0,16), la congestion nasale (-0,26), le prurit oculaire (-0,33) et le larmoiement (-0,21).
La proportion de patients n'utilisant pas de médicaments symptomatiques de secours était de 18,3% dans le groupe 300 IR et 14,8% dans le groupe placebo (NS).
Analyses post-hoc (réalisées après la levée du double aveugle):
|
Etude VO52.06 |
ORALAIR 300IR |
Placebo |
Diff. absolue ajustée |
Diff. relative |
Valeur de p |
|
Médiane |
Médiane |
% |
|||
|
Score moyen ajusté des symptômes D |
4,30 (3,57) |
6,12 (3,85) |
-1,64 [-2,51; -0,78] |
29,8% |
0,0002** |
|
PSCD2-0E |
33.8% (30,0) |
23,7% (27,2) |
- |
- |
0,0107*** |
|
PSFD F |
19,2% (24,9) |
10,5% (18,4) |
- |
- |
0,0037*** |
* Différence relative moyenne: Différence absolue / Placebo
** ANCOVA
*** Test de Wilcoxon
D Score moyen ajusté des symptômes (AASS): score moyen des symptômes quotidiens, ajusté en fonction de la consommation de médicaments (pour chaque patient, en utilisant les scores quotidiens des symptômes et le score quotidien d'utilisation des médicaments symptomatiques de secours).
E Pourcentage des jours avec symptômes contrôlés (PSCD2-0): pourcentage des jours avec un score des symptômes inférieur ou égal à 2 et sans médicament symptomatique de secours.
F Proportion des jours sans symptôme et sans médicament de secours (PSFD): pourcentage des jours sans symptôme et sans prise de médicament symptomatique de secours.
Quarante-quatre patients (34%) du groupe 300 IR ont présenté plus de 50% de jours avec contrôle des symptômes (score des symptômes inférieur ou égal à 2 et pas de prise de médicament symptomatique de secours) sur l'ensemble de la saison pollinique, contre 26 patients (19%) dans le groupe placebo.
5.2. Propriétés pharmacocinétiques
La plupart des allergènes contenus dans Oralair sont un mélange de protéines et de glycoprotéines. Il n'y a pas de passage systémique des extraits allergéniques intacts. Aussi, aucune étude pharmacocinétique chez l'animal ou chez l'homme n'a été conduite pour étudier le profil pharmacocinétique et le métabolisme d'Oralair.
5.3. Données de sécurité préclinique
Les données pré-cliniques issues des études conventionnelles de toxicité après administration unique et après administration répétée chez l'animal, de génotoxicité, de tolérance locale et de développement embryo-ftal n'ont pas révélé de risque particulier pour l'homme.
Dans une étude de toxicité chez le rat juvénile, une posologie journalière administrée pendant 10 semaines à la dose la plus élevée (correspondant à 300 fois la dose thérapeutique chez l'homme) a été associée à un temps de thromboplastine partielle activée (TTPA) significativement raccourci chez le mâle uniquement, sans qu'aucun signe clinique ni anomalie histologique n'ait été observé.
· Cellulose microcristalline;
· Croscarmellose sodique;
· Silice colloïdale anhydre;
· Stéarate de magnésium;
· Lactose monohydraté.
Sans objet.
2 ans.
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation concernant la température.
A conserver dans l'emballage extérieur d'origine à l'abri de l'humidité. Ne pas congeler.
6.5. Nature et contenu de l'emballage extérieur
Traitement d'entretien
1 x 30 comprimés sublinguaux de 300 IR dans une plaquette thermoformée (alu/alu) composée d'un film (polyamide/aluminium/chlorure de polyvinyle) d'un côté et d'une feuille scellée à chaud (aluminium) recouverte d'un vernis (vinyle) sur l'autre face. Boîte de 1 ou de 3.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières délimination et de manipulation
Pas d'exigences particulières.
7. TITULAIRE DE LAUTORISATION DE MISE SUR LE MARCHE
STALLERGENES S.A.
6 RUE ALEXIS DE TOCQUEVILLE
92160 ANTONY
FRANCE
8. NUMERO(S) DAUTORISATION DE MISE SUR LE MARCHE
· 368 952-2 ou 34009 368 952 2 5: 1 plaquette thermoformée (Alu/Alu) de 30 comprimés sublinguaux de 300 IR. Boîte de 1.
· 368 953-9 ou 34009 368 953 9 3: 1 plaquette thermoformée (Alu/Alu) de 30 comprimés sublinguaux de 300 IR. Boîte de 3.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE LAUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I.