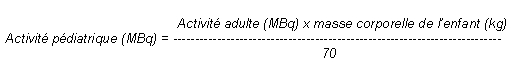
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 14/06/1999
IODURE (131 I) DE SODIUM POUR DIAGNOSTIC, CIS BIO INTERNATIONAL, en gélule. [Référence: I-131-D-B]
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Iodure (131I) de sodium .................................................................................. 1,85 MBq à la date de calibration
Pour une gélule.
L'iode-131 est obtenu par fission d'uranium-235 ou par bombardement neutronique de tellure stable. La période de l'iode-131 est de 8,04 jours. Il décroît en xénon-131 stable par émission de rayonnement gamma de 364 keV (81 %), 637 keV (7,3 %) et 284 keV (6,0 %) et de rayonnement bêta moins d'énergie maximale 606 keV.
Pour la liste complète des excipients, voir rubrique 6.1.
Gélule.
4.1. Indications thérapeutiques
· Une dose "traceuse" d'iodure (131I) de sodium peut être administrée pour étudier la cinétique de l'iode. Les informations obtenues sur la fixation thyroïdienne et la période effective de l'iode radioactif peuvent être utilisées pour calculer l'activité thérapeutique à administrer.
· Dans le cadre du traitement d'une pathologie thyroïdienne maligne, après thyroïdectomie, l'iodure (131I) de sodium permet de rechercher les reliquats de tissu thyroïdien et les métastases.
Dans le cas d'une pathologie thyroïdienne bénigne, l'iode-131 ne peut être utilisé pour réaliser une scintigraphie thyroïdienne que si les produits radiopharmaceutiques marqués à l'iode-123 ou au technétium-99m, présentant une dosimétrie plus favorable, ne sont pas disponibles.
4.2. Posologie et mode d'administration
Chez l'adulte (70 kg), les activités recommandées sont les suivantes :
· Etude de la fixation thyroïdienne: 1 - 4 MBq.
· Après thyroïdectomie (recherche de métastases et de reliquats thyroïdiens): 400 MBq au maximum.
· Scintigraphie thyroïdienne: 8 - 11 MBq.
Les images peuvent être acquises 4 heures après l'administration et entre 18 et 24 heures après l'administration. Pour la scintigraphie, d'autres images peuvent être acquises 72 heures après l'administration.
Chez l'enfant de plus de 10 ans, l'activité administrée est une fraction de celle utilisée chez l'adulte. Elle est calculée en fonction de la masse ou de la surface corporelle selon les formules ci-dessous:
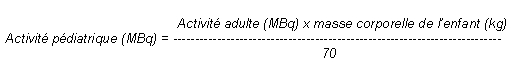
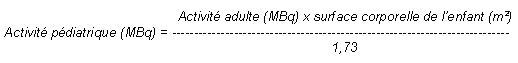
L'activité à administrer chez l'enfant peut aussi être calculée par application des coefficients suivants (selon E.A.N.M.: European Association of Nuclear Medicine):
|
3 kg = 0,10 |
22 kg = 0,50 |
42 kg = 0,78 |
|
4 kg = 0,14 |
24 kg = 0,53 |
44 kg = 0,80 |
|
6 kg = 0,19 |
26 kg = 0,56 |
46 kg = 0,82 |
|
8 kg = 0,23 |
28 kg = 0,58 |
48 kg = 0,85 |
|
10 kg = 0,27 |
30 kg = 0,62 |
50 kg = 0,88 |
|
12 kg = 0,32 |
32 kg = 0,65 |
52-54 kg = 0,90 |
|
14 kg = 0,36 |
34 kg = 0,68 |
56-58 kg = 0,92 |
|
16 kg = 0,40 |
36 kg = 0,71 |
60-62 kg = 0,96 |
|
18 kg = 0,44 |
38 kg = 0,73 |
64-66 kg = 0,98 |
|
20 kg = 0,46 |
40 kg = 0,76 |
68 kg = 0,99 |
La gélule est administrée par voie orale avec une boisson. Elle doit être avalée entière.
Pour favoriser le passage de la gélule dans l'œsophage et créer dans l'estomac un milieu favorable à sa dissolution, le patient doit boire une boisson chaude immédiatement après l'ingestion de la gélule.
· Grossesse.
· Explorations diagnostiques chez l'enfant de moins de 10 ans.
· Scintigraphie thyroïdienne chez les patients présentant une pathologie thyroïdienne bénigne, sauf lorsque des produits radiopharmaceutiques marqués à l'iode-123 ou au technétium-99m ne peuvent être employés.
· Patients présentant une dysphagie, une sténose œsophagienne, une gastrite évolutive, des lésions gastriques érosives ou un ulcère gastroduodénal.
· Patients présentant une suspicion de ralentissement de la motricité gastrointestinale.
4.4. Mises en garde spéciales et précautions d'emploi
Les produits radiopharmaceutiques ne doivent être réceptionnés, utilisés et administrés que par des personnes autorisées dans des services agréés. Leur réception, leur stockage, leur utilisation, leur transfert et leur élimination sont soumis aux réglementations et aux autorisations appropriées des autorités compétentes.
Les produits radiopharmaceutiques doivent être préparés de manière à satisfaire à la fois aux normes de radioprotection et de qualité pharmaceutique.
L'administration de ce produit entraîne généralement des doses d'irradiation élevées.
Il convient de prendre les mesures appropriées afin d'éviter toute contamination par l'activité éliminée par la patient.
Chez l'enfant de plus de 10 ans et l'adolescent, l'administration est déconseillée, sauf circonstances exceptionnelles.
Pour l'utilisation de l'iodure (131I) de sodium dans les indications diagnostiques, il n'existe pas d'argument en faveur d'une fréquence plus élevée de pathologies malignes (cancer, leucémie ou mutations) chez l'homme.
En cas d'hypersensibilité connue à la gélatine ou à ses métabolites, l'administration de la solution (131I) d'iodure de sodium doit être préférée.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
De nombreuses substances pharmacologiques interagissent avec l'iode. Les mécanismes de ces interactions sont variés et peuvent reposer sur une modification de la liaison aux protéines, ou sur une modification des propriétés pharmacocinétiques ou pharmacodynamiques. Il est donc indispensable d'interroger soigneusement le patient afin d'identifier tous les médicaments dont la prise doit être suspendue avant l'administration de la gélule d'iodure (131I) de sodium.
A titre d'exemple, la prise des médicaments suivants doit être arrêtée:
· en général 1 semaine avant le traitement: antithyroïdiens (carbimazole ou autres dérivés imidazolés tels que propylthiouracil), salicylés, corticoïdes, nitroprussiate de sodium, bromosulfophthaléine sodique, perchlorate, ainsi que divers autres médicaments (anticoagulants, antihistaminiques, antiparasitaires, pénicillines, sulfamides, tolbutamide, thiopentane);
· 1 à 2 semaines avant le traitement: phénylbutazone;
· 2 semaines avant le traitement: certaines préparations vitaminées et fluidifiants bronchiques;
· 2 à 6 semaines avant le traitement: produits de substitution hormonale de synthèse ou naturels à visée thyroïdienne (thyroxine sodique, liothyronine sodique, extrait thyroïdien);
· 4 semaines avant le traitement: amiodarone, benzodiazépines et lithium;
· 1 à 9 mois avant le traitement: produits iodés pour application locale;
· enfin jusqu'à 1 an avant le traitement: produits de contraste iodés.
L'iodure (131I) de sodium est contre-indiqué en cas de grossesse, de suspicion de grossesse, ou lorsque cette éventualité n'a pas été exclue (la dose de radiations absorbée au niveau de l'utérus pour ce produit se situe vraisemblablement entre 11 et 511 mGy; de plus, la thyroïde fœtale présente une avidité particulière pour l'iode au cours des 2ème et 3ème trimestres).
Lorsqu'il est nécessaire d'administrer des produits radiopharmaceutiques à la femme en âge de procréer, toute éventualité de grossesse doit être écartée. Toute femme n'ayant pas eu ses règles doit être considérée comme enceinte jusqu'à preuve du contraire. D'autres techniques n'impliquant pas l'emploi de radiations ionisantes peuvent être envisagées.
Avant d'administrer un produit radiopharmaceutique à une femme souhaitant poursuivre l'allaitement maternel, il convient d'estimer si l'examen peut être différé jusqu'à la fin de l'allaitement. Après l'administration d'iodure (131I) de sodium, l'allaitement sera arrêté définitivement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Aucun effet connu à ce jour.
Pour chaque patient, l'exposition aux radiations ionisantes doit être justifiée par le bénéfice attendu. L'activité administrée doit correspondre à la plus faible dose de radiations possible compatible avec le résultat diagnostique escompté.
L'exposition aux radiations ionisantes peut théoriquement induire des cancers et/ou des anomalies héréditaires. L'expérience montre que, pour ce qui est des examens diagnostiques en médecine nucléaire, la fréqence de ces effets indésirables est très faible en raison des faibles activités utilisées.
Pour la plupart des examens de médecine nucléaire à des fins de diagnostic, la dose de radiations délivrée (dose efficace) est inférieure à 20 mSv. Avec ce produit, cette dose délivrée est en général dépassée.
Quelques effets indésirables, consécutifs à l'administration d'iodure (131I) de sodium, ont été signalés: nausées, vomissements et troubles non spécifiques peut-être de nature allergique. Les nausées et les vomissements sont plus fréquents après adminstration par voie orale, et présentent un risque de contamination à ne pas négliger.
Quelques cas de manifestations allergiques ont été signalés après l'administration d'iodure (131I) sodium. Ces réactions sont vraisemblablement liées à une hypersensibilité vis-à-vis de la gélatine constituant les gélules ou vis-à-vis de ses métabolites.
Ce produit doit être utilisé par des personnes compétentes en milieu hospitalier. Le risque de surdosage reste donc théorique.
Les risques éventuels sont liés à l'administration accidentelle d'une activité trop élevée. La dose délivrée au patient peut être diminuée en administrant un inhibiteur de la fixation thyroïdienne, tel que le perchlorate de potassium, en administrant des émétiques et en favorisant l'élimination du radionucléide par une augmentation de la diurèse et de la fréquence des mictions.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Produit radiopharmaceutique à usage diagnostique,
(V: DIVERS).
Aux concentrations chimiques et activités administrées pour l'utilisation diagnostique, l'iode-131 n'a aucun effet pharmacodynamique.
Les effets de l'irradiation sont dus, à plus de 90 %, au rayonnement bêta moins dont le parcours moyen dans les tissus est de 0,5 mm.
5.2. Propriétés pharmacocinétiques
Après administration orale, l'iodure (131I) de sodium est rapidement absorbé au niveau de la partie proximale du tube digestif (90 % en 60 minutes). La pharmacocinétique est identique à celle de l'iodure non radioactif. L'iodure circulant se distribue dans le compartiment extra-thyroïdien, à partir duquel il est essentiellement fixé par la thyroïde ou éliminé par voie rénale.
De petites quantités d'iodure (131I) sont fixées par les glandes salivaires, la muqueuse gastrique et peuvent également être retrouvées dans le lait maternel, le placenta et les plexus choroïdes. La période effective de l'iode radioactif est de l'ordre de 12 heures dans le plasma et d'environ 6 jours dans la thyroïde. Après administration d'iodure (131I) de sodium, la période effective est 0,4 jour pour 40 % environ de l'activité administrée, et 8 jours pour les 60 % restants. L'élimination est urinaire à 37-75 %, l'excrétion fécale est de 10 % environ, et l'excrétion par voie sudorale est pratiquement négligeable.
5.3. Données de sécurité préclinique
En raison des faibles quantités d'iode administrées par rapport aux apports iodés d'une alimentation normale (40-500 µg/jour), une toxicité aiguë est peu probable et n'a jamais été observée.
Il n'existe pas de données concernant la toxicité par administration réitérée d'iodure de sodium. Aucune étude des effets sur la reproduction chez l'animal, de mutagénicité à long terme ou du pouvoir carcinogène n'a été effectuée.
Enveloppe de la gélule:
Corps: gélatine, dioxyde de titane
Coiffe: gélatine, dioxyde de titane, oxyde de fer noir
Aucune connue à ce jour
43 jours à compter de la date de fabrication. La date de péremption est indiquée sur le conditionnement extérieur et sur chaque flacon.
6.4. Précautions particulières de conservation
Le produit doit être conservé à une température comprise entre +15°C et +25°C.
Le stockage doit être effectué conformément aux réglementations nationales relatives aux produits radioactifs.
6.5. Nature et contenu de l'emballage extérieur
Flacon en verre étiré incolore, type III de la Pharmacopée Européenne, fermé par une capsule en polyéthylène.
6.6. Précautions particulières d’élimination et de manipulation
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
CIS BIO INTERNATIONAL
RN 306
BP 32
91192 Gif-sur-Yvette Cedex
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 554 595-1: 1 à 20 gélules en flacon (verre).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
Les données sur la dose absorbée, qui sont présentées dans les tableaux ci-dessous, ont été établies dans la publication n° 60 de la CIPR (Commission Internationale de Protection Radiologique).
Le modèle retenu par la CIPR repose sur une administration par voie intraveineuse. L'absorption de l'iodure radioactif étant rapide et complète, ce modèle s'applique également au cas de l'administration par voie orale. Cependant la voie orale entraîne la délivrance à la paroi gastrique d'une dose de radiation supplémentaire, qui s'ajoute à celle liée aux sécrétions salivaire et gastrique. Le temps de résidence dans l'estomac étant en moyenne de 0,5 heure, la dose absorbée par la paroi gastrique est augmentée d'environ 30 %.
La dose efficace à la suite d'une administration de 400 MBq se situe généralement entre 25,6 mSv (0 % de fixation thyroïdienne) et 16 080 mSv (55 % de fixation thyroïdienne).
Dans les mêmes conditions, la dose délivrée à la thyroïde se situe entre 11,6 et 316 000 mGy et au niveau de la paroi vésicale entre 244 et 116 mGy.
Ces chiffres reposent sur les paramètres suivants:
Masse thyroïdienne:......................................................................................... 20 g
Période biologique:......................................................................................80 jours
Facteur de recyclage:......................................................................................... 1,8
Fixation thyroïdienne bloquée (fixation: 0 %)
|
Organe |
DOSE ABSORBEE PAR UNITE D'ACTIVITE ADMINISTREE |
||||
|
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Paroi vésicale |
0,61 |
0,75 |
1,1 |
1,8 |
3,4 |
|
Reins |
0,065 |
0,080 |
0,12 |
0,17 |
0,31 |
|
Utérus |
0,054 |
0,067 |
0,11 |
0,17 |
0,30 |
|
Paroi du côlon inf. |
0,043 |
0,052 |
0,082 |
0,13 |
0,23 |
|
Ovaires |
0,042 |
0,054 |
0,084 |
0,13 |
0,24 |
|
Intestin grêle |
0,038 |
0,047 |
0,075 |
0,12 |
0,22 |
|
Surrénales |
0,037 |
0,042 |
0,067 |
0,11 |
0,20 |
|
Paroi du côlon sup. |
0,037 |
0,045 |
0,070 |
0,12 |
0,21 |
|
Testicules |
0,037 |
0,045 |
0,075 |
0,12 |
0,23 |
|
Moelle rouge |
0,035 |
0,042 |
0,065 |
0,10 |
0,19 |
|
Pancréas |
0,035 |
0,043 |
0,069 |
0,11 |
0,21 |
|
Paroi gastrique |
0,034 |
0,040 |
0,064 |
0,10 |
0,19 |
|
Rate |
0,034 |
0,040 |
0,065 |
0,10 |
0,20 |
|
Seins |
0,033 |
0,033 |
0,052 |
0,085 |
0,17 |
|
Foie |
0,033 |
0,040 |
0,065 |
0,10 |
0,20 |
|
Surfaces osseuses |
0,032 |
0,038 |
0,061 |
0,097 |
0,19 |
|
Poumons |
0,031 |
0,038 |
0,060 |
0,096 |
0,19 |
|
Thyroïde |
0,029 |
0,038 |
0,063 |
0,10 |
0,20 |
|
Autres tissus |
0,032 |
0,039 |
0,062 |
0,10 |
0,19 |
|
Dose efficace (mSv/MBq) |
0,064 |
0,081 |
0,126 |
0,198 |
0,374 |
La paroi vésicale contribue pour 47,6 % de la dose efficace.
Blocage incomplet
Dose efficace (mSv/MBq) pour une fixation thyroïdienne faible
|
Fixation: 0,5 % |
0,50 |
0,79 |
1,20 |
2,60 |
4,90 |
|
Fixation: 1,0 % |
0,90 |
1,42 |
2,10 |
4,70 |
9,30 |
|
Fixation: 2,0 % |
1,60 |
2,60 |
4,20 |
9,30 |
17 |
Fixation thyroïdienne: 15 %
|
Organe |
DOSE ABSORBEE PAR UNITE D'ACTIVITE ADMINISTREE |
||||
|
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Thyroïde |
210 |
340 |
510 |
1100 |
2000 |
|
Paroi vésicale |
0,52 |
0,64 |
0,98 |
1,5 |
2,9 |
|
Paroi gastrique |
0,46 |
0,58 |
0,84 |
1,5 |
2,9 |
|
Intestin grêle |
0,28 |
0,35 |
0,62 |
1,0 |
2,0 |
|
Reins |
0,060 |
0,075 |
0,11 |
0,17 |
0,29 |
|
Paroi du côlon sup. |
0,059 |
0,065 |
0,10 |
0,16 |
0,28 |
|
Moelle rouge |
0,054 |
0,074 |
0,099 |
0,14 |
0,24 |
|
Utérus |
0,054 |
0,068 |
0,11 |
0,17 |
0,31 |
|
Poumons |
0,053 |
0,071 |
0,12 |
0,19 |
0,33 |
|
Pancréas |
0,052 |
0,062 |
0,10 |
0,15 |
0,27 |
|
Surfaces osseuses |
0,047 |
0,067 |
0,094 |
0,14 |
0,24 |
|
Seins |
0,043 |
0,043 |
0,081 |
0,13 |
0,25 |
|
Ovaires |
0,043 |
0,059 |
0,092 |
0,14 |
0,26 |
|
Rate |
0,042 |
0,051 |
0,081 |
0,12 |
0,23 |
|
Paroi du côlon inf. |
0,042 |
0,053 |
0,082 |
0,13 |
0,23 |
|
Surrénales |
0,036 |
0,043 |
0,071 |
0,11 |
0,22 |
|
Foie |
0,032 |
0,041 |
0,068 |
0,11 |
0,22 |
|
Testicules |
0,028 |
0,035 |
0,058 |
0,094 |
0,18 |
|
Autres tissus |
0,065 |
0,089 |
0,14 |
0,22 |
0,40 |
|
Dose efficace (mSv/MBq) |
11,1 |
17,9 |
26,8 |
58,7 |
107 |
Fixation thyroïdienne: 35 %
|
Organe |
DOSE ABSORBEE PAR UNITE D'ACTIVITE ADMINISTREE |
||||
|
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Thyroïde |
500 |
790 |
1200 |
2600 |
4700 |
|
Paroi gastrique |
0,46 |
0,59 |
0,85 |
1,5 |
3,0 |
|
Paroi vésicale |
0,40 |
0,50 |
0,76 |
1,2 |
2,3 |
|
Intestin grêle |
0,28 |
0,35 |
0,62 |
1,0 |
2,0 |
|
Poumons |
0,090 |
0,12 |
0,21 |
0,33 |
0,56 |
|
Moelle rouge |
0,086 |
0,12 |
0,16 |
0,22 |
0,35 |
|
Surfaces osseuses |
0,076 |
0,12 |
0,16 |
0,23 |
0,35 |
|
Seins |
0,067 |
0,066 |
0,13 |
0,22 |
0,40 |
|
Paroi du côlon sup. |
0,058 |
0,065 |
0,10 |
0,17 |
0,30 |
|
Reins |
0,056 |
0,072 |
0,11 |
0,17 |
0,29 |
|
Pancréas |
0,054 |
0,069 |
0,11 |
0,18 |
0,32 |
|
Utérus |
0,050 |
0,063 |
0,10 |
0,16 |
0,30 |
|
Rate |
0,046 |
0,059 |
0,096 |
0,15 |
0,28 |
|
Surrénales |
0,042 |
0,050 |
0,087 |
0,14 |
0,28 |
|
Ovaires |
0,042 |
0,057 |
0,090 |
0,14 |
0,27 |
|
Paroi du côlon inf. |
0,040 |
0,051 |
0,080 |
0,13 |
0,24 |
|
Foie |
0,037 |
0,049 |
0,082 |
0,14 |
0,27 |
|
Testicules |
0,026 |
0,032 |
0,054 |
0,089 |
0,18 |
|
Autres tissus |
0,11 |
0,16 |
0,26 |
0,41 |
0,71 |
|
Dose efficace (mSv/MBq) |
25,6 |
41,5 |
62,3 |
137 |
248 |
Fixation thyroïdienne: 55 %
|
Organe |
DOSE ABSORBEE PAR UNITE D'ACTIVITE ADMINISTREE |
||||
|
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Thyroïde |
790 |
1200 |
1900 |
4100 |
7400 |
|
Paroi gastrique |
0,46 |
0,59 |
0,86 |
1,5 |
3,0 |
|
Paroi vésicale |
0,29 |
0,36 |
0,54 |
0,85 |
1,6 |
|
Intestin grêle |
0,28 |
0,35 |
0,62 |
1,0 |
2,0 |
|
Poumons |
0,13 |
0,18 |
0,30 |
0,48 |
0,80 |
|
Moelle rouge |
0,12 |
0,18 |
0,22 |
0,29 |
0,46 |
|
Surfaces osseuses |
0,11 |
0,17 |
0,22 |
0,32 |
0,48 |
|
Seins |
0,091 |
0,089 |
0,19 |
0,31 |
0,56 |
|
Paroi du côlon sup. |
0,058 |
0,067 |
0,11 |
0,18 |
0,32 |
|
Pancréas |
0,058 |
0,076 |
0,13 |
0,21 |
0,38 |
|
Rate |
0,051 |
0,068 |
0,11 |
0,17 |
0,33 |
|
Reins |
0,051 |
0,068 |
0,10 |
0,17 |
0,29 |
|
Surrénales |
0,049 |
0,058 |
0,11 |
0,17 |
0,34 |
|
Utérus |
0,046 |
0,060 |
0,099 |
0,16 |
0,30 |
|
Foie |
0,043 |
0,058 |
0,097 |
0,17 |
0,33 |
|
Ovaires |
0,041 |
0,056 |
0,090 |
0,15 |
0,27 |
|
Paroi du côlon inf. |
0,039 |
0,049 |
0,078 |
0,13 |
0,24 |
|
Testicules |
0,026 |
0,031 |
0,052 |
0,087 |
0,17 |
|
Autres tissus |
0,16 |
0,24 |
0,37 |
0,59 |
1,0 |
|
Dose efficace (mSv/MBq) |
40,2 |
65,0 |
100 |
214 |
391 |
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Gélules prêtes à l'emploi.
Les précautions appropriées de radioprotection doivent être respectées.
Le flacon doit être conservé à l'intérieur de sa protection plombée.
Il est conseillé d'ouvrir l'emballage du produit sous une hotte ventilée.
L'administration de produits radiopharmaceutiques présente des risques pour l'entourage du patient en raison de l'irradiation externe ou de la contamination par les urines, les vomissements, les expectorations. Par conséquent il faut prendre des mesures de protection contre les radiations conformément aux réglementations nationales.
L'élimination des déchets radioactifs doit se faire en accord avec les réglementations nationales et internationales.
Liste I.
Prescription réservée à l'usage hospitalier.
Les produits radiopharmaceutiques ne doivent être utilisés que par des personnes qualifiées. Ils ne peuvent être délivrés qu'à des praticiens ayant obtenu l'autorisation spéciale prévue à l'article R.5234-6 du Code de la Santé Publique.