RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 05/11/2001
IODURE (123 I) DE SODIUM, CIS bio international, solution injectable. [Référence: I-123-S-2]
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Iodure (123I) de sodium ................................................................. 18,5 MBq à la date et à l'heure de calibration
Pour 1 ml.
Ce produit est sans entraîneur et ne contient pas de conservateur antimicrobien.
L'iode-123 est produit par irradiation protonique de xénon-124. La période de l'iode-123 est de 13,27 heures. Il décroît en tellure-123 par capture électronique suivie d'une émission de rayonnement gamma de 159 keV (83,3 %), et de rayonnement X de 27 keV (86,6 %).
L'iode-123 peut contenir comme impuretés radionucléidiques de l'iode-125 et du tellure-121.
L'iode-125 a une période de 59,402 jours et émet un rayonnement gamma de 35 keV (6,7 %) et un rayonnement X de 27 keV (114 %). Le tellure-121 a une période de 16,8 jours et ses principaux photons gamma ont des énergies de 573 keV (79 %), 508 keV (19 %) et 470 keV (2 %), sont également émis des rayonnements X de 26 keV (64 %) et de 30 keV (13 %).
L'activité due à des radionucléides autres que l'iode-123 est inférieure à 0,3 % de l'activité totale à la date et l'heure de péremption.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable en flacon multidose.
4.1. Indications thérapeutiques
L'iodure (123I) de sodium, solution injectable, peut être utilisé comme produit de diagnostic pour l'exploration fonctionnelle et/ou morphologique de la glande thyroïde au cours des examens suivants:
· Scintigraphie thyroïdienne
· Etude de la fixation thyroïdienne de l'iode radioactif
Les résultats des taux de fixation à la 24ème heure sont généralement utilisés pour calculer les activités thérapeutiques d'iode (131I).
4.2. Posologie et mode d'administration
Chez l'adulte (70 kg), les activités recommandées sont comprises entre 5 et 15 MBq. L'activité la plus faible (5 MBq) est recommandée pour les études de la fixation thyroïdienne. Les activités les plus élevées (10 à 15 MBq) sont recommandées pour la scintigraphie thyroïdienne. Cependant, l'activité à administrer sera déterminée par le médecin spécialiste pour chaque patient.
Les études de fixation thyroïdienne doivent être effectuées selon des procédures standardisées bien établies.
Chez l'enfant, l'activité administrée est une fraction de celle utilisée chez l'adulte. Elle est calculée en fonction de la masse corporelle selon la formule suivante:
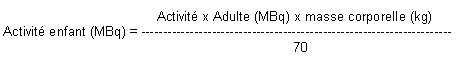
Chez le jeune enfant, il convient d'utiliser une activité adulte de 15 MBq dans la formule de calcul de l'activité enfant ci-dessus, afin d'obtenir des images de qualité satisfaisante.
La solution injectable d'iodure (123I) de sodium est destinée à l'administration par voie intraveineuse. Cependant elle est aussi adaptée à l'administration orale. L'activité de la solution doit être contrôlée immédiatement avant l'administration.
L'acquisition des images a lieu 3 à 6 heures après l'administration.
Aucune connue à ce jour.
4.4. Mises en garde spéciales et précautions d'emploi
Les produits radiopharmaceutiques ne doivent être réceptionnés, utilisés et administrés que par des personnes autorisées dans des services agréés. Leur réception, leur stockage, leur utilisation, leur transfert et leur élimination sont soumis aux réglementations et aux autorisations appropriées des autorités compétentes.
Les produits radiopharmaceutiques doivent être préparés de manière à satisfaire à la fois aux normes de radioprotection et de qualité pharmaceutique. Les précautions appropriées d'asepsie doivent être prises afin de satisfaire aux exigences des Bonnes Pratiques de Fabrication pharmaceutique.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
De nombreux médicaments sont susceptibles de modifier la fixation thyroïdienne de l'iode. La liste de ces médicaments est donnée dans le tableau ci-dessous, avec l'indication, pour chaque groupe de médicaments, du temps de sevrage recommandé avant d'effectuer une mesure du taux de fixation de l'iode par la thyroïde.
Médicaments susceptibles de modifier la fixation thyroïdienne de l'iode
|
Type de médicament |
Temps de sevrage recommandé |
|
Amiodarone |
4 semaines |
|
Antithyroïdes (propylthiouracile, thiamazol) |
1 semaine |
|
Lithium |
4 semaines |
|
Produits de substitution hormonale naturels ou de synthèse à visée thyroïdienne (thyroxine sodique, liothyronine sodique, extrait thyroïdien) |
2-3 semaines |
|
Fluidifiants bronchiques, préparations vitaminées |
2 semaines |
|
Perchlorate |
1 semaine |
|
Phénylbutazone |
1- 2 semaines |
|
Salicylés |
1 semaine |
|
Corticoïdes |
1 semaine |
|
Nitroprussiate de sodium |
1 semaine |
|
Bromosulfophtaléine sodique |
1 semaine |
|
Divers: |
1 semaine |
|
Anticoagulants |
|
|
Antihistaminiques |
|
|
Antiparasitaires |
|
|
Pénicillines |
|
|
Sulfamides |
|
|
Tolbutamide |
|
|
Thiopentane |
|
|
Benzodiazépines |
4 semaines |
|
Produits iodés pour application locale |
1 - 9 mois |
|
Produits de contraste |
1 -2 mois |
|
Produits pour cholécystographie par voie orale |
6 - 9 mois |
|
Produits de contraste iodés huileux: |
|
|
Pour bronchographie |
6 - 12 mois |
|
Pour myélographie |
2 -10 ans |
Lorsqu'il est nécessaire d'administrer des produits radiopharmaceutiques à la femme en âge de procréer, il est indispensable de s'informer de toute éventualité d'une grossesse. Toute femme n'ayant pas eu ses règles doit être considérée comme enceinte jusqu'à preuve du contraire.
D'autres techniques n'impliquant pas l'emploi de rayonnements ionisants peuvent être envisagées si elles n'altèrent pas la qualité diagnostique.
Les examens utilisant des radionucléides chez la femme enceinte entraînent également l'irradiation du fœtus. Il ne faut réaliser au cours de la grossesse que les seules investigations absolument nécessaires lorsque le bénéfice probable dépasse les risques encourus par la mère et le fœtus.
Avant d'administrer un produit radiopharmaceutique à une femme en cours d'allaitement, il est nécessaire d'envisager la possibilité de réaliser l'examen à la fin de l'allaitement ou de s'assurer dans le cas contraire que le radiopharmaceutique choisi est le plus approprié compte tenu de l'éventuel passage de la radioactivité dans le lait. Si l'administration en est indispensable, l'allaitement doit être interrompu pendant 1,5 à 3 jours suivant l'administration d'iode-123 du fait de la présence de l'iode-125 comme impureté radionucléidique. L'allaitement peut être repris lorsque la dose d'irradiation délivrée à l'enfant du fait de l'activité excrétée dans le lait est inférieure à 1 mSv.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Aucun effet connu à ce jour.
Pour chaque patient, l'exposition aux rayonnements ionisants doit être justifiée par le bénéfice attendu. La radioactivité administrée doit être telle que la dose absorbée qui en découle soit aussi faible que possible, en gardant à l'esprit la nécessité d'obtenir un diagnostic.
L'exposition aux rayonnements ionisants peut potentiellement induire des cancers et/ou développer des anomalies héréditaires. L'expérience montre que, pour les examens diagnostiques de médecine nucléaire, la fréquence des effets secondaires est très faible en raison des faibles activités utilisées. Pour la plupart des examens de médecine nucléaire, la dose efficace (E) est inférieure à 20 mSv. Des doses plus élevées peuvent être justifiées dans certaines circonstances.
Des cas isolés de réactions «allergiques» ont été signalés sans que n'en soient précisés ni la fréquence, ni le mécanisme.
En cas d'administration d'une activité excessive de produit radiopharmaceutique, la dose absorbée délivrée au patient doit être réduite en augmentant autant que possible l'élimination du radionucléide. Ainsi, en cas de surdosage en iodure (123I) de sodium, il est recommandé d'utiliser un agent bloquant tel que le perchlorate de potassium afin de diminuer l'irradiation de la glande thyroïde. Il est de plus recommandé d'augmenter l'élimination du radionucléide par une augmentation de la diurèse et de la fréquence des mictions.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Produit radiopharmaceutique à usage diagnostique,
(V: DIVERS).
Aux concentrations chimiques et activités administrées pour l'utilisation diagnostique, l'iodure de sodium n'a aucun effet pharmacodynamique.
5.2. Propriétés pharmacocinétiques
Après injection intraveineuse, environ 20 % de l'iode-123 se fixe au niveau de la glande thyroïde lors du premier passage.
La clairance thyroïdienne de l'iodure circulant est normalement comprise entre 20 et 50 ml/min.
Elle peut atteindre 100 ml/min dans les hypothyroïdies.
La concentration maximale thyroïdienne est atteinte quelques heures après l'administration.
L'acquisition des images peut commencer 3 heures après l'administration.
L'iodure thyroïdien est éliminé avec une demi-vie de l'ordre de 80 jours. La période pendant laquelle l'acquisition des images peut être réalisée n'est donc limitée que par la décroissance physique de l'iode-123.
L'élimination est principalement urinaire (à 37-75 %) et l'excrétion fécale est faible (de l'ordre de 1 %).
5.3. Données de sécurité préclinique
Les effets toxiques dus à l'iodure de sodium à des doses élevées ne sont pas observés avec l'iodure (123I) de sodium, solution injectable, dans son utilisation comme produit de diagnostic pour la scintigraphie thyroïdienne.
Il n'existe pas de données concernant la toxicité par administration réitérée d'iodure de sodium.
Aucune étude des effets sur la reproduction chez l'animal, de mutagénicité à long terme ou du pouvoir carcinogène n'a été effectuée.
Composition du tampon phosphate-thiosulfate pH 7:
Dihydrogénophosphate de sodium monohydraté, thiosulfate de sodium pentahydraté, chlorure de sodium, eau pour préparations injectables.
Aucune connue à ce jour.
2 jours à compter de la date de libération et 8 heures après premier prélèvement.
La date et l'heure de péremption sont indiquées sur le conditionnement extérieur et sur chaque flacon.
6.4. Précautions particulières de conservation
Le produit doit être conservé à une température comprise entre +15°C et +25°C dans son conditionnement d'origine.
Après premier prélèvement, en l'absence de conservateur, conserver le produit à une température comprise entre +2°C et +8°C pendant une journée de 8 heures.
Le stockage doit être effectué conformément aux réglementations nationales relatives aux produits radioactifs.
6.5. Nature et contenu de l'emballage extérieur
Flacon de 15 ml en verre, fermé par un bouchon en caoutchouc et scellé par une capsule en aluminium.
6.6. Précautions particulières d’élimination et de manipulation
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
CIS BIO INTERNATIONAL
RN 306
BP 32
91192 Gif-sur-Yvette Cedex
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 554 574-4: 1 à 10 ml de solution en flacon (verre).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
Les données sur la dose absorbée, qui sont présentées dans les tableaux ci-dessous, ont été établies dans la publication n° 60 de la CIPR (Commission Internationale de Protection Radiologique).
Etant donné le procédé de production de l'iode-123, l'iode-125, qui a une période plus longue que l'iode-123, peut être présent, ce qui augmente la dose de radiations délivrée aux différents organes.
La CIPR fait référence dans ses calculs à de l'iode-123 sans aucune impureté radionucléidique, administré par injection intraveineuse.
Pour ce radionucléide, la dose efficace résultant de l'administration d'une activité de 15 MBq est d'environ 3,7 mSv. La dose efficace dépend du taux de fixation thyroïdienne.
Les doses de radiation délivrées par l'iode-123 et l'iode-125 sont données dans les tableaux ci-dessous. Les organes et les tissus pris en compte pour le calcul de la dose efficace sont: gonades, seins, moelle osseuse rouge, poumons, thyroïde, surfaces osseuses et cinq organes ou tissus additionnels pour lesquels la dose absorbée est la plus importante. Ces cinq autres organes ou tissus pris en compte pour le calcul de la dose efficace sont indiqués par un astérisque.
(123I) (T½ = 13,2 heures)
Fixation thyroïdienne nulle: 0 %
|
Organe |
Dose absorbée par unité d'activité administrée (mGy/MBq) |
||||
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
|
* Paroi vésicale |
0,090 |
0,11 |
0,16 |
0,24 |
0,45 |
|
Utérus |
0,014 |
0,017 |
0,028 |
0,043 |
0,076 |
|
*Reins |
0,011 |
0,014 |
0,020 |
0,029 |
0,051 |
|
Ovaires |
0,0098 |
0,012 |
0,019 |
0,030 |
0,053 |
|
*Paroi du côlon descendant |
0,0097 |
0,012 |
0,019 |
0,029 |
0,054 |
|
Moelle rouge |
0,0094 |
0,011 |
0,017 |
0,026 |
0,047 |
|
*Intestin grêle |
0,0085 |
0,010 |
0,016 |
0,025 |
0,046 |
|
Surfaces osseuses |
0,0081 |
0,0097 |
0,015 |
0,024 |
0,046 |
|
*Paroi du côlon ascendant |
0,0080 |
0,0099 |
0,015 |
0,024 |
0,043 |
|
Pancréas |
0,0076 |
0,0091 |
0,014 |
0,022 |
0,041 |
|
Surrénales |
0,0070 |
0,0087 |
0,014 |
0,021 |
0,039 |
|
Rate |
0,0070 |
0,0083 |
0,013 |
0,020 |
0,037 |
|
|
|
|
|
|
|
|
Testicules |
0,0069 |
0,0094 |
0,015 |
0,025 |
0,048 |
|
Paroi gastrique |
0,0069 |
0,0085 |
0,014 |
0,021 |
0,037 |
|
Foie |
0,0067 |
0,0082 |
0,013 |
0,020 |
0,037 |
|
Autres tissus |
0,0064 |
0,0077 |
0,012 |
0,019 |
0,035 |
|
Poumons |
0,0061 |
0,0078 |
0,012 |
0,019 |
0,035 |
|
Seins |
0,0056 |
0,0056 |
0,0081 |
0,013 |
0,025 |
|
Thyroïde |
0,0051 |
0,0077 |
0,012 |
0,020 |
0,037 |
|
Dose efficace (mSv/MBq) |
0,012 |
0,015 |
0,022 |
0,034 |
0,063 |
|
Dose efficace (mSv/MBq) pour les faibles fixations thyroïdiennes: |
|||||
|
Fixation: 0,5 % |
0,025 |
0,033 |
0,050 |
0,086 |
0,16 |
|
Fixation: 1,0 % |
0,030 |
0,041 |
0,062 |
0,11 |
0,22 |
|
Fixation: 2 % |
0,039 |
0,056 |
0,081 |
0,16 |
0,30 |
(123I) (T½ = 13,2 heures)
Fixation thyroïdienne: 15 %
|
Organe |
Dose absorbée par unité d'activité administrée (mGy/MBq) |
||||
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
|
Thyroïde |
1,9 |
3,0 |
4,5 |
9,8 |
19 |
|
*Paroi vésicale |
0,076 |
0,095 |
0,14 |
0,21 |
0,38 |
|
*Paroi gastrique |
0,068 |
0,085 |
0,12 |
0,20 |
0,38 |
|
*Intestin grêle |
0,043 |
0,054 |
0,091 |
0,14 |
0,27 |
|
*Paroi du côlon ascendant |
0,018 |
0,019 |
0,029 |
0,045 |
0,077 |
|
Utérus |
0,015 |
0,019 |
0,031 |
0,049 |
0,068 |
|
*Pancréas |
0,014 |
0,016 |
0,024 |
0,035 |
0,061 |
|
Ovaires |
0,012 |
0,016 |
0,025 |
0,038 |
0,086 |
|
Paroi du côlon descendant |
0,011 |
0,014 |
0,022 |
0,033 |
0,060 |
|
Reins |
0,010 |
0,013 |
0,018 |
0,027 |
0,046 |
|
Rate |
0,0095 |
0,011 |
0,017 |
0,025 |
0,044 |
|
Moelle rouge |
0,0094 |
0,012 |
0,017 |
0,025 |
0,043 |
|
Surfaces osseuses |
0,0071 |
0,0091 |
0,014 |
0,022 |
0,041 |
|
Autres tissus |
0,0068 |
0,0085 |
0,013 |
0,021 |
0,039 |
|
Surrénales |
0,0063 |
0,0083 |
0,013 |
0,020 |
0,037 |
|
Foie |
0,0062 |
0,0076 |
0,013 |
0,021 |
0,038 |
|
Poumons |
0,0057 |
0,0072 |
0,011 |
0,018 |
0,034 |
|
Testicules |
0,0053 |
0,0072 |
0,012 |
0,020 |
0,038 |
|
Seins |
0,0047 |
0,0047 |
0,0073 |
0,012 |
0,023 |
|
Dose efficace (mSv/MBq) |
0,12 |
0,18 |
0,28 |
0,58 |
1,1 |
(123I) (T½ = 13,2 heures)
Fixation thyroïdienne: 35 %
|
Organe |
Dose absorbée par unité d'activité administrée (mGy/MBq) |
||||
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
|
Thyroïde |
4,5 |
7,0 |
11 |
23 |
43 |
|
*Paroi gastrique |
0,068 |
0,085 |
0,12 |
0,20 |
0,38 |
|
*Paroi vésicale |
0,06 |
0,074 |
0,11 |
0,16 |
0,30 |
|
*Intestin grêle |
0,042 |
0,054 |
0,090 |
0,14 |
0,27 |
|
*Paroi du côlon ascendant |
0,018 |
0,019 |
0,029 |
0,045 |
0,076 |
|
Utérus |
0,014 |
0,017 |
0,029 |
0,044 |
0,079 |
|
*Pancréas |
0,014 |
0,016 |
0,024 |
0,036 |
0,062 |
|
Ovaires |
0,011 |
0,015 |
0,024 |
0,037 |
0,066 |
|
*Paroi du côlon descendant |
0,010 |
0,014 |
0,021 |
0,032 |
0,058 |
|
Moelle rouge |
0,010 |
0,013 |
0,019 |
0,028 |
0,048 |
|
Rate |
0,0096 |
0,011 |
0,017 |
0,025 |
0,045 |
|
Reins |
0,0091 |
0,011 |
0,016 |
0,024 |
0,041 |
|
Autres tissus |
0,0080 |
0,010 |
0,016 |
0,026 |
0,049 |
|
Surfaces osseuses |
0,0079 |
0,012 |
0,016 |
0,025 |
0,046 |
|
Surrénales |
0,0065 |
0,0084 |
0,013 |
0,021 |
0,038 |
|
Poumons |
0,0065 |
0,0086 |
0,014 |
0,022 |
0,042 |
|
Foie |
0,0063 |
0,0078 |
0,013 |
0,021 |
0,040 |
|
Seins |
0,0052 |
0,0052 |
0,0085 |
0,015 |
0,027 |
|
Testicules |
0,0050 |
0,0068 |
0,011 |
0,018 |
0,035 |
|
Dose efficace (mSv/MBq) |
0,25 |
0,39 |
0,59 |
1,3 |
2,4 |
(123I) (T½ = 13,2 heures)
Fixation thyroïdienne: 55 %
|
Organe |
Dose absorbée par unité d'activité administrée (mGy/MBq) |
||||
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
|
Thyroïde |
7,0 |
11 |
17 |
36 |
68 |
|
*Paroi gastrique |
0,068 |
0,085 |
0,12 |
0,20 |
0,39 |
|
*Paroi vésicale |
0,043 |
0,053 |
0,079 |
0,12 |
0,22 |
|
*Intestin grêle |
0,042 |
0,054 |
0,091 |
0,14 |
0,27 |
|
*Paroi du côlon ascendant |
0,018 |
0,019 |
0,029 |
0,044 |
0,076 |
|
*Pancréas |
0,014 |
0,016 |
0,025 |
0,036 |
0,063 |
|
Utérus |
0,012 |
0,016 |
0,026 |
0,040 |
0,072 |
|
Ovaires |
0,011 |
0,015 |
0,023 |
0,036 |
0,064 |
|
Moelle rouge |
0,011 |
0,015 |
0,021 |
0,030 |
0,052 |
|
*Paroi du côlon descendant |
0,0098 |
0,013 |
0,020 |
0,030 |
0,055 |
|
Rate |
0,0097 |
0,011 |
0,017 |
0,026 |
0,046 |
|
Autres tissus |
0,0092 |
0,012 |
0,019 |
0,031 |
0,058 |
|
Reins |
0,0091 |
0,011 |
0,016 |
0,024 |
0,041 |
|
Surfaces osseuses |
0,0086 |
0,012 |
0,018 |
0,028 |
0,051 |
|
Poumons |
0,0072 |
0,0097 |
0,016 |
0,026 |
0,048 |
|
Surrénales |
0,0065 |
0,0085 |
0,014 |
0,021 |
0,039 |
|
Foie |
0,0064 |
0,0079 |
0,013 |
0,022 |
0,041 |
|
Seins |
0,0056 |
0,0056 |
0,0095 |
0,017 |
0,031 |
|
Testicules |
0,0046 |
0,0062 |
0,010 |
0,016 |
0,032 |
|
Dose efficace (mSv/MBq) |
0,38 |
0,60 |
0,91 |
2,0 |
3,7 |
(125I) (T½ = 60,14 jours)
Fixation thyroïdienne nulle: 0 %
|
Organe |
Dose absorbée par unité d'activité administrée (mGy/MBq) |
||||
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
|
*Paroi vésicale |
0,10 |
0,13 |
0,19 |
0,29 |
0,54 |
|
*Reins |
0,010 |
0,013 |
0,019 |
0,028 |
0,051 |
|
Utérus |
0,0095 |
0,012 |
0,022 |
0,038 |
0,075 |
|
Moelle rouge |
0,0083 |
0,010 |
0,017 |
0,029 |
0,059 |
|
Surfaces osseuses |
0,0074 |
0,0093 |
0,016 |
0,027 |
0,057 |
|
*Paroi du côlon descendant |
0,0067 |
0,0081 |
0,013 |
0,023 |
0,048 |
|
Ovaires |
0,0064 |
0,0078 |
0,014 |
0,024 |
0,048 |
|
*Paroi du côlon ascendant |
0,0058 |
0,0068 |
0,012 |
0,019 |
0,039 |
|
*Intestin grêle |
0,0058 |
0,0068 |
0,012 |
0,020 |
0,041 |
|
Rate |
0,0056 |
0,0065 |
0,011 |
0,018 |
0,036 |
|
Pancréas |
0,0056 |
0,0067 |
0,011 |
0,019 |
0,037 |
|
Poumons |
0,0055 |
0,0069 |
0,011 |
0,019 |
0,037 |
|
Foie |
0,0054 |
0,0064 |
0,011 |
0,018 |
0,035 |
|
Paroi gastrique |
0,0053 |
0,0065 |
0,010 |
0,018 |
0,035 |
|
Autres tissus |
0,0052 |
0,0063 |
0,010 |
0,017 |
0,034 |
|
Seins |
0,0051 |
0,0051 |
0,0074 |
0,012 |
0,024 |
|
Testicules |
0,0050 |
0,0065 |
0,012 |
0,021 |
0,044 |
|
Surrénales |
0,0048 |
0,0066 |
0,011 |
0,019 |
0,037 |
|
Thyroïde |
0,0047 |
0,0063 |
0,011 |
0,018 |
0,036 |
|
Dose efficace (mSv/MBq) |
0,010 |
0,013 |
0,021 |
0,033 |
0,065 |
|
Dose efficace (mSv/MBq) pour les faibles fixations thyroïdiennes: |
|||||
|
Fixation: 0,5 % |
0,26 |
0,42 |
0,63 |
1,4 |
2,5 |
|
Fixation: 1,0 % |
0,51 |
0,81 |
1,2 |
2,7 |
4,9 |
|
Fixation: 2 % |
0,99 |
1,6 |
2,5 |
5,4 |
9,8 |
(125I) (T½ = 60,14 jours)
Fixation thyroïdienne: 15%
|
Organe |
Dose absorbée par unité d'activité administrée (mGy/MBq) |
||||
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
|
Thyroïde |
140 |
200 |
260 |
510 |
790 |
|
*Paroi vésicale |
0,085 |
0,11 |
0,16 |
0,24 |
0,46 |
|
Paroi gastrique |
0,071 |
0,090 |
0,13 |
0,22 |
0,44 |
|
Autres tissus |
0,053 |
0,070 |
0,11 |
0,17 |
0,29 |
|
* Intestin grêle |
0,042 |
0,055 |
0,095 |
0,16 |
0,30 |
|
Moelle rouge |
0,017 |
0,039 |
0,051 |
0,077 |
0,14 |
|
Surfaces osseuses |
0,016 |
0,041 |
0,053 |
0,080 |
0,14 |
|
* Paroi du côlon ascendant |
0,016 |
0,014 |
0,024 |
0,039 |
0,076 |
|
Pancréas |
0,0092 |
0,010 |
0,018 |
0,029 |
0,057 |
|
Utérus |
0,0092 |
0,012 |
0,024 |
0,041 |
0,082 |
|
Poumons |
0,0087 |
0,013 |
0,031 |
0,062 |
0,13 |
|
Reins |
0,0086 |
0,011 |
0,016 |
0,024 |
0,046 |
|
*Paroi du côlon descendant |
0,0075 |
0,0095 |
0,016 |
0,027 |
0,054 |
|
Ovaires |
0,0069 |
0,0098 |
0,018 |
0,031 |
0,062 |
|
Rate |
0,0058 |
0,0066 |
0,012 |
0,019 |
0,043 |
|
Seins |
0,0046 |
0,0045 |
0,0085 |
0,019 |
0,051 |
|
Foie |
0,0042 |
0,0049 |
0,0094 |
0,017 |
0,038 |
|
Surrénales |
0,0036 |
0,0051 |
0,0089 |
0,015 |
0,033 |
|
Testicules |
0,0036 |
0,0047 |
0,0088 |
0,016 |
0,034 |
|
Dose efficace (mSv/MBq) |
7,3 |
11 |
14 |
27 |
42 |
(125I) (T½ = 60,14 jours)
Fixation thyroïdienne: 35%
|
Organe |
Dose absorbée par unité d'activité administrée (mGy/MBq) |
||||
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
|
Thyroïde |
330 |
470 |
620 |
1200 |
1900 |
|
Autres tissus |
0,12 |
0,16 |
0,24 |
0,38 |
0,64 |
|
*Paroi gastrique |
0,071 |
0,090 |
0,13 |
0,22 |
0,44 |
|
*Paroi vésicale |
0,066 |
0,083 |
0,12 |
0,19 |
0,36 |
|
*Intestin grêle |
0,042 |
0,055 |
0,095 |
0,16 |
0,30 |
|
Surfaces osseuses |
0,031 |
0,086 |
0,11 |
0,16 |
0,27 |
|
Moelle rouge |
0,030 |
0,079 |
0,099 |
0,15 |
0,27 |
|
*Paroi du côlon ascendant |
0,016 |
0,014 |
0,024 |
0,039 |
0,075 |
|
Poumons |
0,015 |
0,023 |
0,061 |
0,12 |
0,28 |
|
Pancréas |
0,0092 |
0,010 |
0,018 |
0,029 |
0,061 |
|
Utérus |
0,0083 |
0,011 |
0,021 |
0,037 |
0,074 |
|
Reins |
0,0076 |
0,0093 |
0,014 |
0,022 |
0,044 |
|
*Paroi du côlon descendant |
0,0072 |
0,0091 |
0,015 |
0,026 |
0,051 |
|
Ovaires |
0,0067 |
0,0096 |
0,017 |
0,030 |
0,060 |
|
Seins |
0,0059 |
0,0057 |
0,013 |
0,032 |
0,095 |
|
Rate |
0,0058 |
0,0066 |
0,012 |
0,020 |
0,051 |
|
Foie |
0,0042 |
0,0050 |
0,010 |
0,019 |
0,045 |
|
Surrénales |
0,0035 |
0,0050 |
0,0089 |
0,016 |
0,037 |
|
Testicules |
0,0035 |
0,0045 |
0,0082 |
0,015 |
0,031 |
|
Dose efficace (mSv/MBq) |
17 |
25 |
33 |
63 |
99 |
(125I) (T½ = 60,14 jours)
Fixation thyroïdienne: 55%
|
Organe |
Dose absorbée par unité d'activité administrée (mGy/MBq) |
||||
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
|
Thyroïde |
520 |
740 |
970 |
1900 |
2900 |
|
Autres tissus |
0,18 |
0,24 |
0,38 |
0,59 |
0,99 |
|
*Paroi gastrique |
0,071 |
0,090 |
0,13 |
0,22 |
0,45 |
|
*Paroi vésicale |
0,047 |
0,058 |
0,088 |
0,13 |
0,25 |
|
Surfaces osseuses |
0,045 |
0,13 |
0,16 |
0,24 |
0,40 |
|
Moelle rouge |
0,043 |
0,12 |
0,15 |
0,22 |
0,40 |
|
*Intestin grêle |
0,042 |
0,055 |
0,095 |
0,15 |
0,30 |
|
Poumons |
0,021 |
0,034 |
0,091 |
0,19 |
0,42 |
|
*Paroi du côlon ascendant |
0,016 |
0,014 |
0,024 |
0,039 |
0,075 |
|
Pancréas |
0,0092 |
0,010 |
0,018 |
0,030 |
0,066 |
|
Utérus |
0,0075 |
0,010 |
0,019 |
0,033 |
0,067 |
|
Seins |
0,0073 |
0,0070 |
0,017 |
0,046 |
0,14 |
|
*Paroi du côlon descendant |
0,0070 |
0,0088 |
0,015 |
0,024 |
0,049 |
|
Ovaires |
0,0066 |
0,0094 |
0,017 |
0,029 |
0,058 |
|
Reins |
0,0064 |
0,0079 |
0,012 |
0,019 |
0,043 |
|
Rate |
0,0058 |
0,0066 |
0,012 |
0,020 |
0,059 |
|
Foie |
0,0042 |
0,0051 |
0,011 |
0,022 |
0,052 |
|
Surrénales |
0,0036 |
0,0051 |
0,0092 |
0,017 |
0,041 |
|
Testicules |
0,0034 |
0,0044 |
0,0077 |
0,014 |
0,028 |
|
Dose efficace (mSv/MBq) |
27 |
39 |
51 |
99 |
154 |
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
L'iodure (123I) de sodium, solution injectable, est une solution stérile de pH compris entre 6,5 et 7,5. La concentration radioactive est de 18,5 MBq/ml à la date et à l'heure de calibration. La pureté radiochimique est au minimum égale à 95 %.
Le flacon doit être conservé à l'intérieur de sa protection plombée.
Les précautions appropriées d'asepsie et de radioprotection doivent être respectées.
Avant utilisation, le conditionnement, le pH, l'activité et le spectre gamma doivent être vérifiés.
Le flacon ne doit pas être débouché. Après désinfection du bouchon, la solution doit être prélevée aseptiquement à travers le bouchon à l'aide d'une seringue et d'une aiguille stériles à usage unique.
Après le premier prélèvement, en l'absence de conservateur, la solution injectable d'iodure (123I) de sodium restant doit être conservée à une température comprise entre +2°C et +8°C et doit être utilisée dans une journée de 8 heures.
L'administration de produits radiopharmaceutiques présente des risques pour l'entourage du patient en raison de l'irradiation externe ou de la contamination par les urines, les vomissements, les expectorations. Par conséquent, il faut prendre des mesures de protection contre les radiations conformément aux réglementations nationales.
L'élimination des déchets radioactifs doit se faire en accord avec les réglementations nationales et internationales.
Prescription réservée à l'usage hospitalier.
Liste I.
Les produits radiopharmaceutiques ne doivent être utilisés que par des personnes qualifiées. Ils ne peuvent être délivrés qu'à des praticiens ayant obtenu l'autorisation spéciale prévue à l'article R 5234-6 du Code de la Santé publique.