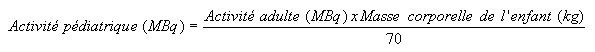
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 08/07/2009
TECHNESCAN DMSA, poudre pour solution injectable. Trousse pour la préparation de la solution injectable de succimère de technétium (99mTc)
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Succimère (Acide dimercaptosuccinique) ............................................................................................ 1,2 mg
Pour un flacon.
Le produit ne contient pas de conservateur antimicrobien.
Pour la liste complètes des excipients, voir rubrique 6.1.
Poudre pour solution injectable en flacon multidose. Trousse pour préparation radiopharmaceutique.
4.1. Indications thérapeutiques
Ce médicament est à usage diagnostique uniquement.
Après reconstitution avec une solution injectable de pertechnétate (99mTc) de sodium, ce produit peut être utilisé pour la scintigraphie rénale statique (acquisition planaire ou tomographique), en vue:
· d'études morphologiques du cortex rénal;
· d'évaluation de la valeur fonctionnelle de chaque rein;
· de localisation d'une ectopie rénale.
4.2. Posologie et mode d'administration
Administration par voie intraveineuse.
L'activité recommandée chez l'adulte est de 30 à 120 MBq.
L'acquisition des images peut être effectuée dès la 1ère heure et jusqu'à la 3ème heure après l'injection.
En cas d'insuffisance rénale ou d'obstruction, il peut être nécessaire de retarder les acquisitions (entre 6 et 24 heures après l'injection).
L'activité destinée à l'enfant doit être calculée en fonction de sa masse corporelle en appliquant la formule suivante:
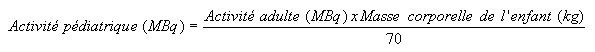
Dans certains cas, le calcul en fonction de la surface corporelle est plus approprié:
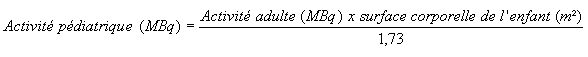
|
3 kg = 0,1 |
4 kg = 0,14 |
6 kg = 0,19 |
8 kg = 0,23 |
10 kg = 0,27 |
|
12 kg = 0,32 |
14 kg = 0,36 |
16 kg = 0,40 |
18 kg = 0,44 |
20 kg = 0,46 |
|
22 kg = 0,50 |
24 kg = 0,53 |
26 kg = 0,56 |
28 kg = 0,58 |
30 kg = 0,62 |
|
32 kg = 0,65 |
34 kg = 0,68 |
36 kg = 0,71 |
38 kg = 0,73 |
40 kg = 0,76 |
|
42 kg = 0,78 |
44 kg = 0,80 |
46 kg = 0,82 |
48 kg = 0,85 |
50 kg = 0,88 |
|
52 - 54 kg = 0,90 |
56 - 58 kg = 0,92 |
60 - 62 kg = 0,96 |
64 - 66 kg = 0,98 |
68 kg = 0,99 |
Aucune connue à ce jour.
4.4. Mises en garde spéciales et précautions d'emploi
Ce produit est un médicament radiopharmaceutique.
Les médicaments radiopharmaceutiques ne peuvent être manipulés que par des personnes qualifiées ayant reçu des autorités compétentes l'autorisation d'utilisation des radioéléments. La réception, l'utilisation et l'administration des radiopharmaceutiques ne peuvent être effectuées que par des personnes autorisées dans des locaux spécialement équipés et habilités. La réception, le stockage, l'utilisation, le transfert et l'élimination sont soumis à la réglementation en vigueur et aux autorisations appropriées des autorités nationales ou locales compétentes.
La préparation d'un médicament radiopharmaceutique doit tenir compte des principes de radioprotection et de qualité pharmaceutique. Des précautions particulières doivent être prises pour assurer la stérilité de la préparation conformément aux principes de Bonnes Pratiques de Fabrication des médicaments pharmaceutiques.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Certains composés chimiques ou pharmaceutiques peuvent affecter la fonction des organes examinés et influencer la fixation du succimère de technétium (99mTc)-DMSA, par exemple:
· le chlorure d'ammonium peut réduire de façon substantielle la fixation rénale et accroître la fixation hépatique du succimère de technétium (99mTc),
· le bicarbonate de sodium réduit la fixation rénale du succimère de technétium (99mTc),
· le mannitol réduit la captation rénale du succimère de technétium (99mTc).
Pour éviter ces interactions, le traitement par l'un de ces produits doit si possible être interrompu avant l'examen.
· chez les patients présentant une sténose unilatérale de l'artère rénale, le captopril diminue la fixation du (99mTc)-DMSA par le rein atteint. Ce phénomène est généralement réversible après arrêt de l'administration de captopril.
On veillera à ce que le patient soit convenablement hydraté avant l'examen.
Avant d'administrer un médicament radiopharmaceutique à une femme en âge de procréer, il est nécessaire de vérifier que celle-ci n'est pas enceinte. Tout retard de règles doit laisser supposer l'éventualité d'une grossesse jusqu'à preuve du contraire. Dans l'incertitude, il est important de limiter l'exposition aux rayonnements au minimum compatible avec l'obtention de l'information clinique recherchée. L'utilisation de techniques de remplacement n'utilisant pas de radiations ionisantes doit être envisagée.
Les radioéléments utilisés chez la femme enceinte délivrent également des doses de radiations au ftus. Pendant la grossesse, seuls des examens dont le bénéfice potentiel est supérieur au risque encouru par la mère et le ftus doivent être pratiqués.
Avant d'administrer un médicament radiopharmaceutique à une femme souhaitant poursuivre l'allaitement maternel, il convient d'estimer, si cela est raisonnablement possible, si cet examen peut être différé jusqu'à la fin de l'allaitement. Sinon, il convient de tenir compte de l'activité susceptible de passer dans le lait maternel pour choisir le médicament radiopharmaceutique le plus approprié.
Si l'administration d'un produit radioactif est indispensable, le lait sera tiré avant l'injection et conservé pour être utilisé ultérieurement. L'allaitement doit être suspendu pendant au moins 12 heures après l'injection et le lait produit pendant cette période doit être éliminé. L'allaitement peut être repris lorsque l'activité dans le lait ne risque pas d'entraîner une dose de radiation pour l'enfant supérieure à 1 mSv.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Aucun connu à ce jour.
Pour chaque patient, l'exposition aux radiations ionisantes doit être justifiée par le bénéfice attendu. L'activité administrée doit correspondre à la plus faible dose de radiations possible compatible avec l'obtention de l'information diagnostique escomptée. L'exposition aux radiations ionisantes peut théoriquement induire des cancers et/ou des anomalies héréditaires. Dans le cas d'examen de médecine nucléaire à visée diagnostique, il est généralement considéré que la fréquence de ces risques est négligeable du fait des faibles doses de radiations délivrées.
La plupart des examens diagnostiques de médecine nucléaire délivrent une dose efficace inférieure à 20 mSv. Des doses plus élevées peuvent être justifiées dans certains cas.
Des réactions occasionnelles de type allergique ont été signalées, bien qu'elles n'aient pas été décrites de façon précise.
En cas de surdosage de succimère de technétium (99mTc), la dose délivrée au patient peut être diminuée en favorisant l'élimination du radionucléide par augmentation de la diurèse avec mictions fréquentes.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique: Produit radiopharmaceutique à usage diagnostique, Code ATC: V09CA02.
Aux concentrations chimiques et aux activités utilisées pour les examens de diagnostic, le succimère de technétium (99mTc) ne semble pas avoir d'effets pharmacodynamiques.
5.2. Propriétés pharmacocinétiques
Après administration intraveineuse, la clairance plasmatique du succimère de technétium (99mTc) évolue en trois phases chez le patient à la fonction rénale normale. La demi-vie plasmatique efficace du succimère de technétium (99mTc) est d'environ 1 heure.
Le succimère de technétium (99mTc) se concentre fortement dans le cortex rénal. La concentration maximale est obtenue entre 3 et 6 heures après injection intraveineuse, avec environ 40 à 50 % de la dose injectée captée par les reins. Moins de 3 % de la dose administrée est retrouvée dans le foie. Néanmoins, le taux hépatique peut être significativement augmenté et la fixation rénale diminuée chez l'insuffisant rénal.
5.3. Données de sécurité préclinique
Aucun effet toxique n'a été observé chez le rat après administrations répétées pendant 14 jours de 0,66 mg/kg/jour de succimère de technétium (99mTc) et de 0,23 mg/kg/jour de chlorure d'étain. La dose habituellement administrée aux patients est de 0,14 mg/kg de succimère de technétium (99mTc).
Ce produit n'est pas destiné à une administration régulière ou continue.
Aucune étude sur les propriétés mutagènes ou carcinogènes à long terme n'a été entreprise.
Chlorure stanneux dihydraté, inositol, chlorure de sodium, azote.
Aucune connue à ce jour.
12 mois à partir de la date de fabrication.
Après marquage, le produit doit être administré dans les 4 heures suivant sa reconstitution.
6.4. Précautions particulières de conservation
A conserver à une température comprise entre + 2 et + 8°C.
Le produit marqué est à conserver à une température ne dépassant pas + 25°C.
6.5. Nature et contenu de l'emballage extérieur
Flacon multidose de 10 mL en verre de type I, fermé par un bouchon bromobutyle et scellé par une capsule métallique.
Boîte de 5 flacons.
6.6. Précautions particulières délimination et de manipulation
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE LAUTORISATION DE MISE SUR LE MARCHE
COVIDIEN IMAGING FRANCE
2, rue Diderot
La Clef Saint Pierre
78990 ELANCOURT
8. NUMERO(S) DAUTORISATION DE MISE SUR LE MARCHE
· 564 458-7: 31,4 mg de poudre en flacon (verre): boîte de 5.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE LAUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
Le technétium (99mTc) décroît en émettant principalement un rayonnement gamma d'énergie de 140 keV, avec une période de 6 heures pour donner du technétium (99Tc) qui peut être considéré comme stable.
La dose efficace, après administration intraveineuse d'une activité de 120 MBq, est de 1,06 mSv (chez un individu de 70 kg).
Selon le CIPR 80 (Commission Internationale de Protection radiologique) les doses de radiation absorbées par les patients sont les suivantes:
|
99mTc-DMSA |
Dose absorbée par unité d'activité administrée |
||||
|
Organe |
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Surrénales |
1,2E-02 |
1,6E-02 |
2,4E-02 |
3,5E-02 |
6,0E-02 |
|
Vessie |
1,8E-02 |
2,3E-02 |
2,9E-02 |
3,1E-02 |
5,7E-02 |
|
Surfaces osseuses |
5,0E-03 |
6,2E-03 |
9,2E-03 |
1,4E-02 |
2,6E-02 |
|
Cerveau |
1,2E-03 |
1,5E-03 |
2,5E-03 |
4,0E-03 |
7,2E-03 |
|
Seins |
1,3E-03 |
1,8E-03 |
2,8E-03 |
4,5E-03 |
8,4E-03 |
|
Vésicule biliaire |
8,3E-02 |
1,0E-02 |
1,4E-02 |
2,2E-02 |
3,1E-02 |
|
Tube digestif |
|
|
|
|
|
|
Estomac |
5,2E-03 |
6,3E-03 |
1,0E-02 |
1,4E-02 |
2,0E-02 |
|
Intestin grêle |
5,0E-03 |
6,4E-03 |
1,0E-02 |
1,4E-02 |
2,4E-02 |
|
Colon |
4,3E-03 |
5,5E-03 |
8,2E-03 |
1,2E-02 |
2,0E-02 |
|
Paroi côlon ascendant |
5,0E-03 |
6,4E-03 |
9,5E-03 |
1,4E-02 |
2,3E-02 |
|
Paroi côlon descendant |
3,3E-03 |
4,3E-03 |
6,5E-03 |
9,6E-03 |
1,6E-02 |
|
Cur |
3,0E-03 |
3,8E-03 |
5,8E-03 |
8,6E-03 |
1,4E-02 |
|
Reins |
1,8E-01 |
2,2E-01 |
3,0E-01 |
4,3E-01 |
7,6E-01 |
|
Foie |
9,5E-03 |
1,2E-02 |
1,8E-02 |
2,5E-02 |
4,1E-02 |
|
Poumons |
2,5E-03 |
3,5E-03 |
5,2E-03 |
8,0E-03 |
1,5E-02 |
|
Muscles |
2,9E-03 |
3,6E-03 |
5,2E-03 |
7,7E-03 |
1,4E-02 |
|
sophage |
1,7E-03 |
2,3E-03 |
3,4E-03 |
5,4E-03 |
9,4E-03 |
|
Ovaires |
3,5E-03 |
4,7E-03 |
7,0E-03 |
1,1E-02 |
1,9E-02 |
|
Pancréas |
9,0E-03 |
1,1E-02 |
1,6E-02 |
2,3E-02 |
3,7E-02 |
|
Moelle osseuse |
3,9E-03 |
4,7E-03 |
6,8E-03 |
9,0E-03 |
1,4E-02 |
|
Peau |
1,5E-03 |
1,8E-03 |
2,9E-03 |
4,5E-03 |
8,5E-03 |
|
Rate |
1,3E-02 |
1,7E-02 |
2,6E-02 |
3,8E-02 |
6,1E-02 |
|
Testicules |
1,8E-03 |
2,4E-03 |
3,7E-03 |
5,3E-03 |
1,0E-02 |
|
Thymus |
1,7E-03 |
2,3E-03 |
3,4E-03 |
5,4E-03 |
9,4E-03 |
|
Thyroïde |
1,5E-03 |
1,9E-03 |
3,1E-03 |
5,2E-03 |
9,4E-03 |
|
Utérus |
4,5E-03 |
5,6E-03 |
8,3E-03 |
1,1E-02 |
1,9E-02 |
|
Autres tissus |
2,9E-03 |
3,7E-03 |
5,2E-03 |
7,7E-03 |
1,4E-02 |
|
Dose efficace |
8,8E-03 |
1,1E-02 |
1,5E-02 |
2,1E-02 |
3,7E-02 |
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Instructions pour le marquage
Ajouter aseptiquement la quantité nécessaire de solution de pertechnétate (99mTc) de sodium (au maximum 3,7 GBq, 100 mCi) dans un volume de 5 mL au flacon de Technescan DMSA, agiter pendant une minute et laisser reposer 15 minutes à température ambiante. La solution peut être injectée. Le rendement de marquage est généralement supérieur à 98 %. Veiller à ne pas introduire d'air dans le flacon.
Instructions pour le contrôle de qualité
Contrôler par chromatographie couche mince sur une plaque de fibre de verre enrobée de gel de silice conformément aux exigences de la monographie 643 de la Pharmacopée Européenne.
Déposer 5 à 10 µl et laisser migrer à l'aide de méthyl éthyl cétone R sur un parcours de 5 à 10 cm. L'ion pertechnétate migre jusqu'au front du solvant alors que le complexe succimère technétié (99mTc) reste très proche du dépôt.
Le pertechnétate libre doit être inférieur ou égal à 2 %.
Le pourcentage de radioactivité retrouvée au niveau du dépôt de succimère technétié (99mTc) doit être supérieur ou égal à 95 %.
L'administration de produits radiopharmaceutiques présente des risques pour l'entourage du patient en raison de l'irradiation externe ou de la contamination par les urines, les vomissements, les expectorations. Par conséquent, il faut prendre les mesures de protection contre les radiations conformément aux réglementations nationales.
L'élimination des déchets doit se faire en accord avec les réglementations nationales et internationales.
Liste I.
Médicament réservé à l'usage hospitalier.
Les produits radiopharmaceutiques ne doivent être utilisés que par des personnes qualifiées. Ils ne peuvent être délivrés qu'à des praticiens ayant obtenu l'autorisation spéciale prévue à l'article R 1333-24 du Code de la Santé Publique.