|

RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 19/06/2013
FLUARIXTETRA suspension injectable en seringue préremplie
Vaccin grippal inactivé à virion fragmenté
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Virus de la grippe* (fragmenté, inactivé) des souches suivantes :
A/California/7/2009 (H1N1) - souche dérivée utilisée NYMC X-181................................15 microgrammes HA**
A/ Perth/16/2009 (H3N2) - souche analogue utilisée NYMC X-187 dérivée de A/Victoria/210/2009
................................................................................................................................ 15 microgrammes HA**
B/Brisbane/60/2008 (Victoria)...................................................................................... 15 microgrammes HA**
B/Brisbane/3/2007 (Yamagata).................................................................................... 15 microgrammes HA**
pour une dose de 0,5 ml
*Cultivé sur œufs embryonnés de poules provenant d’élevages sains.
**Hémagglutinine.
Ce vaccin est conforme aux recommandations de l'OMS (dans l'Hémisphère Nord) et à la décision de l’Union Européenne pour la saison 2011/2012.
Pour la liste complète des excipients, voir rubrique 6.1.
FLUARIXTETRA peut contenir des traces d’œufs (tels que ovalbumine, protéines de poulet), de formaldéhyde, de sulfate de gentamicine, de désoxycholate de sodium, utilisés pendant la fabrication (voir rubrique 4.3).
Suspension injectable en seringue préremplie.
La suspension est incolore ou légèrement opalescente.
4.1. Indications thérapeutiques
L’utilisation de FLUARIXTETRA doit se baser sur les recommandations officielles.
La revaccination annuelle avec ce vaccin est recommandée car l'immunité diminue au cours de l’année suivant la vaccination et les souches circulantes de virus de la grippe peuvent changer d'une année à l'autre.
4.2. Posologie et mode d'administration
Adultes : une dose de 0,5 ml
Population pédiatrique
Enfants à partir de 36 mois : une dose de 0,5 ml.
Pour les enfants de moins de 9 ans n'ayant pas été vaccinés auparavant, une seconde dose devra être injectée après un intervalle d'au moins 4 semaines.
Enfants de moins de 3 ans : la sécurité et l’efficacité de FLUARIXTETRA chez les enfants de moins de 3 ans n’ont pas été établies.
Mode d’administration
Administrer par voie intramusculaire.
Précautions à prendre avant la manipulation ou l’administration du vaccin :
Pour les instructions concernant le mode de préparation du vaccin avant administration, voir rubrique 6.6.
La vaccination doit être différée en cas de maladie fébrile ou d'infection aiguë.
4.4. Mises en garde spéciales et précautions d'emploi
Comme pour tous les vaccins injectables, il est recommandé de disposer d’un traitement médical approprié et d’assurer une surveillance en cas d'une éventuelle réaction anaphylactique suivant l'administration du vaccin.
La réponse en anticorps chez les patients présentant une immunodépression congénitale ou acquise peut être insuffisante.
FLUARIXTETRA n'est pas efficace contre toutes les souches possibles de virus de la grippe. FLUARIXTETRA est destiné à protéger contre les souches de virus à partir desquelles le vaccin est préparé et contre les souches étroitement apparentées.
Comme pour tout vaccin, une réponse immunitaire protectrice peut ne pas être obtenue chez tous les sujets vaccinés.
FLUARIXTETRA ne doit en aucun cas être administré par voie intravasculaire.
Comme avec les autres vaccins administrés par voie intramusculaire, FLUARIXTETRA doit être administré avec prudence chez les sujets présentant une thrombocytopénie ou un trouble de la coagulation en raison du risque de saignement qui peut survenir après administration intramusculaire chez ces sujets.
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, comme réaction psychogène à l’injection avec une aiguille. Ceci peut s’accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d’éviter des blessures en cas d’évanouissement.
Pour l’interférence avec des tests sérologiques, voir rubrique 4.5.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Après vaccination antigrippale, il a été observé des réponses faussement positives aux tests sérologiques utilisant la méthode ELISA pour détecter les anticorps contre HIV1, hépatite C, et surtout HTLV1. Infirmées par le Western Blot, ces réactions transitoires faussement positives pourraient être dues à la réponse IgM induite par la vaccination.
Grossesse
Les vaccins grippaux inactivés peuvent être utilisés à tous les stades de la grossesse. Les données de sécurité disponibles sont plus importantes pour le deuxième et le troisième trimestre de la grossesse que pour le premier trimestre. Cependant, les données d’utilisation des vaccins grippaux inactivés dans le monde n’indiquent pas d’issues anormales pour le fœtus et la mère, attribuables au vaccin.
Allaitement
Le vaccin peut être administré en cas d'allaitement.
Fécondité
Il n’existe pas de données disponibles sur la fécondité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité :
Au cours de 2 essais cliniques, des adultes sains âgés de 18 ans et plus et des enfants sains âgés de 3 à 17 ans ont reçu FLUARIXTETRA (plus de 3 000 adultes et 900 enfants) ou FLUARIX (vaccin antigrippal trivalent de GlaxoSmithKline) (plus de 1 000 adultes et 900 enfants).
Des fréquences similaires d'événements indésirables ont été observés chez les sujets ayant reçu FLUARIXTETRA et FLUARIX.
Dans tous les groupes d'âge la réaction indésirable locale la plus fréquemment rapportée après la vaccination était une douleur au site d'injection (36,4% à 40,9%).
Chez les adultes âgés de 18 ans et plus, les effets indésirables généraux les plus fréquemment rapportés après la vaccination étaient : fatigue (11,1%), céphalées (9,2%) et myalgies (11,8%).
Chez les sujets âgés de 6 à 17 ans, les effets indésirables généraux les plus fréquemment rapportés après la vaccination étaient : fatigue (12,6%), myalgie (10,9%) et céphalées (8,0%).
Chez les sujets âgés de 3 à 5 ans, les effets indésirables généraux les plus fréquemment rapportés après la vaccination étaient : somnolence (9,8%) et irritabilité (11,3%).
Liste des effets indésirables :
Les effets indésirables rapportés sont listés par dose selon les catégories de fréquences suivantes :
Très fréquent ³ 1/10
Fréquent ³ 1/100 à < 1/10
Peu fréquent ≥ 1/1 000 à < 1/100
Rare ≥ 1/10 000 à < 1/1 000
Très rare < 1/10 000
Trouble du métabolisme et de la nutrition :
Fréquent : perte d’appétit1
Affections psychiatriques :
Très fréquent : irritabilité1
Affections du système nerveux :
Fréquent : somnolence1, céphalées
Peu fréquent : sensation vertigineuse2
Affections gastro-intestinales :
Fréquent : symptômes gastro-intestinaux (incluant : nausées, vomissements, diarrhées et/ou douleurs abdominales)
Affections de la peau et du tissu sous-cutané :
Peu fréquent : éruption cutanée3
Affections musculo-squelettiques et systémiques :
Très fréquent : myalgies
Fréquent : arthralgies
Troubles généraux et anomalies au site d’administration :
Très fréquent : douleur au site d’injection, fatigue
Fréquent : rougeur au site d’injection4, gonflement au site d’injection4, frissons, fièvre
Peu fréquent : hématome au site d'injection2, prurit au site d’injection
1rapporté comme un symptôme sollicité chez les sujets âgés de moins de 6 ans
2rapporté chez des sujets adultes
3rapporté chez les sujets âgés de 3 ans à 17 ans
4très fréquent chez les sujets âgés de 3 ans à 17 ans
De plus, les effets indésirables suivants ont été rapportés dans les précédentes études avec Fluarix :
Affections de la peau et du tissu sous-cutané :
Fréquent : sueur
Troubles généraux et anomalies au site d’administration :
Fréquent : induration au site d’injection
Données après commercialisation
Il n'y a pas de données après commercialisation pour FLUARIXTETRA. Cependant, comme les trois souches grippales de FLUARIX sont incluses dans FLUARIXTETRA, les événements indésirables suivants, observés avec FLUARIX au cours de la surveillance après commercialisation, peuvent survenir chez les sujets recevant FLUARIXTETRA.
Affections hématologiques et du système lymphatique :
Rare : lymphadénopathie transitoire.
Affections du système immunitaire :
Rare : réactions allergiques (incluant les réactions anaphylactiques)
Affections du système nerveux :
Rare : névrite, encéphalomyélite aiguë disséminée, syndrome de Guillain-Barré*
*Des notifications spontanées de syndrome de Guillain-Barré ont été rapportées après vaccination avec FLUARIX. Cependant, une relation causale entre la vaccination et le syndrome de Guillain-Barré n’a pas été établie.
Affections de la peau et du tissu sous-cutané :
Rare: urticaire, prurit, érythème, angiœdème
Troubles généraux et anomalies au site d’administration
Rare: syndrome pseudo-grippal, malaise
Il est peu probable qu'un surdosage provoque un effet nocif.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmaco-thérapeutique : vaccin contre la grippe
Code ATC : J07BB02
Mécanisme d'action
FLUARIXTETRA permet une immunisation active contre quatre souches de virus de la grippe (deux sous-types A et deux types B) contenu dans le vaccin.
FLUARIXTETRA induit des anticorps humoraux contre les hémagglutinines. Ces anticorps neutralisent les virus de la grippe.
Il n’a pas été établi de seuil en anticorps inhibant l'hémagglutination (IH) corrélé à une protection contre la grippe après la vaccination par les vaccins grippaux inactivés. Cependant, les titres en anticorps IH ont été utilisés comme mesure de l'activité vaccinale. Dans certaines études de challenge chez l’Homme, des titres en anticorps IH ≥ 1:40 ont été associés à une protection contre la grippe chez jusqu’à 50% des sujets.
Effet pharmacodynamique
Immunogénicité de FLUARIXTETRA versus FLUARIX
Les études cliniques menées chez des adultes (D-QIV-001 et D-QIV-008) et chez des enfants de 3 ans à 17 ans (D-QIV-003) ont évalué la non-infériorité de FLUARIXTETRA versus FLUARIX en terme de moyennes géométriques des titres (MGT) en anticorps IH au jour 21 (pour les adultes) et au jour 28 (pour les enfants) et de taux de séroconversion IH (multiplication par 4 des titres en anticorps ou passage de titre indétectable [<10] à un titre ≥ 40).
Dans toutes les études, la réponse immunitaire induite par FLUARIXTETRA vis-à-vis des trois souches communes était non-inférieure à celle de FLUARIX. FLUARIXTETRA a induit une réponse immunitaire supérieure pour la souche B additionnelle présente dans FLUARIXTETRA comparée à FLUARIX.
Adultes de 18 ans et plus
Dans l'étude clinique D-QIV-008, environ 1 800 adultes de 18 ans et plus ont reçu une dose unique de FLUARIXTETRA et environ 600 sujets ont reçu une dose unique de FLUARIX.
Tableau 1 : Moyenne géométrique des titres en anticorps (MGT) et taux de séroconversion après vaccination
|
Adultes de 18 ans et plus |
FLUARIXTETRA N=1 809 |
N=608 |
|
|
MGT (IC 95%) |
|
A/H1N1 |
201,1 (188,1;215,1) |
218,4 (194,2;245,6) |
|
A/H3N2 |
314,7 (296,8;333,6) |
298,2 (268,4;331,3) |
|
B (Victoria)2 |
404,6 (386,6;423,4) |
393,8 (362,7;427,6) |
|
B (Yamagata)3 |
601,8 (573,3;631,6) |
386,6 (351,5;425,3) |
|
|
Taux de séroconversion (IC 95%) |
|
|
A/H1N1 |
77,5% (75,5;79,4) |
77,2% (73,6;80,5) |
|
A/H3N2 |
71,5% (69,3;73,5) |
65,8% (61,9;69,6) |
|
B (Victoria) |
58,1% (55,8;60,4) |
55,4% (51,3;59,4) |
|
B (Yamagata) |
61,7% (59,5;64,0) |
45,6% (41,6;49,7) |
1contenant A/H1N1, A/H3N2 et B (lignée Victoria)
2souche recommandée par l’OMS au cours de la saison 2010-2011
3souche B additionnelle contenue dans FLUARIXTETRA recommandée durant la saison 2008-2009
Les taux de séroprotection (titre ≥ 40 après 21 jours) après vaccination par FLUARIXTETRA ont été de 91,3% contre A/H1N1, 96,8% contre A/H3N2, 98,8% contre B (Victoria) et 91,8% contre B (Yamagata).
Dans l'étude clinique D-QIV-001 (composition vaccinale de la saison 2007-2008), les taux de séroprotection après vaccination pour FLUARIXTETRA ont été de 92,3% contre A/H1N1, 97,1% contre A/H3N2, 97,1% contre B (Victoria) et 98,1% contre B (Yamagata).
Enfants de 3 à 17 ans
Dans une étude clinique (D-QIV-003), environ 900 enfants de 3 à 17 ans ont reçu respectivement une ou deux doses de FLUARIXTETRA ou FLUARIX.
Tableau 2 : Moyenne géométrique des titres en anticorps (MGT) et taux de séroconversion après vaccination
|
Enfants de 3 à 17 ans |
FLUARIXTETRA N=791 |
FLUARIX1 N=818 |
|
|
MGT (IC 95%) |
|
|
A/H1N1 |
386,2 (357,3;417,4) |
433,2 (401,0;468,0) |
|
A/H3N2 |
228,8 (215,0;243,4) |
227,3 (213,3;242,3) |
|
B (Victoria)2 |
244,2 (227,5;262,1) |
245,6 (229,2;263,2) |
|
B (Yamagata)3 |
569,6 (533,6;608,1) |
224,7 (207,9;242,9) |
|
|
Taux de séroconversion (IC 95%) |
|
|
A/H1N1 |
91,4% (89,2;93,3) |
89,9% (87,6;91,8) |
|
A/H3N2 |
72,3% (69,0;75,4) |
70,7% (67,4;73,8) |
|
B (Victoria) |
70,0% (66,7;73,2) |
68,5% (65,2;71,6) |
|
B (Yamagata) |
72,5% (69,3;75,6) |
37,0% (33,7;40,5) |
1contenant A/H1N1, A/H3N2 et B (lignée Victoria)
2souche recommandée par l’OMS au cours de la saison 2010-2011
3souche B additionnelle contenue dans FLUARIXTETRA recommandée durant la saison 2008-2009
Les taux de séroprotection après vaccination par FLUARIXTETRA ont été de 96,6% contre A/H1N1, 98,0% contre A/H3N2, 97,3% contre B (Victoria) et 99,2% contre B (Yamagata).
Efficacité chez l’adulte de 18 à 64 ans
Une étude clinique réalisée chez plus de 7 600 sujets en République Tchèque et en Finlande a évalué l'efficacité de FLUARIX dans la prévention de la grippe A et/ou B confirmée par culture, pour les souches antigéniquement apparentées à celles du vaccin.
Les sujets étaient surveillés pour tout syndrome pseudo-grippal, qui devait être confirmé par culture (voir tableau ci-dessous pour les résultats). Le syndrome pseudo-grippal était défini comme au moins un symptôme général (fièvre ≥ 37,8°C et/ou myalgies) et au moins un symptôme respiratoire (toux et/ou maux de gorge).
Tableau 3 : Taux d'attaque et efficacité vaccinale contre la grippe A ou B confirmée chez des adultes de 18 à 64 ans (cohorte totale vaccinée)
|
|
Taux d’attaque (n/N)1 |
Efficacité vaccinale (IC95%2) |
||||
|
|
N |
n |
% |
% |
LI3 |
LS |
|
Grippe confirmée par culture, de souche antigéniquement apparentée4 |
||||||
|
FLUARIX |
5 103 |
49 |
1,0 |
66,9 |
51,9 |
77,4 |
|
Placebo |
2 549 |
74 |
2,9 |
- |
- |
- |
|
Toute grippe confirmée par culture (apparentée, non apparentée et non typée)5 |
||||||
|
FLUARIX |
5 103 |
63 |
1,2 |
61,6 |
46,0 |
72,8 |
|
Placebo |
2 549 |
82 |
3,2 |
- |
- |
- |
1n/N : nombre de cas/nombre total de sujets
2IC : Intervalle de Confiance
3LI : Limite Inferieure
4Aucun cas de grippe A/New Caledonia/20/1999 (H1N1) ou B/Malaysia/2506/2004, confirmée par culture, et antigéniquement apparentée, dans le groupe FLUARIX et placebo n’a été rapporté.
5Sur les 22 cas supplémentaires, 18 étaient non apparentés et 4 étaient non typés. Quinze des 22 cas étaient de type A (H3N2) (11 cas dans le groupe FLUARIX et 4 dans le groupe placebo).
Dans cette étude, l'immunogénicité a aussi été évaluée.
Tableau 4 : Moyenne géométrique des titres en anticorps (MGT) et taux de séroconversion après vaccination
|
Adultes de 18 à 64 ans |
FLUARIX1 N=291 |
|
|
MGT (IC 95%) |
|
A/H1N1 |
541,0 (451,0 ; 649,0) |
|
A/H3N2 |
133,2 (114,6 ; 154,7) |
|
B (Victoria) |
242,8 (210,7 ; 279,7) |
|
|
Taux de séroconversion (IC 95%) |
|
A/H1N1 |
76,3% (71,0 ; 81,1) |
|
A/H3N2 |
73,9% (68,4 ; 78,8) |
|
B (Victoria) |
85,2% (80,6 ; 89,1) |
1contenant A/H1N1, A/H3N2 et B (lignée Victoria)
Les taux de séroprotection après vaccination ont été de 97,6% contre A/H1N1, 86,9% contre A/H3N2 et 96,2% contre B (Victoria).
L’Agence européenne des médicaments a différé l’obligation de soumettre les résultats d’études réalisées avec FLUARIXTETRA dans un ou plusieurs sous-groupes de la population pédiatrique, dans la prévention de la grippe de 2 sous-types de virus grippal A et 2 types de virus grippal B contenus dans le vaccin (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).
5.2. Propriétés pharmacocinétiques
5.3. Données de sécurité préclinique
6.4. Précautions particulières de conservation
À conserver au réfrigérateur (entre +2°C et +8°C).
Ne pas congeler.
A conserver dans l’emballage extérieur d’origine, à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Le vaccin doit être amené à température ambiante avant utilisation.
Agiter avant l'emploi. Inspecter visuellement avant l’administration.
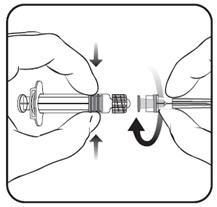
Instructions pour l’administration du vaccin présenté en seringue préremplie sans aiguille sertie
Protège-aiguille

![]() Aiguille
Aiguille
 Seringue
Seringue
 | |||
 | |||
1. En tenant le corps de la seringue d’une main (en évitant de tenir le piston), dévisser l’embout protecteur de la seringue en le tournant dans le sens inverse des aiguilles d’une montre.
2. Pour fixer l’aiguille sur la seringue, visser l’aiguille dans le sens des aiguilles d’une montre sur la seringue jusqu’à sentir un blocage (voir schéma).
3. Enlever le protège aiguille, ce qui à l’occasion peut être un peu difficile.
4. Administrer le vaccin.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation locale en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
LABORATOIRE GLAXOSMITHKLINE
100, ROUTE DE VERSAILLES
78163 MARLY-LE-ROI CEDEX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
274 425-9 ou 34009 274 425 9 9: 0,5 ml en seringue préremplie (verre de type I) munie d'un bouchon-piston (butyle) - boîte de 1.
274 426-5 ou 34009 274 426 5 0: 0,5 ml en seringue préremplie (verre de type I) munie d'un bouchon-piston (butyle) avec aiguille sertie - boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Médicament non soumis à prescription médicale.