

RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 18/01/2013
ULTRA TECHNEKOW FM, générateur de technétium (99mTc)
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Composition du générateur de Molybdène (99Mo)/Technétium (99mTc) :
Molybdate (99Mo) de sodium..................... 2,15-4,30-6,45-8,60-10,75-12,90-17,20-21,50–25,8–30,1–34,4–43 GBq
Alumine oxyde..................................................................................................................................... 2,8 g
Ne contient pas de conservateur antimicrobien.
Pour la liste complète des excipients, voir rubrique 6.1.
Générateur de radionucléide.
4.1. Indications thérapeutiques
Ce médicament est à usage diagnostique uniquement.
L'éluat du générateur, solution injectable de pertechnétate (99mTc) de sodium (Ph. Eur.), peut être utilisé comme précurseur pour le marquage de différents composés fournis sous forme de trousses, ou être administré directement tel que :
a. Lorsqu'elle est injectée par voie intraveineuse, la solution injectable de pertechnétate (99mTc) de sodium peut être utilisée dans les indications diagnostiques suivantes :
· Scintigraphie thyroïdienne : imagerie et mesure de la fixation thyroïdienne permettant d’obtenir des informations sur la présence de nodules, sur leur taille et leur position ainsi que l’étude anatomique et fonctionnelle de la thyroïde.
· Scintigraphie des glandes salivaires : examen anatomique et fonctionnel.
· Scintigraphie de la muqueuse gastrique ectopique : diverticule de Meckel.
b. Lorsqu'elle est utilisée pour le marquage des globules rouges par le technétium (99mTc) après l'administration d'un agent réducteur :
· Scintigraphie cardio-vasculaire :
Angioscintigraphie pour :
o évaluation de la fraction d’éjection ventriculaire
o évaluation globale ou régionale de la motilité de la paroi cardiaque
o imagerie des phases myocardiques
o Imagerie de perfusion d’organe ou d’anomalies vasculaires
c. Après instillation de la solution stérile de pertechnétate (99mTc) de sodium dans l'œil :
· Scintigraphie des canaux lacrymaux.
4.2. Posologie et mode d'administration
La solution injectable de pertechnétate (99mTc) de sodium est habituellement administrée par voie intraveineuse. Les activités utilisées varient largement selon l'information clinique recherchée et l'appareillage utilisé. Le pré-traitement des patients avec des agents bloquant la thyroïde ou avec des agents réducteurs peut être nécessaire pour certaines indications. D’autres niveaux d’activité peuvent être justifiés selon les niveaux de référence diagnostique en vigueur nationalement.
Les radioactivités recommandées sont les suivantes :
ADULTES ET PERSONNES ÂGÉES :
Scintigraphie thyroïdienne : 20 - 80 MBq
Scintigraphie des glandes salivaires : 40 MBq
Scintigraphie des diverticules de Meckel : 400 MBq
Scintigraphies cardiaque et vasculaire : 750 - 950 MBq
Les globules rouges sont marqués in vivo après l’administration préalable d’un agent réducteur.
Scintigraphie des canaux lacrymaux : 2 - 4 MBq dans chaque œil.
Des gouttes sont instillées dans chaque œil.
ENFANTS :
L'utilisation chez l'enfant et l'adolescent doit être envisagée avec prudence, sur la base des besoins cliniques et après une évaluation du rapport bénéfice/risque.
L’activité à administrer à l’enfant peut être calculée à partir des activités recommandées chez l’adulte en fonction de la masse ou de la surface corporelle.
Cependant, le groupe de travail "Pédiatrie" de l'EANM recommande que l’activité administrée à l’enfant soit calculée en fonction de sa masse corporelle en utilisant les facteurs présentés dans le tableau suivant :
Coefficient de correction à appliquer à l’activité chez l’adulte.
|
3 kg |
= |
0,10 |
22 kg |
= |
0,50 |
42 kg |
= |
0,78 |
|
4 kg |
= |
0,14 |
24 kg |
= |
0,53 |
44 kg |
= |
0,80 |
|
6 kg |
= |
0,19 |
26 kg |
= |
0,56 |
46 kg |
= |
0,82 |
|
8 kg |
= |
0,23 |
28 kg |
= |
0,58 |
48 kg |
= |
0,85 |
|
10 kg |
= |
0,27 |
30 kg |
= |
0,62 |
50 kg |
= |
0,88 |
|
12 kg |
= |
0,32 |
32 kg |
= |
0,65 |
52-54 kg |
= |
0,90 |
|
14 kg |
= |
0,36 |
34 kg |
= |
0,68 |
56-58 kg |
= |
0,92 |
|
16 kg |
= |
0,40 |
36 kg |
= |
0,71 |
60-62 kg |
= |
0,96 |
|
18 kg |
= |
0,44 |
38 kg |
= |
0,73 |
64-66 kg |
= |
0,98 |
|
20 kg |
= |
0,46 |
40 kg |
= |
0,76 |
68 kg |
= |
0,99 |
Pour le très jeune enfant (moins de 1 an), une activité minimale de 20 MBq (10 MBq pour la scintigraphie thyroïdienne) pour une administration directe, et de 80 MBq pour le marquage des globules rouges, sont nécessaires pour obtenir des images de qualité satisfaisante.
Méthode d’administration
Pour usage multidose.
Pour voie intraveineuse, oculaire ou marquage.
Pour la scintigraphie thyroïdienne, la scintigraphie des glandes salivaires, l'identification de muqueuse gastrique ectopique, la solution de pertechnétate (99mTc) de sodium est administrée par voie intraveineuse.
Pour la scintigraphie des canaux lacrymaux, des gouttes sont instillées dans chaque œil.
Pour les instructions de préparation extemporanée avant administration, voir rubrique 12.
Pour la préparation du patient, voir rubrique 4.4.
Acquisition des images
Scintigraphie thyroïdienne :
L’acquisition des images est réalisée 20 minutes après l'injection intraveineuse.
Scintigraphie des glandes salivaires :
L’acquisition des images est réalisée immédiatement après l'injection intraveineuse et à intervalles réguliers jusqu'à 15 minutes.
Scintigraphie des diverticules de Meckel :
L’acquisition des images est réalisée immédiatement après l'injection intraveineuse et à intervalles réguliers jusqu'à 30 minutes.
Scintigraphie cardiaque et vasculaire :
Les images du premier passage cardio-vasculaire sont acquises à l’équilibre la première minute après administration ; elles seront suivies par des images durant 30 minutes.
Scintigraphie des canaux lacrymaux :
Une série d’images sont acquises dans les 2 minutes, pendant les 20 minutes suivantes des images statiques sont acquises à intervalles réguliers.
Hypersensibilité à la substance active ou à l’un des excipients voir rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Potentiel de réactions d'hypersensibilité ou de réactions anaphylactiques
En cas de réaction d’hypersensibilité ou de réaction anaphylactique, l’administration du produit médicamenteux doit être immédiatement interrompue et un traitement par voie intraveineuse doit être débuté, si nécessaire. Afin de permettre une prise en charge rapide en cas d’urgence, il convient d’avoir à disposition immédiate les médicaments et le matériel nécessaires, notamment une sonde d’intubation trachéale et du matériel de ventilation.
Justification du rapport bénéfice/risque
Pour chaque patient, l'exposition aux rayonnements ionisants doit être justifiée par rapport au bénéfice attendu. L'activité injectée, doit correspondre à la plus faible dose de radiation possible, compatible avec l'obtention de l'information diagnostique escomptée.
Population pédiatrique
Pour toute information relative à une utilisation chez l’enfant, voir rubrique 4.2
L'indication doit être considérée avec prudence, car la dose efficace par MBq est plus élevée que chez l'adulte, voir rubrique 11.
Préparation du patient
Un pré-traitement des patients par des agents bloquant la thyroïde ou des agents réducteurs peut être nécessaire pour certaines indications.
Le patient doit être bien hydraté avant le début de l'examen et uriner aussi souvent que possible au cours des premières heures suivant l'examen afin de réduire l'exposition aux radiations.
Pour la scintigraphie de diverticules de Meckel, le patient doit être à jeun depuis trois à quatre heures avant l’examen afin de maintenir un faible péristaltisme de l’intestin grêle.
Afin d’éviter de faux positifs et de minimiser l’irradiation en réduisant l’accumulation de pertechnétate dans la thyroïde et les glandes salivaires, du perchlorate de potassium doit être administré avant une scintigraphie des canaux lacrymaux ou une recherche de diverticules de Meckel.
Dans la scintigraphie des glandes salivaires, une spécificité moindre de la méthode doit être attendue comparativement à la sialographie par IRM.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par flacon et peut donc être considéré comme pratiquement «sans sodium ».
Précautions à prendre vis-à-vis de l’environnement, voir rubrique 6.6.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Lorsqu'il est nécessaire d'administrer des produits radiopharmaceutiques à la femme en âge de procréer, il est indispensable de s’informer de toute éventualité de grossesse. Toute femme n'ayant pas eu ses règles doit être considérée comme enceinte jusqu'à preuve du contraire. Dans le doute, il est important que l'exposition aux radiations soit réduite au minimum pour obtenir les informations cliniques souhaitées. D'autres techniques n'impliquant pas l'emploi de radiations ionisantes doivent être envisagées.
Grossesse
Il a été démontré que le technétium (99mTc), sous forme de pertechnétate, passe au travers de la barrière placentaire.
Les examens faisant appel aux radionucléides effectués chez la femme enceinte entraînent une certaine dose de radiation pour le fœtus. Ils ne sont donc réalisés pendant la grossesse que pour des raisons impératives et après avoir évalué le bénéfice attendu par rapport aux risques encourus par la mère et le fœtus.
L'administration directe de 800 MBq de pertechnétate (99mTc) de sodium à une patiente entraîne une dose d'irradiation de l'utérus de 6,5 mGy. En cas d'administration à la patiente d'un agent bloquant la thyroïde, l'administration de 800 MBq de pertechnétate (99mTc) de sodium entraîne une dose d'irradiation de l'utérus de 4,8 mGy. L'administration de 950 MBq de globules rouges marqués au technétium (99mTc) entraîne une dose d'irradiation de l'utérus de 3.7 mGy
Allaitement
Avant d'administrer un produit radiopharmaceutique à une femme en période d'allaitement, il faut envisager si on peut repousser raisonnablement l'examen jusqu'à la fin de l'allaitement ou s'assurer, dans le cas contraire, que le radiopharmaceutique choisi est le plus approprié compte tenu de l'éventuel passage de la radioactivité dans le lait.
Si l'administration est indispensable, l'allaitement doit être interrompu et le lait produit pendant les 12 heures suivantes doit être éliminé.
Tout contact étroit avec des nourrissons doit être évité durant cette période.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont pas été étudiés.
Le tableau suivant décrit les groupes de fréquence utilisés dans cette rubrique :
· Très fréquent (³ 1/10)
· Fréquent (³ 1/100 à < 1/10)
· Peu fréquent (³ 1/1 000 à < 1/100)
· Rare (³ 1/10 000 à < 1/1 000)
· Très rare (< 1/10 000)
· Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
Des informations sur des effets indésirables issus de notifications spontanées sont disponibles. Les types d'effets indésirables rapportés sont des réactions anaphylactoïdes, des réactions neurovégétatives et divers types de réactions au site d'injection. Le pertechnétate (99mTc) de sodium issu du générateur UltraTechnekow FM est utilisé pour le marquage radioactif de différents composés. Le potentiel d'effets indésirables de ces agents pharmaceutiques est généralement plus élevé que celui du 99mTc, et de ce fait, les effets indésirables rapportés sont plutôt liés aux composés marqués qu'au 99mTc. Les types des éventuels effets indésirables survenus à la suite de l'administration intraveineuse d'une préparation pharmaceutique marquée par le 99mTc dépendent du composé spécifique utilisé. Ces informations peuvent être consultées dans le RCP de la trousse utilisée pour la préparation radiopharmaceutique.
Réactions anaphylactiques
Des réactions anaphylactiques ont été rapportées à la suite de l'injection intraveineuse de pertechnétate (99mTc) de sodium et ont comporté divers symptômes cutanés ou respiratoires tels que des irritations cutanées, un œdème ou une dyspnée.
Réactions neurovégétatives (système nerveux et troubles digestifs)
Des cas isolés de réactions neurovégétatives sévères ont été rapportés, mais la plupart des effets neurovégétatifs décrits ont été des troubles digestifs tels que des nausées ou des vomissements. D'autres rapports ont décrit des réactions vasovagales telles que des céphalées ou des sensations vertigineuses. Les effets neurovégétatifs sont plutôt considérés comme liés au contexte de l'examen qu'au technétium (99mTc), particulièrement chez les patients anxieux.
Troubles généraux et anomalies au site d'administration
D'autres rapports ont décrit des réactions locales au site de l'injection. Ces réactions sont liées à l'extravasation de la substance radioactive durant l'injection, et vont d'une tuméfaction locale jusqu'à une cellulite. Selon la radioactivité administrée et le composé radiomarqué, une extravasation étendue peut nécessiter un traitement chirurgical.
Les types de réactions et les symptômes observés sont résumés ci-dessous. Seules des notifications spontanées ont pu être analysées, aucune indication de fréquence ne peut donc être mentionnée.
Effets indésirables classés par classe de système d’organe.
|
Affections du système immunitaire : Fréquence indéterminée*: réactions anaphylactiques (ex. dyspnée, coma, urticaire, érythème, éruption cutanée, prurit, œdème de localisations variées ex. œdème de la face) |
|
Affections du système nerveux : Fréquence indéterminée*: réactions vasovagales (ex. syncope, tachycardie, bradycardie, étourdissements, céphalées, vision floue, bouffées vasomotrices) |
|
Troubles gastro-intestinaux : Fréquence indéterminée*: vomissements, nausées, diarrhées |
|
Troubles généraux et anomalies au site d’administration : Fréquence indéterminée*: réactions au site d’injection (ex. cellulite, douleur, érythème, tuméfaction) |
*Effets indésirables décrits lors de déclarations spontanées.
Pour tout patient, l'exposition aux radiations ionisantes doit être justifiée par le bénéfice diagnostique attendu. La radioactivité administrée doit être telle que l'irradiation qui en découle soit aussi faible que possible, en gardant à l'esprit la nécessité d'obtenir le diagnostic requis.
L'exposition aux radiations ionisantes peut éventuellement induire des cancers ou développer des déficiences héréditaires.
Etant donné que, selon l’indication diagnostique du pertechnétate (99mTc) de sodium, la dose efficace varie entre 0.026 mSv et 12 mSv pour une activité recommandée comprise entre 2 MBq et 950 MBq, la probabilité de survenue de ces effets indésirables est considérée comme faible.
La fixation dans la thyroïde, les glandes salivaires et la muqueuse gastrique peut être significativement réduite si du perchlorate de sodium est administré immédiatement après une dose accidentellement élevée de pertechnétate (99mTc) de sodium.
En cas de surdosage de globules rouges marqués au technétium (99mTc), très peu de mesures efficaces peuvent être envisagées.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : produit radiopharmaceutique à usage diagnostique, Code ATC : V09FX01.
Effets pharmacologiques
Aux concentrations utilisées pour des examens de diagnostic, le pertechnétate (99mTc) de sodium paraît n’avoir aucune activité pharmacodynamique.
5.2. Propriétés pharmacocinétiques
Distribution
L'ion pertechnétate a une distribution biologique similaire à celle des ions iodure et perchlorate, en se concentrant temporairement dans les glandes salivaires, les plexus choroïdes, l'estomac (muqueuse gastrique) et dans la glande thyroïde, d'où il est éliminé inchangé.
L'ion pertechnétate est également présent dans les régions où la vascularisation est accrue, où la perméabilité vasculaire est anormale, particulièrement quand un pré-traitement avec des agents bloquants inhibe la fixation par les structures glandulaires. Le technétium (99mTc) est rapidement éliminé du liquide céphalo-rachidien.
Fixation aux organes
Lorsque la capture sélective du pertechnétate (99mTc) de sodium par les structures glandulaires est inhibée par l'administration préalable d'agents bloquants, l'excrétion suit le même schéma, mais avec une clairance rénale plus rapide.
Lorsque le pertechnétate (99mTc) de sodium est administré après un pré-traitement par des agents réducteurs tels qu'étain (II)/médronate ou étain (II)/pyrophosphate qui conduit à l'incorporation d'étain (II) dans les globules rouges, jusqu’à 95% de l’activité administrée est captée par les globules rouges. Le pertechnétate [99mTc] de sodium non lié est éliminé par voie rénale ; l’activité du plasma représente normalement moins de 5% de l’activité intravasculaire.
Le sort du technétium [99mTc] est lié à celui des globules rouges eux-mêmes et la radioactivité disparaît très lentement. On estime qu'il y a un faible relargage de la radioactivité par les globules rouges circulants.
Elimination
Après administration intraveineuse, le pertechnétate (99mTc) de sodium se répartit dans le système vasculaire d'où il est éliminé par trois principaux mécanismes :
· Diffusion dans le liquide interstitiel donnant une élimination rapide.
· Concentration du pertechnétate dans les tissus glandulaires, principalement la thyroïde, les glandes salivaires et le fundus gastrique, présentant une activité de pompe ionique donnant une vitesse d'élimination intermédiaire
· Filtration glomérulaire rénale donnant une élimination lente.
La période d'élimination plasmatique est d’environ trois heures.
Durant les 24 heures suivant l'administration, l'excrétion est principalement urinaire (environ 25%) ; l'excrétion fécale apparaît dans les 48 heures suivantes. Environ 50% de l’activité administrée est éliminée dans les 50 premières heures.
5.3. Données de sécurité préclinique
Effet toxique sur la reproduction : le passage transplacentaire du technétium-99m après administration intraveineuse de pertechnétate [99mTc] de sodium a été étudié chez la souris. L'utérus pendant la gestation contenait plus de 60% de l’activité injectée lorsque le technétium-99m était administré sans traitement préalable au perchlorate. Des études menées sur des souris pendant la gestation, pendant la gestation et la lactation, et pendant la lactation seule, ont montré des changements dans la descendance tels que réduction de poids, pilosité réduite et stérilité.
Flacon de chlorure de sodium pour injection: chlorure de sodium, eau pour préparations injectables.
Flacon sous vide: eau pour préparations injectables.
Tampons de désinfection: compresse non tissée, alcool isopropylique/eau purifiée.
Eluat : utilisation dans les 8 heures après élution.
Flacons sous-vide : 12 mois
Flacons NaCl 9 mg/mL: 24 mois
L'éluat de pertechnétate [99mTc] de sodium doit être conservé entre 15°C et 25°C, sous une protection appropriée.
6.4. Précautions particulières de conservation
Le générateur doit être conservé à une température inférieure à 25°C, sous une protection appropriée. Ne pas réfrigérer.
Pour la conservation du médicament après l’élution, voir rubrique 6.3.
Flacons sous-vide : entre 15°C et 25°C
Flacons NaCl 9 mg/mL: entre 15°C et 25°C
Le stockage doit être effectué conformément aux réglementations nationales relatives aux produits radioactifs.
6.5. Nature et contenu de l'emballage extérieur
L'ULTRATECHNEKOW FM comprend :
a) un générateur de molybdène [99Mo]/technétium [99mTc] composé de :
· une solution de Mo-99 adsorbée sur une colonne d'alumine contenue dans du verre (type I), le tout placé dans un blindage en plomb;
· une double aiguille d'entrée, l'une connectée au sommet de la colonne, l'autre permettant l'entrée d'air dans le flacon d'éluant à travers un filtre lors de l'élution ;
· une simple aiguille de sortie connectée au bas de la colonne;
· un blindage en plomb, en forme d'ogive de 28 mm à 56 mm d'épaisseur en fonction de l'activité du générateur ;
· un emballage extérieur cylindrique métallique.
b) une trousse d'élution, composée de :
· 7 flacons de verre type I, sous vide, stériles et exempts d'endotoxines
· 1 flacon de 100 mL de NaCl 9mg/mL solution injectable
· 7 tampons antiseptiques
· 1 flacon stérile pour la protection de l'aiguille d'élution
· 7 étiquettes avec le symbole de radioactivité
Les flacons sous vide sont des flacons de 5, 11 ou 25 mL en verre de type I (Pharmacopée Européenne) fermés par un bouchon composé d'un mélange de caoutchouc naturel et de chlorobutyle et scellés par une capsule en aluminium.
Le flacon de NaCl 9 mg/mL est un flacon de 100 mL en verre de type I (Pharmacopée Européenne) fermé par un bouchon en chlorobutyle et scellé par une capsule en aluminium.
6.6. Précautions particulières d’élimination et de manipulation
Les produits radiopharmaceutiques doivent être préparés de manière à satisfaire à la fois aux normes de radioprotection et de qualité pharmaceutique. Les précautions appropriées d'asepsie doivent être prises afin de satisfaire aux exigences de Bonnes Pratiques de Fabrication pharmaceutique.
Comme pour tout produit pharmaceutique, si à tout moment au cours de la préparation de ce produit, l'intégrité d’un flacon venait à être compromise, le produit ne devrait pas être utilisé.
L’administration de radiopharmaceutiques doit être réalisée dans des conditions de façon à minimiser le risque de contamination et d’exposition aux radiations du personnel. L’utilisation de protection plombée adéquate est requise.
L’administration de produits radiopharmaceutiques présente des risques pour l’entourage du patient en raison de l’irradiation externe ou de la contamination par les urines, les vomissements, les expectorations, etc.… Par conséquent, il faut prendre des mesures de protection contre les radiations conformément aux réglementations nationales.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
COVIDIEN IMAGING FRANCE
2, RUE DIDEROT
LA CLEF SAINT PIERRE
78990 ELANCOURT
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 554 176-9 ou 3400955417699 : 2,15 - 4,30 - 6,45 - 8,60 - 10,75 - 12,90 - 17,20 - 21,50 - 25,8 - 30,1 - 34,4 - 43 GBq
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
Selon la CIPR 80, les doses de radiation absorbées par le patient après l'administration directe de pertechnétate [99mTc] de sodium sont les suivantes :
Sans pré-traitement de la fixation glandulaire aux agents bloquants
|
|
Dose absorbée par unité d'activité administrée (en mGy/MBq) |
||||
|
Organe |
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Surrénales |
0.0037 |
0.0047 |
0.0072 |
0.011 |
0.019 |
|
Vessie |
0.018 |
0.0023 |
0.03 |
0.033 |
0.06 |
|
Surfaces osseuses |
0.0054 |
0.0066 |
0.0097 |
0.014 |
0.026 |
|
Cerveau |
0.002 |
0.0025 |
0.0041 |
0.0066 |
0.012 |
|
Seins |
0.0018 |
0.0023 |
0.0034 |
0.0056 |
0.011 |
|
Vésicule biliaire |
0.0074 |
0.0099 |
0.016 |
0.0023 |
0.0035 |
|
Tube digestif Estomac Intestin grêle Côlon Paroi côlon ascendant Paroi colon descendant Coeur Reins Foie Poumons Muscles Oesophage Ovaires Pancréas Glandes salivaires Moelle osseuse Peau Rate Testicules Thymus Thyroïde Utérus Autres tissus
|
0.026 0.016 0.042 0.057 0.021 0.0031 0.005 0.0038 0.0026 0.0032 0.0024 0.001 0.0056 0.0093 0.0036 0.0018 0.0043 0.0028 0.0024 0.0022 0.0081 0.0035
|
0.034 0.02 0.054 0.073 0.028 0.004 0.006 0.0048 0.0034 0.004 0.0032 0.013 0.0073 0.012 0.0045 0.0022 0.0054 0.0037 0.0032 0.036 0.01 0.0043
|
0.048 0.031 0.88 0.12 0.045 0.0061 0.0087 0.0081 0.0051 0.006 0.0047 0.018 0.011 0.017 0.0066 0.0035 0.0081 0.0058 0.0047 0.055 0.015 0.0064
|
0.078 0.047 0.14 0.2 0.072 0.0092 0.013 0.013 0.0079 0.009 0.075 0.026 0.016 0.024 0.009 0.0056 0.0012 0.0087 0.0075 0.12 0.022 0.0096
|
0.16 0.082 0.27 0.38 0.13 0.017 0.021 0.022 0.014 0.016 0.014 0.045 0.027 0.039 0.015 0.010 0.021 0.016 0.014 0.22 0.037 0.017
|
|
Dose efficace (en mSv/MBq) |
0.013 |
0.017 |
0.026 |
0.042 |
0.079 |
Avec pré-traitement de la fixation glandulaire aux agents bloquants
|
|
Dose absorbée par unité d'activité administrée (en mGy/MBq) |
||||
|
Organe |
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Surrénales Vessie Surfaces osseuses Cerveau Seins Vésicule biliaire Tube digestif Estomac Intestin grêle Côlon Paroi côlon ascendant Paroi côlon descendant Coeur Reins Foie Poumons Muscles Oesophage Ovaires Pancréas Moelle osseuse Peau Rate Testicules Thymus Thyroïde Utérus Autres tissus
|
0.0029 0.03 0.0044 0.002 0.0017 0.003
0.0027 0.0035 0.0036 0.0032 0.0042 0.0027 0.0044 0.0026 0.0023 0.0025 0.0024 0.0043 0.003 0.0025 0.0016 0.0026 0.003 0.0024 0.0024 0.006 0.0025
|
0.0037 0.0038 0.0054 0.0026 0.0022 0.0042
0.0036 0.0044 0.0048 0.0043 0.0054 0.0034 0.0054 0.0034 0.0031 0.0031 0.0031 0.0054 0.0039 0.0032 0.002 0.0034 0.004 0.0031 0.0031 0.0073 0.0031
|
0.0056 0.048 0.0081 0.0042 0.0032 0.007
0.0059 0.0067 0.0071 0.0064 0.0081 0.0052 0.0077 0.0053 0.0046 0.0047 0.0046 0.0078 0.0059 0.0049 0.0032 0.0054 0.006 0.0046 0.005 0.011 0.0048
|
0.0086 0.05 0.012 0.0071 0.0052 0.01
0.0086 0.01 0.01 0.01 0.011 0.0081 0.011 0.0082 0.074 0.0072 0.0075 0.011 0.0093 0.0072 0.0053 0.083 0.0087 0.0075 0.084 0.014 0.0073
|
0.016 0.091 0.022 0.012 0.001 0.013
0.015 0.018 0.018 0.017 0.019 0.014 0.019 0.015 0.013 0.013 0.014 0.019 0.016 0.013 0.0097 0.015 0.016 0.014 0.015 0.023 0.013
|
|
Dose efficace (en mSv/MBq) |
0.0042 |
0.0054 |
0.0077 |
0.011 |
0.019 |
La dose efficace résultant de l'administration d'une activité de 950 MBq de pertechnétate de sodium [99mTc] est de 12,35 mSv pour un individu de 70 kg.
La dose efficace résultant de l'administration d'une activité de 400 MBq de pertechnétate de sodium [99mTc] est de 5,2 mSv pour un individu de 70 kg.
Après pré-traitement aux agents bloquants, la dose efficace résultant de l'administration d'une activité de 950 MBq de pertechnétate de sodium [99mTc] est de 3,99 mSv pour un individu de 70 kg.
Après pré-traitement aux agents bloquants, la dose efficace résultant de l'administration d'une activité de 400 MBq de pertechnétate de sodium [99mTc] est de 1,68 mSv pour un individu de 70 kg. La dose de radiation absorbée par le cristallin suivant l'administration de pertechnétate [99mTc] de sodium afin de procéder à une scintigraphie des canaux lacrymaux, est estimée à 0,038 mGy/MBq. Il en résulte une dose efficace équivalente de moins de 0,01 mSv pour une activité administrée de 4 MBq.
L’exposition aux radiations présentée est uniquement applicable si la fonction de tous les organes accumulant le pertechnétate (99mTc) de sodium est normale. Un hyperfonctionnement ou un hypofonctionnement (par exemple de la thyroïde, de la muqueuse gastrique ou des reins) et des processus étendus avec altération de la barrière hémato-encéphalique ou troubles de l’élimination rénale peuvent entraîner des modifications de l’exposition aux radiations et même de fortes augmentations locales de celle-ci.
(iii) Les doses de radiation absorbées par le patient après injection intraveineuse de globules rouges marqués au technétium [99mTc] sont les suivantes :
|
|
Dose absorbée par unité d'activité administrée (en mGy/MBq) |
||||
|
Organe |
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Surrénales Vessie Surfaces osseuses Cerveau Seins Vésicule biliaire Tube digestif Estomac Intestin grêle Côlon Paroi côlon ascendant Paroi côlon descendant
Coeur Reins Foie Poumons Muscles
Oesophage Ovaires Pancréas Moelle osseuse Peau
Rate Testicules Thymus Thyroïde Utérus
Autres tissus
|
0.0099 0.085 0.0074 0.0036 0.0035 0.0065
0.0046 0.0039 0.0037 0.004 0.0034
0.023 0.018 0.013 0.018 0.0033
0.0061 0.0037 0.0066 0.0061 0.002
0.014 0.0023 0.0061 0.0057 0.0039
0.0035
|
0.012 0.011 0.012 0.0046 0.0041 0.0081
0.0059 0.0049 0.0048 0.0051 0.0044
0.029 0.022 0.017 0.022 0.004
0.007 0.0048 0.0081 0.0076 0.0024
0.017 0.003 0.007 0.0071 0.0049
0.0045
|
0.02 0.014 0.019 0.0075 0.007 0.0013
0.0097 0.0078 0.0075 0.008 0.0069
0.043 0.036 0.026 0.035 0.0061
0.0098 0.007 0.013 0.012 0.0038
0.027 0.0044 0.0098 0.012 0.074
0.0073
|
0.03 0.017 0.036 0.012 0.011 0.02
0.014 0.012 0.012 0.013 0.01
0.066 0.057 0.04 0.056 0.0094
0.015 0.011 0.019 0.02 0.0062
0.042 0.0069 0.0015 0.019 0.011
0.0013
|
0.056 0.031 0.074 0.022 0.019 0.03
0.025 0.021 0.02 0.022 0.018
0.11 0.11 0.072 0.11 0.017
0.023 0.019 0.033 0.037 0.0012
0.081 0.013 0.023 0.036 0.019
0.023
|
|
Dose efficace (en mSv/MBq) |
0.007 |
0.0089 |
0.014 |
0.021 |
0.039 |
La dose efficace résultant de l’administration d’une activité de 950 MBq de globules rouges marqués au technétium-99m est de 6,65 mSv.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Le lieu où l'élution est effectuée doit être un environnement contrôlé et capable de maintenir la stérilité du générateur.


|
1 Couvercle du générateur |
Filtre à air pour l’élution fractionnée |
10 |
|
2 Station d’élution |
Aiguille d’admission de l’air stérile |
11 |
|
3 Chambre pour le flacon d’éluant |
Aiguille d’admission de l’éluant |
12 |
|
4 Capuchon en plastique de la double aiguille pour l’éluant |
Filtre à air pour le flacon d’éluant |
13 |
|
5 Capuchon en caoutchouc de la simple aiguille pour l’éluat |
Conteneur métallique UltrateckneKow |
14 |
|
6 Aiguille de sortie de l’éluat |
Protection en plomb de 28, 35, 42, 49 ou 56 mm |
15 |
|
7 Valve de sécurité |
Calage de la protection de plomb |
16 |
|
8 Valve pour l’élution fractionnée |
Colonne du générateur |
17 |
|
9 Collier de serrage |
Bandelette indicateur de couleur |
18 |
Mode d’emploi
Effectuer dans l'ordre les opérations suivantes :
1. Ouvrir le colis et extraire le calage supérieur en polystyrène et la (les) trousse(s) d'élution. Enlever le couvercle du générateur après ouverture du collier de serrage.
2. Positionner le générateur dans l'enceinte en plomb.
3. En vue de l'élution, placer un flacon d'élution dans le conteneur d'élution de manière à pouvoir lire les graduations au travers de la fenêtre en verre plombé. Nettoyer soigneusement le bouchon avec un tampon antiseptique.
4. Enlever de la double aiguille d'entrée le capuchon ou le flacon vide d'éluant de l'élution précédente et insérer le nouveau flacon d'éluant.
5. Enlever de la simple aiguille de sortie le capuchon ou le flacon stérile de protection de l’aiguille placé à l’issue de l'élution précédente et insérer le flacon sous vide préparé dans le conteneur d'élution.
6. Le temps d'élution est d'environ 2 minutes. L'apparition de bulles dans le flacon sous vide d’élution indique la fin de l'élution. Attendre la fin du bullage.
7. Enlever le conteneur d'élution.
8. Insérer sur la simple aiguille de sortie ainsi libérée le flacon stérile pour protéger l'aiguille d'élution, le bouchon étant préalablement nettoyé avec un tampon antiseptique.
9. Mesurer l'activité éluée dans une chambre d'ionisation calibrée. Transférer le flacon d'éluat dans un conteneur approprié. Compléter deux des étiquettes fournies en indiquant l'activité mesurée, l'heure de la mesure, le volume et l'activité volumique. Coller une étiquette sur le flacon d'éluat et l'autre sur le conteneur.
10 Pour les élutions suivantes, reprendre à partir du point 3.
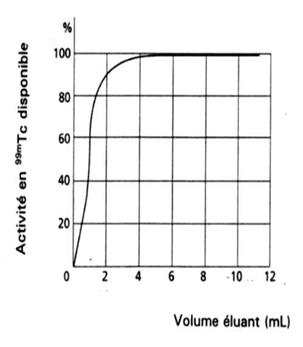
Remarque : Le rendement d'élution est généralement supérieur à 90 % pour autant que le volume d'élution soit supérieur à 6 mL.
Elution fractionnée:
Pour obtenir des élutions fractionnées, il est possible d'arrêter l'élution lorsque le volume désiré est atteint dans le flacon d'élution (lecture au travers de la fenêtre en verre plombé).
Pour cela, il faut faire pivoter le conteneur d'élution de 90° en le poussant vers le bas.
Pourcentage de radioactivité éluable en fonction du volume
Calcul de la radioactivité maximale éluable de technétium (99mTc)
La radioactivité du technétium-99m (99mTc) présente dans le générateur dépend de la radioactivité du molybdène-99 (99Mo) au temps d’élution et du temps écoulé depuis la dernière élution :
soit : A(99mTc)(t) = Ao(99Mo) x F(99Mo) x F(99mTc).
A(99mTc)(t) = activité en technétium-99m présent dans le générateur au temps t.
Ao(99Mo) = activité nominale en molybdène-99 à l'heure et à la date de calibration.
F(99Mo) = facteur de décroissance du Mo-99 correspondant au temps séparant l’élution de l’heure et la date de calibration.
F1(99mTc) = facteur de croissance du Tc-99m depuis la dernière élution.
F2 (99mTc) = facteur de décroissance du Tc99m depuis la dernière élution.
Exemple 1
Un générateur de 21,50 GBq est expédié le vendredi à 16 h. Il est calibré à 6 h le dimanche de la semaine suivante. La dernière élution a eu lieu le vendredi à 12 h avant le départ. On élue pour la première fois le générateur, le lundi à 8 h.
La radioactivité maximale éluable le lundi à 8 h est :
21,50 x 4,545 x 0,979 x 0,960 = 91,84 GBq
Soit Ao(99Mo) x F(99Mo) correspondant à (-) 6 jours par rapport à la calibration x F(99Mo) correspondant à (+) 2 heures par rapport à la calibration x F1 (99mTc) à (+) 60 heures depuis la dernière élution.
Exemple 2
Un générateur de 17,20 GBq calibré à 6 h le dimanche est élué le lundi suivant à 15 h, la dernière élution étant le même lundi à 8 h, le matin.
17,20 x 0.777 x 0,91 x 0,501 = 6,09 GBq
Soit Ao(99Mo) x F(99Mo) correspondant à (+) 1 jour par rapport à la calibration x F(99Mo) correspondant à + 9 heures par rapport à la calibration x F1 (99mTc) à (+) 7 heures depuis la dernière élution.
Facteur de décroissance du (99Mo) soit F(99Mo)
|
Temps séparant l’élution avant la calibration |
F(99Mo) |
Temps séparant l’élution avant la calibration |
F(99Mo) |
Temps séparant l’élution avant la calibration |
F(99Mo) |
Temps séparant l’élution avant la calibration |
F(99Mo) |
|
6 jours 5 jours 4 jours 3 jours 2 jours 1 jour |
4.545 3.521 2.741 2.130 1.656 1.287 |
22 h 20 18 h 16 h 14 h 12 h |
1.259 1.233 1.207 1.183 1.158 1.133 |
11 h 10 h 9 h 8 h 7 h 6 h |
1.122 1.111 1.098 1.088 1.076 1.064 |
5 h 4 h 3 h 2 h 1 h 0 h |
1.053 1.042 1.031 1.021 1.010 1.000 |
|
Temps séparant l’élution après la calibration |
F(99Mo) |
Temps séparant l’élution après la calibration |
F(99Mo) |
Temps séparant l’élution après la calibration |
F(99Mo) |
Temps séparant l’élution après la calibration |
F(99Mo) |
Temps séparant l’élution après la calibration |
F(99Mo) |
|
0 h 1 h 2 h 3 h 4 h 5 h |
1.000 0.990 0.979 0.969 0.959 0.949 |
6 h 7 h 8 h 9 h 10 h 11 h |
0.939 0.929 0.919 0.910 0.900 0.891 |
12 h 14 h 16 h 18 h 20 h 22 h |
0.882 0.863 0.845 0.828 0.811 0.794 |
1 jour 2 jours 3 jours 4 jours 5 jours 6 jours |
0.777 0.604 0.469 0.365 0.284 0.220 |
7 jours 8 jours 9 jours 10 jours 11 jours 12 jours |
0.171 0.133 0.103 0.080 0.062 0.042 |
N.B. : Pour les intervalles intermédiaires : multiplier les facteurs de la table correspondante.
Facteur F(99Mo) pour 3 jours + 10 heures avant la date de calibration
= facteur 3 jours (2,130) x facteur 10 heures (1,111) = 2,366
Facteur F(99Mo) pour 2 jours + 17 heures après la date de calibration
= facteur 2 jours (0,604) x facteur 10 heures (0,900) x facteur 7 heures (0,929) = 0,505
Facteur de croissance 99m –Tc après une élution complète soit F1 (99mTc)
|
Temps écoulé depuis dernière élution |
F1 (99mTc)
|
Temps écoulé depuis dernière élution |
F1 (99mTc)
|
Temps écoulé depuis dernière élution |
F1 (99mTc)
|
Temps écoulé depuis dernière élution |
F1 (99mTc)
|
|
0 h 1 h 2 h 3 h 4 h 5 h |
0.000 0.096 0.183 0.260 0.330 0.394 |
6 h 7 h 8 h 9 h 10 h 11 h |
0.450 0.501 0.547 0.589 0.625 0.660 |
12 h 14 h 16 h 18 h 20 h 22 h |
0.690 0.741 0.783 0.817 0.845 0.867 |
24 h 36 h 48 h 60 h 72 h et + |
0.885 0.940 0.956 0.960
0.962 |
Facteur de décroissance du 99mTc soit F2 (99mTc)
|
Temps écoulé après élution |
F2(99mTc) |
Temps écoulé après élution |
F2(99mTc) |
Temps écoulé après élution |
F2(99mTc) |
Temps écoulé après élution |
F2(99mTc) |
|
0 h 0.25 h 0.5 h 1 h 2 h 3 h |
1.000 0.972 0.944 0.891 0.794 0.707 |
4 h 5 h 6 h 7 h 8 h 9 h |
0.630 0.561 0.500 0.445 0.397 0.354 |
10 h 11 h 12 h 14 h 16 h 18 h |
0.315 0.281 0.250 0.198 0.157 0.125 |
20 h 22 h 24 h 36 h 48 h 60 h |
0.099 0.079 0.063 0.016 0.004 0.001 |
Calcul de la masse du technétium dans l’éluat :
Le rendement de certains marquages peut être affecté par la radioactivité spécifique du technétium.
L’éluat contient toujours du technétium-99 provenant soit de la décroissance du technétium-99 soit de la décroissance du molybdène-99 (voir figure).
La quantité totale de technétium 99Tc + 99mTc dans l’éluat dépend de l'activité en technétium-99m au moment de l’élution A (99mTc) et du délai depuis l’élution précédente du générateur (voir tableau R ci-après). Le facteur R est le rapport du nombre d’atomes de technétium-99 au nombre total de technétium (99Tc + 99mTc).
On peut calculer la masse totale de technétium dans l'éluat en appliquant l'équation suivante :
Masse technétium (en µg) = 5,14.10-3.A(99mTc)
R
La masse totale de technétium est calculée de la manière suivante :
- dans l'exemple 1 :
A(99mTc) = 91,84 GBq
Délai = 68 h depuis l’élution précédente (R = 0,08)
Masse du Tc = 5,14 x 10-3 x 91,84/0,08 = 5,9 µg
Activité spécifique = 91,84/5,9 = 15,57 GBq/µg
- dans l'exemple 2 :
A(99mTc) = 6,09 GBq
Délai = 7 h (F = (0,63+0,57)/2 = 0,60)
Masse du Tc = 6,09 x 10-3 x 5,14/0,6 = 52,2 ng ou 0,0522 µg ou 52,2.10-3 µg
Activité spécifique : 6,09/52,2 = 0,117 GBq/ng ou 117 GBq/mg
Tableau R : 99mTc en fonction du temps écoulé depuis l'élution précédente
99mTc+99Tc
Tableau facteur R en fonction du délai depuis l’élution précédente
|
Heures |
Jour 0 |
Jour 1 |
Jour 2 |
Jour 3 |
Jour 4 |
Jour 5 |
|
0 2 4 6 8 10 12 14 16 18 20 22 24 |
1,00 0,78 0,70 0,63 0,57 0,51 0,47 0,43 0,39 0,36 0,33 0,30 0,28 |
0,28 0,26 0,24 0,23 0,21 0,20 0,19 0,18 0,17 0,16 0,15 0,14 0,13 |
0,13 0,13 0,12 0,11 0,11 0,10 0,10 0,10 0,09 0,09 0,08 0,08 0,08 |
0,08 0,07 0,07 0,07 0,07 0,06 0,06 0,06 0,06 0,06 0,05 0,05 0,05 |
0,05 0,05 0,05 0,05 0,04 0,04 0,04 0,04 0,04 0,04 0,04 0,04 0,03 |
0,03 0,03 0,03 0,03 0,03 0,03 0,03 0,03 0,03 0,03 0,03 0,03 0,02 |
Caractéristiques nucléaires :
Tc-99m
![]() (6.02h)
(6.02h)
 |
β -
(87.5 %)
Mo-99 γ Ru-99 (stable)
 (66.02h)
(66.02h)
 |
β - β -
(12.5 %)
Tc-99
(2.14 x 105 ans)
Caractéristiques de l’éluat :
L’éluat est clair, incolore, stérile, exempt d’endotoxines et ne contient aucune impureté visible.
La pureté radionucléidique de l’éluat est conforme aux exigences de la Ph. Européenne.
Le rapport Mo-99/Tc-99m, 8 heures après élution est inférieur à 1,5 x 10-4.
pH = 4,5 à 7
Tc-99m TcO4 : 95 %
Al3+ inférieur à 5 ppm.
Contrôle de qualité
Les contrôles de qualité suivants peuvent être effectués après élution du générateur.
Mesure de molybdène-99 dans l'éluat (spécification : Mo-99/Tc-99m ≤ 1,5 x 10-4) :
Prendre un volume d'éluat correspondant à 400 MBq et enregistrer le spectre de rayonnements gamma avec un détecteur à iodure de sodium, en interposant entre l'échantillon et le détecteur un écran de plomb de 6 mm d'épaisseur. La réponse dans la zone correspondant au photon de 0,740 MeV du molybdène-99 n'excède pas celle obtenue avec 60 kBq d'une préparation étalon de molybdène-99 mesurée dans les mêmes conditions, toutes les mesures étant rapportées à la date et heure d'administration (réf : Ph. Eur.).
Test limite d'aluminium (spécification : Al ≤ 5 ppm) :
Diluer la préparation à examiner au 1/10 avec de l'eau. Dans un tube à essai d'un diamètre intérieur de 12 mm environ, introduire 1 mL de solution tampon acétate pH 4,6 R et 2 mL de la dilution. Ajouter 0,05 mL d'une solution de chromazurol R à 1% m/v. Après 3 minutes, la solution à examiner n'est pas plus fortement colorée qu'une solution témoin préparée simultanément dans les mêmes conditions avec 2 mL de solution à 1 ppm d'aluminium (Al) R (Réf: Ph. Eur.).
Exigences supplémentaires :
L'administration de produits radiopharmaceutiques présente des risques pour l'entourage du patient en raison de l'irradiation externe ou de la contamination par les urines, les vomissements, les expectorations. Par conséquent, il faut donc prendre toutes les mesures de protection conformément aux réglementations nationales.
L'élimination des déchets radioactifs doit se faire en accord avec les réglementations nationales et internationales.
Pour la reprise du générateur : suivre les instructions délivrées.
Protection contre les radiations :
L'indice de transport (I.T.) au moment du départ usine d'un colis contenant un générateur est au maximum 4. Cela correspond à un débit de dose de 40 µSv/h à un mètre de distance du colis.
Sans blindage supplémentaire, le débit de dose au contact du générateur est au maximum de 160 µSv/h par GBq de Mo-99.
L'emploi du château de plomb prévu pour assurer la radioprotection lors de l'élution réduit le débit de dose au contact d'un facteur de 550 à 1300.
Liste I.
Médicament réservé à l'usage hospitalier.
Les produits radiopharmaceutiques ne doivent être utilisés que par des personnes qualifiées. Ils ne peuvent être délivrés qu'à des praticiens ayant obtenu l'autorisation spéciale prévue à l'article R 1333-24 du code de la Santé Publique.