RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 08/01/2015
1. DENOMINATION DU MEDICAMENT
CHLORURE DE SODIUM MALLINCKRODT 9 mg/mL, solution injectable en seringue préremplie
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 mL contient 9 mg de chlorure de sodium, équivalent à 0,154 mmol de Na+ et 0,154 mmol de Cl-.
Chaque seringue de 50 mL contient 7,7 mmol (soit 177 mg) de sodium.
Chaque seringue de 125 mL contient 19,3 mmol (soit 443 mg) de sodium.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution injectable en seringue préremplie
Solution aqueuse, stérile, apyrogène, limpide, incolore et inodore
pH : 4,5 ‑ 7,0
Osmolarité théorique: 308 mOsm/L
4. DONNEES CLINIQUES
4.1. Indications thérapeutiques
Ce médicament est à usage diagnostique uniquement.
Le chlorure de sodium Mallinckrodt est indiqué pour le rinçage des produits de contraste compatibles administrés par des dispositifs d’abord intravasculaire déjà en place.
4.2. Posologie et mode d'administration
Posologie
Adultes
Le volume de solution saline de rinçage doit être déterminé au cas par cas pour chaque patient sur la base, notamment, de la procédure d’imagerie, de la localisation du site d’injection, de la longueur de tubulure entre le perfuseur électrique du produit de contraste et le dispositif d’abord vasculaire.
Les débits de perfusion et les volumes de rinçage doivent aussi être définis au cas par cas en fonction de la masse corporelle, du statut volémique et de l’état clinique de chaque patient.
Les volumes de solution de chlorure de sodium habituellement utilisés pour le rinçage suite à l’administration d’un produit de contraste chez l’adulte sont de 10 à 60 mL par injection à un débit ne dépassant pas 10 mL par seconde.
Certains perfuseurs électriques permettent une perfusion supplémentaire de Chlorure de sodium Mallinckrodt afin de maintenir la perméabilité de l’abord vasculaire. Dans ce cas, les débits de perfusion habituellement utilisés sont compris entre 0,5 et 1 mL par minute.
Population pédiatrique
Chlorure de sodium Mallinckrodt n’est pas recommandé pour l’administration chez les enfants et les adolescents de moins de 18 ans, les données de sécurité et d’efficacité étant insuffisantes.
Mode d’administration
Voie intraveineuse ou voie intra-artérielle.
· Seringue de 50 mL : pour administration manuelle ou à l’aide d’un perfuseur électrique;
· Seringue de 125 mL : pour administration à l’aide d’un perfuseur électrique.
Administration à l’aide d’un perfuseur électrique
Les systèmes de perfusion utilisés pour l’administration de ce médicament doivent avoir fait l’objet d’une validation préalable par leur fabricant.
Il conviendra alors de suivre strictement toute instruction de manipulation transmise par le fabricant.
4.3. Contre-indications
Aucune contre-indication connue.
4.4. Mises en garde spéciales et précautions d'emploi
Embolie gazeuse
Éliminer entièrement l’air contenu dans la seringue et les tubulures raccordées avant l’injection afin d’éviter une embolie gazeuse et les risques d’accident vasculaire cérébral, d’ischémie d’organes et/ou d’infarctus ou de décès, associés.
Surcharge liquidienne
Le Chlorure de sodium Mallinckrodt doit être utilisé avec la plus grande prudence, et seulement si nécessaire, chez les patients présentant une insuffisance cardiaque congestive, une insuffisance rénale sévère ou un état clinique marqué par des œdèmes, une rétention sodique, une hypernatrémie ou une hyperchlorémie.
L’âge, la masse corporelle, le statut volémique, l’état clinique du patient ainsi que la procédure radiologique prévue doivent être pris en compte pour déterminer la pertinence de l’utilisation de Chlorure de sodium Mallinckrodt chez un patient.
Extravasation
L’extravasation d’une solution saline isotonique peut entraîner une compression mécanique des structures neurovasculaires. La perméabilité du cathéter intravasculaire doit être confirmée avant l’administration de Chlorure de sodium Mallinckrodt.
Population pédiatrique
La sécurité et l’efficacité du Chlorure de sodium Mallinckrodt chez les enfants et les adolescents jusqu’à 18 ans n’ont pas été établies.
Personnes âgées
De façon générale, le choix de la posologie chez un patient âgé doit être effectué avec prudence, en commençant par la plus faible des posologies possibles, afin de prendre en compte la fréquence accrue des altérations des fonctions hépatique, rénale ou cardiaque et des comorbidités ou des traitements concomitants.
Mises en garde spéciales
Ce médicament contient 0,154 mmol (ou 9 mg) de sodium par mL.
Pour les doses jusqu’à 6,5 mL
Ce médicament contient moins de 1 mmol (23 mg) de sodium, c’est à dire qu’il est essentiellement « sans sodium ».
Pour les doses de plus de 6,5 mL
Doit être pris en compte chez les patients contrôlant leur apport alimentaire en sodium.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
4.6. Grossesse et allaitement
Grossesse
Il n’existe pas de données sur l’utilisation du Chlorure de sodium Mallinckrodt chez la femme enceinte. Par mesure de précaution, il est préférable d’éviter l’utilisation du Chlorure de sodium Mallinckrodt pendant la grossesse. En outre, toute exploration radiologique chez la femme enceinte implique une exposition du fœtus aux rayonnements ionisants.
Durant la grossesse, seules les explorations essentielles doivent donc être réalisées, lorsque le bénéfice attendu surpasse le risque encouru par la mère et le fœtus.
Allaitement
Le chlorure de sodium est excrété dans le lait maternel mais, aux doses thérapeutiques de Chlorure de sodium Mallinckrodt, aucun effet sur les nouveau-nés/nourrissons allaités n’est attendu.
Fertilité
Pas de données disponibles. Aucun effet n’est attendu.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Chlorure de sodium Mallinckrodt n’a aucun effet ou qu’un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
4.8. Effets indésirables
Des réactions dues à la technique d’administration sont possibles, notamment une infection au site d’injection, une thrombose veineuse ou une phlébite s’étendant à partir du site d’injection, une extravasation.
La fréquence des effets indésirables est définie comme suit :
Très fréquent (≥ 1/10)
Fréquent (≥ 1/100, < 1/10)
Peu fréquent (≥ 1/1 000, < 1/100)
Rare (≥ 1/10 000, < 1/1 000)
Très rare (< 1/10 000)
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
|
Affections vasculaires :
|
|
|
Fréquence indéterminée
|
Thrombose veineuse ; phlébite
|
|
|
Troubles généraux et anomalies au site d’administration :
|
|
Fréquence indéterminée
|
Infection au site d’injection, extravasation
|
|
|
|
|
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé doivent déclarer tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (Ansm) et réseau des Centres Régionaux de Pharmacovigilance. Site internet : www.ansm.sante.fr.
4.9. Surdosage
Il existe un risque de surdosage lors de l’utilisation du Chlorure de sodium Mallinckrodt, marqué par un déséquilibre électrolytique et/ou une surcharge liquidienne, en particulier chez les patients dont la fonction rénale ou cardiaque est altérée. En cas de surdosage, interrompre la perfusion, réévaluer le patient et instaurer une prise en charge appropriée.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Solvants et diluants, solutions d’irrigation incluses
Code ATC : V07AB
Le sodium est le principal cation du compartiment extracellulaire et, en association avec divers anions, il en régule la taille. Le sodium et le potassium sont les médiateurs majeurs des processus bio-électriques au sein de l’organisme. Le taux de sodium et le statut volémique de l’organisme sont étroitement liés. Lorsque la concentration du sodium dans le plasma s’écarte de la valeur physiologique, le statut volémique de l’organisme s’en trouve simultanément affecté. L’augmentation du taux de sodium dans l’organisme implique également une réduction du volume d’eau libre dans l’organisme, indépendamment de l’osmolalité sérique.
5.2. Propriétés pharmacocinétiques
Une solution de chlorure de sodium à 0,9 % possède la même osmolarité que le plasma. L’administration de cette solution entraîne principalement l’accroissement du compartiment interstitiel, qui représente environ 2/3 du compartiment extracellulaire. Seul 1/3 du volume administré demeure dans le compartiment intravasculaire. Par conséquent, l’administration de la solution provoque un effet hémodynamique à court terme.
Le taux de sodium total dans l’organisme est d’environ 80 mmol/kg, dont 97 % environ dans le compartiment extracellulaire et 3 % environ dans le compartiment intracellulaire. Le renouvellement quotidien est d’environ 100‑180 mmol (soit 1,5‑2,5 mmol/kg de masse corporelle).
L’équilibre sodique et hydrique est essentiellement régulé par les reins associé aux mécanismes de régulation hormonaux, le système rénine-angiotensine-aldostérone, l’hormone antidiurétique et l’hormone natriurétique.
5.3. Données de sécurité préclinique
Il n’existe aucune donnée préclinique pertinente pour le prescripteur outre celles déjà mentionnées dans les autres rubriques du RCP.
6. DONNEES PHARMACEUTIQUES
6.1. Liste des excipients
Eau pour préparations injectables
6.2. Incompatibilités
En cas de mélange avec d’autres médicaments, des incompatibilités éventuelles doivent être envisagées.
6.3. Durée de conservation
3 ans
Après utilisation, éliminer toute solution résiduelle.
6.4. Précautions particulières de conservation
Ne pas congeler.
Éliminer la solution si elle présente un changement de coloration ou contient des particules.
6.5. Nature et contenu de l'emballage extérieur
50 mL ou 125 mL de solution en seringues préremplies (polypropylène) muni d’un capuchon et d’un piston (caoutchouc naturel).
Présentations :
Seringues préremplies :
1 x 50 mL et 10 x 50 mL
1 x 125 mL et 10 x 125 mL
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Seringues préremplies:
La partie externe de la seringue n’est pas stérile.
Inspecter la seringue pour vérifier l’absence de signes de fuite. En cas de fuite, ne pas utiliser.
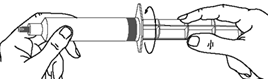
Utilisation de la seringue préremplie (50 mL), pour un usage manuel ou avec un perfuseur électrique :
|
|
Une fois la tige poussoir vissée dans le piston de la seringue, il est important de la visser d’un ½ tour supplémentaire afin que le piston bleu tourne librement.
|
|

|
Avant d’utiliser la seringue, dévisser le capuchon de protection bleu et le jeter. La seringue est alors prête à être raccordée à une aiguille ou une tubulure de perfusion.
|
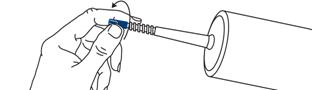
Utilisation de la seringue préremplie (125 mL) avec un perfuseur électrique :
|
|
Introduire la seringue dans le compartiment du porte-seringue.
Pour retirer le capuchon de protection bleu de la seringue, appuyer dessus et le dévisser, puis le jeter. La surface protégée par le capuchon est stérile. Toutes les précautions nécessaires doivent désormais être prises.
|
|
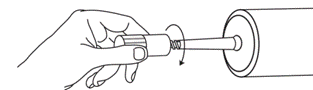
|
Retirer ensuite le bouchon du dispositif Luer Lock de protection anti-poussière de sécurité en le faisant tourner de façon à rompre la bague d’inviolabilité. Jeter le bouchon. Fixer le dispositif Luer Lock sur la seringue en le tenant par la protection anti-poussière et visser jusqu’à venir en butée. Ne retirer la protection anti-poussière qu’au moment de fixer l’embase de la tubulure stérile.
|
À usage unique. Après usage, jeter la seringue et la solution résiduelle.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Embolie gazeuse
Éliminer entièrement l’air contenu dans la seringue et les tubulures raccordées avant l’injection afin d’éviter une embolie gazeuse et les risques d’accident vasculaire cérébral, d’ischémie d’organes et/ou d’infarctus et de décès associés.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
MALLINCKRODT FRANCE
27-43, RUE DU COLONEL AVIA
75015 PARIS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 024 8 3 : 50 ml de solution injectable en seringue préremplie. Boîte de 1.
· 34009 300 024 9 0 : 50 ml de solution injectable en seringue préremplie. Boîte de 10.
· 34009 300 025 0 6 : 125 ml de solution injectable en seringue préremplie. Boîte de 1.
· 34009 300 025 1 3 : 125 ml de solution injectable en seringue préremplie. Boîte de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
11. DOSIMETRIE
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Médicament non soumis à prescription médicale



