RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 08/01/2015
1. DENOMINATION DU MEDICAMENT
AMIPED, solution pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
La solution pour perfusion contient :
|
Acides aminés :
|
pour 1 ml
|
pour 100 ml
|
pour 250 ml
|
|
Isoleucine
|
5,10 mg
|
0,51 g
|
1,28 g
|
|
Leucine
|
7,60 mg
|
0,76 g
|
1,90 g
|
|
Lysine monohydratée
(équivalent en lysine)
|
9,88 mg
(8,80 mg)
|
0,99 g
(0,88 g)
|
2,47 g
(2,20 g)
|
|
Méthionine
|
2,00 mg
|
0,20 g
|
0,50 g
|
|
Phénylalanine
|
3,10 mg
|
0,31 g
|
0,78 g
|
|
Thréonine
|
5,10 mg
|
0,51 g
|
1,28 g
|
|
Tryptophane
|
4,00 mg
|
0,40 g
|
1,00 g
|
|
Valine
|
6,10 mg
|
0,61 g
|
1,53 g
|
|
Arginine
|
9,10 mg
|
0,91 g
|
2,28 g
|
|
Histidine
|
4,60 mg
|
0,46 g
|
1,15 g
|
|
Alanine
|
15,90 mg
|
1,59 g
|
3,98 g
|
|
Glycine
|
2,00 mg
|
0,20 g
|
0,50 g
|
|
Acide aspartique
|
6,60 mg
|
0,66 g
|
1,65 g
|
|
Acide glutamique
|
9,30 mg
|
0,93 g
|
2,33 g
|
|
Proline
|
6,10 mg
|
0,61 g
|
1,53 g
|
|
Sérine
|
2,00 mg
|
0,20 g
|
0,50 g
|
|
N-Acétyltyrosine
(équivalent en tyrosine)
|
1,30 mg
(1,06 mg)
|
0,13 g
(0,11 g)
|
0,33 g
(0,27 g)
|
|
Acétylcystéine
(équivalent en cystéine)
|
0,700 mg
(0,520 mg)
|
0,070 g
(0,052 g)
|
0,175 g
(0,13 g)
|
|
Taurine
|
0,300 mg
|
0,030 g
|
0,075 g
|
|
|
pour 1 ml
|
pour 100 ml
|
pour 250 ml
|
|
Teneur en acides aminés
|
0,1 g
|
10 g
|
25 g
|
|
Teneur en azote
|
0,0152 g
|
1,52 g
|
3,8 g
|
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution pour perfusion.
Solution limpide, incolore à jaune pâle
|
Energie [kJ/l (kcal/l)]
|
1700 (400)
|
|
Osmolarité théorique [mOsm/l]
|
790
|
|
Acidité (titration jusqu'à pH 7,4)
|
23 mmol
|
|
pH
|
approx. 6,1
|
4. DONNEES CLINIQUES
4.1. Indications thérapeutiques
Apport en acides aminés dans le cadre d'une nutrition parentérale associée à un apport en énergie (glucose et lipides) et en électrolytes sous forme de solutions, chez les nouveau-nés à terme ou prématurés, les nourrissons et les enfants, lorsque la nutrition orale ou entérale est impossible, insuffisante ou contre-indiquée.
4.2. Posologie et mode d'administration
Posologie
Population pédiatrique
Les posologies indiquées ci-dessous pour ces groupes d'âge sont des valeurs moyennes données à titre indicatif. La posologie exacte doit être ajustée de manière personnalisée en fonction de l'âge, du stade de développement, de la maladie prédominante et du type de traitement.
La vitesse d'administration initiale doit être en dessous de la vitesse de perfusion visée et être ensuite augmentée jusqu'à la valeur cible au cours de la première heure.
Apport parentéral en acides aminés considéré comme adéquat pour la plupart des patients pédiatriques :
Prématurés : 1,5 ‑ 4,0 g acides aminés/kg de poids corporel par jour = 15 ‑ 40 ml /kg de p. c./j
Nouveau-nés à terme (0 - 27 jours) : 1,5 ‑ 3,0 g /kg de p. c./j = 15 ‑ 30 ml/kg de p. c./j
Nourrissons (28 jours à 23 mois) : 1,0 ‑ 2,5 g /kg de p. c./j = 10 ‑ 25 ml/kg de p. c./j
Enfants (de 2 à 11 ans) : 1,0 ‑ 2,0 g /kg de p. c./j = 10 ‑ 20 ml/kg de p. c./j
Chez les enfants gravement malades, l'apport recommandé en acides aminés peut être plus élevé (jusqu'à 3,0 g d'acides aminés/kg de poids corporel par jour).
Vitesse maximale de perfusion jusqu'à 0,1 g d'acides aminés/kg de poids corporel et par heure, correspondant approximativement à 1 ml/kg de poids corporel et par heure.
Mode d’administration
Voie intraveineuse.
En raison de son osmolarité élevée, Amiped non dilué ne doit être administré que par voie centrale. Cependant, une dilution suffisante d'Amiped, par exemple avec de l'eau pour préparations injectables ou une solution appropriée, permet de diminuer l'osmolarité et de mettre en place une perfusion périphérique.
Si les apports concomitants en énergie et en électrolytes sont appropriés, il n'y a pas de restriction dans le cadre d'une nutrition parentérale.
Amiped représente simplement une base de nutrition parentérale. Chez les patients recevant uniquement une nutrition par voie parentérale, un traitement de remplacement concomitant avec des sources d'énergie (prenant en compte les besoins en acides gras essentiels), d'électrolytes, de vitamines et d'oligo-éléments sera nécessaire.
4.3. Contre-indications
· Hypersensibilité à la (aux) substance(s) active(s) ou à l’un des excipients mentionnés à la rubrique 6.1
· États d'hyperhydratation, hypokaliémie
· Erreurs innées du métabolisme des acides aminés
· Troubles métaboliques aigus dus à une hypoxie et à une acidose
· Instabilité circulatoire menaçant le pronostic vital
· Œdème pulmonaire aigu
· Insuffisance cardiaque décompensée
Comme pour toutes les solutions contenant des acides aminés, Amiped est contre-indiqué en cas de : insuffisance hépatique sévère, coma hépatique et insuffisance rénale sévère en l'absence de traitement de substitution rénale.
4.4. Mises en garde spéciales et précautions d'emploi
Il convient de prendre des précautions si l'osmolarité sérique est augmentée.
Des précautions sont également de mise si l'apport en liquides doit être restreint, comme par exemple en cas d’hyponatrémie.
En particulier, une surveillance plus fréquente de l'état clinique et des analyses biologiques pertinentes sera nécessaire chez les patients souffrant de :
· Troubles du métabolisme des acides aminés.
· Insuffisance hépatique, en raison du risque de récurrence ou d'exacerbation de troubles neurologiques existants associés à l'hyperammoniémie.
· Insuffisance rénale, notamment en présence d'hyperkaliémie, ou facteurs de risque de développement ou d'exacerbation d'acidose métabolique, ou en cas d'hyperazotémie due à une altération de la clairance rénale.
La posologie doit être ajustée en fonction de l'âge, du statut nutritionnel et de la maladie sous-jacente. Voir rubrique 4.2.
En outre, il est essentiel de supplémenter le traitement avec des sources d'énergie (glucose et lipides), de vitamines et d'oligo-éléments.
Dans le cas des micronutriments, il convient d'utiliser des formulations pédiatriques.
Avant d'administrer Amiped via une veine périphérique, le produit doit être suffisamment dilué avec une solution adaptée. Voir rubrique 4.2.
L'équilibre hydro-électrique, l'osmolarité sérique, l'équilibre acido-basique, la concentration de glucose dans le sang ainsi que les valeurs relatives aux fonctions rénale et hépatique doivent être surveillés pendant toute la durée du traitement parentéral, la fréquence de cette surveillance étant déterminée par la sévérité de la maladie sous-jacente et l'état clinique du patient.
Il convient de mesurer les concentrations d'azote uréique et d'ammoniaques sériques.
En cas d'utilisation à long terme (plusieurs semaines), la numération sanguine et les facteurs de coagulation doivent être surveillés plus étroitement.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune interaction connue.
4.6. Grossesse et allaitement
Amiped est uniquement destiné à être utilisé dans la population pédiatrique.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Sans objet.
4.8. Effets indésirables
Des effets indésirables peuvent survenir. Cependant, ceux-ci ne sont pas spécifiquement liés au produit mais à la nutrition parentérale en général, particulièrement au début de celle-ci.
Peu fréquent (≥ 1/1 000 à < 1/100) :
Affections gastro-intestinales : Nausée, vomissements
Troubles généraux et anomalies au site d'administration : Maux de tête, frissons, fièvre
Une thrombophlébite peut survenir lorsque le produit est administré par une veine périphérique sans avoir été suffisamment dilué, en raison de l'osmolarité élevée de la solution.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.ansm.sante.fr.
4.9. Surdosage
Symptômes
Une vitesse de perfusion trop élevée peut entraîner des réactions d'intolérance se manifestant sous forme de nausées, vomissements, bouffées congestives au niveau de la tête, sensation de chaleur, pertes d'acides aminés dans l'urine se traduisant par un déséquilibre en acides aminés.
Traitement
Si des réactions d'intolérance se produisent, la perfusion d'acides aminés doit être interrompue temporairement puis redémarrée à une vitesse de perfusion inférieure.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Solutions pour nutrition parentérale, acides aminés, code ATC : B05BA01.
Mécanisme d’action
La solution pour perfusion contient 19 acides aminés afin de couvrir les besoins qualitatifs de l'enfant en protéines :
· tous les acides aminés essentiels et semi-essentiels pour l'enfant
Comparé aux solutions conventionnelles d'acides aminés, Amiped contient :
· une proportion relativement élevée de lysine
· de la taurine
· une proportion relativement faible de méthionine
· une faible proportion de phénylalanine et de proline.
Les solutions ne contiennent pas d'électrolytes supplémentaires afin d'exclure tout effet sur le traitement électrolytique chez les enfants en réanimation.
Effets pharmacodynamiques
Les acides aminés sont les éléments assemblés dans la synthèse des protéines. Des solutions pures d'acides aminés sont administrées dans le cadre d'un traitement nutritionnel parentéral avec des sources d'énergie et d'autres nutriments tels que des électrolytes, des oligo-éléments, des vitamines et des liquides, afin de maintenir et améliorer le statut nutritionnel de l'organisme ou réduire les pertes éventuelles de substances.
5.2. Propriétés pharmacocinétiques
Absorption
Amiped est perfusé par voie intraveineuse. Par conséquent, tous les substrats sont immédiatement disponibles pour métabolisation.
Distribution
Les concentrations plasmatiques d'acides aminés libres sont sujettes à des fluctuations importantes. Ceci s'applique aussi bien aux acides aminés individuels qu'à la somme des concentrations d'acides aminés. En revanche, les interrelations entre acides aminés restent relativement constantes quelle que soit la concentration totale en acides aminés ou les concentrations absolues en acides aminés individuels. Il semblerait que l'organisme tente de maintenir le « substrat d'acides aminés » à un niveau constant dans une plage physiologique de référence afin d'éviter autant que possible tout déséquilibre du profil d'acides aminés. Dans la plupart des cas où l'organisme peut continuer à compenser, les changements drastiques d'administration de substrat n'entraînent qu'une altération de l'homéostasie des acides aminés dans le sang. Des changements pathologiques typiques du profil plasmatique d'acides aminés ne sont attendus que lorsque l'indice de régulation des organes métaboliques de base, comme par ex. le foie ou les reins, est altéré de manière importante. Si nécessaire, ces modifications peuvent être traitées avec des solutions d'acides aminés de composition spécifique pour restaurer l'homéostasie.
Dans des conditions pathologiques sans apport exogène d'acides aminés, des modifications typiques et importantes du profil plasmatique d'acides aminés se produisent, affectant généralement la concentration absolue d'acides aminés individuels et leur pourcentage dans la composition plasmatique d'acides aminés.
Biotransformation
Les acides aminés sont globalement un système complexe de substances qui influent mutuellement les unes sur les autres. Par ailleurs, il existe une dépendance métabolique directe entre les acides aminés individuels (par exemple : la production de tyrosine par hydroxylation de la phénylalanine). En outre, d'autres mécanismes métaboliques de l'organisme peuvent présenter une réponse sensible à un changement de profil d'acides aminés en modifiant la concentration d'acides aminés individuels ou de groupes d'acides aminés (par exemple : des modifications du rapport entre les acides aminés aromatiques et à chaîne branchée). De plus, les modifications de relations à l'intérieur d'un groupe d'acides aminés ayant une configuration chimique et un comportement métabolique semblables peuvent avoir des effets sur le métabolisme global de l'organisme.
5.3. Données de sécurité préclinique
Aucune étude préclinique n’a été effectuée avec Amiped.
6. DONNEES PHARMACEUTIQUES
6.1. Liste des excipients
Acide citrique monohydraté (pour ajustement du pH), eau pour préparations injectables.
6.2. Incompatibilités
Ce médicament ne doit pas être mélangé avec d’autres médicaments à l’exception de ceux mentionnés dans la rubrique 6.6.
6.3. Durée de conservation
Avant ouverture (poche dans son suremballage) :
· 2 ans
Après première ouverture :
· Le produit doit être utilisé immédiatement.
Après mélange avec d'autres composantes de nutrition parentérale :
· La stabilité physico-chimique pendant l'utilisation après mélange avec d'autres composantes de nutrition parentérale a été démontrée pendant 24 heures à 2-8°C ainsi que pendant 24 heures à 37°C.
· Après l'ajout et le mélange d’additifs, la solution doit être conservée à l'abri de la lumière.
Toutefois, d'un point de vue microbiologique, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, les durées et conditions de conservation après mélange et avant utilisation relèvent de la seule responsabilité de l'utilisateur.
6.4. Précautions particulières de conservation
Ne pas congeler. En cas de congélation accidentelle, éliminer la poche.
Pour les conditions de conservation du médicament après ajout et mélange d’additifs, voir rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Poches souples constituées d'une feuille multicouches (Polypropylène, Styrène-Ethylène/Butylène-Styrène (SEBS) et Copolyester-éther). La couche interne en contact avec la solution est en polypropylène.
Poches de 100 ml ou 250 ml.
La poche est recouverte d'un suremballage protecteur. Un absorbeur d'oxygène (sachet de matière inerte contenant de l'hydroxyde de fer en poudre) est placé entre la poche et le suremballage.
Les différentes tailles de contenants sont présentées dans des emballages en carton contenant 12 poches.
Présentations : 12 x 100 ml et 12 x 250 ml.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières pour l’élimination de la poche, du suremballage ou de l'absorbeur d'oxygène.
Ne pas utiliser si le suremballage a déjà été ouvert ou s’il est endommagé. Utiliser uniquement des poches non endommagées dans lesquelles la solution d'acides aminés est limpide et exempte de particules.
Amiped doit être mélangé uniquement avec d'autres solutions IV dont la compatibilité a été prouvée préalablement.
Les données de compatibilité pour différents additifs (par ex. glucose, lipides, électrolytes, oligo-éléments, vitamines) et la durée de conservation correspondante de ces mélanges peuvent être fournies sur demande par le fabricant.
Amiped est fourni en poches à usage unique. Tout résidu non utilisé doit être éliminé.
La solution doit toujours être amenée à température ambiante avant la perfusion.
Il est essentiel que tout mélange soit préparé dans des conditions d'asepsie strictes étant donné que ce mélange de nutriments favorise la croissance microbienne.
|
Amiped : Manipulation
Figure A : Poche et suremballage protecteur
|
|
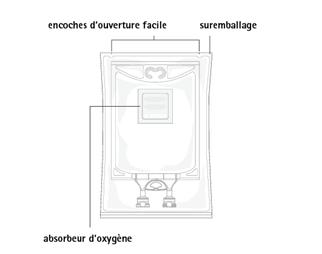
|
|
Figure B : Poche
|
|
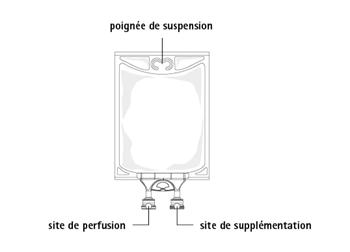
|
|
Pour ouvrir :
Retirer la poche de son suremballage protecteur après avoir déchiré ce dernier à partir de l'encoche du haut et retirer la poche avec la solution (figure 1).
Éliminer le suremballage et l'absorbeur d'oxygène.
Vérifier qu'il n'y a pas de fuites. Si la poche fuit, éliminer le produit car sa stérilité pourrait être compromise.
|
|
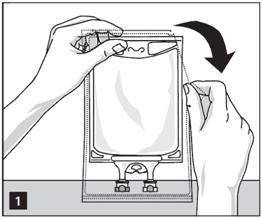
|
|
Médicaments à ajouter :
Tout mélange doit être préparé dans des conditions d'asepsie strictes.
Les médicaments supplémentaires compatibles peuvent être ajoutés par le port à médicaments (de couleur transparente).
1. Préparer le port à médicaments (de couleur transparente) en ôtant la feuille d'aluminium (figure 2a). Note : La zone du port à médicaments sous la feuille d'aluminium est stérile.
2. Percer le port à médicament refermable et injecter le(s) additif(s) (figure 2b).
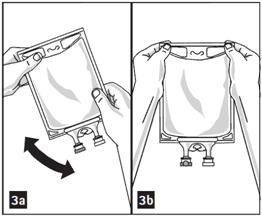
3. Mélanger la solution et le(s) médicament(s) soigneusement (figure 3a).
4. Le port à médicaments peut être nettoyé avec un tampon imbibé de désinfectant (par ex. iso-propanol) avant d'être repercé.
5. Effectuer une vérification visuelle du mélange pour détecter toute présence de matière particulaire (figure 3b).
|
|
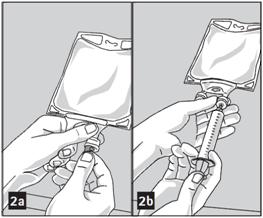
|
|
|
Préparation à l'administration :
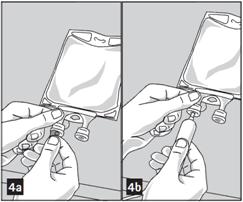
1. Retirer la feuille d'aluminium du port de perfusion (de couleur verte) en bas de la poche (figure 4a) et rattacher le système d'administration (figure 4b) : utiliser un système de perfusion non ventilé ou fermer la valve d'aération si le système est ventilé. Suivre le mode d'emploi du système de perfusion. Note : La zone du port de perfusion sous la feuille d'aluminium est stérile.
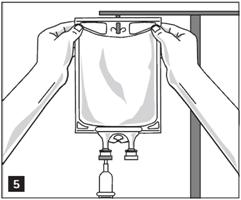
2. Suspendre la poche à une potence à perfusion (figure 5).
|
|
|
|
|
Informations supplémentaires :
Le récipient est sans PVC, sans DEP et sans latex.
|
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
B BRAUN MELSUNGEN AG
CARL-BRAUN-STRASSE 1
34212 MELSUNGEN
ALLEMAGNE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 280 273 2 0 : 100 ml en poche (polypropylène, SEBS, copolyester-éther). Boîte de 12.
· 34009 280 274 9 8 : 250 ml en poche (polypropylène, SEBS, copolyester-éther). Boîte de 12.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[A compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[A compléter ultérieurement par le titulaire]
11. DOSIMETRIE
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Médicament non soumis à prescription médicale.






