
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 29/06/2015
ORNIDYL 20 g/100 ml, solution injectable pour perfusion en flacon
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chlorhydrate d'éflornithine ...................................................................................................................... 20 g
Pour un flacon.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable pour perfusion.
4.1. Indications thérapeutiques
Traitement de la trypanosomiase humaine africaine à Trypanosoma brucei gambiense (maladie du sommeil) en phase neurologique chez l’adulte et l’enfant.
Remarque: les patients doivent être suivis sur une longue période afin qu'ils reçoivent, en cas de rechute, un traitement complémentaire adéquat (voir rubrique 4.4).
Il convient de tenir compte des recommandations de l’OMS concernant le traitement des patients atteints de trypanosomiase humaine africaine.
4.2. Posologie et mode d'administration
Patient normo-rénal
Adulte
ORNIDYL doit être administré à la posologie de 100 mg/kg toutes les 6 heures, selon un schéma en monothérapie, par perfusion intraveineuse d’une durée d’au moins 45 minutes pendant 14 jours.
Par ailleurs, l’OMS recommande un schéma en bithérapie (schéma NECT : Nifurtimox-Eflornithine Combination Therapy) chez les patients âgés de 15 ans et plus, sur la base d’une étude (étude NECT) (voir rubrique 5.1):
ORNIDYL à la posologie de 200 mg/kg toutes les 12 heures, par perfusion intraveineuse d’une durée de 2 heures, pendant 7 jours, en association avec un autre médicament antiparasitaire.
Enfant
Des enfants âgés de 2 à 12 ans ont été traités avec succès par ORNIDYL en monothérapie à la dose de 400 mg/kg/jour. Cependant, il existe un consensus pour considérer que la posologie efficace chez l'enfant est de 600 mg/kg/jour.
Il n'y a pas de données chez les enfants de moins de 2 ans. Chez l'enfant de moins de 2 ans, le bénéfice attendu du traitement devra être pondéré par les risques potentiels sur la croissance et le développement avant toute administration.
Insuffisant rénal
Le chlorhydrate d'éflornithine n'est pas lié aux protéines plasmatiques et 80 % de la dose administrée sont éliminés, inchangés par les urines (voir rubrique 5.2). Il est donc recommandé, étant donné le risque d'accumulation du médicament, de réduire la posologie chez l'insuffisant rénal sévère.
L'excrétion de l'éflornithine au niveau rénal suit approximativement la clairance de la créatinine. Ainsi, chez les patients présentant une atteinte de la fonction rénale, des ajustements de la posologie sont nécessaires pour compenser l'excrétion plus faible du produit. La première dose d’ORNIDYL devra être administrée à la posologie normale mais toutes les autres doses devront être réduites en corrélation avec la valeur de la clairance de la créatinine chez les patients selon la formule suivante:

Clcr = clairance de la créatinine chez l'insuffisant rénal
D = dose normale
D* = dose d'entretien pour le patient insuffisant rénal
Chez les sujets pour lesquels seules les valeurs de la créatinine sérique sont disponibles, la clairance de la créatinine peut être calculée selon la formule de Cockcroft:
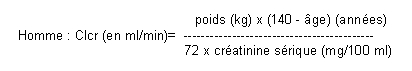
Femme: Clcr = 0,85 x valeur trouvée pour l'homme
Sujet âgé
Chez ces patients, insuffisance hépatique et insuffisance rénale peuvent être observées, l'adaptation de posologie d’ORNIDYL peut se faire sur la clairance de la créatinine compte-tenu de l'absence de métabolisation hépatique.
Mode d’administration
ORNIDYL injectable doit être dilué avant administration (voir rubrique 6.6 pour plus de détails sur la préparation de la solution pour perfusion).
Hypersensibilité à l'éflornithine.
4.4. Mises en garde spéciales et précautions d'emploi
L’utilisation de l’éflornithine exige une bonne connaissance de l’évolution naturelle de la trypanosomiase à T.b. gambiense et de l’état du patient. Du fait du risque de rechute après traitement par ORNIDYL, le patient atteint de trypanosomiase à T.b. gambiense en phase neurologique devra être suivi pendant au moins 24 mois de façon à mettre en route un nouveau traitement en cas de rechute.
Surveillance hématologique :
L'effet toxique le plus fréquent et le plus grave du chlorhydrate d'éflornithine est la suppression de l'activité médullaire (myelosuppression). Des cas de thrombocytopénie, d'anémie et de leucopénie ont été rapportés avec le chlorhydrate d'éflornithine.
Du fait de la myélotoxicité d‘ORNIDYL, les patients devront faire l'objet d'un suivi renforcé. Une Numération-Formule Sanguine complète, comprenant les plaquettes, devra être réalisée avant la mise en route du traitement, deux fois par semaine pendant la durée du traitement et au moins une fois par semaine après l'arrêt du traitement jusqu'au retour à la normale des constantes hématologiques.
Toute décision visant à modifier la posologie, à interrompre ou à abandonner le traitement doit être basée sur la réponse au traitement, la gravité du ou des symptômes observés et la possibilité d'avoir recours à des moyens de compensation.
Convulsions :
Le chlorhydrate d'éflornithine a été associé temporairement à des cas de convulsions, qui peuvent aussi être dues à la maladie sous-jacente. Des convulsions sont survenues chez environ 5% des patients traités par le chlorhydrate d'éflornithine en monothérapie par voie intraveineuse au cours des essais cliniques d’enregistrement du produit. Leur étiologie (méningo-encéphalitique, médicamenteuse ou une combinaison des deux) n'a pas été déterminée. La possibilité de survenue de convulsions doit donc être prise en compte.
Précaution d’emploi
Diarrhée et vomissements :
Une attention particulière devra être apportée à l'apparition de diarrhée et de vomissements qui peuvent entraîner une déshydratation et des troubles électrolytiques. Cette déshydratation et ces perturbations électrolytiques devront être traitées par les méthodes de substitution liquidiennes et électrolytiques habituelles.
Troubles auditifs :
Il a été signalé des troubles auditifs occasionnels au cours d'études effectuées avec le chlorhydrate d'éflornithine. Les patients devront être incités à signaler toute modification de l'audition, tout étourdissement ou vertige (voir rubrique 4.8.).
Une réduction de la dose ou un arrêt momentané du traitement pourra être envisagé en cas d'apparition de l'un de ces effets secondaires.
Insuffisance rénale et/ou hépatique, sujet âgé :
Quatre-vingt pour cent (80 %) de la dose administrée de chlorhydrate d'éflornithine étant éliminée sous forme inchangée par les urines, il est donc recommandé de réduire la posologie chez les patients présentant une atteinte de la fonction rénale (voir rubriques 4.2 et 5.2). Les effets d‘ORNIDYL chez les patients à fonction rénale ou hépatique anormale, ainsi que chez le sujet âgé, n'ont pas été évalués.
Ces patients peuvent présenter des effets secondaires plus importants du fait d'une possible accumulation du médicament (voir rubrique 4.2.)
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Au cours des essais cliniques, ORNIDYL n'a montré aucune interaction significative avec les autres produits administrés aux patients. Par ailleurs, les données pharmacologiques disponibles ne suggèrent pas la possibilité d'interactions avec d'autres produits.
Chez l'animal, on constate un effet létal embryonnaire et fœtal, un retard de croissance et des atteintes du système nerveux central (essentiellement fonctionnelles) en cas d'administration pré- et post-natale d’éflornithine.
Dans l'espèce humaine, en l'absence de données fiables, le risque n'est pas connu.
En conséquence :
Des moyens efficaces de contraception devront être utilisés chez la femme en âge de procréer.
En cas de grossesse : en l'absence d'alternative thérapeutique, compte-tenu des résultats chez l’animal et de l'absence de données cliniques, le traitement par ORNIDYL ne sera introduit qu'avec une extrême prudence, sous couverture d'une surveillance attentive de la croissance et du développement intra-utérins (en particulier cérébral).
Allaitement
L'excrétion du produit dans le lait maternel n'est pas connue. Du fait des effets indésirables potentiels de l'éflornithine, la décision du maintien de l'allaitement pendant le traitement devra prendre en considération le bénéfice attendu.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Sans objet.
Le non-respect des règles d’hygiène liées à l’administration par voie intraveineuse du médicament peut entraîner les effets suivants : pneumonie, septicémie, infection au point d’injection, infection des tissus mous. Il est impératif de respecter des règles d’hygiène strictes et des conditions rigoureuses d’asepsie pour l’administration d’ORNIDYL.
Les effets indésirables sont listés ci-dessous par système organe classe et fréquence. Les fréquences sont définies de la manière suivante: très fréquent (>1/10); fréquent (>1/100, <1/10); peu fréquent (>1/1000, <1/100); rare (> 1/10000, <1/1000); très rare (<1/10000).
ORNIDYL en monothérapie :
Affections hématologiques et du système lymphatique
Fréquent: Thrombocytopénie, réversible à l'arrêt du traitement; éosinophilie.
Peu fréquent: Anémie; leucopénie d'apparition précoce au cours du traitement.
Troubles du métabolisme et de la nutrition
Fréquent: Anorexie.
Affections du système nerveux
Très fréquent: Céphalées.
Fréquent: Convulsions (elles ne peuvent être liées systématiquement au produit, la maladie déterminant également des convulsions); étourdissements.
Affections de l'oreille et du labyrinthe
Une diminution de la fonction auditive peut survenir, classiquement à des posologies supérieures et dans un contexte thérapeutique différent. Elle est habituellement réversible à l'arrêt du traitement.
Affections gastro-intestinales
Fréquent: diarrhée, nausées, vomissements, douleurs abdominales.
Affections de la peau et des tissus sous cutanés
Fréquent: Alopécie, œdème facial.
Troubles généraux et anomalies au site d'administration
Très fréquent: Fièvre.
Fréquent: Asthénie.
Un pour cent (1%) des patients sont décédés durant leur traitement ou peu après la fin du traitement. Il n’a pas été possible d’établir si ces décès étaient imputables à la maladie sous-jacente ou à l’utilisation de l’éflornithine.
ORNIDYL en association avec un autre médicament antiparasitaire (schéma NECT):
Dans le cadre de l’étude NECT (Nifurtimox Eflornithine Combination Therapy) qui associe l’éflornithine par voie injectable et le nifurtimox par voie orale, un taux d’effets indésirables sévères statistiquement supérieur a été observé dans le bras monothérapie par rapport au bras bithérapie (p=0,002).
Aucune information n'est disponible en ce qui concerne les effets d'un éventuel surdosage chez l'Homme. En cas de surdosage l'état clinique et la numération formule sanguine devront être surveillées avec restauration globulaire si besoin. L'éflornithine ne se fixe pas aux protéines plasmatiques. Elle est dialysable selon les données issues des travaux in vitro.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Antileishmaniens et trypanocides - Code ATC : P01CX03
Le chlorhydrate d'éflornithine est un analogue structurel de l'ornithine. Il agit comme inhibiteur suicide spécifique et irréversible de l'ornithine décarboxylase (ODC), enzyme qui contrôle la synthèse des polyamines dont la putrescine, la spermidine et la spermine, qui existent dans toutes les cellules vivantes et jouent un rôle important dans la division et la différentiation cellulaire.
L'inhibition de l'activité de l'ODC interrompt la synthèse des polyamines et entraîne l'inhibition de la croissance et de la différenciation cellulaires.
Le chlorhydrate d'éflornithine inhibe in vitro la croissance de nombreux protozoaires, en particulier celle de Trypanosoma brucei brucei, Trypanosoma brucei gambiense, Trypanosoma brucei rhodesiense.
Schéma NECT (Nifurtimox-Eflornithine Combination Therapy)
Le schéma NECT a été validé par l’OMS sur la base de l’étude NECT (voir rubrique 4.2), étude menée en ouvert, multicentrique, randomisée, contrôlée de phase III, conduite chez 287 patients âgés de 15 ans et plus, atteints de trypanosomiase humaine africaine (Trypanosoma brucei gambiense) à un stade avancé de la maladie (phase neurologique). Dans cette étude, l’éflornithine administrée en monothérapie, à la dose de 100 mg/kg toutes les 6 heures en perfusions intraveineuses pendant 14 jours, a été comparée à l’éflornithine administrée à la dose de 200 mg/kg toutes les 12 heures en perfusions intraveineuses pendant 7 jours associée au nifurtimox administré par voie orale à la posologie de 5 mg/kg toutes les 8 heures pendant 10 jours consécutifs.
5.2. Propriétés pharmacocinétiques
Après une administration intraveineuse de chlorhydrate d'éflornithine chez l'homme, la demi-vie plasmatique terminale est d'environ 3 heures.
La cinétique est linéaire jusqu'à 100 mg/kg/6 heures.
80 % de la dose administrée par voie intraveineuse sont excrétés, inchangés, par les urines de 24 heures.
Le chlorhydrate d'éflornithine ne se lie pas aux protéines plasmatiques. Le passage dans le LCR est rapide. A la posologie recommandée en monothérapie, les concentrations dans le LCR sont identiques à celles qui se sont montrées actives sur le trypanosome in vitro, et représentent 25 à 95 % des concentrations sériques, le rapport le plus faible étant observé chez l'enfant de moins de 12 ans.
Chez le sujet âgé, l'insuffisant rénal et l'insuffisant hépatique, la cinétique du chlorhydrate d'éflornithine n'est pas connue. Toutefois, l'excrétion de l'éflornithine par voie rénale correspond approximativement à la clairance de la créatinine. Par conséquent, chez les sujets dont la fonction rénale est diminuée, il est recommandé de réduire la posologie étant donné le risque d'accumulation du médicament (voir rubrique 4.2).
5.3. Données de sécurité préclinique
La DL 50 après administration intraveineuse est de 1035 mg/kg chez la souris et 2134 mg/kg chez le rat. Ces doses sont plusieurs fois supérieures à celles nécessaires pour obtenir l'action pharmacologique recherchée chez ces espèces.
L'éflornithine ne s'est pas montrée mutagène in vitro sur cellules bactériennes (Salmonella). Son potentiel cancérogène n'a pas été évalué chez l'animal.
Considérant le mécanisme d'action de l'éflornithine et en présence d'études animales limitées, un effet du chlorhydrate d'éflornithine sur la spermatogenèse ne peut être exclu.
Un effet létal embryonnaire et fœtal a été observé chez la souris, le rat, le lapin, et le hamster.
Un retard de croissance et un retard de développement postnatal (système nerveux central, cœur, reins) ont été observés chez des rats exposés à l'éflornithine in utero puis via le lait maternel. Des résultats similaires ont été rapportés dans des études conduites chez le rat juvénile.
Eau pour préparations injectables.
Ce médicament ne doit pas être mélangé avec d'autres médicaments à l'exception de ceux mentionnés dans la rubrique 6.6.
3 ans.
Après ouverture: le produit doit être utilisé immédiatement.
6.4. Précautions particulières de conservation
A conserver à température ambiante.
6.5. Nature et contenu de l'emballage extérieur
1 ou 12 flacons (verre) de 100 ml.
6.6. Précautions particulières d’élimination et de manipulation
Avant leur administration les médicaments pour usage parentéral doivent être inspectés visuellement afin de déceler la présence de particules ou d'une décoloration de la solution.
Préparation de la solution diluée pour l'administration intraveineuse
ORNIDYL 20 g/100 ml est une solution hypertonique qui doit être diluée à environ 40 mg/ml avant administration IV comme suit:
· Dilution à l'aide d'eau pour préparations injectables (EPPI):
L'addition d'une partie en volumes de ORNIDYL 20 g/100 ml à 4 parties en volumes d'eau pour préparation injectable (EPPI) permet d'obtenir une solution dans les limites de 10 % de la tonicité plasmatique (approximativement 290 mosm/kg).
· Des conditions rigoureuses d'asepsie devront être mises en œuvre lors de cette manipulation afin de réduire le risque de contamination microbienne (voir rubrique 4.8).
· Les dilutions ainsi obtenues peuvent être conservées 24 heures dans un réfrigérateur avant administration.
· Aucun autre médicament ne devra être administré par voie intraveineuse pendant une perfusion d'ORNIDYL.
Le tableau ci-après donne les informations relatives à l'utilisation du produit selon le schéma posologique proposé. Le volume figurant dans le tableau devra être dilué, avant perfusion, avec de l'eau pour préparation injectable (EPPI) comme indiqué ci-après :
|
Poids des patients (Kg) |
Quantité d’éflornithine par dose (g) Schéma |
Volume (ml) à prélever dans le flacon à 20 g/100 ml pour des administrations toutes les 6 h (posologie 100 mg/kg) |
|
35 |
3,5 |
17,5 |
|
40 |
4,0 |
20 |
|
45 |
4,5 |
22,5 |
|
50 |
5,0 |
25 |
|
55 |
5,5 |
27,5 |
|
60 |
6,0 |
30 |
|
65 |
6,5 |
32,5 |
|
70 |
7,0 |
35 |
|
75 |
7,5 |
37,5 |
|
80 |
8,0 |
40 |
|
85 |
8,5 |
42,5 |
|
90 |
9,0 |
45 |
|
95 |
9,5 |
47,5 |
|
100 |
10,0 |
50 |
Les modalités de préparation de la solution seront à adapter avec le schéma en association recommandé par l’OMS, établi à partir de l’étude NECT avec une posologie de l’éflornithine administrée à la dose de 200 mg/kg toutes les 12 heures.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
SANOFI AVENTIS FRANCE
1-13, boulevard Romain Rolland
75014 Paris
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 569 637-7: 100 ml en flacon (verre); boîte de 1.
· 557 300-2: 100 ml en flacon (verre); boîte de 12.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I.
Réservé à l'usage hospitalier.