RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 16/07/2015
SAYANAPRESS 104 mg,suspension injectable en injecteur prérempli
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Acétate de médroxyprogestérone ……………………………………………………………………104 mg
pour 0,65 ml de suspension injectable
Chaque injecteur unidose prérempli contient 104 mg d’acétate de médroxyprogestérone (AMP).
Excipients à effet notoire :
Parahydroxybenzoate de méthyle (E218) – 1,04 mg pour 0,65 ml
Parahydroxybenzoate de propyle (E216) – 0,0975 mg pour 0,65 ml
Sodium – 2,47 mg pour 0,65 ml
Pour la liste complète des excipients, voir rubrique 6.1.
Suspension injectable en injecteur prérempli.
Suspension homogène de couleur blanche à blanc cassé.
4.1. Indications thérapeutiques
En raison de la possibilité d’une perte de densité minérale osseuse (DMO) chez les femmes de tous âges qui prennent SAYANAPRESS à long terme (voir rubrique 4.4), une évaluation du rapport bénéfices/risques, tenant compte également de la diminution de la DMO qui survient au cours de la grossesse et/ou l’allaitement, doit être envisagée avant l’administration de SAYANAPRESS.
Il est aussi important que la patiente soit informée de la nature prolongée des effets de ce produit, notamment du retour retardé de la fertilité (voir rubrique 4.4).
Utilisation chez les adolescentes (12-18 ans)
Chez les adolescentes, l’utilisation de SAYANAPRESS n’est indiquée que lorsque les autres méthodes de contraception sont jugées inadaptées ou inacceptables, en raison des effets inconnus à long terme de la perte osseuse associée à SAYANAPRESS au cours de la période critique de croissance osseuse (voir rubrique 4.4).
SAYANAPRESS n’a pas été étudié chez les femmes de moins de 18 ans mais des données, pour des injections de l’AMP par voie intramusculaire, sont disponibles dans cette population.
4.2. Posologie et mode d'administration
Le récipient unidose de SAYANAPRESS doit être agité vigoureusement avant utilisation pour s’assurer que la dose à administrer se présente sous forme d’une suspension homogène. Le contenu est hermétiquement scellé dans le réservoir de l’injecteur. L’injecteur doit être activé avant l’utilisation. La procédure d’activation consiste à percer le joint interne de façon à ce que le médicament puisse passer dans l’aiguille lorsque le réservoir est sous pression. Le liquide ne remplit pas complètement le réservoir. Une petite bulle d’air se trouve au-dessus du liquide. Lors de l’administration, l’injecteur doit être utilisé avec l’aiguille orientée vers le bas. Ceci garantit que la dose complète de liquide est délivrée à travers l’aiguille. Le médicament doit être injecté lentement pendant 5 à 7 secondes environ. Le traitement doit être instauré par un médecin ou tout autre professionnel de santé habilité à prescrire SAYANAPRESS puis administré par injection sous-cutanée (SC) dans la partie antérieure de la cuisse ou dans l’abdomen.
Pour des instructions détaillées concernant la préparation et l’injection de SAYANAPRESS, voir la rubrique 6.6 « Précautions particulières d’élimination et de manipulation » et la rubrique « Informations réservées aux professionnels de santé » de la notice.
Posologie
Adultes
Première injection : Pour obtenir une couverture contraceptive pendant le premier cycle d’utilisation, une injection SC de 104 mg doit être administrée pendant les cinq premiers jours d’un cycle menstruel normal. Si l’injection est pratiquée selon ces instructions, aucune autre mesure contraceptive n’est requise.
Doses suivantes : A partir de la deuxième injection, le traitement doit être administré à intervalles de 13 semaines ; tant que l’injection est pratiquée dans un délai n’excédant pas sept jours après cette période, aucune autre mesure contraceptive (par exemple, méthode barrière) n’est nécessaire. Si le délai écoulé depuis l’injection précédente est supérieur à 14 semaines (13 semaines plus 7 jours), quelle qu’en soit la raison, l’éventualité d’une grossesse doit être écartée avant l’administration de l’injection suivante. L’efficacité de SAYANAPRESS repose sur le respect du schéma thérapeutique recommandé.
Post-partum : Si la patiente n’allaite pas, l’injection doit être administrée dans les 5 jours suivant l’accouchement (pour s’assurer autant que possible que la patiente ne soit pas enceinte). Si l’injection est administrée à un autre moment, l’éventualité d’une grossesse doit être écartée.
Si la patiente allaite, l’injection ne doit pas être administrée avant 6 semaines après l’accouchement, lorsque le système enzymatique du nourrisson est plus développé (voir rubrique 4.6).
Des données indiquent que les femmes ayant pris SAYANAPRESS immédiatement après l’accouchement peuvent présenter des saignements prolongés et abondants. C’est pourquoi, le médicament doit être utilisé avec précaution pendant la période puerpérale. Les femmes qui envisagent d’utiliser le produit immédiatement après un accouchement ou une interruption de grossesse doivent être informées du risque accru de saignements abondants ou prolongés. Il est rappelé aux médecins que l’ovulation peut se produire dès la quatrième semaine chez la patiente en post-partum qui n’allaite pas.
Changement de méthodes de contraception : Lors du changement de méthode de contraception pour SAYANAPRESS, ce médicament doit être administré de façon à offrir une couverture contraceptive continue en fonction du mécanisme d’action des deux méthodes (par exemple, les patientes qui passent d’un contraceptif oral à SAYANAPRESS doivent recevoir leur première injection dans les 7 jours suivant la prise du dernier comprimé actif du contraceptif oral).
Populations particulières
Patientes souffrant d’insuffisance hépatique : L’effet d’une maladie hépatique sur la pharmacocinétique de SAYANAPRESS n’est pas connu. SAYANAPRESS étant largement éliminé par voie hépatique, il est possible qu’il soit faiblement métabolisé chez les patientes souffrant d’insuffisance hépatique sévère (voir rubrique 4.3).
Patientes souffrant d’insuffisance rénale : L’effet d’une maladie rénale sur la pharmacocinétique de SAYANAPRESS n’est pas connu. Aucun ajustement posologique ne devrait être nécessaire chez les femmes en insuffisance rénale, puisque SAYANAPRESS est presque exclusivement éliminé par métabolisme hépatique.
Population pédiatrique
SAYANAPRESS n’est pas indiqué avant l’apparition des premières règles (voir rubrique 4.1). Des données chez les adolescentes (12-18 ans) sont disponibles en ce qui concerne l’administration IM d’AMP (voir rubriques 4.4 et 5.1). Hormis les préoccupations relatives à la perte de DMO, la sécurité et l’efficacité de SAYANAPRESS devraient être similaires chez les adolescentes réglées et chez les femmes adultes.
L’acétate de médroxyprogestérone est contre-indiqué :
· chez les patientes qui ont une hypersensibilité connue à l’AMP ou à l’un des excipients mentionnés à la rubrique 6.1
· en cas de grossesse confirmée ou suspectée
· chez les femmes qui présentent une tumeur maligne confirmée ou suspectée du sein ou des organes génitaux
· chez les patientes qui présentent des saignements vaginaux non diagnostiqués
· chez les patientes qui souffrent d’insuffisance hépatique sévère
· chez les patientes qui souffrent d’une maladie osseuse métabolique
· chez les patientes qui souffrent d’une maladie thromboembolique et les patientes qui présentent ou qui ont des antécédents de maladie cérébrovasculaire.
4.4. Mises en garde spéciales et précautions d'emploi
Mises en garde spéciales
Perte de Densité Minérale Osseuse :
Cette perte de DMO est particulièrement préoccupante pendant l’adolescence et au début de l’âge adulte, une période critique de croissance osseuse. On ignore si l’utilisation d’AMPR en injection sous-cutanée chez des femmes plus jeunes diminuera le pic de masse osseuse et augmentera le risque de fracture par la suite.
Une étude visant à évaluer les effets sur la DMO de l’acétate de médroxyprogestérone par voie IM (DEPO-PROVERA, AMPR) chez des adolescentes a montré que son utilisation était associée à une diminution significative de la DMO par rapport aux valeurs initiales. Chez un petit nombre de femmes qui étaient suivies, la DMO moyenne se rapprochait à peu près des valeurs initiales dans les 1 à 3 ans suivant l’arrêt du traitement. Chez les adolescentes, SAYANAPRESS peut être utilisé mais uniquement après discussion avec la patiente des autres méthodes de contraception et que celles-ci aient été jugées inadaptées ou inacceptables.
Chez les femmes de tous âges, une réévaluation minutieuse des risques et des bénéfices du traitement doit être effectuée chez celles qui souhaitent poursuivre le traitement au-delà de 2 ans. En particulier, chez les femmes qui présentent des facteurs de risque significatifs d’ostéoporose de par leur mode de vie ou leur état de santé, d’autres méthodes de contraception doivent être envisagées avant d’utiliser SAYANAPRESS.
Les facteurs de risque significatifs d’ostéoporose comprennent :
· L’abus d’alcool et/ou le tabagisme
· L’utilisation chronique de médicaments pouvant réduire la masse osseuse, comme les anticonvulsivants ou les corticoïdes
· Un indice de masse corporel bas ou des troubles alimentaires, comme l’anorexie mentale ou la boulimie
· Des antécédents de fracture secondaire à un traumatisme mineur
· Des antécédents familiaux d’ostéoporose
Une étude de cohorte rétrospective utilisant les données de la General Practice Research Database (GPRD) a rapporté que les femmes qui reçoivent des injections d’AMP (AMPR) présentent un risque plus élevé de fractures, comparativement aux utilisatrices de contraceptifs qui n’ont pas pris d’AMPR (ratio du taux d’incidence : 1,41 ; IC à 95 % : 1,35-1,47 pour la période de suivi de cinq ans) ; on ignore si ce phénomène est dû à l’utilisation d’AMPR ou à d’autres facteurs en lien avec le mode de vie qui influent sur le taux de fractures. En revanche, chez les femmes qui reçoivent l’AMPR, le risque de fractures avant et après le début du traitement par AMPR n’est pas majoré (risque relatif : 1,08 ; IC à 95 % : 0,92-1,26). Il est important de noter que cette étude n’a pas pu déterminer si l’utilisation d’AMPR avait un effet sur le taux de fractures plus tard au cours de la vie.
Pour plus d’informations sur les fluctuations de la DMO chez les femmes adultes et adolescentes, comme cela a été rapporté dans des études cliniques récentes, se référer à la rubrique 5.1 (Propriétés pharmacodynamiques). Il est important que les femmes de tous âges prennent des quantités adéquates de calcium et de vitamine D pour préserver leur santé osseuse, que ce soit par le biais de l’alimentation ou d’une supplémentation,.
Menstruations irrégulières :
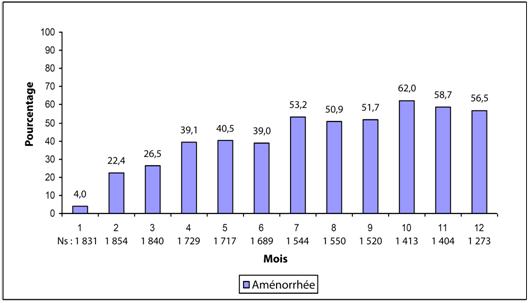
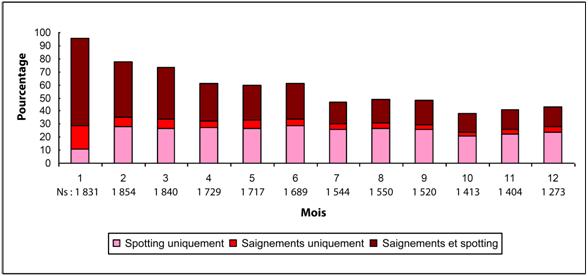
La plupart des femmes ayant utilisé l’AMPR en injection sous-cutanée ont présenté une modification de leur cycle menstruel. Les patientes doivent être correctement informées sur la possibilité de troubles menstruels et d’un éventuel retard du retour de l'ovulation. Avec la poursuite des injections sous-cutanées d’AMPR, moins de femmes ont présenté des saignements irréguliers et plus de femmes ont présenté une aménorrhée. Après avoir reçu leur quatrième dose, 39 % des femmes ont développé une aménorrhée au cours du sixième mois. Au douzième mois, 56,5 % des femmes ont développé une aménorrhée. Les modifications du cycle menstruel observées dans les trois études évaluant l’effet contraceptif sont présentées dans les figures 1 et 2. La figure 1 montre l’augmentation du pourcentage de femmes en aménorrhée au cours de l’étude de 12 mois. La figure 2 présente le pourcentage de femmes ayant présenté un spotting uniquement, des saignements uniquement, ou à la fois des saignements et un spotting au cours de la même période. Outre l’aménorrhée, l’altération du cycle menstruel s’est également caractérisée par des saignements intermenstruels, une ménorragie ou une métrorragie. Si les saignements anormaux associés à l’AMPR en injection sous-cutanée persistent ou s’ils sont sévères, des examens appropriés doivent être effectués et un traitement doit être instauré.
Figure 1. Pourcentage de femmes traitées par AMPR en injection sous-cutanée ayant présenté une aménorrhée dans les études évaluant l’effet contraceptif, par mois de 30 jours (population ITT, N = 2 053)

Figure 2. Pourcentage de femmes traitées par AMPR en injection sous-cutanée ayant présenté des saignements et/ou un spotting dans les études évaluant l’effet contraceptif, par mois de 30 jours (population ITT, N = 2 053)
Risques de cancer :
La surveillance cas-témoins à long terme des utilisatrices d’AMPR IM à 150 mg a montré l’absence d’augmentation globale du risque de cancer ovarien, hépatique ou cervical, et un effet protecteur prolongé sur la réduction du risque de cancer de l’endomètre dans cette population.
Le cancer du sein est rare chez les femmes de moins de 40 ans, qu’elles utilisent ou pas une contraception hormonale.
Les résultats de quelques études épidémiologiques suggèrent une petite différence de risque de contracter la maladie chez les utilisatrices actuelles et récentes, comparativement aux femmes non utilisatrices. Le risque supplémentaire chez les utilisatrices actuelles et récentes d’AMPR est faible par rapport au risque global de cancer du sein, en particulier chez les femmes jeunes (voir ci-dessous), et n’apparaît pas 10 ans après la dernière prise. La durée d’utilisation ne semble pas être importante.
Nombre possible de cas supplémentaires de cancer du sein diagnostiqués jusqu’à 10 ans après l’arrêt des progestatifs injectables*
|
Age lors de la dernière utilisation d’AMPR |
Nombre de cas pour 10 000 femmes naïves d’utilisation |
Cas supplémentaires possibles pour 10 000 utilisatrices d’AMPR |
|
20 |
Moins de 1 |
Bien moins que 1 |
|
30 |
44 |
2-3 |
|
40 |
160 |
10 |
*sur la base d’une utilisation pendant 5 ans
Affections thromboemboliques
Bien qu’aucun lien de causalité n’ait été établi entre l’AMP et la survenue d’affections thrombotiques ou thromboemboliques, toute patiente qui développe ce type d’événement, comme une embolie pulmonaire, une maladie cérébrovasculaire ou une thrombose rétinienne ou une thrombose veineuse profonde, pendant le traitement par SAYANAPRESS, ne doit plus prendre le médicament. Les femmes ayant des antécédents d’affections thromboemboliques n’ont pas été étudiées dans les essais cliniques et aucune information appuyant la sécurité d’emploi de SAYANAPRESS n’est disponible pour cette population.
Anaphylaxie et réaction anaphylactoïde
Lors d’une réaction anaphylactique, un traitement adapté sera instauré. Les réactions anaphylactiques graves exigent un traitement médical en urgence.
Affections oculaires
En cas de perte soudaine de la vue, partielle ou complète, ou en cas d’apparition soudaine d’une exophtalmie, d’une diplopie ou d’une migraine, le médicament ne doit pas être réadministré tant qu’un examen n’a pas été pratiqué. Si l’examen révèle un œdème papillaire ou des lésions vasculaires de la rétine, le médicament ne doit pas être réadministré.
Précautions d’emploi
Variations de poids
Les variations de poids sont fréquentes mais imprévisibles. Dans les études de phase 3, le poids corporel a été suivi pendant 12 mois. La moitié (50 %) des femmes présentait une fluctuation de leur poids corporel initial de l’ordre de 2,2 kg. 12 % des femmes ont perdu plus de 2,2 kg et 38 % des femmes ont pris plus de 2,3 kg.
Rétention hydrique
Des données indiquent que les progestatifs peuvent entraîner un certain degré de rétention liquidienne ; par conséquent, le médicament devra être administré avec précaution chez toute patiente présentant une affection médicale préexistante susceptible d’être affectée par la rétention hydrique.
Retour de l’ovulation
Après une dose unique d’AMPR en injection sous-cutanée, le taux cumulé de retour de l’ovulation, mesuré par le taux plasmatique de la progestérone, était de 97,4 % (38 patientes sur 39) dans l’année suivant l’administration. Après la fenêtre thérapeutique de 14 semaines, le retour à l’ovulation le plus précoce est survenu dans un délai d’une semaine, et le délai médian était de 30 semaines. Les femmes doivent être avisées du risque potentiel de retour retardé de l’ovulation après l’utilisation de cette méthode, quelle que soit la durée d’utilisation. Toutefois, il est établi que l’aménorrhée et/ou les irrégularités menstruelles qui suivent l’arrêt de la contraception hormonale peuvent être dues à un trouble sous-jacent associé à des irrégularités menstruelles, notamment à un syndrome des ovaires polykystiques.
Affections psychiatriques
Les patientes ayant déjà été traitées pour une dépression doivent faire l’objet d’une surveillance rigoureuse pendant la prise de SAYANAPRESS.
Protection contre les maladies sexuellement transmissibles
Les patientes doivent être avisées du fait que SAYANAPRESS ne protège pas de l’infection par le VIH (SIDA) ou des autres maladies sexuellement transmissibles.
Glucides/Métabolisme
Certaines patientes recevant des progestatifs peuvent présenter une diminution de la tolérance au glucose. Les patientes diabétiques doivent faire l’objet d’une surveillance rigoureuse pendant la prise de ce type de traitement.
Fonction hépatique
Si une femme développe une jaunisse pendant la prise de SAYANAPRESS, il faut envisager de ne pas poursuivre le traitement (voir rubrique 4.3).
Hypertension et troubles lipidiques
Des données limitées suggèrent une légère augmentation du risque d’événements cardiovasculaires chez les femmes présentant une hypertension ou des anomalies lipidiques qui ont utilisé des progestatifs seuls sous forme injectable. Si une hypertension apparaît pendant le traitement par SAYANAPRESS et/ou si l’augmentation de l’hypertension ne peut être correctement contrôlée avec des antihypertenseurs, le traitement par SAYANAPRESS doit être interrompu. Les autres facteurs de risque d’affections thrombotiques artérielles comprennent : l’hypertension, le tabagisme, l’âge, les anomalies lipidiques, la migraine, l’obésité, les antécédents familiaux, les valvulopathies cardiaques, la fibrillation auriculaire.
SAYANAPRESS doit être utilisé avec prudence chez les patientes présentant au moins l’un de ces facteurs de risque.
Autres affections
Les affections suivantes ont été rapportées pendant la grossesse et pendant l’utilisation d’hormones sexuelles stéroïdiennes, mais aucun lien n’a été établi avec l’utilisation de progestatifs : une jaunisse et/ou un prurit associé à une cholestase, la formation de calculs biliaires, une porphyrie, un lupus érythémateux disséminé, un syndrome hémolytique et urémique, une chorée de Sydenham, un herpès gravidique, une perte auditive liée à une otosclérose.
En présence de l’un(e) de ces affections/facteurs de risque, les bénéfices de l’utilisation de SAYANAPRESS doivent être évalués individuellement en fonction des risques éventuels pour chaque femme et faire l’objet d’une discussion avec la patiente avant qu’elle décide de prendre le médicament. En cas d’aggravation, d’exacerbation ou d’apparition de l’un(e) de ces affections ou facteurs de risque, la patiente doit contacter son médecin. Le médecin devra ensuite déterminer si l’utilisation de SAYANAPRESS doit être interrompue.
Analyses de laboratoire
Le pathologiste doit être avisé du traitement par un progestatif lorsque les échantillons concernés lui sont transmis. Le médecin doit être informé que certains tests endocriniens et de la fonction hépatique, ainsi que des paramètres sanguins, peuvent être affectés lors d’un traitement par un progestatif.
a) Diminution des stéroïdes plasmatiques/urinaires (par exemple, progestérone, œstradiol, prégnanediol, testostérone, cortisol)
b) Diminution des taux plasmatiques et urinaires de gonadotrophine (par exemple, LH, FSH)
c) Diminution des concentrations de globuline de liaison aux hormones sexuelles (SHBG).
Informations importantes au sujet des excipients
Ce produit contenant du parahydroxbenzoate de méthyle (E218) et du parahydroxbenzoate de propyle (E216), il peut provoquer des réactions allergiques (éventuellement retardées) et exceptionnellement, un bronchospasme. Ce médicament contient moins d’1 mmol de sodium (23 mg) pour 104 mg/ 0,65 ml, c’est à dire « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée avec SAYANAPRESS.
De rares cas d’interactions avec d’autres traitements médicaux (notamment des anticoagulants oraux) ont été rapportés, mais le lien de causalité n’a pas été établi. La possibilité d’interactions doit être prise en compte chez les patientes recevant des traitements concomitants.
In vitro, l’AMP est métabolisé essentiellement par hydroxylation via le CYP3A4. Aucune étude d’interactions médicamenteuses spécifiques évaluant les effets cliniques avec des inducteurs ou des inhibiteurs du CYP3A4 sur l’AMP n’a été réalisée ; par conséquent, les effets cliniques des inducteurs ou des inhibiteurs du CYP3A4 ne sont pas connus.
Une étude a révélé que les nourrissons issus de grossesses accidentelles survenues 1 à 2 mois après l’injection IM d’acétate de médroxyprogestérone à 150 mg présentaient un risque accru de faible poids de naissance, ce qui a été associé à un risque majoré de mort néonatale. Cependant, le risque global d’un tel phénomène est très faible car les grossesses pendant le traitement par l’acétate de médroxyprogestérone à 150 mg en injection IM sont peu fréquentes.
Les enfants exposés à l’AMP in utero et suivis jusqu’à l’adolescence n’ont présenté aucun signe d’effet indésirable sur leur santé, notamment leur développement physique, intellectuel, sexuel ou social.
Allaitement
De faibles quantités détectables de médicament ont été retrouvées dans le lait de mères recevant de l’AMP. Chez les femmes qui allaitent et qui reçoivent des injections IM d’acétate de médroxyprogestérone à 150 mg, la composition, la qualité et la quantité de lait ne sont pas affectées. Les effets sur le développement et sur le comportement ont été étudiés chez les nouveau-nés et les nourrissons exposés à l’AMP, par le biais du lait maternel, jusqu’à la puberté. Aucun effet indésirable n’a été constaté. Cependant, en raison de données limitées sur les effets de l’AMP chez les nourrissons allaités de moins de 6 semaines, SAYANAPRESS doit être administré au moins 6 semaines après l’accouchement, lorsque le système enzymatique du nourrisson est mieux développé.
Fertilité
SAYANAPRESS est indiqué pour la prévention d’une grossesse.
Les femmes peuvent présenter un retour de la fertilité (conception) retardé après l’arrêt de SAYANAPRESS (voir rubrique 4.4).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
SAYANAPRESS n’a aucun effet sur l’aptitude à conduire des véhicules et à utiliser des machines.
Evénements observés lors des essais cliniques :
Dans trois vastes essais cliniques ayant inclus 1 980 femmes traitées par l’AMPR en injection
sous-cutanée pendant une durée allant jusqu’à 1 an, les événements indésirables suivants ont été rapportés comme étant liés au médicament. Les effets indésirables sont répertoriés selon les catégories suivantes :
Très fréquent (³ 1/10)
Fréquent (³ 1/100 à < 1/10)
Peu fréquent (³ 1/1 000 à < 1/100)
Rare (³ 1/10 000 à < 1/1 000)
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
Evénements observés lors de la surveillance post-commercialisation :
Par ailleurs, les événements indésirables cliniquement significatifs extraits des données post-commercialisation de l’AMPR injectable (IM ou SC) sont également inclus dans la liste ci-dessous :
|
Classe de systèmes d’organes |
Très fréquent |
Fréquent
|
Peu fréquent
|
Rare |
|
|
Infections et infestations |
|
Vaginite |
|
|
|
|
Tumeurs bénignes, malignes et non précisées (incl kystes et polypes) |
|
|
|
Cancer du sein (voir rubrique 4.4) |
|
|
Affections du système immunitaire |
|
|
|
|
Réactions d’hypersensibilité (par exemple, anaphylaxie et réactions anaphylactoïdes, angioedème (voir rubrique 4.4)) |
|
Troubles du métabolisme et de la nutrition |
Prise de poids, perte de poids (voir rubrique 4.4) |
|
Rétention hydrique (voir rubrique 4.4), augmentation de l’appétit, diminution de l’appétit |
|
|
|
Affections psychiatriques |
|
Dépression, anorgasmie, anxiété, trouble émotionnel, trouble affectif, diminution de la libido, irritabilité |
Insomnie, nervosité |
|
|
|
Affections du système nerveux |
|
Sensation vertigineuse, céphalée |
Migraine, somnolence |
|
Convulsions
|
|
Affections de l’oreille et du labyrinthe |
|
|
Vertige |
|
|
|
Affections cardiaques |
|
|
Tachycardie |
|
|
|
Affections vasculaires |
|
|
Embolie pulmonaire, thrombophlébite, hypertension (voir rubrique 4.4), varice, bouffées de chaleur |
|
Affections thromboemboliques (voir rubrique 4.4) |
|
Affections gastro-intestinales |
|
Douleur abdominale, nausées
|
Distension abdominale |
|
|
|
Affections hépatobiliaires |
|
|
Taux d’enzyme hépatique anormal
|
|
Jaunisse, perturbation de la fonction hépatique (voir rubrique 4.4) |
|
Affections de la peau et du tissu sous-cutané |
|
Acné |
Chloasma, dermatite, ecchymose, rash, alopécie, hirsutisme, prurit, urticaire |
|
Strie cutanée |
|
Affections musculo-squelettiques et systémiques |
|
Dorsalgie, douleur dans les membres |
Perte de la densité minérale osseuse (voir rubrique 4.4), arthralgie, crampes musculaires |
|
Ostéoporose, incluant des fractures ostéoporotiques |
|
Affections des organes de reproduction et du sein |
|
Aménorrhée, douleur/ hypersensibilité mammaire, dysménorrhée, métrorragie, ménométrorragie, ménorragie (voir rubrique 4.4) |
Kyste de l’ovaire, hémorragie utérine (irrégulière, augmentée, diminuée), pertes vaginales, sécheresse vulvo-vaginale, accroissement mammaire, dyspareunie, galactorrhée, douleur pelvienne, syndrome prémenstruel |
|
|
|
Troubles généraux et anomalies au site d’administration |
|
Réactions au site d’injection (telles qu’une douleur au point d’injection, une sensibilité au niveau du site d’injection, un nodule au site d’injection, une atrophie (persistante) au site d’injection et une lipoatrophie au site d’injection), fatigue |
Asthénie |
Fièvre |
|
|
Investigations |
|
Frottis cervical anormal
|
Tolérance diminuée au glucose (voir rubrique 4.4) |
|
|
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
Aucune action n’est requise outre l’interruption du traitement.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : progestatifs, code ATC : G03AC06.
L’AMP est un analogue de la 17 a‑hydroxyprogestérone avec des effets anti-œstrogéniques, antiandrogéniques et antigonadotrophiques.
L’AMPR en injection sous-cutanée inhibe la sécrétion des gonadotrophines ce qui, à son tour, prévient la maturation folliculaire et l’ovulation. Le principal mécanisme de suppression de l’ovulation entraîne également un amincissement de l’endomètre, et ces actions produisent son effet contraceptif.
Modifications de la DMO chez les Femmes Adultes
Une étude comparant les modifications de la DMO chez des femmes utilisant de l’AMPR en injection sous-cutanée et chez des femmes recevant de l’acétate de médroxyprogestérone injectable (150 mg IM) n’a pas montré de différences significatives de perte de DMO entre les deux groupes après deux ans de traitement. Les pourcentages moyens de modification de la DMO dans le groupe AMPR en injection sous-cutanée sont indiqués dans le tableau 1.
Tableau 1. Modification moyenne (%) de la DMO par rapport aux valeurs initiales chez des femmes prenant SAYANAPRESS, par site squelettique
|
Durée du traitement |
Rachis lombaire |
Hanche totale |
Col du fémur |
|||
|
N |
Modification (%) (IC à 95 %) |
N |
Modification (%) (IC à 95 %) |
N |
Modification (%) (IC à 95 %) |
|
|
1 an |
166 |
-2,7 (-3,1 à -2,3) |
166 |
-1,7 (-2,1 à -1,3) |
166 |
-1,9 (-2,5 à -1,4) |
|
2 ans |
106 |
- 4,1 (-4,6 à -3,5) |
106 |
-3,5 (-4,2 à -2,7) |
106 |
-3,5 (-4,3 à -2,6) |
Une autre étude clinique contrôlée menée chez des femmes adultes prenant de l’acétate de médroxyprogestérone injectable (150 mg IM) pendant une durée maximale de 5 ans a montré des diminutions moyennes de la DMO de l’ordre de 5-6 % au niveau du rachis et de la hanche, et aucun changement significatif de la DMO dans le groupe témoin. La diminution de la DMO était plus marquée durant les deux premières années d’utilisation, avec des diminutions plus faibles au cours des années suivantes. Des modifications moyennes de la DMO de l’ordre de -2,86 %, -4,11 %, -4,89 %, -4,93 % et -5,38 % ont été observées au niveau du rachis lombaire après 1, 2, 3, 4 et 5 ans, respectivement. Les diminutions moyennes de la DMO au niveau de la hanche totale et du col du fémur étaient similaires. Voir le tableau 2 ci-dessous pour plus de détails.
Après l’arrêt des injections d’acétate de médroxyprogestérone (150 mg IM), la DMO a augmenté vers les valeurs initiales au cours de la période post-traitement. Une durée de traitement plus longue a été associée à une récupération plus lente de la DMO.
Tableau 2. Modification moyenne (%) de la DMO par site squelettique par rapport aux valeurs initiales chez des femmes adultes, de la cohorte traitées pendant 5 ans par l’acétate de médroxyprogestérone à 150 mg IM et après 2 ans post-traitement ou après 7 ans d’observation chez des femmes du groupe témoin
|
Durée d’inclusion dans l’étude |
Rachis |
Hanche totale |
Col du fémur |
|||
|
|
AMP |
Groupe témoin |
AMP |
Groupe témoin |
AMP |
Groupe témoin |
|
5 ans* |
n = 33 -5,38 % |
n = 105 0,43 % |
n = 21 -5,16 % |
n = 65 0,19 % |
n = 34 -6,12 % |
n = 106 -0,27 % |
|
7 ans** |
n = 12 -3,13 % |
n = 60 0,53 % |
n = 7 -1,34 % |
n = 39 0,94 % |
n = 13 -5,38 % |
n = 63 -0,11 % |
*Le groupe de traitement se composait de femmes ayant reçu de l’acétate de médroxyprogestérone en injection (150 mg IM) pendant 5 ans, et le groupe témoin se composait de femmes n’ayant pas utilisé de contraception hormonale au cours de cette période.
**Le groupe de traitement se composait de femmes ayant reçu de l’acétate de médroxyprogestérone en injection (150 mg IM) pendant 5 ans puis suivies pendant une période maximale de 2 ans post-traitement, et le groupe témoin se composait de femmes n’ayant pas utilisé de contraception hormonale pendant 7 ans.
Modifications de la DMO chez les Adolescentes (12-18 ans)
Les résultats d’une étude clinique non randomisée en ouvert portant sur l’utilisation de l’acétate de médroxyprogestérone en injection (150 mg IM toutes les 12 semaines pendant une période de 240 semaines [4,6 ans] maximum, suivie de mesures post-traitement) chez des adolescentes (12-18 ans) ont également montré que l’utilisation d’acétate de médroxyprogestérone IM était associée à une diminution significative de la DMO par rapport aux valeurs initiales. Chez les patientes qui recevaient ≥ 4 injections/période de 60 semaines, la diminution moyenne de la DMO au niveau du rachis lombaire était de -2,1 % au bout de 240 semaines (4,6 ans) ; les diminutions moyennes de la DMO au niveau de la hanche totale et du col du fémur étaient de -6,4 % et -5,4 %, respectivement. Le suivi post-traitement a montré que, sur la base des valeurs moyennes, la DMO au niveau du rachis lombaire retrouvait les valeurs initiales environ 1 an après l’arrêt du traitement et que la DMO au niveau de la hanche retrouvait les valeurs initiales environ 3 ans après l’arrêt du traitement. Toutefois, il est important de noter qu’un grand nombre de sujets sont sortis d’étude, et que ces résultats se basent donc sur un petit nombre de sujets (n = 71 à 60 semaines et n = 25 à 240 semaines après l’arrêt du traitement). En revanche, une cohorte non comparable de sujets non traités et non appariés, présentant des paramètres osseux initiaux différents de ceux des utilisatrices d’AMPR, a montré des augmentations moyennes de la DMO à 240 semaines de l’ordre de 6,4 %, 1,7 % et 1,9 % au niveau du rachis lombaire, de la hanche totale et du col du fémur, respectivement.
5.2. Propriétés pharmacocinétiques
|
Tableau 1. Paramètres pharmacocinétiques de l’AMP après une injection SC unique de SAYANAPRESS chez des femmes en bonne santé (n = 42) |
||||||
|
|
Cmax (ng/ml) |
Tmax (jour) |
C91 (min) (ng/ml) |
ASC0-91 (ng·jour/ml) |
ASC0-¥ (ng·jour/ml) |
t½ (jour) |
|
Moyenne |
1,56 |
8,8 |
0,402 |
66,98 |
92,84 |
43 |
|
Min |
0,53 |
2,0 |
0,133 |
20,63 |
31,36 |
16 |
|
Max |
3,08 |
80,0 |
0,733 |
139,79 |
162,29 |
114 |
|
Cmax = pic sérique ; Tmax = temps quand Cmax est observé, ASC0-91 = aire sous la courbe concentration-temps sur 91 jours ; t½ = demi-vie terminale ; 1 nanogramme = 103 picogrammes.
|
||||||
Caractéristiques générales
Absorption
L’absorption de l’AMP du site d’injection SC pour atteindre les niveaux thérapeutiques est relativement rapide. Le Tmax moyen était atteint une semaine environ après l’injection. Les concentrations maximales d’AMP (Cmax) sont généralement comprises entre 0,5 et 3,0 ng/ml avec une Cmax moyenne de 1,5 ng/ml après une injection SC unique.
Effet du site d’injection
L’AMPR était administré par injection sous cutanée au niveau de la partie antérieure de la cuisse ou de l’abdomen afin d’en évaluer les effets sur le profil concentration-temps de l’AMP. Les concentrations minimales d’AMP (Cmin ; Jour 91) étaient similaires pour les deux sites d’injection, ce qui suggère que le site d’injection ne nuit pas à l’efficacité contraceptive.
Distribution
La liaison de l’AMP aux protéines plasmatiques avoisine 86 %. L’AMP se lie essentiellement à l’albumine sérique ; il ne se fixe pas à la SHBG.
Biotransformation
L’AMP est fortement métabolisé dans le foie par les enzymes P450. Son métabolisme porte essentiellement sur une réduction de l’anneau A et/ou de la chaîne latérale, une perte du groupe acétyle, une hydroxylation en position 2, 6 et 21 ou une combinaison de ces positions, donnant lieu à plus de 10 métabolites.
Élimination
Les concentrations résiduelles d’AMP au terme de l’intervalle d’administration (3 mois) d’AMPR en injection sous-cutanée sont généralement inférieures à 0,5 ng/ml, ce qui est en accord avec sa demi-vie terminale apparente d’environ 40 jours après une administration SC. La plupart des métabolites de l’AMP sont excrétés dans les urines sous forme de glucuroconjugués, avec seulement de faibles quantités excrétées sous forme de sulfates.
Linéarité/non-linéarité
Les données relatives à l’utilisation de doses uniques n’ont pas révélé de relation non linéaire pour des doses de 50 à 150 mg après l’administration SC. La relation entre l’ASC ou la Cmin et la dose SC d’AMP s’est révélée linéaire. La Cmax moyenne n’a pas varié de manière substantielle avec l’augmentation de la dose.
Race
Il n’y a pas eu de différence apparente de profil pharmacocinétique et/ou pharmacodynamique de l’AMP après l’administration SC d’AMPR aux femmes de toutes les origines ethniques étudiées. Le profil pharmacocinétique/pharmacodynamique de l’AMP a été évalué chez des femmes asiatiques dans le cadre d’une étude séparée.
Effet du poids corporel
Aucun ajustement posologique de SAYANAPRESS n’est nécessaire en fonction du poids corporel. L’effet du poids corporel sur les paramètres pharmacocinétiques de l’AMP a été évalué dans un sous-ensemble de femmes (n = 42, indice de masse corporelle [IMC] compris entre 18,2 et 46,0 kg/m2). Les valeurs d’ASC0-91 pour l’AMP étaient de 68,5 ; 74,8 et 61,8 ng - jour/ml chez les femmes appartenant aux catégories d’IMC £ 25 kg/m2, > 25 à ≤ 30 kg/m2, et > 30 kg/m2, respectivement. La Cmax moyenne de l’AMP était de 1,65 ng/ml chez les femmes ayant un IMC £ 25 kg/m2, de 1,76 ng/ml chez les femmes ayant un IMC compris entre > 25 et ≤ 30 kg/m2, et de 1,40 ng/ml chez les femmes ayant un IMC > 30 kg/m2. La fourchette des valeurs des concentrations minimales (Cmin) et des demi-vies de l’AMP étaient comparables pour les 3 groupes d’IMC.
Relation(s) pharmacocinétique/pharmacodynamique
D’un point de vue pharmacodynamique, la durée de la suppression de l’ovulation dépend du maintien des concentrations thérapeutiques de l’AMP tout au long de l’intervalle d’administration de 13 semaines.
5.3. Données de sécurité préclinique
Parahydroxybenzoate de méthyle (E218)
Parahydroxybenzoate de propyle (E216)
Chlorure de sodium
Polysorbate 80
Phosphate monosodique monohydraté
Phosphate disodique dodécahydraté
Méthionine
Povidone
Acide chlorhydrique et/ou hydroxyde de sodium pour l’ajustement du pH
Eau pour préparations injectables
Après ouverture : A utiliser immédiatement. Eliminer toute portion inutilisée.
6.4. Précautions particulières de conservation
Ne pas mettre au réfrigérateur. Ne pas congeler.
6.5. Nature et contenu de l'emballage extérieur
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Instructions d’utilisation et de manipulation
|
Préparatifs |
|
|
· Vérifier que le médicament est à température ambiante. · S’assurer que les éléments suivants sont disponibles : o Un sachet en aluminium fermé contenant SAYANAPRESS dans l’injecteur prérempli o Un tampon alcoolisé o Un morceau de coton propre
(Le tampon alcoolisé et le coton ne sont pas fournis avec SAYANAPRESS.)
|
|
|
Etape 1 : Choix et préparation de la zone d’injection |
|
|
· Choisir une zone adaptée pour l’injection sous-cutanée, à savoir l’abdomen ou l’avant du haut de la cuisse. Eviter les zones osseuses et le nombril. · Utiliser un tampon alcoolisé pour nettoyer la peau de la zone d’injection choisie. Laisser la peau sécher.
|
|
|
Etape 2 : Préparation de l’injecteur |
|
|
· Au moment d’administrer l’injection, déchirer soigneusement le sachet en aluminium et sortir l’injecteur. Ne pas retirer le protecteur d’aiguille à ce stade. · Vérifier l’injecteur comme suit : o Le protecteur d’aiguille doit être dans la position indiquée sur l’illustration. Il doit y avoir un espace entre l’extrémité du protecteur d’aiguille et le porte-aiguille. o En l’absence d’espace, jeter l’injecteur et en utiliser un autre. o Si le protecteur d’aiguille s’est désolidarisé de l’aiguille, ou s’il est manquant, jeter l’injecteur et en utiliser un autre.
|
|
|
Etape 3 : Mélange du médicament |
|
|
· Bien tenir l’injecteur par le porte-aiguille (voir la Figure 1 pour connaître l’emplacement du porte-aiguille) · Agiter vigoureusement l’injecteur pendant 30 secondes pour bien mélanger le médicament. Ne pas le plier. · En cas de délai entre le mélange du médicament et le passage aux étapes suivantes, renouveler la procédure de mélange ci-dessus. |
|
|
· Vérifier l’injecteur. Le liquide à l’intérieur doit être de couleur blanche à blanc cassé et uniforme. Il ne doit présenter aucune fuite. · En cas de problème, jeter l’injecteur et en utiliser un autre. |
|
|
Etape 4 : Activation de l’injecteur |
|
|
· Bien tenir l’injecteur par le porte-aiguille d’une main. · Tenir le protecteur d’aiguille avec l’autre main. Il y a un espace entre le porte-aiguille et l’extrémité du protecteur d’aiguille. |
|
|
· Pousser le protecteur d’aiguille vers le porte-aiguille. Continuer de presser fermement jusqu’à ce qu’il n’y ait plus d’espace entre le protecteur d’aiguille et le porte-aiguille. L’injecteur est à présent activé. |
|
|
· Continuer de bien tenir l’injecteur par le porte-aiguille. · Tirer sur le protecteur d’aiguille pour le retirer de l’aiguille.
|
|
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
23-25 AVENUE DU DR LANNELONGUE
75014 PARIS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 078 6 0 : injecteur prérempli contenant 0,65 ml de suspension injectable. Boite de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[A compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[A compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I