RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 09/01/2014
CARDIOMIBI 1 mg, trousse pour préparation radiopharmaceutique
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque flacon contient 1 mg de tétrafluoroborate de tétrakis (2-méthoxy-isobutyl isonitrile) cuivre (I)
A reconstituer à l'aide d'une solution injectable de pertechnétate de sodium (99mTc)
Le radioélément n'est pas fourni avec la trousse.
Excipient:
0,009 mmol de sodium par flacon
Pour la liste complète des excipients, voir rubrique 6.1.
Trousse pour préparation radiopharmaceutique.
Poudre blanche lyophilisée.
4.1. Indications thérapeutiques
Ce médicament est à usage diagnostique uniquement.
Après reconstitution avec une solution injectable de pertechnétate (99mTc) de sodium, la solution de Technétium (99mTc) sestamibi est indiquée pour :
· La scintigraphie de perfusion myocardique en vue de la détection et la localisation de la maladie ischémique coronarienne et de l’infarctus du myocarde.
· L’évaluation de la fonction ventriculaire globale (détermination de la fraction d’éjection ventriculaire, de la motricité de la paroi et du volume ventriculaire gauche par méthode de premier passage ou par tomoscintigraphie myocardique synchronisée par l’électrocardiogramme (ECG)).
· La scintigraphie mammaire pour la détection du cancer du sein.
Détection du cancer du sein lorsque la mammographie n’est pas concluante, n’est pas adaptée ou ne donne pas de résultat décisif.
· La localisation de foyers de tissu parathyroïdien hyperactif chez les patients atteints d’hyperparathyroïdie récidivante ou persistante et chez les patients devant bénéficier d’une chirurgie des parathyroïdes.
4.2. Posologie et mode d'administration
Ce produit est pour administration intraveineuse uniquement.
Ce produit doit être reconstitué avant utilisation avec une solution injectable de pertechnétate (99mTc) de sodium (non incluse dans cette trousse).
Les instructions pour la préparation et le contrôle de la pureté radiochimique du radiopharmaceutique sont précisés dans la rubrique 12.
Pour la préparation du patient, voir la rubrique 4.4.
Posologie
Adultes, y compris les patients de plus de 65 ans
Les activités recommandées en injection intraveineuse chez un adulte de masse corporelle moyenne (70 kg) sont les suivantes :
Diagnostic de la diminution de la perfusion coronaire (ischémie myocardique) et de l’infarctus du myocarde :
400 – 900 MBq
Evaluation de la fonction ventriculaire globale :
600 – 800 MBq
Pour l’imagerie mammaire : 740 – 925 MBq
Injectés en embole dans le bras opposé à la lésion
Pour l’imagerie parathyroïdienne : 200 – 750 MBq
Injectés en embole
Patients pédiatriques
Nouveau-nés, nourrissons, enfants, adolescents :
L’utilisation de ce médicament chez l’enfant et l’adolescent devra être décidée à l’issue d’une évaluation soigneuse des indications cliniques et du rapport bénéfice / risque chez cette population. L‘innocuité et l'efficacité chez l’enfant et l’adolescent de moins de 18 ans n'ont pas été complètement établies. Les activités administrées chez l’enfant devront être adaptées conformément aux recommendations du groupe de travail en pédiatrie (Paediatric Task Group) de l’'EANM (1990). Ces activités pourront être déterminées en appliquant les coefficients multiplicateurs suivants aux activités recommandées chez l’adulte sur la base de la masse corporelle :
3 kg = 0,10 22kg = 0,50 42 kg = 0,78
4 kg = 0,14 24 kg = 0,53 44 kg = 0,80
6 kg = 0,19 26 kg = 0,56 46 kg = 0,82
8 kg = 0,23 28 kg = 0,58 48 kg = 0,85
10 kg = 0,27 30 kg = 0,60 50 kg = 0,88
12 kg = 0,32 32 kg = 0,62 52-54 kg = 0,90
14 kg = 0,36 34 kg = 0,64 56-58 kg = 0,92
16 kg = 0,40 36 kg = 0,66 60-62 kg = 0,96
18 kg = 0,44 38 kg = 0,68 64-66 kg = 0,98
20 kg = 0,46 40 kg = 0,70 68 kg = 0,99
Adaptation de la posologie
En cas d’insuffisance rénale, l’exposition aux rayonnements ionisants peut se trouver accrue. Ce paramètre doit être pris en compte lors du calcul de l’activité à administrer.
De façon générale, la détermination de l’activité devra se faire avec prudence chez les patients en insuffisance hépatique, en commençant à la limite inférieure de l’intervalle des posologies recommandées.
Méthode d’administration et acquisition des images
Scintigraphie de perfusion myocardique
Pour le diagnostic de l’ischémie myocardique, deux injections (après stimulation et au repos) sont nécessaires afin de pouvoir différencier les hypofixations myocardiques transitoires des hypofixations persistantes.
Conformément aux recommandations européennes, les activités recommandées pour le diagnostic de l’ischémie myocardique sont de :
· Protocole sur deux jours : 600 – 900 MBq / injection
· Protocole sur un jour : 400 – 500 MBq, lors de la première injection, et trois fois plus pour la seconde injection.
Au total, l’activité administrée ne devra pas dépasser 2 000 MBq dans le cadre d’un protocole sur un jour et 1 800 MBq si le protocole se déroule sur deux jours. Si le protocole a lieu sur un jour, les deux injections (effort et repos) doivent être pratiquées à deux heures d’intervalle au minimum mais l’ordre est indifférent. Après l’injection à l’effort, le patient sera encouragé à poursuivre l’activité physique pendant encore une minute (si possible).
Pour le diagnostic de l’infarctus du myocarde, une injection au repos peut suffire.
Dans tous les cas l’activité administrée doit être aussi faible que possible pour obtenir l’information diagnostique.
Toute injection supérieure aux doses de référence diagnostiques (DRL, Diagnostic Reference Levels) devra être justifiée.
L’acquisition est débutée 60 min environ après l’injection afin de permettre la clairance hépatobiliaire du produit. Un délai plus important peut être nécessaire en cas d’examen au repos ou lors d’examen après stimulation par des vasodilatateurs seuls, en raison d’un risque d’augmentation de l’activité sous diaphragmatique du 99mTc.
Aucune variation significative de la concentration ou de la diffusion du traceur myocardique n’ayant été établie, l’acquisition des images peut être réalisée jusqu’à 6 heures après l’injection.
Pour le diagnostic de l’ischémie myocardique et de l’infarctus du myocarde, l’imagerie planaire ou tomographique peuvent être utilisés. Les deux peuvent être effectuées avec synchronisation ECG.
Pour l’imagerie en mode planaire, les 3 projections planaires standards (antérieure, OAG (Oblique Antérieure Gauche) 45°, OAG 70° ou PG (Profil Gauche)) doivent être utilisées (par exemple 5-10 minutes chacune).
Pour l’imagerie tomographique, en fonction de la dose injectée, chaque projection devrait être acquise en 20-40 secondes.
Pour l’évaluation de la fonction ventriculaire globale, les mêmes techniques et projections standards peuvent être utilisées, que celles validées pour les études de fraction d’éjection au premier passage au Technétium (99mTc) ; les données peuvent être acquises en mode liste ou en mode histogramme par un ordinateur couplé à une caméra à haut taux de comptage. Les protocoles d’imagerie cardiaque synchronisée, sont utilisables pour l’évaluation de la cinétique régionale des parois myocardiques. Cette évaluation doit cependant être exclusivement visuelle, à moins que ces images soient évaluées par un logiciel spécifique.
Pour l’imagerie des seins
Pour être optimale, l’acquisition des images mammaires est débutée 5 à 10 minutes après l’injection, la patiente étant placée en décubitus ventral, le sein examiné pendant librement. Une acquisition de profil de 10 minutes est réalisée pour le sein suspecté de contenir un foyer cancéreux en plaçant le détecteur aussi près que possible du sein.
La patiente est ensuite repositionnée de façon à laisser pendre le sein opposé et une acquisition des images de profil est pratiquée pour ce sein. Ensuite, une image antérieure est réalisée, la patiente étant en décubitus dorsal, les deux bras derrière la tête.
Pour l’imagerie des glandes parathyroïdes
La marche à suivre pour l’imagerie en cas d’hyperparathyroïdisme varie selon qu’une technique par soustraction ou une technique en 2 temps est utilisée. Dans le cas de la technique par soustraction, l’image de la glande thyroïde est également réalisée, à l’aide de 123I ou de 99mTc, conformément aux publications et recommandations en vigueur et aux niveaux d’activité recommandés.
Si la technique en deux temps est employée, 370 à 740 MBq de technétium (99mTc) Sestamibi sont injectés 10 minutes avant de procéder à la première acquisition des images du cou et du thorax. L’acquisition des images du cou et du thorax est renouvelée après une période d’élimination de 1 à 2 heures.
Les images acquises en mode planaire peuvent être complétées par un examen TEMP ou TEMP/TDM lors des temps précoces ou tardifs.
Hypersensibilité à la substance active ou à l'un des excipients.
4.4. Mises en garde spéciales et précautions d'emploi
Grossesse : voir la rubrique 4.6.
Nouveau-nés, nourrissons, enfants, adolescents : voir rubrique 4.2.
D’autres techniques n’impliquant pas de radiations ionisantes doivent être envisagées.
Indication de l’examen
Pour tous les patients, l’activité administrée doit être déterminée en limitant autant que possible la dose de radiation résultante tout en permettant d’obtenir le diagnostic ou le résultat thérapeutique recherché.
Patients en insuffisance rénale, l’exposition aux rayons ionisants peut se trouver accrue. Ce paramètre doit être pris en compte lors du calcul de l’activité à administrer.
Préparation du patient
Afin de diminuer la dose de radiation absorbée par la vessie, une hydratation appropriée du patient doit être encouragée pour permettre des mictions fréquentes dans les heures qui suivent l’administration.
Pour l’imagerie cardiaque :
Le patient doit, si possible, être à jeun depuis au moins quatre heures lors de l’examen. Il est recommandé que le patient absorbe une légère collation composée d’aliments lipidiques ou qu’il boive un ou deux verres de lait après chaque injection et avant l’acquisition des images. Cette précaution facilite la clairance hépatobiliaire du Technétium (99mTc) sestamibi, réduisant ainsi l’activité de l’aire hépatique.
Pour l’épreuve de stimulation, les contre-indications et précautions générales d’évaluation ergométrique et pharmacologique doivent être prises en considération.
En cas de réaction d’hypersensibilité ou de réaction anaphylactique, l’administration du produit médicamenteux doit être immédiatement interrompue et un traitement par voie intraveineuse doit être débuté, si nécessaire. Afin de permettre une prise en charge rapide en cas d’urgence, il conviendra d’avoir à disposition immédiate les médicaments et le matériel nécessaires, notamment des sondes d’intubation trachéale et du matériel de ventilation.
Mises en garde générales :
La réception, l’utilisation et l’administration des radiopharmaceutiques ne peuvent être effectuées que par des personnes autorisées dans des locaux spécialement équipés et habilités. La réception, le stockage, l’utilisation, le transfert et l’élimination sont soumis à la réglementation en vigueur et aux autorisations appropriées des autorités nationales ou locales compétentes. La préparation d’un médicament radiopharmaceutique doit tenir compte des principes de radioprotection et de qualité pharmaceutique. Les précautions appropriées d’asepsie doivent être prises afin de satisfaire aux exigences des Bonnes Pratiques de Fabrication pharmaceutique.
Le contenu des flacons est destiné à être utilisé uniquement pour la préparation de la solution injectable de Technétium (99mTc) Sestamibi et ne doit pas être directement administré au patient sans satisfaire à la procédure de préparation préalable.
En raison du risque potentiel de dommage tissulaire, l’injection extravasculaire de ce produit radioactif doit être strictement évitée.
Mises en garde pour l’imagerie mammaire :
Aucune lésion < 5 mm n’a été décrite grâce à l’utilisation des détecteurs standards.
Mises en gardes liées aux excipients :
Ce produit contient du sodium. La quantité est inférieure à 1 mmol (23 mg) par flacon, c’est-à-dire « pratiquement sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d'interaction médicamenteuse n'a été réalisée à ce jour.
Cependant, les médicaments affectant la fonction myocardique et/ou le débit sanguin peuvent engendrer des résultats négatifs erronés lors du diagnostic des coronaropathies. En conséquence, les traitements co-administrés doivent être pris en compte lors de l'interprétation des résultats de la scintigraphie.
Femmes en âge de procréer
Lorsqu'il est nécessaire d'injecter des médicaments radiopharmaceutiques chez une femme en âge de procréer, l'éventualité d'une grossesse doit être systématiquement envisagée. Tout retard de règles doit laisser supposer la possibilité d'une grossesse jusqu'à preuve du contraire. Au moindre doute, il est important de limiter l'exposition aux radiations au minimum nécessaire pour obtenir les informations cliniques souhaitées.
Les autres techniques possibles n'impliquant pas les rayons ionisants, devront systématiquement être envisagées.
Femmes enceintes
L'activité prévisionnelle reçue par l'utérus à partir d'une injection de 740 MBq au repos serait de 5,8 mGy.
Une dose d'irradiation supérieure à 0,5 mGy (approximativement équivalente à l'exposition naturelle annuelle) peut potentiellement représenter un risque pour le fœtus. Cet examen n'est donc pas recommandé chez les femmes enceintes. Si la décision de réaliser cette procédure chez une femme enceinte est prise, une attention toute particulière doit être donnée à l'optimisation de l'exposition, en tenant compte de l'exposition de la future mère et de l'enfant à venir. La dose chez le fœtus ne doit pas dépasser 1 mGy. Toute réduction de l'activité administrée ne doit pas avoir d'impact sur la probabilité d'obtenir un résultat diagnostique.
Avant toute administration de médicaments radiopharmaceutiques chez une femme qui allaite, il conviendra de s'assurer que l'examen ne peut pas raisonnablement être repoussé jusqu'à la fin de l'allaitement et que le choix de l'agent radiopharmaceutique à utiliser est le plus approprié, en gardant à l'esprit que la radioactivité passe dans le lait maternel. Si l'administration du médicament est jugée nécessaire, l'allaitement devra être suspendu pendant 24 heures après l'injection et le lait produit pendant cette période devra être éliminé.
Les contacts rapprochés avec les nourrissons doivent être évités pendant cette période.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets sur l'aptitude à conduire des véhicules et à utiliser des machines n'ont pas été étudiés.
Le tableau suivant décrit les groupes de fréquence utilisés dans cette rubrique:
|
Très fréquent (≥ 1/10) |
|
Fréquent (≥1/100 à < 1/10) |
|
Peu fréquent |
|
Rare (≥ 1/10 000 à < 1/1 000) |
|
Très rare (< 1/10 000) |
|
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) |
Troubles cardiaques:
Peu fréquent: douleur thoracique/angine de poitrine, anomalies de l'ECG.
Rare: arythmie.
Troubles du système nerveux:
Peu fréquent: céphalées.
Rare: crises convulsives (peu après l'administration), syncope.
Troubles gastro-intestinaux:
Peu fréquent: nausées
Rare: douleur abdominale.
Troubles de la peau et des tissus sous-cutanés:
Rare: réactions allergiques affectant la peau et les muqueuses avec exanthème (prurit, urticaire, œdème), vasodilatation, réactions locales au site d'injection, éruption cutanée non prurigineuse, hypoesthésie et paresthésie, bouffées vasomotrices.
Très rare: D'autres réactions d'hypersensibilité ont été décrites chez des patients prédisposés.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles): érythème polymorphe.
Troubles généraux et anomalies au site d'administration:
Fréquent: immédiatement après l'injection, un goût métallique ou amer, associé dans certains cas à une sécheresse buccale et une altération de la perception olfactive, peut être ressenti.
Rare: fièvre, fatigue, étourdissements, douleur pseudo-arthritique transitoire, dyspepsie.
Troubles du système immunitaire:
Rare: réactions d'hypersensibilité sévères telles que dyspnée, hypotension, bradycardie, asthénie et vomissements (généralement dans les 2 heures suivant l'administration), angiœdème.
Autres troubles:
L'exposition aux radiations ionisantes peut potentiellement induire des cancers ou développer des déficiences héréditaires. La plupart des examens de médecine nucléaire à des fins de diagnostic implique une dose de radiation délivrée (E: dose efficace) faible, inférieure à 20 mSv, ces effets secondaires sont peu probables. Après administration de l'activité maximale recommandée de 2000 MBq de produit (500 MBq au repos et 1500 MBq après épreuve de stimulation), la dose efficace est de 16,3 mSv.
En cas de surdosage du Technétium (99mTc) sestamibi, la dose absorbée par le patient peut être diminuée en favorisant l'élimination du radionucléide en augmentant la fréquence des mictions et défécations.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique: produit radiopharmaceutique à usage diagnostique, composés au Technétium (99mTc)
Code ATC: V 09G A01.
Des effets pharmacodynamiques ne sont pas attendus après administration de la solution de Technétium (99mTc) sestamibi.
Après reconstitution avec du pertechnétate-(99mTc) de sodium, il se forme un complexe technétié Technétium (99mTc) sestamibi dont la structure est la suivante :
(99mTc) (MIBI)6+ (où MIBI = 2-méthoxy isobutyl isonitrile).
Le Technétium (99mTc) Sestamibi, administré aux niveaux d’activité usuels et par la voie usuelle, n’induit aucun effet pharmacodynamique cliniquement détectable.
Généralités
La fixation tissulaire du technétium (99mTc) Sestamibi dépend principalement de la vascularisation, laquelle est généralement accrue dans les tissus cancéreux. En raison de sa nature lipophile et de sa charge positive, le complexe de technétium (99mTc) Sestamibi traverse les membranes cellulaires et se concentre dans le compartiment cellulaire chargé le plus négativement, le compartiment mitochondrial.
Ce processus dépend essentiellement de la vascularisation tissulaire, de son débit sanguin lié à la taille de la cible, de la concentration extracellulaire du Sestamibi, et de l’activité métabolique cellulaire essentiellement mitochondriale.
L’accumulation de Sestamibi dans un territoire ne peut différencier tissu malin et bénin. Cependant les analyses cytologiques/histologiques montrent qu’elle permettrait la distinction entre des lésions de métabolisme mitochondrial différent.
Bien que la détection des cellules cancéreuses soit fondée sur une élévation du potentiel membranaire intrinsèque et de l’activité mitochondriale, la captation cellulaire du Sestamibi n’est pas spécifique de la malignité.
En cas de résistance multidrogue (MDR), l’efflux du Sestamibi est augmenté, de façon corrélée à la surexpression et l’hyperactivité de la Glycoprotéine-P. Ce phénomène pourrait avoir une valeur pronostique, mais pourrait aussi entrainer des résultats faux négatifs s’il n’est pas reconnu.
Indications cardiaques
Le Technétium (99mTc) Sestamibi se liant à la membrane mitochondriale, l’intégrité de celle-ci est une condition importante pour sa liaison intracellulaire.
La fixation myocardique du Technétium (99mTc) Sestamibi est proportionnelle au débit sanguin dans l’intervalle des flux en condition physiologique. La vitesse de fixation passive dépend de la perméabilité membranaire au médicament et de la surface du lit vasculaire à laquelle il est exposé. Le traceur radioactif pénétrant dans la cellule par diffusion, le débit sanguin est sous-estimé pour les valeurs élevées de celui-ci (> 2,0 mL/g/min).
Pour un débit coronarien compris entre 0,52 et 3,19 mL/g/min, l’extraction myocardique du Technétium (99mTc) Sestamibi est en moyenne de 0,38 +/- 0,09. Le Technétium (99mTc) Sestamibi se distribue rapidement dans les tissus à partir du compartiment sanguin. Cinq minutes après l’injection, environ 8% seulement de l’activité injectée est encore en circulation. La redistribution du Technétium (99mTc) Sestamibi au fil du temps est minime. Ceci peut avoir une incidence sur la détection des lésions car le différentiel d’élimination entre le myocarde normal et ischémique peut entraîner une réduction de la taille ou de la sévérité du défaut au fil du temps.
Indications dans les tumeurs mammaires
Une augmentation de la concentration cellulaire du technétium (99mTc) Sestamibi a été mise en évidence dans les cancers mammaires, ceci s’expliquant probablement par la teneur élevée en mitochondries dans les cellules tumorales et le potentiel transmembranaire très élevé des cellules tumorales.
Plusieurs études in vitro ont montré que le technétium (99mTc) Sestamibi était un substrat de la glycoprotéine P. Une corrélation directe entre l’expression de la glycoprotéine P et l’élimination du technétium (99mTc) Sestamibi hors du tissu tumoral a été établie. La surexpression cellulaire de la glycoprotéine P peut entraîner des résultats faux négatifs, en particulier pour les cancers d’un diamètre supérieur à 1 cm.
De plus, la fixation au niveau du tissu mammaire semble dépendre de la phase du cycle.
Indications dans l’hyperparathyroïdie
Dans le cas d’adénome des glandes parathyroïdes, le débit sanguin et le nombre de mitochondries sont accrus. Ceci pourrait expliquer la captation importante et la rétention du technétium (99mTc) Sestamibi dans les adénomes parathyroïdiens. La capacité de localisation du technétium (99mTc) Sestamibi semble dépendre du débit sanguin tissulaire, de la concentration du technétium (99mTc) Sestamibi à laquelle est exposé le tissu et de la taille de l’adénome parathyroïdien.
5.2. Propriétés pharmacocinétiques
Le complexe cationique s'accumule dans le tissu myocardique viable proportionnellement au débit coronaire régional.
Le Technétium (99mTc) Sestamibi est rapidement distribué du sang vers les tissus: 5 minutes après l'injection, seulement 8% de la dose injectée est encore dans la circulation.
L'expérimentation animale a montré que la captation est indépendante de la capacité fonctionnelle de la pompe sodium-potassium.
Indications cardiaques
Le Technétium (99mTc) Sestamibi se liant à la membrane mitochondriale, l'intégrité de celle-ci est une condition importante pour sa liaison intracellulaire.
La fixation myocardique du Technétium (99mTc) Sestamibi est proportionnelle au débit sanguin dans l'intervalle des flux en condition physiologique. La vitesse de fixation passive dépend de la perméabilité membranaire au médicament et de la surface du lit vasculaire à laquelle il est exposé. Le traceur radioactif pénétrant dans la cellule par diffusion, le débit sanguin est sous-estimé pour les valeurs élevées de celui-ci (> 2,0 mL/g/min).
Pour un débit coronarien compris entre 0,52 et 3,19 mL/g/min, l'extraction myocardique du Technétium (99mTc) Sestamibi est en moyenne de 0,38 +/- 0,09. Le Technétium (99mTc) Sestamibi se distribue rapidement dans les tissus à partir du compartiment sanguin. Cinq minutes après l'injection, environ 8% seulement de l'activité injectée est encore en circulation. La redistribution du Technétium (99mTc) Sestamibi au fil du temps est minime. Ceci peut avoir une incidence sur la détection des lésions car le différentiel d'élimination entre le myocarde normal et ischémique peut entraîner une réduction de la taille ou de la sévérité du défaut au fil du temps.
Elimination
La clairance du Technétium (99mTc) sestamibi est principalement hépatobiliaire. L'activité du Technétium (99mTc) sestamibi accumulée dans la vésicule biliaire est retrouvée dans l'intestin dans l'heure qui suit l'injection. Environ 27 % de l'activité injectée est éliminé par voie rénale en 24 heures, et approximativement 33 % est éliminé dans les selles en 48 heures. Cinq minutes après l'injection, environ 8% de la dose injectée reste dans la circulation.
Demi-vie
La demi-vie biologique myocardique du Technétium (99mTc) sestamibi est d'environ 7 heures au repos et après épreuve de stimulation. La demi-vie efficace, qui tient compte des demi-vies biologique et physique (décroissance radioactive), est approximativement de 3 heures.
Fixation myocardique
La fixation myocardique, qui dépend du flux coronaire, est de 1,5% de la dose injectée à l'issue de l'épreuve de stimulation et de 1,2% de la dose injectée au repos.
Le traceur radioactif pénétrant dans la cellule par diffusion, le débit sanguin est sous-estimé pour les valeurs élevées de celui-ci (> 2,0 mL/g/min).
Pour un débit coronarien compris entre 0,52 et 3,19 mL/g/min, l'extraction myocardique du Technétium (99mTc) Sestamibi est en moyenne de 0,38 +/- 0,09.
La perfusion myocardique couplée à la TEMP peut être utilisée pour suivre les changements (ou la stabilité) de la fonction ventriculaire gauche au cours du temps.
5.3. Données de sécurité préclinique
Lors des études de toxicité par administration unique chez la souris, le rat et le chien, la dose la plus faible de produit reconstitué n’ayant pas entraîné la mort était de 7 mg/kg chez le rat femelle (exprimé en Cu(MIBI)4BF4). Cette dose correspond à 500 fois la dose maximale de 0,014 mg/kg chez un homme adulte de 70 kg. La DL50 (calculée par la méthode de Lichfield-Wilcoxon) chez la souris est de 19 mg/kg de masse corporelle, ce qui correspond à 1300 fois la dose maximale humaine.
Aucun signe de toxicité n'a été observé lors de l’administration pendant 28 jours, chez le rat et le chien respectivement, de doses de 0,42 mg/kg (30 fois la dose maximale humaine recommandée) et de 0,07 mg/kg (5 fois la dose maximale humaine recommandée).
Aucune étude sur les fonctions de reproduction n’a été effectuée.
Le Cu(MIBI)4BF4 ne présente pas d’activité mutagène dans les tests d’Ames, de CHO/HPRT et d’échanges des chromatides sœurs.
In vitro à concentration cytotoxique, il entraîne une augmentation du nombre des aberrations chromosomiques lors du test sur des lymphocytes humains. Aucune activité génotoxique n’a été observée lors du test in vivo du micronoyau chez la souris à la dose de 9 mg/kg.
Aucune étude de cancérogénèse n’a été effectuée à propos du Technétium (99mTc) Sestamibi.
Chlorure stanneux dihydraté, chlorhydrate de L-cystéine monohydraté, citrate de sodium dihydraté, D-Mannitol (E 421).
Les réactions de marquages au Technétium dépendent du maintien du niveau stanneux à l'état réduit. De ce fait, la solution injectable de pertechnétate de sodium (99mTc), contenant des oxydants, ne doit pas être utilisée.
Le produit reconstitué, Technétium (99mTc) Sestamibi, doit être utilisé dans les 12 heures suivant la préparation (radiomarquage) et conservé à une température inférieure à 25°C.
D'un point de vue microbiologique, le produit doit être utilisé immédiatement, à moins que la méthode d'ouverture, de marquage et de dilution exclue le risque de contamination microbiologique.
S'il n'est pas utilisé immédiatement, les durées et conditions de conservation avant utilisation sont de la responsabilité de l'utilisateur.
6.4. Précautions particulières de conservation
Conserver au réfrigérateur (2-8°C).
Le contenu des flacons n'est pas radioactif. Toutefois, après marquage par la solution injectable de pertechnétate de sodium (99mTc), le contenu des flacons est radioactif et il convient donc d'appliquer les règles de protection et de sécurité en vigueur.
Pour la conservation du médicament reconstitué, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Flacon de capacité nominale de 10 mL, en verre borosilicaté (Type I Ph.Eur.) fermé par un bouchon en caoutchouc bromobutylé et scellé par une capsule en aluminium.
Les flacons sont emballés dans des boîtes en carton, et des boîtes de 3 ou 6 flacons sont disponibles.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Le contenu des flacons n'est pas radioactif avant préparation. Toutefois, après addition de la solution injectable de pertechnétate de sodium (99mTc), une protection adéquate de la préparation finale doit être maintenue.
Après reconstitution, le contenant et les composants inutilisés doivent être manipulés comme des déchets radioactifs conformément à la réglementation nationale et internationale relative aux produits radiopharmaceutiques.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
NATIONAL CENTER FOR NUCLEAR RESEARCH
Andrzej Soltan 7
05-400 OTWOCK
POLOGNE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 574 397-0 ou 34009 574 397 0 5: 24,675 mg de poudre. Boîte de 3.
· 575 246-6 ou 34009 575 246 6 1: 24,675 mg de poudre. Boîte de 6.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
Les calculs dosimétriques par organes et tissus chez un patient de masse corporelle moyenne (70 kg) après injection intraveineuse de Technétium (99mTc) Sestamibi sont donnés ci-après.
Les données répertoriées ci-dessous sont issues de l’ICRP 80 et ont été calculées sur la base des hypothèses suivantes : après injection intraveineuse, la substance quitte rapidement la circulation sanguine et s’accumule principalement dans les tissus musculaires (y compris myocardique), le foie, les reins et, dans une moindre proportion, dans les glandes salivaires et la thyroïde. Lorsque la substance est injectée dans le cadre d’une épreuve d’effort, la captation par les organes et les tissus est considérablement augmentée. La substance est excrétée à 75% par le foie et à 25% par les reins.
Doses de radiations absorbées après injection du Technétium (99mTc) sestamibi (au repos)
|
|
Estimation des doses de radiations absorbées (mGy/MBq) |
||||
|
Organe |
Adulte |
15 ans |
10 ans |
5 ans |
1an |
|
Surrénales Paroi vésicale Surfaces osseuses Cerveau Seins Paroi de la vésicule biliaire Tube digestif: Estomac Intestin grêle Côlon (Côlon ascendant (Côlon descendant Coeur Reins Foie Poumons Muscles Oesophage Ovaires Pancréas Moelle osseuse Glandes salivaires Peau Rate Testicules Thymus Thyroïde Utérus
Autres organes
Dose efficace (mSv/MBq) |
7,5E-03 1,1E-02 8,2E-03 5,2E-03 3,8E-03 3,9E-02
6,5E-03 1,5E-02 2,4E-02 2,7E-02 1,9E-02 6,3E-03 3,6E-02 1,1E-02 4,6E-03 2,9E-03 4,1E-03 9,1E-03 7,7E-03 5,5E-03 1,4E-02 3,1E-03 6,5E-03 3,8E-03 4,1E-03 5,3E-03 7,8E-03
3,1E-03
9,0E-03 |
9,9E-03 1,4E-02 1,0E-02 7,1E-03 5,3E-03 4,5E-02
9,0E-03 1,8E-02 3,1E-02 3,5E-02 2,5E-02 8,2E-03 4,3E-02 1,4E-02 6,4E-03 3,7E-03 5,7E-03 1,2E-02 1,0E-02 7,1E-03 1,7E-02 4,1E-03 8,6E-03 5,0E-03 5,7E-03 7,9E-03 1,0E-02
3,9E-03
1,2E-02 |
1,5E-02 1,9E-02 1,6E-02 1,1E-02 7,1E-03 5,8E-02
1,5E-02 2,9E-02 5,0E-02 5,7E-02 4,1E-02 1,2E-02 5,9E-02 2,1E-02 9,7E-03 5,4E-03 8,6E-03 1,8E-02 1,6E-02 1,1E-02 2,2E-02 6,4E-03 1,4E-02 7,5E-03 8,6E-03 1,2E-02 1,5E-02
6,0E-03
1,8E-02 |
2,2E-02 2,3E-02 2,1E-02 1,6E-02 1,1E-02 1,0E-01
2,1E-02 4,5E-02 7,9E-02 8,9E-02 6,5E-02 1,8E-02 8,5E-02 3,0E-02 1,4E-02 7,6E-03 1,3E-02 2,5E-02 2,4E-02 3,0E-02 1,5E-02 9,8E-03 2,0E-02 1,1E-02 1,3E-02 2,4E-02 2,2E-02
8,8E-03
2,8E-02 |
3,8E-02 4,1E-02 3,8E-02 2,7E-02 2,0E-02 3,2E-01
3,5E-02 8,0E-02 1,5E-02 1,7E-01) 1,2E-01) 3,0E-02 1,5E-01 5,2E-02 2,5E-02 1,4E-02 2,3E-02 4,5E-02 3,9E-02 4,4E-02 2,6E-02 1,9E-02 3,4E-02 2,1E-02 2,3E-02 4,5E-02 3,8E-02
1,6E-02
5,3E-02 |
Doses de radiations absorbées après injection du Technétium (99mTc) sestamibi (à l’effort)
|
|
Estimation de dose de radiations absorbées (mGy/MBq) |
||||
|
Organe |
Adulte |
15 ans |
10 ans |
5 ans |
1an |
|
Surrénales Paroi vésicale Surfaces osseuses Cerveau Seins Paroi de la vésicule biliaire Tube digestif Estomac Intestin grêle Côlon (Côlon ascendant (Côlon descendant Cœur Reins Foie Poumons Muscles Oesophage Ovaires Pancréas Moelle osseuse Glandes salivaires Peau Rate Testicules Thymus Thyroïde Utérus
Autres organes
Dose efficace (mSv/MBq) |
6,6E-03 9,8E-03 7,8E-03 4,4E-03 3,4E-03 3,3E-02
5,9E-03 1,2E-02 1,9E-02 2,2E-02 1,6E-02 7,2E-03 2,6E-02 9,2E-03 4,4E-03 3,2E-03 4,0E-03 8,1E-03 6,9E-03 5,0E-03 9,2E-03 2,9E-03 5,8E-03 3,7E-03 4,0E-03 4,4E-03 7,2E-03
3,3E-03
7,9E-03 |
8,7E-03 1,3E-02 9,7E-03 6,0E-03 4,7E-03 3,8E-02
8,1E-03 1,5E-02 2,5E-02 2,8E-02 2,1E-02 9,4E-03 3,2E-02 1,2E-02 6,0E-03 4,1E-03 5,5E-03 1,1E-02 9,1E-03 6,4E-03 1,1E-02 3,7E-03 7,6E-03 4,8E-03 5,5E-03 6,4E-03 9,3E-03
4,3E-03
1,0E-02 |
1,3E-02 1,7E-02 1,4E-02 9,3E-03 6,2E-03 4,9E-02
1,3E-02 2,4E-02 4,1E-02 4,6E-02 3,4E-02 1,0E-02 4,4E-02 1,8E-02 8,7E-03 6,0E-03 8,0E-03 1,5E-02 1,4E-02 9,5E-03 1,5E-03 5,8E-03 1,2E-02 7,1E-03 8,0E-03 9,9E-03 1,4E-02
6,4E-03
1,6E-02 |
1,9E-02 2,1E-02 2,0E-02 1,4E-02 9,7E-03 8,6E-02
1,9E-02 3,7E-02 6,4E-02 7,2E-02 5,3E-02 2,1E-02 6,3E-02 2,5E-02 1,3E-02 9,0E-03 1,2E-02 2,3E-02 2,1E-02 1,3E-02 2,0E-03 9,0E-03 1,7E-02 1,1E-02 1,2E-02 1,9E-02 2,0E-02
9,8E-03
2,3E-02 |
3,3E-02 3,8E-02 3,6E-02 2,3E-02 1,8E-02 2,6E-01
3,2E-02 6,6E-02 1,2E-01 1,3E-01) 9,9E-02) 3,5E-02 1,1E-01 4,4E-02 2,3E-02 1,7E-02 2,3E-02 4,0E-02 3,5E-02 2,3E-02 2,9E-03 1,7E-02 3,0E-02 2,0E-02 2,3E-02 3,5E-02 3,5E-02
1,8E-02
4,5E-02
|
La dose efficace pour une activité administrée est calculée selon une fréquence de miction de 3,5 heures chez l’adulte.
La dose efficace résultant de l’administration d’une activité (maximale recommandée) de 2000 MBq de Technétium (99mTc) Sestamibi chez un adulte de 70 kg est d’environ 16,3 mSv (500 MBq au repos et 1500 MBq après épreuve de stimulation).
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Le flacon est reconstitué avec un maximum de 11 GBq de solution injectable de pertechnétate de sodium (99mTc) stérile et sans oxydant. La pureté radiochimique de la solution reconstituée doit être contrôlée avant l'administration au patient selon la méthode recommandée décrite ci-après.
La procédure de radiomarquage doit être réalisée de façon aseptique par des personnes qualifiées et expérimentées.
Comme avec tout produit pharmaceutique, si l'intégrité du flacon est compromise à tout instant de la préparation du produit, celui-ci ne doit pas être utilisé. De plus, avant la procédure de radiomarquage, inspecter soigneusement le flacon pour détecter la présence d'altération, en particulier des fissures. Ne pas utiliser de flacon endommagé car il pourrait se casser pendant la phase de chauffage.
Avant d'ajouter la solution injectable de pertechnétate de sodium (99mTc) au flacon, une étiquette avec la date, l'heure, le degré de radioactivité à ajouter et le symbole de radioactivité doit être fixée au flacon.
Pendant la préparation du produit radiomarqué, les mains de l'opérateur devraient être protégées avec des gants étanches. Enlever l'opercule en plastique du flacon et désinfecter la surface du bouchon avec de l'alcool.
Après achèvement de la procédure de radiomarquage, contrôler le contenu du flacon qui doit être clair, sans particule ni changement de couleur.
Instructions pour la préparation du Technétium (99mTc) sestamibi
Protocole par ébullition
Placer le flacon de lyophylisat dans un conteneur blindé en plomb.
A l'aide d'une seringue stérile munie d'une protection blindée en plomb (perçant le bouchon plastique), introduire 1-5 mL d'éluat [solution stérile et apyrogène de pertechnétate de sodium (99mTc) Ph. Eur.] d'activité maximale 11000 MBq (ou un volume d'éluat ajusté à la radioactivé désirée avec une solution saline physiologique) dans un flacon contenant le Tétrafluoroborate de tétrakis (2-méthoxy isobutyl isonitrile) cuivre (I) lyophilisé.
Sans enlever l'aiguille, soustraire un volume d'air équivalent au volume d'éluat injecté afin de rétablir la pression atmosphérique dans le flacon.
Agiter le flacon jusqu'à dissolution complète du contenu (environ 1 minute).
Enlever le flacon de sa protection de plomb et le placer dans un bain-marie (l'eau doit bouillir pendant la procédure de radiomarquage) porté à ébullition pendant 10-12 minutes. Pendant l'ébullition, faire en sorte que l'eau bouillante n'entre pas en contact avec la capsule en aluminium. Garder le flacon bien droit dans le bain-marie en le plaçant dans un conteneur en plomb, monté dans le bain-marie à l'aide d'un Erlenmeyer ou 4 pinces attachées à la paillasse. Pour une meilleure conduction de la chaleur, quelques mL d'eau peuvent être ajoutés à la protection en plomb.
Retirer le flacon du bain-marie, le placer dans un conteneur en plomb et le laisser refroidir à température ambiante (environ 15 minutes).
La solution obtenue est une solution injectable prête à l'emploi.
Protocole par bloc chauffant
Placer le flacon de lyophilisat dans un conteneur blindé.
A l'aide d'une seringue (perçant le bouchon plastique), introduire 1-5 mL d'éluat [solution pertechnétate de sodium (99mTc)] d'activité maximale 11 000 MBq (ou un volume d'éluat ajusté à la radioactivé désirée avec une solution saline physiologique) dans un flacon contenant le Tétrafluoroborate de tétrakis (2-méthoxy isobutyl isonitrile) cuivre (I) lyophylisé.
Sans enlever l'aiguille, soustraire un volume d'air équivalent afin de rétablir la pression atmosphérique dans le flacon.
Agiter le flacon jusqu'à dissolution complète du contenu (environ 1 minute).
Enlever le flacon de sa protection de plomb, le placer dans le bloc étroit d'un thermocycleur utilisé pour le radiomarquage et lancer le thermocycleur sur auto-programme.
Alternativement, placer le flacon dans un creuset en cuivre (épaisseur des parois ≥ 3 mm pour la radioprotection) et mettre le creuset sur la plaque pré-chauffée programmable du thermocycleur. Programmer le thermocycleur pour un cycle de pré-chauffage à 99°C pendant 5 minutes, suivi par un cycle de chauffage du flacon à 99°C pendant 12 minutes et finalement suivi par un cycle de refroidissement à 25-30°C jusqu'à température constante (approximativement 10 minutes). Les durées mentionnées peuvent différer en fonction des capacités de chauffage/refroidissement du chauffeur utilisé.
La solution obtenue est une solution injectable prête à l'emploi.
Méthodes de contrôle qualité du Technétium (99mTc) Sestamibi
En complément de la méthode recommandée décrite ci-après, la méthode de la monographie n°1926 de la Pharmacopée Européenne [solution injectable de Technétium (99mTc) Sestamibi] peut aussi être utilisée.
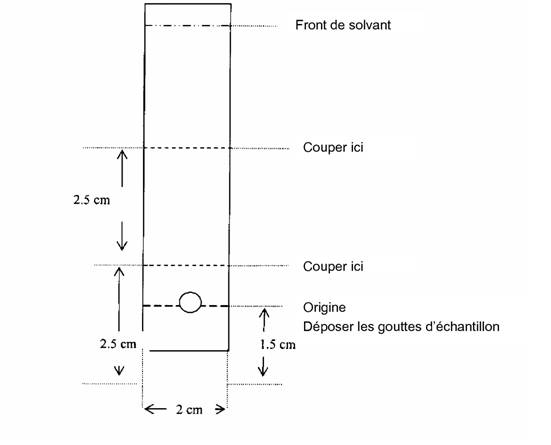
Déposer 2-5 µL de Technétium (99mTc) Sestamibi à 1,5 cm de l'extrémité inférieure d'une plaque chromatographique en oxyde d'aluminium de 2 cm x 8 cm.
Placer la plaque dans la chambre chromatographique et développer les chromatogrammes dans de l'éthanol jusqu'à ce que le front de solvant migre à environ 6 cm de l'origine.
Retirer la plaque et la laisser sécher à l'air libre.
Déterminer la distribution de la radioactivité en balayant le chromatogramme avec un détecteur de radiations adapté ou en coupant la plaque comme montré ci-après (en 3 pièces) et en mesurant l'activité du 99mTc dans chaque pièce à l'aide d'un détecteur de radiations adapté.
Dans ces conditions:
Le radiocolloïde reste à l'origine (Rf = 0,0 - 0,1)
Le pertechnétate libre 99mTcO4- migre avec le solvant (Rf = 0,4 - 0,7).
Le complexe marqué, Technétium (99mTc) Sestamibi, migre avec le solvant.

Calculer la pureté radiochimique qelle que % Tc-99m Sestamibi = activité de la partie supérieure (Rf 0,8 - 1,0) divisée par la somme des activités de toutes les parties multipliée par 100:
![]()
% Tc-99m Sestamibi doit être de 94 %, sinon la préparation doit être éliminée.
Note: ne pas utiliser la préparation si la pureté radiochimique est inférieure à 94 %.
Des informations détaillées sur ce médicament sont disponibles sur le site internet de la France / Agence national de sécurité du médicament et des produits de santé (ANSM).
Liste I.
Médicament réservé à l'usage hospitalier.
Les produits radiopharmaceutiques ne doivent être utilisés que par des personnes qualifiées. Ils ne peuvent être délivrés qu'à des praticiens ayant obtenu l'autorisation spéciale prévue à l'article R1333-24 du code de la Santé publique.