RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 15/02/2016
1. DENOMINATION DU MEDICAMENT
YANIMO RESPIMAT 2,5 microgrammes/2,5 microgrammes/dose, solution à inhaler
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Tiotropium............................................................................................ 2,5 microgrammes
(Sous forme de bromure de tiotropium monohydraté)
Olodatérol............................................................................................ 2,5 microgrammes
(Sous forme de chlorhydrate d’olodatérol)
Pour une dose délivrée
La dose délivrée correspond à la quantité de tiotropium et d’olodatérol délivrée à la sortie de l'embout buccal.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution à inhaler.
Solution à inhaler limpide et incolore.
4. DONNEES CLINIQUES
4.1. Indications thérapeutiques
YANIMO RESPIMAT est indiqué en traitement bronchodilatateur continu destiné à soulager les symptômes des patients adultes présentant une bronchopneumopathie chronique obstructive (BPCO).
4.2. Posologie et mode d'administration
Voie inhalée exclusivement.
La cartouche contenant la solution à inhaler ne peut être inhalée qu’avec l’inhalateur RESPIMAT.
Posologie
Adultes
La posologie recommandée est de 5 microgrammes de tiotropium et de 5 microgrammes d'olodatérol, soit 2 bouffées administrées à l'aide de l'inhalateur RESPIMAT, en 1 prise par jour à heure fixe dans la journée.
Ne pas dépasser la dose recommandée.
Sujets âgés :
YANIMO RESPIMAT peut être utilisé chez les sujets âgés sans adaptation de la posologie.
Insuffisance hépatique et insuffisance rénale :
YANIMO RESPIMAT contient du tiotropium qui est éliminé majoritairement par voie rénale et de l’olodatérol qui est métabolisé majoritairement par le foie.
Insuffisance hépatique :
En cas d’insuffisance hépatique légère à modérée, YANIMO RESPIMAT peut être utilisé sans adaptation de la posologie.
Il n’existe pas de données concernant l’administration de YANIMO RESPIMAT chez les patients présentant une insuffisance hépatique sévère.
Insuffisance rénale :
En cas d’insuffisance rénale, YANIMO RESPIMAT peut être utilisé sans adaptation de la posologie.
Voir les rubriques 4.4 et 5.2. pour ce qui concerne l'insuffisance rénale modérée à sévère (clairance de la créatinine ≤ 50 ml/min).
YANIMO RESPIMAT contient de l’olodatérol. Les données relatives à l'utilisation de l’olodatérol chez les patients présentant une insuffisance rénale sévère sont limitées.
Population pédiatrique :
Il n’y a pas de justification à l'utilisation de YANIMO RESPIMAT chez les enfants de moins de 18 ans dans l’indication de la BPCO.
Mode d’administration
Pour une administration correcte du médicament, le médecin ou un autre professionnel de santé devra s'assurer du bon usage de l’inhalateur par le patient.
|
Instructions destinées aux patients pour l'utilisation et la manipulation
|
|
|
|

|
|
Inhalateur YANIMO RESPIMAT et cartouche YANIMO RESPIMAT
1) Insertion de la cartouche
Les étapes suivantes 1 à 6 sont nécessaires avant la première utilisation :
|
|
|
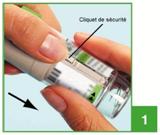
1. En maintenant le capuchon vert clair (A) fermé, appuyer sur le cliquet de sécurité (E) tout en retirant la base transparente(G).
|
|

|
2. Sortir la cartouche (H) de la boîte. Pousser l'extrémité la plus étroite de la cartouche dans l'inhalateur jusqu'à ce qu'elle s'enclenche.
|
|

|
Pousser fermement le fond de la cartouche contre une surface solide afin qu'elle pénètre au maximum dans l’inhalateur.
La cartouche dépassera de l’inhalateur, la bande argentée du bas de la cartouche étant toujours visible.
Ne pas retirer la cartouche lorsqu’elle a été insérée dans l’inhalateur.
|
|
|
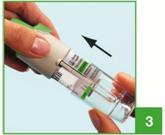
3. Remettre en place la base transparente (G).
Ne plus retirer la base transparente.
|
|
2) Préparation de l’inhalateur YANIMO RESPIMAT pour la première utilisation
|
|

|
4. Maintenir l'inhalateur YANIMO RESPIMAT verticalement, avec le capuchon vert clair (A) fermé. Tourner la base (G) dans la direction des flèches noires imprimées sur l'étiquette jusqu'à entendre un déclic (un demi-tour).
|
|

|
5. Ouvrir le capuchon vert clair (A) jusqu'à ce qu'il s'ouvre complètement avec un claquement.
|
|

|
6. Diriger l'inhalateur YANIMO RESPIMAT en direction du sol. Puis appuyer sur le bouton de libération de la dose (D).
Fermer le capuchon vert clair (A).
Répéter les étapes 4, 5 et 6 jusqu'à ce qu'un nuage soit visible.
Puis répéter les étapes 4, 5 et 6 trois autres fois pour que l'inhalateur soit prêt à être utilisé.
L'inhalateur YANIMO RESPIMAT est maintenant prêt à l'emploi.
Ces étapes ne modifient pas le nombre de doses disponibles. Après cette préparation, l'inhalateur YANIMO RESPIMAT pourra délivrer 60 bouffées (correspondant à 30 jours de traitement.)
|
|
 Utilisation quotidienne de votre inhalateur YANIMO RESPIMAT Utilisation quotidienne de votre inhalateur YANIMO RESPIMAT
L'inhalateur sera utilisé 1 SEULE FOIS PAR JOUR
Lors de chaque utilisation, prendre DEUX BOUFFÉES.
|
|

|
I. Maintenir l'inhalateur YANIMO RESPIMAT en position verticale, avec le capuchon vert clair (A) fermé, afin d'éviter la libération accidentelle d'une dose. Tourner la base (G) dans la direction des flèches noires imprimées sur l'étiquette jusqu'à entendre un déclic (un demi-tour).
|
|
|
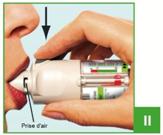
II. Ouvrir le capuchon vert clair (A) jusqu'à ce qu'il s'ouvre complètement (avec un claquement). Expirer lentement et complètement, puis fermer les lèvres autour de l'extrémité de l'embout buccal sans recouvrir les prises d'air (C). Diriger l'inhalateur YANIMO RESPIMAT vers le fond de la gorge.
Tout en inspirant lentement et profondément par la bouche, appuyer sur le bouton de libération de la dose (D), et continuer d'inspirer lentement aussi longtemps que possible. Retenir sa respiration pendant 10 secondes ou aussi longtemps que cela est possible sans être gêné.
|
|
|
|
III. Répéter les étapes I et II afin de recevoir la quantité recommandée de médicament (2 bouffées).
YANIMO RESPIMAT ne sera utilisé qu'1 SEULE FOIS DANS LA JOURNEE pour administrer les 2 bouffées.
Laisser le capuchon vert clair fermé jusqu'à l'utilisation le jour suivant.
Si l'inhalateur YANIMO RESPIMAT n'a pas été utilisé pendant plus de 7 jours, libérer une bouffée vers le sol.
Si l'inhalateur YANIMO RESPIMAT n'a pas été utilisé pendant plus de 21 jours, reprendre les étapes 4 à 6 jusqu'à ce qu'un nuage soit visible. Puis, répéter les étapes 4 à 6 trois autres fois.
|
|
Quand se procurer un nouvel inhalateur YANIMO RESPIMAT ?
|
|

|
L'inhalateur YANIMO RESPIMAT contient 60 bouffées (correspondant à 30 jours de traitement). L'indicateur de doses montre approximativement la quantité de médicament restant dans l'inhalateur. Lorsque l'indicateur entre dans la zone rouge de l'échelle, il reste suffisamment de médicament pour environ sept jours de traitement (14 bouffées). C'est le moment où le patient devra renouveler la prescription pour un nouvel inhalateur YANIMO RESPIMAT.
Lorsque l'indicateur de doses atteint la fin de l'échelle rouge (c'est-à-dire que l'ensemble des 60 bouffées auront été administrées), l'inhalateur YANIMO RESPIMAT se bloque automatiquement – aucune dose ne pourra plus être libérée. A ce stade, la base ne peut plus être tournée.
L'inhalateur YANIMO RESPIMAT doit être jeté au plus tard après trois mois d’utilisation, même si la totalité du médicament n'a pas été utilisée.
|
|
Comment entretenir l’inhalateur ?
Nettoyer l'embout buccal, y compris la partie métallique à l'intérieur de l'embout buccal, avec un linge ou un tissu humide uniquement, au moins une fois par semaine.
Une décoloration mineure de l'embout buccal n'affecte pas les performances de l'inhalateur YANIMO RESPIMAT.
Le cas échéant, essuyer l'extérieur de l'inhalateur YANIMO RESPIMAT avec un linge humide.
|
4.3. Contre-indications
Hypersensibilité (allergie) au tiotropium ou à l’olodatérol ou à l’un des excipients (voir rubrique 6.1).
Antécédent d’hypersensibilité (allergie) à l'atropine ou à ses dérivés, tels que par exemple l'ipratropium ou l'oxitropium.
4.4. Mises en garde spéciales et précautions d'emploi
Asthme
YANIMO RESPIMAT ne doit pas être utilisé chez les patients asthmatiques. L’efficacité et la sécurité de YANIMO RESPIMAT n'ont pas été étudiées chez les patients asthmatiques.
Utilisation aigüe : non recommandée :
YANIMO RESPIMAT n’est pas indiqué en tant que médicament de "secours" pour le traitement des épisodes aigus de bronchospasme.
Bronchospasme paradoxal
Comme avec tout médicament administré par voie inhalée, l'inhalation de YANIMO RESPIMAT peut entraîner un bronchospasme paradoxal pouvant engager le pronostic vital. En cas de bronchospasme paradoxal, le traitement par YANIMO RESPIMAT doit être arrêté immédiatement et remplacé par un autre traitement.
Effets anticholinergiques liés au tiotropium en cas de glaucome à angle fermé, d'hypertrophie de la prostate ou de rétrécissement du col de la vessie
En raison de l’activité anticholinergique du tiotropium, YANIMO RESPIMAT doit être utilisé avec prudence en cas de glaucome à angle fermé, d'hypertrophie de la prostate ou de rétrécissement du col de la vessie.
Symptômes oculaires
Il conviendra d’avertir les patients du risque de déclenchement ou d’aggravation d'un glaucome à angle fermé, de douleur ou gêne oculaire, de vision trouble transitoire avec halo visuel coloré associé à une rougeur et un œdème cornéo-conjonctival, en cas de projection intraoculaire du produit. Si un ou plusieurs de ces symptômes oculaires apparaîssent, les patients doivent interrompre l’utilisation du bromure de tiotropium et consulter immédiatement un médecin.
Caries dentaires
La sécheresse buccale observée avec les traitements anticholinergiques en général, peut à long terme favoriser la survenue de caries dentaires.
Patients présentant une insuffisance rénale
Les concentrations plasmatiques de tiotropium augmentent en cas d’altération de la fonction rénale ; par conséquent, chez les patients atteints d'insuffisance rénale modérée à sévère (clairance de la créatinine £ 50 ml/min), YANIMO RESPIMAT ne sera utilisé que si le bénéfice attendu dépasse le risque potentiel. A ce jour, il n'y a pas d'expérience à long terme chez les patients présentant une insuffisance rénale sévère (voir rubrique 5.2).
Effets cardiovasculaires
Les essais cliniques ont exclu les patients ayant des antécédents d'infarctus du myocarde survenu dans l'année précédente, une arythmie cardiaque instable ou susceptible d'engager le pronostic vital, des antécédents d'hospitalisation pour insuffisance cardiaque au cours des 12 derniers mois ainsi que les patients présentant des épisodes de tachycardie paroxystique (> 100 battements par minute). L'expérience dans ces situations est donc limitée et la prudence est requise pour ce type de patients. Comme les autres agonistes β2-adrénergiques, l’olodatérol peut provoquer chez certains patients des effets cardiovasculaires cliniquement significatifs, se manifestant par des augmentations de la fréquence cardiaque, de la pression artérielle et/ou des symptômes cliniques. Dans ce cas, il peut être nécessaire d’interrompre le traitement. De plus, des modifications de l’électrocardiogramme (ECG) telles qu’un aplatissement de l’onde T et un sous-décalage du segment ST ont été rapportées avec les agonistes β-adrénergiques, mais la signification clinique de ces observations est inconnue.
Les agonistes β2-adrénergiques de longue durée d’action doivent être administrés avec prudence chez les patients présentant des troubles cardiovasculaires, notamment une cardiopathie ischémique, une décompensation cardiaque sévère, une arythmie cardiaque, une cardiomyopathie obstructive hypertrophique, une hypertension et un anévrisme, chez les patients présentant des épisodes convulsifs ou une thyrotoxicose, ainsi que chez les patients présentant un allongement de QT connu ou suspecté (par exemple QT > 0,44 s) et chez les patients développant des réactions indésirables aux amines sympathomimétiques.
Hypokaliémie
Les agonistes β2-adrénergiques peuvent induire chez certains patients une hypokaliémie significative, qui peut entraîner des effets indésirables cardiovasculaires. La diminution de la kaliémie est généralement transitoire et ne nécessite pas de supplémentation. Chez les patients présentant une BPCO sévère, l'hypokaliémie peut être potentialisée par l'hypoxie et par des traitements concomitants (voir rubrique 4.5), ce qui augmente le risque de survenue d'arythmies cardiaques.
Hyperglycémie
L'inhalation de doses élevées d'agonistes β2-adrénergiques peut entraîner des augmentations de la glycémie.
Anesthésie
La prudence est recommandée si une intervention chirurgicale nécessitant l'utilisation d'anesthésiques à base d'hydrocarbures halogénés est prévue, en raison de l'augmentation du risque de survenue d'effets indésirables cardiaques des bronchodilatateurs bêta agonistes.
YANIMO RESPIMAT ne doit pas être utilisé en association avec d'autres médicaments contenant des agonistes β 2-adrénergiques de longue durée d'action.
Il convient d'informer les patients qui prenaient des agonistes β2-adrénergiques de courte durée d’action en inhalation de manière régulière (par exemple quatre fois par jour) de ne plus les utiliser que "à la demande" pour le soulagement des symptômes respiratoires aigus.
La posologie de YANIMO RESPIMAT ne doit pas dépasser une prise par jour.
Hypersensibilité
Des réactions d'hypersensibilité immédiates (allergie) peuvent survenir après l'administration de YANIMO RESPIMAT.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Il n’a pas été effectué d’étude spécifique d’interaction in vivo entre YANIMO RESPIMAT et d’autres médicaments. Néanmoins, il n’a pas été rapporté de manifestation clinique évoquant une interaction médicamenteuse lors de l’administration concomitante d’autres médicaments habituellement utilisés dans la bronchopneumopathie chronique obstructive (BPCO), notamment les bronchodilatateurs sympathomimétiques de courte durée d’action et les corticostéroïdes inhalés.
+ Médicaments anticholinergiques
L’administration concomitante de bromure de tiotropium (une des substances de YANIMO RESPIMAT), avec d'autres médicaments à activité anticholinergique n'a pas été étudiée et n’est par conséquent, pas recommandée.
+ Médicaments adrénergiques
L'administration concomitante d'autres médicaments adrénergiques (seuls ou dans le cadre d'un traitement en association) peut potentialiser les effets indésirables de YANIMO RESPIMAT.
+ Dérivés xanthiques, stéroïdes ou diurétiques
Un traitement concomitant par des dérivés xanthiques, des stéroïdes ou des diurétiques non épargneurs du potassium est susceptible de potentialiser les effets hypokaliémiants des agonistes adrénergiques (voir rubrique 4.4).
+ Bêta-bloquants
Les bêta-bloquants peuvent diminuer ou antagoniser l'effet de l’olodatérol. L'utilisation de bêta-bloquants cardiosélectifs pourra être envisagée mais avec prudence.
+ Inhibiteurs de la monoamine oxydase (IMAO) et antidépresseurs tricycliques, médicaments qui prolongent l'intervalle QTc
Les inhibiteurs de la monoamine oxydase ou les antidépresseurs tricycliques, ou d'autres médicaments connus pour prolonger l'intervalle QTc, peuvent potentialiser l'action de YANIMO RESPIMAT sur le système cardio-vasculaire.
Interactions pharmacocinétiques
Il n'a pas été observé d'effet significatif sur l'exposition systémique à l'olodatérol dans les études d’interaction pharmacocinétique étudiant l'effet de l'administration concomitante de fluconazole, utilisé comme modèle d’inhibiteur du CYP 2C9.
L'administration concomitante du kétoconazole qui est un inhibiteur puissant de la P‑gp et du CYP3A4, a augmenté l'exposition systémique à l’olodatérol d’environ 70%. Il n'y a pas lieu d'envisager une adaptation de la dose de YANIMO RESPIMAT.
Les études conduites in vitro n'ont pas mis en évidence d'effet inhibiteur de l'olodatérol sur les enzymes du CYP ni sur les transporteurs des médicaments aux concentrations plasmatiques atteintes en pratique clinique.
4.6. Grossesse et allaitement
Grossesse
Tiotropium
Les données disponibles sur l’utilisation du tiotropium chez la femme enceinte sont très limitées. Les études effectuées chez l’animal n’ont pas mis en évidence d’effets délétères directs ou indirects sur la reproduction à des doses cliniquement significatives (voir rubrique 5.3).
Olodatérol
Il n'existe pas de données cliniques concernant l'utilisation de l’olodatérol pendant la grossesse. Les données issues des études effectuées chez l'animal avec l’olodatérol ont mis en évidence des effets caractéristiques des agonistes β-adrénergiques à des doses plusieurs fois supérieures aux doses thérapeutiques (voir rubrique 5.3).
Par précaution, il est préférable d'éviter l'utilisation de YANIMO RESPIMAT pendant la grossesse.
Comme les autres agonistes β2-adrénergiques, l’olodatérol, une des substances de YANIMO RESPIMAT, peut inhiber le travail au moment de l'accouchement par effet relaxant sur le muscle lisse utérin.
Allaitement
Aucune donnée clinique n'est disponible concernant des femmes exposées au tiotropium et/ou à l'olodatérol pendant l'allaitement.
Dans les études animales menées avec le tiotropium et l’olodatérol, les substances et/ou leurs métabolites ont été détectés dans le lait de rates allaitantes, mais l’excrétion du tiotropium et/ou de l’olodatérol dans le lait maternel humain n’a pas été établie.
La décision d'interrompre/continuer l'allaitement ou bien le traitement par YANIMO RESPIMAT doit prendre en compte le bénéfice de l'allaitement pour l'enfant par rapport au bénéfice du traitement pour la femme.
Fertilité
Aucune donnée clinique sur la fertilité n'est disponible pour le tiotropium, l’olodatérol ou l’association des deux substances. Les études précliniques réalisées avec le tiotropium ou l’olodatérol séparemment n’ont pas montré d’effets toxiques sur la fertilité (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets sur l'aptitude à conduire des véhicules et à utiliser des machines n'ont pas été étudiés.
Cependant, il convient d'avertir les patients que des sensations vertigineuses ou une vision trouble ont été rapportées lors de l’utilisation de YANIMO RESPIMAT et qu'ils doivent donc être prudents s'ils conduisent ou utilisent des machines. Si un patient présente de tels symptômes, il doit éviter de réaliser des tâches qui peuvent être dangereuses, comme conduire ou utiliser des machines.
4.8. Effets indésirables
a. Résumé du profil de sécurité
La plus grande partie des effets indésirables rapportés peut être attribuée aux propriétés anticholinergiques du bromure de tiotropium ou aux propriétés β2-adrénergiques de l’olodatérol, qui sont les substances actives de YANIMO RESPIMAT.
b. Tableau résumé des effets indésirables
Les fréquences des effets indésirables présentées ci-dessous sont basées sur l'incidence des effets indésirables (c'est-à-dire les événements imputables à YANIMO RESPIMAT) observés dans le groupe tiotropium 5 microgrammes/olodatérol 5 microgrammes (1 302 patients), regroupés à partir de 5 études cliniques conduites en groupes parallèles contrôlées contre comparateur actif ou placebo, incluant des patients présentant une BPCO, dont les durées de traitement étaient comprises entre 4 et 52 semaines.
Les effets indésirables rapportés dans tous les essais cliniques avec Yanimo Respimat sont présentés ci-dessous par classe de système organe.
Tous les effets indésirables rapportés antérieurement avec une des substances sont également inclus.
La fréquence est définie selon la classification conventionnelle :
Très fréquent (≥1/10) ; fréquent (≥1/100 à <1/10) ; peu fréquent (≥1/1000 à <1/100) ; rare (≥1/10 000 à <1/1000) ; très rare (<1/10 000) ; non déterminé (fréquence de survenue ne pouvant être estimée sur la base des données disponibles).
|
Système classe d’organes
|
Effet indésirable
|
Fréquence
|
|
Infections et infestations
|
Rhinopharyngite
|
Rare
|
|
Troubles du métabolisme et de la nutrition
|
Déshydratation
|
Non déterminée
|
|
Troubles du système nerveux
|
Sensations vertigineuses
|
Peu fréquent
|
|
|
Insomnie
|
Peu fréquent
|
|
|
Céphalées
|
Peu fréquent
|
|
Troubles oculaires
|
Vision trouble
|
Rare
|
|
|
Glaucome
|
Non déterminée
|
|
|
Augmentation de la pression intraoculaire
|
Non déterminée
|
|
Troubles cardiaques
|
Fibrillation auriculaire
|
Peu fréquent
|
|
|
Palpitations
|
Peu fréquent
|
|
|
Tachycardie
|
Peu fréquent
|
|
|
Tachycardie supraventriculaire
|
Rare
|
|
Troubles vasculaires
|
Hypertension
|
Peu fréquent
|
|
Troubles respiratoires, thoraciques et médiastinaux
|
Toux
|
Peu fréquent
|
|
|
Dysphonie
|
Rare
|
|
|
Epistaxis
|
Rare
|
|
|
Laryngite
|
Rare
|
|
|
Pharyngite
|
Rare
|
|
|
Bronchospasme
|
Non déterminée
|
|
|
Sinusite
|
Non déterminée
|
|
Troubles gastro-intestinaux
|
Sécheresse buccale
|
Fréquent
|
|
|
Constipation
|
Peu fréquent
|
|
|
Gingivite
|
Rare
|
|
|
Nausées
|
Rare
|
|
|
Candidose oropharyngée
|
Rare
|
|
|
Occlusion intestinale
Iléus paralytique
|
Non déterminée
|
|
|
Caries dentaires
|
Non déterminée
|
|
|
Dysphagie
|
Non déterminée
|
|
|
Reflux gastro-œsophagien
|
Non déterminée
|
|
|
Glossite
|
Non déterminée
|
|
|
Stomatite
|
Non déterminée
|
|
Troubles cutanés et du tissu sous-cutané,trouble du système immunitaire
|
Angio-œdème
|
Rare
|
|
|
Urticaire
|
Rare
|
|
|
Hypersensibilité
|
Rare
|
|
|
Prurit
|
Rare
|
|
|
Réaction anaphylactique
|
Non déterminée
|
|
|
Eruption cutanée
|
Non déterminée
|
|
|
Sécheresse cutanée
|
Non déterminée
|
|
|
Infection cutanée/ulcération cutanée
|
Non déterminée
|
|
Troubles musculo-squelettiques et systémiques
|
Douleurs dorsales1
|
Rare
|
|
|
Arthralgie
|
Rare
|
|
|
Gonflement articulaire
|
Non déterminée
|
|
Troubles rénaux et des voies urinaires
|
Rétention d’urine
|
Rare
|
|
|
Dysurie
|
Rare
|
|
|
Infection urinaire
|
Non déterminée
|
1 Effet indésirable rapporté avec l’association YANIMO RESPIMAT mais pas avec les substances actives prises séparemment.
c. Description d’effets indésirables sélectionnés
Yanimo RESPIMAT associe les propriétés anticholinergiques du tiotropium et ß2-adrénergiques de l’olodatérol.
Profil d’effets indésirables des anticholinergiques
Dans les études cliniques à long terme de 52 semaines utilisant YANIMO RESPIMAT, l’effet indésirable lié aux effets anticholinergiques le plus fréquemment observé était la sécheresse buccale avec environ 1,7% des patients traités par YANIMO RESPIMAT et respectivement 2,7% et 1% des patients dans les groupes tiotropium 5 microgrammes et olodatérol 5 microgrammes. La sécheresse buccale a entraîné l’arrêt du traitement chez 1 patient sur 1 029 (0,1%) traités par YANIMO RESPIMAT.
Les effets indésirables graves liés aux effets anticholinergiques incluent : glaucome, constipation, occlusion intestinale y compris iléus paralytique et rétention urinaire.
Profil d’effets indésirables des agonistes bêta-adrénergiques
Dans les études cliniques à long terme de 52 semaines utilisant YANIMO RESPIMAT, les effets indésirables liés aux effets ß-adrénergiques les plus fréquemment observés étaient les palpitations, une tachycardie et une hypertension.
L'olodatérol est un agoniste β2-adrénergique de longue durée d'action. De ce fait, la possibilité d'apparition d'autres effets indésirables liés à la classe des agonistes β2-adrénergiques non listés ci-dessus doit être prise en compte, par exemple, arythmie, ischémie myocardique, angor, hypotension, tremblement, nervosité, spasmes musculaires, fatigue, malaise, hypokaliémie, hyperglycémie et acidose métabolique.
d. Autres populations particulières
Le risque de survenue des effets anticholinergiques peut augmenter avec l’âge.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.ansm.sante.fr.
4.9. Surdosage
Les données concernant le surdosage avec Yanimo Respimat sont limitées. Yanimo Respimat a été étudié aux doses allant jusqu'à 5 microgrammes (tiotropium) /10 microgrammes (olodaterol) chez des patients présentant une BPCO et jusqu'à 10 microgrammes (tiotropium)/40 microgrammes (olodaterol) chez des sujets sains et aucun effet cliniquement significatif n'a été observé. Un surdosage pourrait entraîner une exagération des effets anti-muscariniques liés au tiotropium et/ou des effets des agonistes β2 liés à l’olodaterol.
Symptômes
Surdosage lié aux effets anticholinergiques du tiotropium
L'administration de doses élevées de bromure de tiotropium peut déclencher l'apparition de signes et symptômes de type anticholinergique.
Cependant, aucun effet indésirable anticholinergique systémique n’a été observé après l’inhalation d’une dose unique allant jusqu’à 340 microgrammes de bromure de tiotropium administrée chez les volontaires sains. De plus, aucun événement indésirable pertinent, en plus de la sécheresse de la bouche, de la gorge et de la muqueuse nasale, n’a été observé après 14 jours de tiotropium en solution pour inhalation administré chez des volontaires sains à une dose allant jusqu'à 40 microgrammes, à l'exception d’une diminution importante du flux salivaire à partir du 7ème jour.
Surdosage lié aux effets ß2-agonistes de l’olodatérol
Un surdosage en olodatérol peut entraîner une exacerbation des effets spécifiques des agonistes β2‑adrénergiques, tels que : ischémie myocardique, hypertension ou hypotension, tachycardie, arythmies, palpitations, sensations vertigineuses, nervosité, insomnies, anxiété, céphalées, tremblements, sécheresse buccale, spasmes musculaires, nausées, fatigue, malaise, hypokaliémie, hyperglycémie et acidose métabolique.
Conduite à tenir en cas de surdosage
Le traitement par YANIMO RESPIMAT doit être arrêté. Un traitement symptomatique et une surveillance sont indiqués. En cas de signes de gravité, les patients doivent être hospitalisés. L'utilisation de bêta-bloquants cardiosélectifs peut être envisagée, mais avec une extrême prudence car l'administration d'un bêta-bloquant peut favoriser le bronchospasme.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : médicaments pour les syndromes obstructifs des voies aériennes ; Médicaments adrénergiques en association avec des médicaments anticholinergiques
Code ATC : R03AL06
Mécanisme d’action
YANIMO RESPIMAT est une solution pour inhalation contenant l'association de tiotropium, un antagoniste spécifique des récepteurs muscariniques de longue durée d’action (LAMA) et d’olodatérol, un agoniste sélectif des récepteurs bêta2-adrénergiques de longue durée d’action (LABA), délivrée par l’inhalateur Respimat.
Les deux substances actives exercent un effet bronchodilatateur additif lié à leurs deux modes d’action différents. Dans la mesure où les récepteurs muscariniques semblent plus nombreux dans les voies aériennes centrales, et que les récepteurs bêta2-adrénergiques ont un niveau d’expression plus élevé dans les voies aériennes périphériques, l’association du tiotropium et de l’olodatérol devrait apporter une bronchodilatation optimale dans toutes les régions des poumons.
Tiotropium
Le bromure de tiotropium est un antagoniste spécifique de longue durée d’action des récepteurs muscariniques, qui montre une affinité similaire pour les sous-types de récepteurs muscariniques M1 à M5. Dans les voies aériennes, le bromure de tiotropium se fixe de façon compétitive et réversible sur les récepteurs M3 des muscles lisses bronchiques, et inhibe les effets cholinergiques (bronchonconstriction) de l’acétylcholine, entraînant ainsi une relaxation des muscles lisses bronchiques. L’effet est dose-dépendant et persiste plus de 24 heures. Le bromure de tiotropium est un anticholinergique de type ammonium quaternaire, et il exerce une action topique (bronchique) sélective lorsqu’il est administré par inhalation, offrant ainsi une marge thérapeutique acceptable avant l’apparition des effets anticholinergiques systémiques.
Olodatérol
L'olodatérol présente une affinité et une sélectivité élevées pour les récepteurs β2-adrénergiques humains.
Des études in vitro ont montré que l'olodatérol exerce une activité agoniste plus élevée sur les récepteurs β2-adrénergiques que sur les récepteurs β1-adrénergiques (241 fois supérieure) ainsi que sur les récepteurs β3- adrénergiques (2 299 fois supérieure).
L'olodatérol, administré par voie inhalée, exerce un effet local par liaison et activation des récepteurs β2-adrénergiques.
L'activation de ces récepteurs au niveau des voies aériennes respiratoires entraîne une stimulation de l'adénylcyclase intracellulaire qui est une enzyme impliquée dans la synthèse du 3',5'‑adénosine monophosphate cyclique (cAMP). Des taux élevés de cAMP entraînent une bronchodilatation par relaxation des muscles lisses des voies respiratoires.
Le profil des caractéristiques non-cliniques de l'olodatérol est celui d'un agoniste sélectif des récepteurs β2- adrénergiques sélectif de longue durée d'action (LABA) ayant un début d'action rapide et une durée d'action d'au moins 24 heures.
Les récepteurs β-adrénergiques sont divisés en trois catégories : les récepteurs β1-adrénergiques, exprimés principalement au niveau du muscle cardiaque, les récepteurs β2-adrénergiques exprimés principalement au niveau des muscles lisses des voies respiratoires et les récepteurs β3-adrénergiques exprimés principalement au niveau du tissu adipeux. L'action des agonistes β2 entraîne un effet bronchodilatateur. Bien que le récepteur β2 soit le principal récepteur β-adrénergique présent au niveau des muscles lisses des voies respiratoires, il est aussi présent à la surface de diverses autres cellules telles que les cellules épithéliales et endothéliales pulmonaires, ainsi qu'au niveau cardiaque. L'activité des récepteurs β2 cardiaques n'est pas connue avec précision mais du fait de leur présence, la possibilité que même des agonistes β2-adrénergiques hautement sélectifs puissent entraîner des effets cardiaques n'est pas exclue.
Effets sur l'électrophysiologie cardiaque
Tiotropium
Dans une étude spécifique sur l’intervalle QT et portant sur 53 volontaires sains, l’administration de tiotropium 18 µg et 54 µg (soit 3 fois la dose thérapeutique) pendant 12 jours n’a pas allongé significativement l’intervalle QT sur l’électrocardiogramme (ECG).
Olodatérol
L'effet de l'olodatérol sur l'intervalle QT/QTc sur I'ECG a été étudié chez 24 hommes et femmes volontaires sains dans une étude en double aveugle randomisée, contrôlée contre placebo et contre comparateur actif (moxifloxacine). L'inhalation de doses uniques de 10, 20, 30 et 50 microgrammes d'olodaterol, a entraîné, sur la période de 20 minutes à 2 heures suivant l'administration, une augmentation dose-dépendante moyenne de l'espace QT par rapport à la valeur initiale de 1,6 ms (10 microgrammes d'olodatérol) à 6,5 ms (50 microgrammes d'olodatérol) comparativement au placebo. La limite supérieure des intervalles de confiance à 90 % bilatéraux de l'espace QT corrigé (QTc) était inférieure à 10 ms pour toutes les doses.
Les effets de 5 microgrammes et de 10 microgrammes d’olodatérol sur la fréquence et le rythme cardiaques ont été évalués par électrocardiogramme (ECG) continu sur 24 heures (Holter) dans un sous-groupe de 772 patients issus des essais de phase Ill de 48 semaines contrôlés contre placebo. Il n'a pas été observé d’influence de la dose ou du temps pour les modifications moyennes de la fréquence cardiaque ou pour la survenue d'extrasystoles. Il n'a pas été mis en évidence de différence significative sur la survenue d'extrasystoles entre l'état initial et la fin de l'administration de l'olodatérol 5 microgrammes, de l'olodatérol 10 microgrammes et du placebo.
Yanimo Respimat
Deux études randomisées et en double aveugle de 52 semaines effectuées avec YANIMO RESPIMAT ont inclus un total de 5 162 patients présentant une bronchopneumopathie chronique obstructive (BPCO). Dans une analyse groupée, la proportion de patients présentant une variation de l’intervalle QTcF corrigé (correction de Fredericia) > 30 ms par rapport à la valeur initiale, dans les 40 minutes suivant l’administration de la dose aux jours 85, 169 et 365, ont été respectivement les suivants : 3,1 % ; 4,7 % et 3,6 % pour le groupe Yanimo Respimat contre 4,1 % ; 4,4 % et 3,6 % pour le groupe olodatérol 5 microgrammes et 3,4 % ; 2,3 % et 4,6 % pour le groupe tiotropium 5 microgrammes.
Données cliniques d’efficacité et de sécurité
Le programme de développement clinique de phase III de Yanimo Respimat a inclus trois études randomisées et en double aveugle :
· deux études ayant un protocole identique, conduites en groupes parallèles pendant 52 semaines comparant YANIMO RESPIMAT au tiotropium 5 microgrammes et à l’olodatérol 5 microgrammes (1 029 patients ont reçu Yanimo Respimat) [Études 1 et 2] ;
· une étude en plan croisé de 6 semaines comparant YANIMO RESPIMAT au tiotropium 5 microgrammes et à l’olodatérol 5 microgrammes et un placebo (139 patients ont reçu YANIMO RESPIMAT) [Étude 3].
Dans ces études, le tiotropium 5 microgrammes, l’olodatérol 5 microgrammes et le placebo, étaient administrés avec l’inhalateur Respimat.
Caractéristiques des patients
La majorité des 5 162 patients recrutés globalement dans les études de 52 semaines [Études 1 et 2] étaient des hommes (73 %), blancs (71 %) ou asiatiques (25 %), et la moyenne d'age était de 64,0 ans. La moyenne du VEMS post-bronchodilatateur était de 1,37 litres (répartition selon la classification de GOLD: GOLD 2 [50 %], GOLD 3 [39 %], GOLD 4 [11 %]). L'effet moyen observé sur le VEMS après administration du béta2 agoniste par rapport à la valeur initiale était de 16,6% (+ 0,171 litres). Les médicaments à visée pulmonaire autorisés en traitement concomitant étaient les corticoïdes inhalés (47 %) et les xanthines (10 %).
L’étude de 6 semaines [Étude 3] a été menée en Europe et en Amérique du Nord. La majorité des 219 patients recrutés étaient des hommes (59 %) blancs (99 %). La moyenne d’âge était de 61,1 ans. La moyenne du VEMS post-bronchodilatateur était de 1,55 litres (répartition selon la classification de GOLD: GOLD 2 [64 %], GOLD 3 [34 %], GOLD 4 [2 %]). L'effet moyen observé après administration du béta2 agoniste par rapport aux valeurs initiales était de 15,9 % (0,193 litre). Les médicaments à visée pulmonaire autorisés en traitement concomitant étaient les corticoïdes inhalés (41 %) et les xanthines (4 %).
Effets sur la fonction pulmonaire
Dans les études de 52 semaines ayant utilisé YANIMO RESPIMAT administré une fois par jour, le matin, l'amélioration de la fonction pulmonaire dans les 5 minutes suivant la première dose était nettement observée par rapport au tiotropium 5 microgrammes (augmentation moyenne du VEMS de 0,137 litre pour Yanimo Respimat comparé à 0,058 litre pour le tiotropium 5 microgrammes [p < 0,0001] et 0,125 litre pour l’olodatérol 5 microgrammes [p = 0,16]).
Dans les deux études, des améliorations significatives de l’ASC0-3h du VEMS et du VEMS résiduel pré-bronchodilatateur) mesurés à la 24ème semaine (critères d’évaluation principaux de l'étude) ont été observées dans les groupes traités par YANIMO RESPIMAT, comparativement au tiotropium 5 microgrammes et à l’olodatérol 5 microgrammes (Tableau 1).
Tableau 1 Différence de l’ASC0-3h du VEMS et du VEMS résiduel (pré-bronchodilatateur) pour YANIMO RESPIMAT comparativement au tiotropium 5 microgrammes et l’olodatérol 5 microgrammes après 24 semaines (Études 1 et 2)
|
|
ASC0-3h du VEMS
|
VEMS résiduel
|
|
|
Étude 1
|
Étude 2
|
Étude 1
|
Étude 2
|
|
|
n
|
Moyenne
|
n
|
Moyenne
|
n
|
Moyenne
|
n
|
Moyenne
|
|
Yanimo Respimat
comparativement à :
|
522
|
--
|
502
|
--
|
521
|
--
|
497
|
--
|
|
Tiotropium 5 microgrammes
|
526
|
0,117 L
|
500
|
0,103 L
|
520
|
0,071 L
|
498
|
0,050 L
|
|
Olodatérol 5 microgrammes
|
525
|
0,123 L
|
507
|
0,132 L
|
519
|
0,082 L
|
503
|
0,088 L
|
Moyenne du VEMS initial à l'inclusion : Étude 1 = 1,16 L ; Étude 2 = 1,15 L
p ≤ 0,0001 pour toutes les comparaisons :
n= nombre de patients
L'effet bronchodilatateur de Yamino Respimat était plus élevé chez les patients dont la réversibilité bronchique était plus élevée à l'inclusion comparativement à ceux ayant une réversibilité faible.
Les effets bronchodilatateurs supérieurs de YANIMO RESPIMAT par rapport au tiotropium 5 microgrammes et à l’olodatérol 5 microgrammes ont été maintenus pendant toute la période d’étude de 52 semaines. Une amélioration du débit expiratoire de pointe (DEP) mesuré quotidiennement par les patients a été observée dans le groupe traité par YANIMO RESPIMAT comparativement au tiotropium 5 microgrammes et à l’olodatérol 5 microgrammes.
Dans l’étude de 6 semaines, l'effet sur le VEMS observé dans le groupe traité par YANIMO RESPIMAT était significativement supérieur à celui observé avec tiotropium 5 microgrammes, olodatérol 5 microgrammes et placebo (p < 0,0001) et ceci sur l'ensemble de la période des 24 heures entre deux doses (Tableau 2).
Tableau 2 Différence moyenne du VEMS (litre) à 3 h, 12 h et 24 h et différence du VEMS résiduel (litre) pour Yanimo Respimat par rapport au tiotropium 5 microgrammes, à l’olodatérol 5 microgrammes et au placebo après 6 semaines (Étude 3)
|
|
n
|
3 h moyenne
|
n
|
12 h moyenne
|
24 h moyenne 1
|
Fin de dose
|
|
Yanimo Respimat
comparativement à:
|
138
|
--
|
138
|
--
|
--
|
--
|
|
Tiotropium 5 microgrammes
|
137
|
0,109
|
135
|
0,119
|
0,110
|
0,079
|
|
Olodatérol 5 microgrammes
|
138
|
0,109
|
136
|
0,126
|
0,115
|
0,092
|
|
Placebo
|
135
|
0,325
|
132
|
0,319
|
0,280
|
0,207
|
Moyenne du VEMS initial à l'inclusion : 1,30 L
1 Critère d’évaluation principal de l’étude.
p < 0,0001 pour toutes les comparaisons
n= nombre de patients
Qualité de vie liée à l’état de santé
La réduction du score total du questionnaire de St George (St George's Respiratory Questionnaire) (SGRQ) montre une amélioration de la qualité de vie liée à l’état de santé avec YANIMO RESPIMAT. Après 24 semaines, la différence observée sur le score total du questionnaire SGRQ entre le groupe traité par YANIMO RESPIMAT et le groupe recevant du tiotropium 5 microgrammes et de l’olodatérol 5 microgrammes était statistiquement significative (tableau 3). Des améliorations ont été observées pour tous les domaines du SGRQ. Un plus grand nombre de patients traités par YANIMO RESPIMAT avait une amélioration du score total du questionnaire SGRQ supérieure à la différence minimale cliniquement significative (DMCS = 4 unités) par rapport aux patients traités par tiotropium 5 microgrammes (57,5 % contre 48,7 %, p = 0,0001)et olodatérol 5 microgrammes (57,5 % contre 44,8 %, p < 0,0001).
Tableau 3 : Score total du questionnaire SGRQ après 24 semaines de traitement
|
|
|
n
|
Moyenne du traitement (évolution par rapport à la valeur initiale)
|
Différence par rapport à Yanimo Respimat
|
|
|
|
Moyenne (valeur de p)
|
|
Score total
|
Valeur initiale
|
|
43,5
|
|
|
|
Yanimo Respimat
|
979
|
36,7 (-6,8)
|
|
|
|
Tiotropium 5 microgrammes
|
954
|
37,9 (-5,6)
|
-1,23 (p = 0,025)
|
|
|
Olodatérol 5 microgrammes
|
954
|
38,4 (-5,1)
|
-1,69 (p = 0,002)
|
n= nombre de patients
Dyspnée
Après 24 semaines, le score de l'index de mesure de la dyspnée (Transition Dyspnea Index (TDI)) était de 1,98 unités pour YANIMO RESPIMAT, avec une amélioration significative par rapport au tiotropium 5 microgrammes (différence moyenne : 0,36 ; p = 0,008) et l’olodatérol 5 microgrammes (différence moyenne : 0,42 ; p = 0,002).
Un plus grand nombre de patients traités par YANIMO RESPIMAT avait une amélioration du score TDI supérieure à la différence minimale cliniquement significative (DMCS = 1 unité) par rapport au tiotropium 5 microgrammes (54,9 % vs 50,6 % ; p = 0,0546) et l’olodatérol 5 microgrammes (54,9 % vs 48,2 % ; p = 0,0026).
Recours au traitement symptomatique dit médicament de "secours" :
Les patients traités par YANIMO RESPIMAT ont utilisé moins de salbutamol en traitement symtomatique de secours pendant la journée et la nuit comparativement aux patients traités par le tiotropium 5 microgrammes et l’olodatérol 5 microgrammes. L'utilisation moyenne diurne du médicament de secours dans le groupe traité par YANIMO RESPIMAT était de 0,76 fois par jour contre 0,97 fois par jour dans le groupe traité par tiotropium 5 microgrammes et 0,87 fois par jour dans le groupe olodatérol 5 microgrammes; p < 0,0001. L'utilisation moyenne nocturne du médicament de secours était de 1,24 fois par jour dans le groupe YANIMO RESPIMAT contre 1,69 fois dans le groupe tiotropium 5 microgrammes et 1,52 fois par jour dans le groupe olodatérol 5 microgrammes; p < 0,0001).
Évaluation globale par les patients
Les patients traités par YANIMO RESPIMAT ont, d'après l'échelle de notation globale par les patients, perçu une amélioration plus importante de leur fonction respiratoire que les patients sous tiotropium 5 microgrammes et olodatérol 5 microgrammes.
Exacerbations
Il a été précédemment démontré que le tiotropium 5 microgrammes entraînait une réduction statistiquement significative du risque d’exacerbations de BPCO par rapport au placebo. Les exacerbations de BPCO ont été ajoutées parmi les critères d’évaluation au cours des études pivots de 52 semaines (Études 1 et 2).Sur l’ensemble des données groupées, la proportion de patients présentant au moins une exacerbation de BPCO modérée ou sévère a été de 27,7 % avec YANIMO RESPIMAT et de 28,8 % avec le tiotropium 5 microgrammes (p = 0,39). Ces études n’ont pas été conçues de manière spécifique pour évaluer les effets des traitements sur les exacerbations de BPCO.
Capacité inspiratoire, gêne respiratoire et endurance à l’effort
Les effets de YANIMO RESPIMAT sur la capacité inspiratoire, la gêne respiratoire et l’endurance à l’effort limitée par les symptômes ont été explorés au cours de trois études randomisées et en double aveugle chez des patients atteints de BPCO :
· deux études en plan croisé de 6 semaines ayant un protocole identique et comparant YANIMO RESPIMAT au tiotropium 5 microgrammes, à l’olodatérol 5 microgrammes et à un placebo au cours d’une épreuve sur bicyclette à vitesse constante (450 patients ont reçu YANIMO RESPIMAT) [Étude 4 et 5] ;
· une étude en groupes parallèles de 12 semaines comparant YANIMO RESPIMAT à un placebo au cours d’une épreuve sur bicyclette à vitesse constante (139 patients ont reçu YANIMO RESPIMAT) et une épreuve de marche à vitesse constante (dans un sous-groupe de patients) [Étude 6].
Une amélioration significative de la capacité inspiratoire au repos mesurée deux heures après l’administration était observée après 6 semaines dans les groupes traités avec YANIMO RESPIMAT comparativement au tiotropium 5 microgrammes (Etude 4: 0,114 litre; p < 0,0001 ; Étude 5: ‑ 0,088 litre ; p = 0,0005), à l’olodatérol 5 microgrammes (Etude 4 : 0,119 litre ; p < 0,0001 ; Étude 5 : ‑ 0,080 litre ; p = 0,0015) et au placebo (Etude 4: 0,244 L ; p < 0,0001 ; Étude 5 – 0,265 L ; p < 0,0001).
Dans les études 4 et 5, une amélioration significative de l’endurance au cours d’une épreuve sur bicyclette à vitesse constante était observée avec YANIMO RESPIMAT comparativement au placebo après 6 semaines (Étude 4 : moyenne géométrique de l’endurance :454 secondes avec YANIMO RESPIMAT comparativement à 375 secondes avec le placebo [soit amélioration de 20,9 % ; p < 0,0001] ; Étude 5 : moyenne géométrique de l’endurance : 466 secondes avec YANIMO RESPIMAT comparativement à 411 secondes avec le placebo [soit une amélioration de 13,4 % ; p < 0,0001]).
Dans l’étude 6, une amélioration significative de l’endurance au cours d’une épreuve sur bicyclette à vitesse constante a été observée avec YANIMO RESPIMAT comparativement au placebo après 12 semaines (moyenne géométrique de l’endurance : 528 secondes avec YANIMO RESPIMAT contre 464 secondes avec le placebo (amélioration de 13,8 % ; p = 0,021)).
Population pédiatrique
L'Agence européenne des médicaments a accordé une dérogation à l'obligation de soumettre les résultats d'études réalisées avec YANIMO RESPIMAT dans la bronchopneumopathie chronique obstructive (BPCO) dans tous les sous-groupes de la population pédiatrique conformément à la dérogation par classe (voir rubrique 4.2 pour les informations concernant l'usage pédiatrique).
5.2. Propriétés pharmacocinétiques
a. Introduction générale
Lorsque le tiotropium et l’olodatérol ont été administrés en association par voie inhalée, les paramètres pharmacocinétiques de chacune des substances ont été similaires à ceux observés lorsque chacune des substances actives a été administrée séparément.
La cinétique du tiotropium et de l’olodatérol est linéaire dans l’intervalle thérapeutique. Après administrations répétées en une prise par jour par voie inhalée, l’état d’équilibre du tiotropium a été atteint le 7ème jour. Pour l'olodatérol administré en prises uniques quotidiennes, l’état d’équilibre a été atteint après 8 jours avec un facteur d'accumulation par rapport à une administration unique allant jusqu'à 1,8.
b. Caractéristiques générales des substances actives après administration du médicament.
Absorption
Tiotropium : les données concernant l’excrétion urinaire chez de jeunes volontaires sains suggèrent qu’environ 33 % de la dose inhalée par l’inhalateur RESPIMAT atteignent la circulation systémique. La biodisponibilité absolue de la solution administrée par voie orale a été de 2 à 3 %. Les concentrations plasmatiques maximales du tiotropium ont été observées à 5-7 minutes après inhalation du médicament avec RESPIMAT.
Olodatérol : chez les volontaires sains, la biodisponibilité absolue de l'olodatérol après inhalation est estimée à environ 30 %, contre moins de 1 % après administration en solution par voie orale. Les concentrations plasmatiques maximales d'olodatérol sont généralement atteintes en 10 à 20 minutes après inhalation du médicament avec RESPIMAT.
Distribution
La liaison du tiotropium avec les protéines plasmatiques est d'environ 72% et le volume de distribution est de 32 L/kg. Les études chez le rat ont montré que le bromure de tiotropium ne traverse pas la barrière hémato-encéphalique de façon significative.
La liaison de l'olodatérol avec les protéines plasmatiques est d'environ 60% et le volume de distribution est de 1110 L. L'olodatérol est un substrat des transporteurs P-gp, OAT1, OAT3 et OCT1. L'olodatérol n'est pas un substrat des transporteurs BCRP, MRP, OATP2, OATP8, OATP-B, OCT2 et OCT3.
Métabolisme
Tiotropium : le métabolisme du bromure de tiotropium est faible comme le montre le taux d’excrétion dans l’urine de plus de 74 % sous forme inchangée après une dose intraveineuse. L'ester du bromure de tiotropium est clivé, indépendamment d’un mécanisme enzymatique, en un dérivé alcool (N-méthylscopine) et un dérivé acide (acide dithiénylglycolique), qui ne se lient pas aux récepteurs muscariniques. Les études réalisées in vitro sur microsomes hépatiques et sur hépatocytes d'origine humaine montrent qu'une petite partie supplémentaire (< 20% de la dose administrée par voie intraveineuse) est métabolisée par oxydation dépendante du cytochrome P450 (CYP) 2D6 et 3A4 suivie d'une conjugaison avec le glutathion, donnant naissance à une série de métabolites secondaires.
L'olodatérol est métabolisé principalement par glucuronidation directe et par O-déméthylation au niveau du groupement méthoxy suivie d'une conjugaison. Parmi les six métabolites identifiés, seul le composé déméthylé non conjugué se lie aux récepteurs β2. Toutefois, ce métabolite n'est pas détectable dans le plasma après inhalations répétées aux doses thérapeutiques préconisées ni avec des doses jusqu'à 4-fois supérieures. Les isoenzymes CYP2C9 et CYP2C8 du cytochrome P450 et, dans une moindre mesure, l'isoenzyme CYP3A4, sont impliquées dans la O-déméthylation de l'olodatérol, tandis que les isoformes UGT2B7, UGT1A1, 1A7 et 1A9 de l’uridine diphosphate glycosyl transférase sont impliquées dans la formation de glucuronides de l'olodatérol.
Élimination
Tiotropium : la clairance totale a été de 880 ml/mn chez des volontaires sains. Le tiotropium administré par voie intraveineuse est principalement excrété sous forme inchangée dans l’urine (74 %). Après inhalation répétée chez des patients présentant une BPCO jusqu’à l’état d’équilibre, l’excrétion urinaire a été de 18,6 % de la dose, le reste de celle-ci étant principalement constitué de médicament non absorbé dans l’intestin, éliminé par les fèces. La clairance rénale du tiotropium est supérieure au taux de filtration glomérulaire, ce qui indique une sécrétion active dans l’urine. La demi-vie efficace du tiotropium après inhalation par des patients présentant une BPCO est comprise entre 27 et 45 heures.
Olodatérol: chez les sujets sains, la clairance totale de l'olodatérol est de 872 mL/min et la clairance rénale est de 173 mL/min. Après administration intraveineuse de l'olodatérol marqué au [C14], 38 % de la dose radioactive a été retrouvée dans l'urine et 53 % dans les selles. La quantité d'olodatérol sous forme inchangée retrouvée dans l'urine après administration intraveineuse était de 19 %. Après administration orale, seulement 9 % de la radioactivité (0,7 % d'olodatérol sous forme inchangée) a été retrouvée dans l'urine, la plus grande partie ayant été retrouvée dans les selles (84 %). Plus de 90 % de la dose ont été excrétés dans les 6 jours suivant l'administration par voie intraveineuse et dans les 5 jours suivant l'administration par voie orale. A l'état d'équilibre après inhalation chez les volontaires sains, 5 à 7 % de la dose d'olodatérol administrée ont été excrétés par voie urinaire sous forme inchangée. Les concentrations plasmatiques d'olodatérol après inhalation diminuent de façon multiphasique, avec une demi-vie terminale d'environ 45 heures.
c. Caractéristiques des patients
Tiotropium : comme attendu chez les sujets agés avec les produits ayant une excrétion majoritairement rénale, une diminution de la clairance rénale du tiotropium de 347 ml/mn a été observée chez des patients âgés de < 65 ans présentant une BPCO et de 275 ml/mn chez ceux agés de ≥ 65 ans. Cette variation n’était pas associée à une augmentation de l’ASC0-6 ou des valeurs de la Cmax.
Olodatérol : une méta-analyse pharmacocinétique effectuée à partir des données de deux études cliniques contrôlées ayant inclus 405 patients présentant une BPCO et 296 patients présentant un asthme suggère au vu des effets observés sur l’exposition systémique à l’olodatérol qu'il n'y a pas lieu d'ajuster la posologie chez les sujets âgés, ni en fonction du sexe ni du poids.
Origine ethnique
Olodatérol : l'analyse des données de pharmacocinétique issues des études cliniques conduites avec l’olodatérol a révélé une tendance à une exposition systémique plus élevée chez les sujets japonais et originaires d'autres pays asiatiques comparativement aux sujets caucasiens.
Il n'a pas été identifié de problème de sécurité d'emploi dans les études cliniques incluant des sujets caucasiens et asiatiques traités sur une durée allant jusqu'à un an avec olodatérol RESPIMAT à des doses jusqu'à deux fois la dose thérapeutique préconisée.
Insuffisance rénale
Tiotropium : l’administration répétée de tiotropium par inhalation une fois par jour jusqu’à l’état d’équilibre chez des patients atteints de BPCO présentant une insuffisance rénale légère (clairance de la créatinine [ClCr] 50 à 80 ml/mn) a entraîné une légère augmentation de l’ASC0-6 (entre 1,8 et 30 % d’augmentation) et une valeur similaire de la Cmax par rapport aux patients présentant une fonction rénale normale (clairance de la créatinine > 80 ml/mn). Chez les sujets présentant une insuffisance rénale modérée à sévère (clairance de la créatinine < 50 ml/mn), l’administration intraveineuse de tiotropium a entraîné une exposition totale deux fois supérieure (augmentation de 82 % de l’ASC0-4h et de 52 % de la Cmax) comparativement à des sujets dont la fonction rénale était normale. Ces résultats ont également été observés après inhalation de la spécialité en poudre sèche.
Olodatérol : il n'a pas été observé d'augmentation cliniquement significative de l'exposition systémique chez les patients insuffisants rénaux.
Insuffisance hépatique
Tiotropium : il n’est pas attendu de modification significative de la pharmacocinétique du bromure de tiotropium en cas d’insuffisance hépatique, dans la mesure où le produit est essentiellement éliminé par voie rénale (74 % chez le jeune volontaire sain) et métabolisé par simple clivage non enzymatique des liaisons esters en produits pharmacologiquement inactifs.
Olodatérol : il n'a pas été observé de différence d'élimination de l’olodatérol ni de sa liaison aux proteïnes plasmatiques chez les sujets présentant une insuffisance hépatique légère ou modérée comparativement aux sujets témoins sans insuffisance hépatique. Il n'y a pas d'étude chez des sujets présentant une insuffisance hépatique sévère.
5.3. Données de sécurité préclinique
Tiotropium + olodatérol
Au cours des études non-cliniques avec l’association tiotropium et olodaterol, des effets ont été observés seulement avec des expositions considérées comme suffisamment supérieures à l’exposition maximale chez l’homme, conduisant à une faible pertinence clinique.
Tiotropium
Les études de génotoxicité et cancérogénicité n’ont révélé aucun risque particulier pour l’Homme.
Des effets toxiques sur la gestation, le développement embryofœtal, la mise bas et le développement postnatal n’ont pu être mis en évidence qu’à des doses toxiques pour la mère. Le bromure de tiotropium n’est pas tératogène chez le rat ou chez le lapin. Des modifications au niveau du système respiratoire (irritation) et du système urogénital (prostatite) ainsi qu’une reprotoxicité ont été observées à des expositions après administration locale ou systémique de plus de cinq fois supérieures à l’exposition thérapeutique.
Olodatérol
Les études de génotoxicité et de cancérogénicité n'ont révélé aucun risque particulier pour l'homme. Il a été observé une augmentation de l'incidence des léïomyomes mésovariens chez le rat et une augmentation des léïomyomes utérins et des léiomyosarcomes chez la souris. Ces observations sont considérées comme étant liées à un effet de classe observé chez les rongeurs après exposition à long terme à des doses élevées d'agonistes β2. A ce jour, les agonistes β2 n'ont pas été associés à la survenue de cancers chez l'homme.
Chez le rat, aucun effet tératogène n'est survenu après inhalation de doses de 1 054 microgrammes/kg/jour (correspondant à une exposition > 2600 fois l’exposition humaine (ASC0‑24) à la dose de 5 microgrammes). Chez des lapines NZW gravides, la dose de 2 489 microgrammes/kg/jour administrée par inhalation de l'olodatérol (correspondant à une exposition > 7130 fois l’exposition humaine à la dose de 5 microgrammes en terme d'ASC0-24) a entraîné une toxicité fœtale caractéristique de la stimulation du récepteur β-adrénergique, notamment ossification incomplète, os courts/courbés, ouverture incomplète des yeux, fente palatine, anomalies cardio-vasculaires. Aucun effet significatif n'est survenu à une dose de 974 microgrammes/kg/jour après inhalation (environ 1 353 fois la dose de 5 microgrammes en terme d’ASC0-24h).
6. DONNEES PHARMACEUTIQUES
6.1. Liste des excipients
Chlorure de benzalkonium
Édétate disodique
Eau purifiée
Acide chlorhydrique 1M (pour l'ajustement du pH)
6.2. Incompatibilités
Sans objet.
6.3. Durée de conservation
3 ans.
Après insertion de la cartouche dans l’inhalateur : 3 mois.
6.4. Précautions particulières de conservation
Ne pas congeler.
6.5. Nature et contenu de l'emballage extérieur
Type et matériel de conditionnement directement en contact avec le produit :
Solution en cartouche de polyéthylène/polypropylène comprenant un bouchon de polypropylène muni d'un joint d'étanchéité intégré en silicone. La cartouche est incluse dans un cylindre d'aluminium.
Chaque cartouche contient 4 mL de solution à inhaler.
Présentations des dispositifs :
Boîte unique: un inhalateur RESPIMAT et une cartouche de 60 doses.
Boîte double: 2 boîtes uniques, chacune contenant un inhalateur RESPIMAT et une cartouche de 60 doses.
Boîte triple: 3 boîtes uniques, chacune contenant un inhalateur RESPIMAT et une cartouche de 60 doses.
Boîte octuple: 8 boîtes uniques, chacune contenant un inhalateur RESPIMAT et une cartouche de 60 doses.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
BOEHRINGER INGELHEIM INTERNATIONAL GMBH
BINGER STRASSE 173
D-55216 INGELHEIM AM RHEIN
ALLEMAGNE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 413 1 4 : 60 doses en cartouche (PE/Polypropylène) avec inhalateur; boîte de 1.
· 34009 550 152 4 6 : 60 doses en cartouche (PE/Polypropylène) avec inhalateur; boîte de 2.
· 34009 550 152 5 3 : 60 doses en cartouche (PE/Polypropylène) avec inhalateur; boîte de 3.
· 34009 550 152 6 0 : 60 doses en cartouche (PE/Polypropylène) avec inhalateur; boîte de 8.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[A compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[A compléter ultérieurement par le titulaire]
11. DOSIMETRIE
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I.








![]() Utilisation quotidienne de votre inhalateur YANIMO RESPIMAT
Utilisation quotidienne de votre inhalateur YANIMO RESPIMAT

