RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 06/07/2015
1. DENOMINATION DU MEDICAMENT
SALMESON 500 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
50 microgrammes de Salmétérol (sous forme de xinafoate de salmétérol) et 500 microgrammes de Propionate de fluticasone.
Excipient à effet notoire : 24,427 mg de lactose par dose.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre pour inhalation en récipient unidose.
Poudre blanche.
SALMESON contient deux médicaments conditionnés dans chacune des deux cavités de la bande monodose double-cavités, lesquelles sont stockées dans l'Elpenhaler®.
Chaque dose est pré-distribuée dans une bande monodose double-cavités.
4. DONNEES CLINIQUES
4.1. Indications thérapeutiques
Asthme
SALMESON est indiqué chez l’adulte en traitement continu de l'asthme, dans les situations où l'administration par voie inhalée d'un médicament associant un corticoïde et un bronchodilatateur bêta-2 agoniste de longue durée d'action est justifiée :
· chez des patients insuffisamment contrôlés par une corticothérapie inhalée et la prise d'un bronchodilatateur bêta-2 agoniste de courte durée d'action par voie inhalée "à la demande"
ou
· chez des patients contrôlés par l'administration d'une corticothérapie inhalée associée à un traitement continu par bêta-2 agoniste de longue durée d'action par voie inhalée.
Bronchopneumopathie chronique obstructive (BPCO)
SALMESON est indiqué chez l’adulte en traitement symptomatique de la BPCO chez les patients dont le VEMS (mesuré avant administration d'un bronchodilatateur) est inférieur à 60 % de la valeur théorique qui présentent des antécédents d'exacerbations répétées et des symptômes significatifs malgré un traitement bronchodilatateur continu.
4.2. Posologie et mode d'administration
Voie inhalée uniquement.
Il conviendra d'informer le patient que pour observer un effet optimal du traitement, SALMESON doit être administré quotidiennement même lorsque les symptômes sont améliorés.
Le médecin devra vérifier régulièrement que le dosage prescrit de SALMESON est bien adapté à l'état clinique du patient. La posologie ne sera modifiée que sur avis médical. Il convient de toujours rechercher la posologie minimale efficace. Lorsque les symptômes sont contrôlés par la plus faible posologie recommandée en deux prises par jour, l'administration d'un corticoïde inhalé seul sera alors envisagée. Il pourra être également envisagé de réduire la posologie de SALMESON à une prise par jour, si le médecin estime nécessaire de maintenir un traitement par bêta-2 mimétique de longue durée d'action pour le contrôle des symptômes.
L'horaire de la prise de SALMESON sera alors fonction de la fréquence d'apparition des symptômes. Si les symptômes sont à prédominance nocturne, SALMESON sera administré le soir ; s’ils sont à prédominance diurne, SALMESON sera administré le matin.
Le dosage de SALMESON qui sera prescrit au patient devra correspondre à la dose de propionate de fluticasone adaptée à la sévérité de son asthme. Chez les sujets asthmatiques, le propionate de fluticasone (FP) est aussi efficace que les autres corticoïdes administrés par voie inhalée à environ la moitié de la dose quotidienne. Si les dosages disponibles de cette association fixe ne répondent pas aux nécessités pour ajuster les posologies en fonction de l'état du patient, bêta-2 agonistes et/ou corticoïdes devront être prescrites individuellement.
Posologie préconisée :
Asthme
Adultes :
· une inhalation de 250 µg de propionate de fluticasone et 50 µg de salmétérol 2 fois par jour
ou
· une inhalation de 500 µg de propionate de fluticasone et 50 µg de salmétérol 2 fois par jour
SALMESON peut être envisagé en traitement d'initiation pendant une courte période d'essai chez des adultes ayant un asthme persistant modéré (défini par l'existence d'une symptomatologie diurne, l'utilisation quotidienne d'un bronchodilatateur de courte durée d'action en traitement symptomatique de secours et une obstruction bronchique modérée à sévère) et chez qui il apparaît essentiel d'obtenir un contrôle rapide de l'asthme. Dans ces cas, la dose initiale recommandée est d’une inhalation de 50 microgrammes de salmétérol et 100 microgrammes de propionate de fluticasone, deux fois par jour. Lorsque le contrôle de l'asthme est obtenu, le traitement doit être réévalué afin d'envisager la réduction du traitement à un corticoïde inhalé seul. Il est important que les patients soient suivis régulièrement lors de la période de réduction du traitement.
Il n'a pas été établi de bénéfice de SALMESON utilisé en traitement d'initiation par rapport à un traitement inhalé par propionate de fluticasone seul, lorsque 1 à 2 des critères de sévérité évoqués ci-dessus ne sont pas présents. Dans la majorité des cas, le traitement de première intention demeure l'administration de corticoïdes inhalés seuls. SALMESON n'est pas destiné au traitement de première intention de l'asthme léger. Le dosage 50 microgrammes /100 microgrammes de salmétérol / propionate de fluticasone ne convient pas aux adultes ayant un asthme sévère ; chez ces patients, la dose appropriée de corticoïdes inhalés devra être ajustée individuellement avant d'instaurer un traitement par une association fixe.
Si le dosage de SALMESON ne répond pas aux nécessités pour ajuster la posologie requise, d'autres spécialités de dosages différents de fluticasone/salmetrol sont disponibles.
Bronchopneumopathie chronique obstructive
Adultes :
une inhalation de 50 µg de salmétérol et 500 µg de propionate de fluticasone 2 fois par jour.
Populations à risque
Il n'y a pas lieu d'ajuster les doses chez les sujets âgés ou atteints d'insuffisance rénale. Aucune donnée n'est disponible concernant l'utilisation de l'association de salmétérol et de propionate de fluticasone chez les patients atteints d'insuffisance hépatique.
Enfants et adolescents
SALMESON n'est pas destiné à une utilisation chez l'enfant et l’adolescent.
4.3. Contre-indications
Hypersensibilité (allergie) connue à l'un des principes actifs ou excipients (voir rubrique 6.1).
4.4. Mises en garde spéciales et précautions d'emploi
L'adaptation d'un traitement de l’asthme se fait par palier en fonction de l'état clinique du patient qui sera régulièrement réévalué par un suivi médical et le contrôle de la fonction respiratoire.
SALMESON n'est pas adapté au traitement des crises d'asthme et des épisodes de dyspnée paroxystique. Dans ces situations, le patient devra avoir recours à un bronchodilatateur à action rapide et de courte durée pour traiter les symptômes aigus.
Le patient sera informé qu'il doit ainsi avoir en permanence à sa disposition un médicament bronchodilatateur à action rapide et de courte durée destiné à être utilisé en cas de crise d'asthme.
Le traitement par SALMESON ne doit pas être initié pendant une exacerbation, ni en cas d'aggravation significative ou de détérioration aiguë de l'asthme.
Des évènements indésirables graves liés à l'asthme et des exacerbations peuvent survenir lors du traitement par SALMESON. Il convient d'informer les patients que si les symptômes de l'asthme persistent ou s'aggravent au cours du traitement par SALMESON, ils doivent continuer leur traitement mais prendre avis auprès de leur médecin.
Une augmentation de la consommation de bronchodilatateurs à action rapide et de courte durée pour traiter les symptômes est le signe d'une déstabilisation de la maladie. Dans ce cas, le patient devra consulter son médecin. Une détérioration plus ou moins rapide du contrôle des symptômes doit faire craindre une évolution vers un asthme aigu grave pouvant mettre en jeu le pronostic vital et, par conséquent, nécessite une consultation médicale urgente. Il conviendra alors d'envisager une augmentation de la corticothérapie. De même, si le contrôle des symptômes reste insuffisant à la suite d'un traitement par SALMESON, une consultation médicale est nécessaire.
Dès que les symptômes de l'asthme sont contrôlés, une diminution progressive de la dose de SALMESON doit être envisagée. Il est important que les patients soient suivis régulièrement lors de la période de réduction du traitement. La dose minimale efficace de SALMESON doit être utilisée (voir rubrique 4.2).
Chez les patients asthmatiques ou ayant une BPCO, la prescription d'une corticothérapie complémentaire doit être prise en compte.
Chez les patients asthmatiques, le traitement par SALMESON ne devra pas être interrompu brusquement en raison d'un risque d'exacerbation. Par ailleurs, il conviendra de toujours rechercher la posologie minimale efficace sous contrôle médical. Chez les patients atteints de BPCO, l'arrêt du traitement peut aussi s'accompagner d'une détérioration symptomatique et doit donc être réalisée sous contrôle médical.
Comme d'autres corticoïdes destinés à être administrés par voie inhalée, SALMESON doit être utilisé avec précaution chez les patients atteints de tuberculose pulmonaire.
Rarement, SALMESON peut entraîner des troubles du rythme cardiaque tels que tachycardie supraventriculaire, extrasystoles et fibrillation auriculaire, ainsi qu'une baisse modérée et transitoire de la kaliémie à des doses thérapeutiques élevées. Par conséquent, SALMESON doit être utilisé avec prudence en cas de pathologies cardiovasculaires sévères, de troubles du rythme cardiaque, de diabète, d'hyperthyroïdie, d'hypokaliémie non corrigée ou chez les patients à risque d'hypokaliémie.
Des augmentations de la glycémie ont été très rarement rapportées (voir rubrique 4.8). Ceci doit être pris en compte lors de la prescription chez des patients diabétiques
Comme avec d'autres produits inhalés, l'augmentation du sifflement bronchique témoignant d'un bronchospasme à la suite de l'inhalation de la poudre, doit conduire à l'arrêt du traitement par SALMESON et à un examen clinique du patient. Le traitement devra être réévalué pour envisager le cas échéant, une thérapeutique alternative.
Des précautions devront être prises lors du relais de la corticothérapie générale par SALMESON notamment chez les patients susceptibles de présenter une fonction surrénalienne altérée.
La corticothérapie inhalée peut entraîner des effets systémiques, en particulier lors de traitements à fortes doses au long cours. La survenue de ces effets reste cependant moins probable qu'au cours d'une corticothérapie orale. Il peut être observé un syndrome de Cushing, un tableau clinique cushingoïde, une inhibition de la fonction surrénalienne, une diminution de la densité minérale osseuse, une cataracte et un glaucome et plus rarement, des effets psychologiques ou des troubles du comportement, incluant hyperactivité psychomotrice, troubles du sommeil, anxiété, dépression ou comportement aggressif (notamment chez les enfants). En conséquence, le patient sera suivi régulièrement et la posologie minimale efficace devra toujours être recherchée.
L'administration prolongée de doses élevées de corticoïdes par voie inhalée peut provoquer une inhibition de la fonction surrénalienne en favorisant la survenue d'une insuffisance surrénale aiguë. Des cas d'inhibition de la fonction surrénale et d'insuffisance surrénale aiguë ont également été très rarement décrits avec des doses de propionate de fluticasone comprises entre 500 et 1000 microgrammes. Une insuffisance surrénale aigüe peut être déclenchée par un traumatisme, une intervention chirurgicale, une infection ou toute diminution rapide de la posologie. Le tableau clinique est généralement atypique pouvant comprendre anorexie, douleur abdominale, perte de poids, fatigue, maux de tête, nausées, vomissements, hypotension, troubles de la conscience, hypoglycémie et convulsions. En cas de stress ou lorsqu'une intervention chirurgicale est prévue, une corticothérapie de supplémentation par voie générale peut être nécessaire.
L'administration de propionate de fluticasone par voie inhalée favorise la diminution du recours aux corticoïdes oraux pour traiter l'asthme, mais elle ne prévient pas le risque d'apparition d'une insuffisance surrénale lors du sevrage des patients traités au long cours par une corticothérapie orale. Ce risque existe également chez les patients ayant reçu de fortes doses de corticoïdes en urgence. Le risque de persistance d'une inhibition des fonctions surrénales doit rester présent à l'esprit dans les situations d'urgence et/ou susceptibles de déclencher un état de stress. Une corticothérapie substitutive adaptée devra être envisagée. Un avis spécialisé peut être requis.
Le ritonavir peut augmenter considérablement les concentrations plasmatiques de propionate de fluticasone. Par conséquent, à moins que le bénéfice attendu pour le patient ne l'emporte sur le risque d'effets systémiques de la corticothérapie, il convient d'éviter de les administrer de façon concomitante. Le risque d'effets systémiques de la corticothérapie est également augmenté en cas d'administration concomitante de propionate de fluticasone avec d'autres inhibiteurs puissants du cytochrome P 3A4 (voir rubrique 4.5).
Une augmentation des cas d'infections respiratoires basses (en particulier pneumonie et bronchite) a été observée dans l'étude TORCH chez des patients atteints de BPCO traités par salmétérol/fluticasone 50 microgram/500 microgram/dose deux fois par jour, par rapport à ceux recevant du placebo, ainsi que dans les études SCO40043 et SCO100250 qui ont comparé une dose plus faible de salmétérol /fluticasone non approuvée dans la BPCO, de 50 microgram/250 microgram/dose deux fois par jour contre 50 microgrammes deux fois par jour de salmétérol seul (voir rubriques 4.8 et 5.1). Une incidence similaire de cas de pneumonie a été observée dans les groupes salmétérol /fluticasone de toutes les études. Dans l'étude TORCH, le risque de développer une pneumonie, indépendamment du traitement, était le plus élevé chez les patients âgés, les patients ayant un faible indice de masse corporelle (< 25kg/m2) et ceux ayant une BPCO très sévère (VEMS < 30 % de la valeur théorique). Les médecins doivent rester vigilants sur la survenue possible d'une pneumonie ou d'autres infections respiratoires basses chez les patients atteints de bronchopneumopathie chronique obstructive (BPCO) car les manifestations cliniques de ce type d'infection et d'une simple exacerbation sont souvent confondues. La survenue d'une pneumonie chez un sujet atteint de BPCO à un stade sévère doit conduire à réévaluer le traitement par salmétérol /fluticasone.
Des données issues d'un essai clinique à grande échelle (« Salmeterol Multi-Center Asthma Research Trial, SMART ») ont suggéré une augmentation du risque de survenue d'évènements indésirables respiratoires graves ou de décès d'origine respiratoire chez les patients afro-américains traités par salmétérol par rapport au placebo (voir rubrique 5.1). Il n'a pu être déterminé si ces observations étaient d'origine pharmacogénétique ou résultaient d'autres facteurs intercurrents. Si les symptômes de l'asthme persistent ou s'aggravent au cours du traitement par Salmeson, les patients d'origine noire africaine ou afro-caribéenne doivent continuer leur traitement tout en prenant rapidement avis auprès de leur médecin.
L'administration concomitante de kétoconazole par voie systémique augmente de manière significative l'exposition systémique au salmétérol pouvant entraîner une augmentation du risque de survenue d'effets systémiques (par exemple: prolongation de l'intervalle QTc et palpitations). Par conséquent, il convient d'éviter l'administration concomitante de kétoconazole ou d'autres inhibiteurs puissants du cytochrome P 3A4 sauf si les bénéfices attendus l'emportent sur le risque potentiel de survenue d'effets systémiques du salmétérol (voir rubrique 4.5).
Ce médicament contient du lactose. Son utilisation est déconseillée chez les patients présentant une intolérance au galactose, un déficit en lactase de lapp ou un syndrome de malabsorption du glucose ou du galactose (rares problèmes héréditaires).
L'attention des sportifs sera attirée sur le fait que cette spécialité contient deux principes actifs pouvant induire une réaction positive des tests pratiqués lors des contrôles antidopage.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les bêta-bloquants, sélectifs ou non, doivent être évités chez les patients atteints d'asthme sauf nécessité absolue.
L'administration concomitante d'autres bêta-adrénergiques peut potentialiser les effets bêta-2 mimétiques.
Propionate de fluticasone
Dans les conditions normales d'emploi, les concentrations plasmatiques de propionate de fluticasone atteintes après administration par voie inhalée sont faibles du fait d'un effet de premier passage hépatique important et d'une forte clairance plasmatique par une importante métabolisation médiée par le cytochrome P450 3A4. Par conséquent, le risque d'interactions cliniquement significatives avec le propionate de fluticasone semble faible.
Néanmoins, une étude d'interaction chez des volontaires sains recevant du propionate de fluticasone par voie nasale a montré que le ritonavir (un inhibiteur très puissant du cytochrome P450 3A4) à la dose de 100 mg deux fois par jour augmentait de plusieurs centaines de fois les concentrations plasmatiques de propionate de fluticasone, entraînant une diminution marquée des concentrations en cortisol plasmatique. Il n'y a pas de donnée documentant l'interaction avec le propionate de fluticasone administré par voie inhalée, mais une augmentation importante des concentrations plasmatiques est attendue; des cas de syndrome de Cushing et d'inhibition de la fonction surrénalienne ont été rapportés. Il convient donc d'éviter l'administration concomitante de propionate de fluticasone et de ritonavir, à moins que le bénéfice ne l'emporte sur le risque accru d'effets systémiques de la corticothérapie.
Une étude de faible effectif menée chez des volontaires sains a montré que le kétoconazole, inhibiteur un peu moins puissant du cytochrome P450 3A4 augmentait de 150 % l'exposition systémique d'une dose de propionate de fluticasone par voie inhalée. La réduction du cortisol plasmatique était plus importante que celle observée après l'administration de propionate de fluticasone seul. Une augmentation de l'exposition systémique et du risque d'effets indésirables systémiques est attendue en cas d'administration concomitante d'autres inhibiteurs puissants du cytochrome P450 3A4 (ex: itraconazole). La prudence est recommandée et les traitements au long cours associant ce type de médicaments devront être évités dans la mesure du possible.
Salmétérol
Inhibiteurs puissants du cytochrome P450 3A4
L'administration concomitante de kétoconazole (400 mg par voie orale une fois par jour) et de salmétérol (50 µg par voie inhalée deux fois par jour) chez 15 volontaires sains pendant 7 jours a entraîné une augmentation significative des concentrations plasmatiques de salmétérol (Concentration maximale (Cmax) augmentée d'un facteur 1,4 et aire sous la courbe (ASC) augmentée d'un facteur 15). Cette observation suggère donc une augmentation du risque de survenue des effets systémiques du salmétérol, tels que prolongation de l'intervalle QT et palpitations, par rapport à l'administration de salmétérol ou de kétoconazole seuls (voir rubrique 4.4). Il n'a pas été observé d'effet cliniquement significatif sur la pression artérielle, la fréquence cardiaque, la glycémie et la kaliémie. L'administration concomitante de kétoconazole n'a pas entraîné de prolongation de la demi-vie d'élimination du salmétérol ni son accumulation après administrations répétées.
Il convient d'éviter l'association de kétoconazole avec un traitement par salmétérol sauf si les bénéfices attendus l'emportent sur le risque potentiel de survenue d'effets systémiques du salmétérol. Un risque d'interaction du même ordre est attendu avec d'autres inhibiteurs puissants du cytochrome P450 3A4 (par exemple avec l'itraconazole, la télithromycine, le ritonavir).
Inhibiteurs modérés du cytochrome P450 3A4
L'administration concomitante d'érythromycine (500 mg par voie orale trois fois par jour) et de salmétérol (50 µg par voie inhalée deux fois par jour) chez 15 volontaires sains pendant 6 jours a entraîné une légère augmentation, non statistiquement significative, des concentrations plasmatiques du salmétérol (Cmax augmentée d'un facteur 1,4 et ASC augmentée d'un facteur 1,2). Aucun effet indésirable grave n'a été associé à l'administration concomitante avec l'érythromycine.
4.6. Grossesse et allaitement
Grossesse
Une quantité modérée de données obtenues chez la femme enceinte (entre 300 et 1000 cas de grossesses documentées) ne rapportent pas de toxicité malformative ou fœto-néonale du salmétérol et du propionate de fluticasone. Les études menées chez l'animal sur les fonctions de reproduction ont mis en évidence une toxicité des bêta-2-mimétiques et des glucocorticoïdes (voir rubrique 5.3).
L'utilisation de SALMESON au cours de la grossesse ne devra être envisagée que si le bénéfice attendu pour la mère l'emporte sur les risques éventuels pour le fœtus.
Chez la femme enceinte, il conviendra de toujours rechercher la dose minimale efficace de propionate de fluticasone assurant un contrôle satisfaisant des symptômes de l'asthme.
Allaitement
Le passage dans le lait maternel du salmétérol et du propionate de fluticasone/et de leurs métabolites n'est pas connu.
Des études ont mis en évidence que le salmétérol et le propionate de fluticasone, et leurs métabolites sont excrétés dans le lait des rates allaitantes.
Un risque pour les nouveau-nés/nourrissons nourris au sein ne peut être exclu. La décision d'interruption de l'allaitement ou du traitement par SALMESON sera fonction du bénéfice attendu de l'allaitement maternel pour l'enfant face à celui du traitement pour la femme qui allaite.
Fertilité
Il n'existe pas de donnée chez l'homme. Cependant, les études menées chez l'animal n'ont montré aucun effet du salmétérol ou du propionate de fluticasone sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Il n'y a pas eu d'étude évaluant les effets de ce médicament sur l'aptitude à conduire les véhicules et à utiliser des machines.
4.8. Effets indésirables
SALMESON contient du salmétérol et du propionate de fluticasone, dont les effets indésirables sont connus. Aucun effet indésirable nouveau n'est apparu lors de l'administration conjointe des deux principes actifs dans la même formulation.
Les effets secondaires, associés au salmétérol et au propionate de fluticasone sont cités ci-dessous, listés par classe organique et par fréquence. Les fréquences sont définies en: très fréquent (≥ 1/10), fréquent (≥ 1/100 et < 1/10), peu fréquent (≥ 1/1000 et < 1/100), rare (≥ 1/10000 et < 1/1000), très rare (< 1/10000) et fréquence de survenue indéterminée (ne peut être estimée sur la base des données disponibles). Les fréquences ont été déterminées à partir des données issues des essais cliniques. L'incidence correspondante dans le bras placebo n'a pas été prise en compte.
|
Classes organiques
|
Effets indésirables
|
Fréquence
|
|
|
Infections et Infestations
|
Candidose buccale et pharyngée
|
Fréquent
|
|
|
|
Pneumonie
|
Fréquent1,3,5
|
|
|
|
Bronchite
|
Fréquent1,3
|
|
|
Troubles du système immunitaire
|
Réactions d'hypersensibilité à type de :
|
|
|
|
|
· réactions cutanées d'hypersensibilité
|
Rare
|
|
|
|
· angio-œdème (principalement œdème facial et oropharyngé)
|
Rare
|
|
|
|
· symptômes respiratoires (dyspnée)
|
Peu fréquent
|
|
|
|
· symptômes respiratoires (bronchospasme)
|
Rare
|
|
|
|
· réactions anaphylactiques incluant le choc anaphylactique.
|
Rare
|
|
|
Troubles endocriniens
|
Syndrome de Cushing, tableau cushingoïde, inhibition de la fonction surrénalienne, ralentissement de la croissance chez l'enfant et l'adolescent, diminution de la densité minérale osseuse
|
Rare4
|
|
|
Troubles du métabolisme de la nutrition
|
Hypokaliémie
Hyperglycémie
|
Fréquent3
Rare4
|
|
|
|
Troubles psychiatriques
|
Anxiété
|
Peu fréquent
|
|
|
|
Troubles du sommeil et troubles du comportement incluant hyperactivité et irritabilité (notamment chez les enfants)
|
Rare
|
|
|
|
Dépression et agression (notamment chez les enfants)
|
Fréquence indeterminée
|
|
|
Troubles du système nerveux
|
Maux de tête
Tremblements
|
Très fréquent1
Peu fréquent
|
|
|
|
Troubles oculaires
|
Cataracte, glaucome
|
Rare4
|
|
|
Troubles cardiaques
|
Palpitations
Tachycardie
Arythmies cardiaques (y compris fibrillation auriculaire, tachycardie supraventriculaire et extrasystoles)
|
Peu fréquent
Peu fréquent
Rare
|
|
|
|
|
|
Angine de poitrine
|
Peu fréquent
|
|
|
Troubles respiratoires, thoraciques et médiastinaux
|
Rhino-pharyngite
|
Très fréquent2,3
|
|
|
Gêne pharyngée
|
Peu fréquent
|
|
|
Raucité de la voix/dysphonie
|
Fréquent
|
|
|
Sinusite
|
Fréquent1,3
|
|
|
|
Bronchospasme paradoxal
|
Rare4
|
|
|
Troubles cutanés et sous-cutanés
|
Contusions
|
Fréquent1,3
|
|
|
Troubles musculo-squelettiques et systémiques
|
Crampes musculaires
|
Peu fréquent
|
|
|
Fractures traumatiques
|
Fréquent1,3
|
|
|
Arthralgies
|
Fréquent
|
|
|
Myalgies
|
Fréquent
|
|
1. Rapportés fréquemment dans les groupes placebo.
2. Rapportés très fréquemment dans les groupes placebo.
3. Rapportés sur une période de 3 ans dans une étude dans la BPCO.
4. Voir rubrique 4.4.
5. Voir rubrique 5.1.
Description de certains effets indésirables
Des effets secondaires liés aux propriétés pharmacodynamiques bêta-2 mimétiques du salmétérol, tels que tremblements, palpitations et maux de tête, ont été rapportés. Ils sont le plus souvent transitoires et diminuent avec la poursuite du traitement.
Des effets indésirables associés au propionate de fluticasone comme une raucité de la voix et une candidose (muguet) buccale et pharyngée peuvent survenir chez certains patients. Elles peuvent être réduites par le rinçage de la bouche à l'eau après utilisation de SALMESON. Les candidoses symptomatiques peuvent être traitées par des antifongiques locaux tout en continuant le traitement par SALMESON.
Population pédiatrique :
Les effets systémiques tels que Syndrome de Cushing, tableau cushingoïde, inhibition de la fonction surrénalienne et ralentissement de la croissance chez l'enfant et chez l'adolescent, sont possibles (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé doivent déclarer tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (Ansm) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
4.9. Surdosage
Aucun surdosage n'a été décrit dans les essais cliniques menés avec SALMESON.
Néanmoins, les signes de surdosage sont connus pour chacun des principes actifs.
Les symptômes d'un surdosage en salmétérol sont des tremblements, des céphalées et une tachycardie. Les antidotes de choix sont les agents bêta-bloquants cardiosélectifs, mais ceux-ci doivent être utilisés avec grande prudence chez les patients ayant des antécédents de bronchospasme.
Si le traitement par SALMESON doit être interrompu en raison d'une exposition excessive aux bêta-2 mimétiques, il sera remplacé par un corticoïde seul. Si une hypokaliémie apparaît, elle devra être corrigée par un apport adapté de potassium.
Surdosage aigu : l'administration de propionate de fluticasone à des doses supérieures à celles recommandées par voie inhalée peut entraîner une inhibition temporaire de la fonction surrénalienne. Il n'y a pas lieu d'adopter une mesure d'urgence car la fonction surrénalienne se rétablit en quelques jours comme en témoignent les mesures du cortisol plasmatique.
Surdosage chronique : se reporter à la rubrique 4.4, risque d'inhibition des glandes surrénales. Une surveillance pourra alors être nécessaire. En cas de surdosage en propionate de fluticasone, le traitement par SALMESON peut être poursuivi en ajustant la posologie aux doses suffisantes pour un contrôle optimal des symptômes de l'asthme.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique: Adrénergiques et autres médicaments pour les syndromes obstructifs des voies aériennes.
Code ATC: R03AK06.
Mécanisme d'action
SALMESON contient du salmétérol et du propionate de fluticasone qui possède des modes d'actions différents:
Salmétérol
Le salmétérol est un agoniste sélectif de longue durée d'action (12 heures) des récepteurs bêta-2 adrénergiques. Il possède une longue chaîne latérale qui le lie à l'exo-site du récepteur.
Le salmétérol produit une bronchodilatation qui persiste pendant environ 12 heures. Cette durée est supérieure à celle observée généralement avec les bêta-2 mimétiques de courte durée d’actions administrées aux posologies usuelles.
Propionate de fluticasone
Le propionate de fluticasone administré par voie inhalée aux doses préconisées exerce une activité glucocorticoïde entraînant un effet anti-inflammatoire local au niveau de la muqueuse bronchique. En conséquence, les symptômes et les exacerbations d'asthme sont diminués alors que les effets systémiques sont limités comparativement à l'administration de corticoïdes par voie générale.
Etudes cliniques conduites avec l'association propionate de fluticasone/salmétérol dans l'asthme:
Une étude de 12 mois (Gaining Optimal Asthma controL, GOAL) réalisée chez 3416 patients adultes et adolescents atteints d'asthme persistant, a comparé la tolérance et l'efficacité de salmétérol /fluticasone à une corticothérapie inhalée seule (propionate de fluticasone) afin d'évaluer la possibilité d'atteindre les objectifs de la prise en charge de l'asthme. La posologie du traitement était augmentée toutes les 12 semaines jusqu'à ce que le contrôle total** ait été obtenu ou que la posologie la plus forte de l'étude ait été atteinte. GOAL a montré qu'il y avait plus de patients qui atteignaient le contrôle de l'asthme lorsqu'ils étaient traités par salmétérol /fluticasone que lors d'un traitement par corticoïdes inhalés seuls, ce contrôle étant obtenu avec une moindre dose de corticoïdes.
Un « Bon Contrôle » de l'asthme a été obtenu plus rapidement chez les patients traités par salmétérol /fluticasone que chez les patients traités par un corticoïde inhalé seul. Le temps nécessaire pour que 50 % des sujets inclus dans l'étude atteignent leur première semaine de « Bon Contrôle » a été de 16 jours pour les sujets traités par salmétérol /fluticasone et de 37 jours pour ceux traités par corticostéroïdes inhalés (CSI). Dans le sous-groupe des patients asthmatiques non traités préalablement par des corticoïdes inhalés, ce temps était respectivement de 16 jours (salmétérol /fluticasone) et de 23 jours (CSI).
Les résultats globaux de l'étude étaient les suivants :
|
Pourcentage de patients atteignant le *Bon Contrôle (BC) et le **Contrôle Total (CT) de l'asthme sur 12 mois
|
|
Traitement avant inclusion dans l'étude
|
FP4/Salmétérol
|
FP4
|
|
BC
|
CT
|
BC
|
CT
|
|
Aucun CSI1 (ß2 CDA2 seul)
|
78 %
|
50 %
|
70 %
|
40 %
|
|
CSI à faible dose (≤ 500 µg de BDP3 ou équivalent par jour)
|
75 %
|
44 %
|
60 %
|
28 %
|
|
CSI à dose moyenne (> 500-1000 µg de BDP3 ou équivalent par jour)
|
62 %
|
29 %
|
47 %
|
16 %
|
|
Résultats globaux (quel que soit le traitement antérieur)
|
71 %
|
41 %
|
59 %
|
28 %
|
1 CSI: corticostéroïdes par voie inhalée
2 ß2 CDA: Bêta-2 agoniste de courte durée d'action
3 BDP: Dipropionate de béclométasone
4 FP: Propionate de fluticasone
* Bon contrôle de l'asthme: symptômes occasionnels ou utilisation occasionnelle d'un bronchodilatateur bêta-2 agoniste de courte durée d'action, ou fonction pulmonaire inférieure à 80 % des valeurs théoriques, sans réveil nocturne, ni exacerbation, ni effet indésirable entraînant une modification de traitement.
** Contrôle total de l'asthme: pas de symptômes, pas d'utilisation d'un bronchodilatateur bêta-2 agoniste de courte durée d'action, fonction pulmonaire supérieure ou égale à 80 % des valeurs théoriques, sans réveil nocturne, ni exacerbation, ni effet indésirable entraînant une modification de traitement.
Les résultats de cette étude suggèrent que salmétérol /fluticasone 100 microgrammes/50 microgrammes/dose, deux fois par jour, peut être envisagé en initiation d'un traitement de fond chez des patients ayant un asthme persistant modéré chez qui il apparaît essentiel d'obtenir un contrôle rapide de l'asthme (voir rubrique 4.2).
Une étude en double aveugle, randomisée en groupes parallèles, conduite chez 318 patients d'au moins 18 ans, atteints d'asthme persistant, a évalué la sécurité et la tolérance de l'administration de deux inhalations deux fois par jour (double dose) de salmétérol /fluticasone pendant deux semaines. Cette étude a montré que le doublement de la dose de salmétérol /fluticasone (quel que soit le dosage), sur une durée allant jusqu'à 14 jours, entraîne par rapport à l'administration d'une inhalation deux fois par jour, une légère augmentation des effets indésirables liés à l'activité bêta-mimétique (tremblements : 1 patient [1 %] contre 0, palpitations: 6 [3 %] contre 1 [<1 %], crampes musculaires: 6 [3 %] contre 1 [<1 %]) et une incidence similaire des effets indésirables liés au corticoïde inhalé (candidose orale: 6 [6 %] contre 16 [8 %], raucité de la voix : 2 [2 %] contre 4 [2 %]). La faible augmentation des effets indésirables liés à l'activité bêta-mimétique doit être prise en considération, s'il est envisagé de doubler la dose prescrite de salmétérol /fluticasone chez des patients adultes qui nécessiteraient une augmentation de la corticothérapie inhalée pendant une courte période (jusqu'à 14 jours).
Etudes cliniques menées avec salmétérol /fluticasone dans la BPCO :
TORCH est une étude qui avait pour objectif la comparaison du taux de mortalité globale sur 3 ans de traitement par salmétérol /fluticasone 50 µg/500 µg/dose 2 fois par jour, par salmétérol 50 µg/dose 2 fois par jour, par propionate de fluticasone (FP) 500 µg/dose 2 fois par jour ou par placebo chez des patients atteints de BPCO. Les patients atteints de BPCO présentant à l'inclusion, un VEMS (pré-bronchodilatateur) < 60 % de la valeur théorique ont été randomisés pour recevoir les traitements médicamenteux en double aveugle.
Pendant l'étude, les patients pouvaient utiliser leur traitement habituel de la BPCO à l'exception des autres corticoïdes inhalés, des bronchodilatateurs de longue durée d'action et des corticoïdes par voie systémique au long cours. La survie à 3 ans a été déterminée pour l'ensemble des patients y compris ceux ayant arrêté le traitement en cours d'étude. Le critère de jugement principal était la réduction de la mortalité globale à 3 ans avec salmétérol /fluticasone par rapport au placebo.
|
|
Placebo
N = 1524
|
Salmétérol
50 µg
N = 1521
|
Propionate de fluticasone (FP)
500 µg
N = 1534
|
salmétérol /fluticasone
50/500 µg
N = 1533
|
|
|
Mortalité globale à 3 ans
|
|
|
Nombre de décès
( %)
|
231
|
205
|
246
|
193
|
|
|
(15,2 %)
|
(13,5 %)
|
(16,0 %)
|
(12,6 %)
|
|
|
Risque relatif vs placebo
(IC)
valeur du « p »
|
|
0,879
|
1,060
|
0,825
|
|
|
N/A
|
(0,73; 1,06)
|
(0,89; 1,27)
|
(0,68; 1,00)
|
|
|
|
0,180
|
0,525
|
0,052*
|
|
|
Risque relatif Salmétérol /fluticasone 500/50 vs chacun des principes actifs (salmétérol ou FP)
(IC)
valeur du « p »
|
N/A
|
0,932
(0,77; 1,13)
0,481
|
0,774
(0,64; 0,93)
0,007
|
N/A
|
|
|
|
* p = statistiquement non significatif - valeur déterminée après ajustement prenant en compte les 2 analyses intermédiaires sur le critère principal d'efficacité - Analyse log-rank stratifiée en fonction du degré de tabagisme.
Il a été observé une tendance à une amélioration de la survie à 3 ans avec salmétérol /fluticasone par rapport au placebo mais le seuil de significativité statistique (p≤0,05) n'a pas été atteint.
Le pourcentage de patients décédés d'une cause liée à leur BPCO durant les 3 ans était de 6,0 % pour le placebo; 6,1 % pour le salmétérol; 6,9 % pour le propionate de fluticasone (FP) et 4,7 % pour salmétérol /fluticasone.
Le taux annuel moyen d'exacerbations modérées à sévères était significativement diminué dans le groupe des sujets traités par salmétérol /fluticasone comparé aux groupes des sujets traités par salmétérol, par propionate de fluticasone (FP) et ceux recevant un placebo (taux moyen dans le groupe salmétérol /fluticasone : 0,85 par rapport à 0,97 dans le groupe salmétérol; 0,93 dans le groupe FP et 1,13 dans le groupe placebo). La réduction des taux observés d'exacerbations modérées à sévères était de 25 % (IC 95 % [19 à 31 %], p<0,001) par rapport au placebo, de 12 % par rapport au salmétérol (IC 95 % [5 à 19 %], p=0,002) et de 9 % par rapport au propionate de fluticasone (FP) (IC 95 % [1 à 16 %], p=0,024). Le taux d'exacerbations avec le salmétérol et le propionate de fluticasone était significativement diminué par rapport au placebo, respectivement de 15 % (IC 95 % [7 à 22 %], p<0,001) et de 18 % (IC 95 % [11 % à 24 %], p<0,001).
La qualité de vie, mesurée à l'aide du Questionnaire Respiratoire de l'Hôpital St George (SGRQ), a été améliorée dans chacun des groupes des traitements actifs comparativement au placebo. Dans le groupe de patients traités par salmétérol /fluticasone, l'amélioration moyenne sur 3 ans était de -3,1 unités (IC 95 % [-4,1 à -2,1], p<0,001) par rapport au placebo, de -2,2 unités (p<0,001) par rapport au salmétérol et de -1,2 unités par rapport à FP (p=0,017). Une diminution de 4 unités est considérée comme cliniquement pertinente.
La probabilité estimée dans l'étude sur 3 ans, de la survenue d'une pneumonie rapportée en tant qu'évènement indésirable était de 12,3 % pour le placebo ; 13,3 % pour le salmétérol; 18,3 % pour le propionate de fluticasone et 19,6 % pour salmétérol /fluticasone (Risque relatif pour salmétérol /fluticasone contre placebo : 1,64 (IC 95 % [1,33 à 2,01], p<0,001)). Il n'a pas été mis en évidence d'augmentation de la mortalité en relation avec la survenue de pneumonies. Le nombre de cas où la cause principale du décès a été attribuée à la survenue d'une pneumonie était de 7 pour le placebo, 9 pour le salmétérol, 13 pour le propionate de fluticasone et 8 pour salmétérol /fluticasone. Aucune différence significative n'a été mise en évidence concernant le pourcentage d'apparition de fracture osseuse (placebo: 5,1 % ; salmétérol : 5,1 %; FP : 5,4 % et salmétérol /fluticasone : 6,3 % - Risque relatif pour salmétérol /fluticasone contre placebo : 1,22 (IC 95 % [0,87 à 1,72], p=0,248)).
Les études cliniques contrôlées contre placebo, d'une durée de 6 ou 12 mois, ont montré qu'une prise régulière de salmétérol /fluticasone 50 microgrammes/500 microgrammes/dose améliore la fonction respiratoire et réduit la dyspnée et la consommation des médicaments destinés au traitement des symptômes aigus.
Les études SCO40043 et SCO100250, conduites selon un protocole identique, étaient des études randomisées, en groupes parallèles comparant en double aveugle, les effets de salmétérol /fluticasone 50 microgrammes/250 microgrammes/dose deux fois par jour (dose n'ayant pas été approuvée pour le traitement de la BPCO dans l'Union Européenne) à ceux de 50 microgrammes deux fois par jour de salmétérol sur le taux annuel d'exacerbations modérées/sévères chez des patients atteints de BPCO présentant un VEMS inférieur à 50 % de la valeur prédite et ayant des antécédents d'exacerbations. Les exacerbations modérées/sévères étaient définies comme une aggravation des symptômes nécessitant une corticothérapie orale et/ou une antibiothérapie ou une hospitalisation.
Les sujets en état clinique stable après une période de 4 semaines (période de « run-in ») de traitement standard, en ouvert, par l'association FP/salmétérol 250/50, étaient randomisés selon un ratio 1:1 pour recevoir en aveugle pendant 52 semaines, FP/salmétérol 250/50 (n total en ITT = 776) ou salmétérol (n total en ITT = 778). Les traitements antérieurs de la BPCO, à l'exception des bronchodilatateurs de courte durée d'action étaient interrompus avant la période de run-in préalable à la randomisation. L'utilisation concomitante des bronchodilatateurs de longue durée d'action par voie inhalée (bêta-2 mimétiques et anticholinergiques), des associations d'ipratropium/salbutamol, des bêta-2 mimétiques oraux et des préparations à base de théophylline n'était pas autorisée pendant la période de traitement. Les corticoïdes oraux et les antibiotiques étaient autorisés pour le traitement des exacerbations de BPCO, selon des modalités d'utilisations spécifiques. Pendant les études, les patients utilisaient le salbutamol en traitement bronchodilatateurs pris «à la demande ». Les résultats de ces deux études ont montré un taux annuel d'exacerbations modérées/sévères de BPCO significativement plus bas dans le groupe traité par salmétérol /fluticasone 250/50 par rapport au groupe recevant le traitement par salmétérol (étude SCO40043: respectivement 1,06 et 1,53 exacerbation par sujet et par an ; rapport: 0,70 ; IC à 95 % : 0,58 à 0,83 ; p<0,001 et étude SCO100250 : respectivement 1,10 et 1,59 exacerbation par sujet et par an ; rapport : 0,70 ; IC à 95 %: 0,58 à 0,83 ; p<0,001). Les résultats sur les critères d'efficacité secondaires (délai avant la survenue de la première exacerbation modérée/sévère, taux annuel d'exacerbations nécessitant une corticothérapie orale et VEMS matinal avant la prise) étaient significativement en faveur de salmétérol /fluticasone 250 microgrammes/50 microgrammes/dose deux fois par jour par rapport au salmétérol. Les événements indésirables étaient similaires, à l'exception d'une incidence plus élevée des cas de pneumonie et des effets secondaires locaux bien connus (candidose et dysphonie) dans le groupe salmétérol /fluticasone 250 microgrammes/50 microgrammes/dose deux fois par jour par rapport au salmétérol. Des événements associés à une pneumonie ont été signalés par 55 (7 %) sujets dans le groupe salmétérol /fluticasone 50 microgrammes/250 microgrammes/dose deux fois par jour et par 25 sujets (3 %) dans le groupe salmétérol. L'incidence accrue de cas de pneumonie signalés avec salmétérol /fluticasone 50 microgrammes/250 microgrammes/dose deux fois par jour semble être du même ordre de grandeur que celle observée suite au traitement par salmétérol /fluticasone 50 microgrammes/500 microgrammes/dose deux fois par jour dans l'étude TORCH.
Essai multicentrique dans l'asthme avec le salmétérol (« Salmeterol Multi-Center Asthma Research Trial, SMART »)
L'étude SMART était une étude multicentrique, randomisée, en double aveugle, en groupes parallèles, contre placebo, réalisée aux Etats-Unis sur 28 semaines. 13176 patients ont reçu du salmétérol (50 microgrammes deux fois par jour) et 13179 patients ont reçu du placebo administré en plus de leur traitement anti-asthmatique habituel. Pour être inclus dans l'étude, les patients devaient être âgés d'au moins 12 ans, être asthmatiques et avoir un traitement de l’asthme en cours (à l'exclusion d'un traitement par bêta-2 agoniste de longue durée d'action). La corticothérapie inhalée n'était pas obligatoire pendant l'étude, la prise éventuelle de corticoïdes était néanmoins enregistrée à l'entrée dans l'étude. Le critère de jugement principal de l'étude SMART était un critère combiné associant le nombre de décès liés à une cause respiratoire et le nombre de détresses respiratoires mettant en jeu le pronostic vital.
Résultats de l'étude SMART sur le critère de jugement principal :
|
Groupes de patient
|
Critère principal:
Nombre d'événements/nombre de patients
|
Risque relatif
(Intervalle de Confiance à 95 %)
|
|
salmétérol
|
placebo
|
|
Population globale incluse
|
50/13176
|
36/13179
|
1,40 (0,91; 2,14)
|
|
Patients utilisant des corticoïdes inhalés
|
23/6127
|
19/6138
|
1,21 (0,66; 2,23)
|
|
Patients n'utilisant pas de corticoïdes inhalés
|
27/7049
|
17/7041
|
1,60 (0,87; 2,93)
|
|
Sous groupe des patients afro-américains
|
20/2366
|
5/2319
|
4,10 (1,54; 10,90)**
|
** Statistiquement significatif à 95 %.
Autres résultats de l'étude SMART en fonction de la prise ou non de corticoïdes par voie inhalée à l'inclusion:
|
|
Critères secondaires:
Nombre d'événements/ nombre de patients
|
Risque relatif
(Intervalle de Confiance à 95 %)
|
|
|
salmétérol
|
placebo
|
|
Nombre de décès liés à une cause respiratoire
|
|
Patients utilisant des corticoïdes inhalés
|
10/6127
|
5/6138
|
2,01 (0,69; 5,86)
|
|
Patients n'utilisant pas de corticoïdes inhalés
|
14/7049
|
6/7041
|
2,28 (0,88; 5,94)
|
|
Critère combiné associant les épisodes d'asthme ayant entraîné le décès ou mettant en jeu le pronostic vital
|
|
Patients utilisant des corticoïdes inhalés
|
16/6127
|
13/6138
|
1,24 (0,60; 2,58)
|
|
Patients n'utilisant pas de corticoïdes inhalés
|
21/7049
|
9/7041
|
2,39 (1,10; 5,22)**
|
|
Nombre de décès liés à l'asthme
|
|
Patients utilisant des corticoïdes inhalés
|
4/6127
|
3/6138
|
1,35 (0,30; 6,04)
|
|
Patients n'utilisant pas de corticoïdes inhalés
|
9/7049
|
0/7041
|
*
|
* = risque relatif n'ayant pu être calculé en raison de l'absence d'événement dans le groupe placebo.
** Les résultats sont statistiquement significatifs à 95 %. Les critères secondaires dans le tableau ci-dessus ont atteint la significativité statistique dans l'ensemble de la population étudiée.
Les critères secondaires de « décès ou menaces vitales toutes causes confondues », « décès toutes causes confondues » ou « hospitalisation toutes causes confondues » n'ont pas atteint la significativité statistique sur l'ensemble de la population étudiée.
5.2. Propriétés pharmacocinétiques
L'administration concomitante de salmétérol et de propionate de fluticasone par voie inhalée ne modifie pas les paramètres pharmacocinétiques de chacun des principes actifs administrés séparément. La pharmacocinétique de chaque constituant peut donc être considérée séparément.
Salmétérol
Le salmétérol agissant localement au niveau pulmonaire, les taux plasmatiques ne sont pas corrélés à l'effet thérapeutique. De plus, peu de données sont disponibles sur la pharmacocinétique du salmétérol après administration par voie inhalée car les concentrations plasmatiques observées aux doses thérapeutiques sont très faibles (au maximum 200 picogrammes/ml), et difficilement mesurables.
Propionate de fluticasone
La biodisponibilité absolue après administration d'une dose unique de propionate de fluticasone inhalé chez les volontaires sains varie approximativement entre 5 et 11 % de la dose nominale selon le dispositif d'inhalation utilisé. Une moindre exposition systémique au propionate de fluticasone a été observée chez les patients asthmatiques ou atteints de BPCO.
L'absorption est essentiellement pulmonaire. Elle est rapide dans un premier temps puis se poursuit plus lentement. Le reste de la dose peut être dégluti mais ne contribue qu'en faible partie à l'exposition systémique du fait d'une faible solubilité aqueuse et d'un important métabolisme de premier passage. La biodisponibilité orale est ainsi inférieure à 1 %. L'exposition systémique augmente de façon linéaire avec l'augmentation de la dose inhalée.
L'élimination du propionate de fluticasone est caractérisée par une forte clairance plasmatique (1150 ml/min), un important volume de distribution à l'état d'équilibre (environ 300 litres) et une demi-vie terminale d'environ 8 heures.
La liaison aux protéines plasmatiques est de 91 %.
Le propionate de fluticasone est éliminé très rapidement de la circulation systémique. Le produit est essentiellement métabolisé en un dérivé acide carboxylique inactif, par l'isoenzyme CYP3A4 du cytochrome P450. D'autres métabolites non identifiés sont également retrouvés dans les fécès.
La clairance rénale du propionate de fluticasone est négligeable. Moins de 5 % de la dose est excrétée dans les urines, principalement sous forme de métabolites. La majorité de la dose est éliminée dans les fécès sous forme de métabolites et sous forme inchangée.
5.3. Données de sécurité préclinique
Les résultats des études de sécurité menées chez l'animal avec chacun des principes actifs ont révélé des effets en relation avec une exacerbation de l'activité pharmacodynamique de chacun des produits.
Au cours des études de reproduction menées chez l'animal, des malformations ont été observées après administration de glucocorticoïdes (fentes palatines, malformations osseuses). Cependant, ces résultats expérimentaux observés chez l'animal, ne semblent pas prédictifs d'un effet malformatif chez l'homme aux doses recommandées. Les études menées chez l'animal avec le xinafoate de salmétérol ont montré une toxicité embryofœtale seulement après exposition à de fortes doses.
Après administration concomitante des deux principes actifs, il a été observé chez des rats recevant des doses de glucocorticoïdes connues pour induire des anomalies, une augmentation de la fréquence d'apparition de transposition de l'artère ombilicale et d'ossifications incomplètes au niveau de l'occipital.
6. DONNEES PHARMACEUTIQUES
6.1. Liste des excipients
Lactose monohydraté.
6.2. Incompatibilités
Sans objet.
6.3. Durée de conservation
2 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
SALMESON contient deux médicaments conditionnés dans les deux cavités (aluminium-aluminium) des récipients unidose (bandes monodose double-cavités), lesquels sont stockés dans le dispositif d'inhalation Elpenhaler.
La bande (film thermosoudé) protège la poudre pour inhalation des effets de l'atmosphère.
Chaque dose est pré-distribuée dans une bande monodose double-cavités.
Chaque boîte contient un dispositif d'inhalation Elpenhaler avec 60 bandes double-cavités. 60 doses par boîte.
Chaque boîte contient un dispositif d'inhalation Elpenhaler avec 30 bandes double-cavités (aluminium-aluminium) et un compartiment de stockage de réserve avec 30 bandes double-cavités (aluminium-aluminium) additionnelles. 60 doses par boîte.
Chaque boîte contient un dispositif d'inhalation Elpenhaler avec 30 bandes double-cavités (aluminium-aluminium). 30 doses par boîte.
Chaque boîte contient trois dispositifs d'inhalation Elpenhaler avec 60 bandes double-cavités (aluminium-aluminium) chacun. 180 doses par boîte.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pour assurer la bonne administration du médicament, le patient doit recevoir les instructions adaptées pour une utilisation correcte de l'inhalateur par le médecin ou un autre professionnel de santé.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
INSTRUCTIONS POUR L'UTILISATION ET LA MANIPULATION DE L'INHALATEUR Elpenhaler
Les instructions destinées au patient pour une inhalation correcte de chacun des principes actifs présents dans chacune des cavités des bandes monodoses (bandes à double cavité) de l'inhalateur Elpenhaler.
DESCRIPTION
L'Elpenhaler est un dispositif qui permet d'inhaler simultanément deux médicaments sous forme de poudre. Les deux médicaments constituent l'association fixe. Les composants sont dans 2 cavités séparées de la bande monodose double-cavité spécialement conçue pour cet usage. La bande monodose double-cavité contient une (1) dose de l'association fixe.
|

|
L'Elpenhaler est constitué de 3 parties :
- L'embout buccal et son couvercle protecteur (1).
- La surface (2) sur laquelle la bande double-cavité est positionnée (surface de positionnement)
- Le compartiment de stockage (3) qui contient les bandes double-cavités.
Les trois parties sont fixées entre elles et peuvent être ouvertes séparément.
|
|

|
La surface de positionnement contient :
- Un point d'accrochage (2A) sur lequel la bande double-cavité est attaché.
- Deux cavités (2B) dans lesquelles s'adaptent les deux cavités de la bande.
- Deux guides (2C), qui positionnent et assurent le bon maintien de la bande double-cavité sur la surface de positionnement.
|
|
|
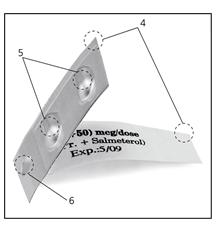
La bande double-cavité contient :
- Deux feuilles (4)
- Deux cavités (5), dont une contient le salmétérol et l’autre contient le proprionate de fluticasone
- Une perforation (6)
|
Utilisation du Elpenhaler
A. Préparation du dispositif
|

|
Ouvrir le compartiment de stockage, retirer une bande, puis refermer le compartiment de stockage.
|
|

|
- Oter complètement le couvercle de l’embout buccal.
- Débloquer et pousser l'embout buccal en arrière afin de révéler la surface de positionnement.
- Maintenir la bande double-cavité avec la surface brillante vers le haut.
- Positionner la bande sur le point d'accrochage de la surface et l'insérer dans la petite perforation. En appuyant légèrement, vous assurez que la bande est bien attachée sur le point d'accrochage.
- Les deux cavités de la bande entreront dans les cavités correspondantes de la surface de positionnement et les guides fixeront la bande dans la bonne position.
|
|

|
- Fermer l'embout buccal et tirer la languette qui dépasse vers soi afin de l'extraire. La dose est maintenant prête à être inhalée. Ne retirer la languette qu'immédiatement avant d'inhaler la dose.
|
B. Inhalation de la dose
|

|
- Tenir l'appareil loin de la bouche
- Expirer complètement. Faire attention de ne pas souffler dans l'embout buccal exposé.
- Approcher l'Elpenhaler de la bouche et placer les lèvres bien autour de l'embout buccal.
- Inhaler lentement et en profondeur par la bouche (non pas par le nez) jusqu’à remplir les poumons.
- Retenir la respiration pendant 5 secondes ou aussi longtemps sans que cela entraine une gêne, tout en retirant l'appareil de la bouche.
|
|

|
- Ouvrir l'embout buccal. Vérifier que la totalité de la poudre a été inhalée et que les cavités sont maintenant vidées.
- Retirer la bande usagée et procéder à l'étape C.
|
C. Nettoyage du dispositif
· Apres chaque utilisation, essuyer l'embout buccal et la surface de positionnement avec un tissu ou un papier sec. Ne pas utiliser d'eau pour nettoyer l'appareil.
· Fermer l'embout buccal et remettre son couvercle protecteur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
ELPEN PHARMACEUTICAL CO. INC.
95, Marathonos Ave
19009 Pikermi
Attica
GRECE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 277 077 1 1 : Récipients unidoses sous film thermosoudé (Aluminium/Aluminium) en inhalateur (ELPENHALER). Boîte de 30 doses.
· 34009 300 095 9 8 : Récipients unidoses (30 doses) sous film thermosoudé (Aluminium/Aluminium) en inhalateur (ELPENHALER) et un compartiment de stockage de réserve (30 doses).
· 34009 277 078 8 9 : Récipients unidoses sous film thermosoudé (Aluminium/Aluminium) en inhalateur (ELPENHALER). Boîte de 60 doses.
· 34009 550 064 5 9 : Récipients unidoses sous film thermosoudé (Aluminium/Aluminium) en inhalateur (ELPENHALER). Boîte de 180 doses.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
11. DOSIMETRIE
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I







