RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 17/11/2015
ZOMACTON 10 mg/ml, poudre et solvant pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Somatropine* ................................................................................................... 10 mg/ml après reconstitution
Pour un flacon.
*produite dans cellules d'Escherichia coli par la technique de l'ADN recombinant.
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour solution injectable.
ZOMACTON est une poudre lyophilisée blanche à blanc cassé. Le solvant dans la seringue est limpide et incolore.
4.1. Indications thérapeutiques
ZOMACTON est indiqué :
· dans le traitement à long terme des enfants présentant un retard de croissance lié à un déficit de sécrétion de l’hormone de croissance
· dans le traitement à long terme d’un retard de croissance lié au syndrome de Turner, confirmé par l’analyse chromosomique.
4.2. Posologie et mode d'administration
Un traitement par ZOMACTON doit être réalisé uniquement sous la responsabilité d'un médecin spécialiste qualifié, ayant l’expérience du suivi des patients présentant un déficit en hormone de croissance.
La posologie de ZOMACTON doit être adaptée à chaque patient.
La durée du traitement, en général de plusieurs années, dépend du bénéfice thérapeutique maximal obtenu.
L’administration sous-cutanée d’hormone de croissance peut entraîner une raréfaction ou une augmentation du tissu adipeux au site d’injection. Il est donc préférable d’alterner les sites d’injection.
Déficit de sécrétion de l’hormone de croissance
En général, la dose recommandée est de 0,17 à 0,23 mg/kg de poids corporel par semaine (soit environ 4,9 mg/m2 à 6,9 mg/m2 de surface cutanée) répartie en 6 à 7 injections S.C par semaine (soit une injection quotidienne de 0,02 à 0,03 mg/kg de poids corporel ou 0,7 à 1,0 mg/m2 de surface cutanée).
La dose totale hebdomadaire de 0,27 mg/kg ou 8 mg/m2 de surface cutanée ne devra pas être dépassée (soit jusqu’à 0,04 mg/kg/jour).
Syndrome de Turner
En général, la posologie recommandée est de 0,33 mg/kg de poids corporel par semaine (approximativement 9,86 mg/m2 de surface corporelle) répartie en 6 à 7 injections S.C par semaine (soit une injection quotidienne de 0,05 mg/kg de poids corporel ou 1,40 à 1,63 mg/m2 de surface cutanée).
Pour les instructions pour l’utilisation et la manipulation, voir rubrique 6.6.
Administration
La dose requise de ZOMACTON 10 mg/ml est administrée au moyen du dispositif sans aiguille ZOMAJET VISION X ou avec une seringue ordinaire.
Les instructions spécifiques à l’usage de ZOMAJET VISION X sont données dans une brochure fournie avec le dispositif.
Hypersensibilité à la somatropine ou à l’un des excipients.
La somatropine ne doit pas être administrée en cas de tumeur active. Les tumeurs intracrâniennes doivent être inactives et le traitement anti-tumoral doit être terminé avant la mise en place du traitement par l’hormone de croissance. Le traitement doit être arrêté en cas de développement de tumeur.
La somatropine ne doit pas être utilisée pour stimuler la croissance chez les enfants dont les épiphyses sont soudées.
Le traitement par la somatropine est contre-indiqué chez les patients présentant un état critique aigu, souffrant de complications secondaires à une intervention à cœur ouvert, à une intervention chirurgicale abdominale, à un poly-traumatisme, à une insuffisance respiratoire aiguë ou un état similaire.
Chez les enfants souffrant d’une maladie rénale chronique, le traitement par la somatropine devra être interrompu en cas de transplantation rénale.
4.4. Mises en garde spéciales et précautions d'emploi
La dose quotidienne maximale recommandée ne doit pas être dépassée (voir rubrique 4.2).
De très rares cas de myosite ont été observés et pourraient être liés au métacrésol employé comme conservateur. En cas de myalgie ou de douleur disproportionnée au site d’injection, la possibilité d’une myosite doit être envisagée et, si elle est confirmée, il conviendra d’utiliser une formulation de ZOMACTON sans métacrésol.
ZOMACTON n’est pas indiqué dans le traitement à long terme des enfants qui ont un déficit de croissance lié à un syndrome de Prader-Willi, confirmé par caryotype sauf en cas d’un déficit en hormone de croissance associé. Des cas d’apnée du sommeil et de mort subite survenant après l’initiation d’un traitement par l’hormone de croissance ont été rapportés chez des enfants ayant un syndrome de Prader-Willi qui présentaient un ou plusieurs facteurs de risque suivants : obésité sévère, antécédents d’obstruction des voies respiratoires ou d’apnée du sommeil ou infection respiratoire d’origine non identifiée.
De rares cas d’hypertension intracrânienne bénigne ont été décrits. En présence de céphalées sévères ou récurrentes, de troubles visuels et de nausées/vomissements, un examen du fond d’œil est recommandé afin de rechercher un éventuel œdème papillaire. Si celui-ci est confirmé, le diagnostic d’hypertension intracrânienne bénigne doit être considéré et il convient alors d’arrêter le traitement par l’hormone de croissance (voir également rubrique 4.8). A ce jour, il n’y a pas suffisamment de données pour orienter la décision clinique chez les patients ayant une hypertension intracrânienne normalisée. Si le traitement par hormone de croissance est réinstitué, une surveillance attentive des signes d’hypertension intracrânienne s’impose.
Des cas de leucémie ont été rapportés chez un petit nombre de patients présentant un déficit en hormone de croissance, dont certains avaient été traités par somatropine. Néanmoins, il n’a pas été montré d’augmentation de l’incidence de la leucémie chez les patients traités par l’hormone de croissance et ne présentant pas de facteurs de prédisposition.
Comme avec tous les produits contenant de la somatropine, un faible pourcentage de patients peut développer des anticorps anti-somatropine. La capacité de liaison de ces anticorps est faible et ils n’ont pas d’effet sur le taux de croissance. La recherche d'anticorps anti-somatropine doit être effectuée chez tout patient non-répondeur au traitement.
L’hormone de croissance augmente la conversion extra-thyroïdienne de T4 en T3 et peut, en tant que telle, révéler une hypothyroïdie infraclinique. La surveillance de la fonction thyroïdienne devra donc être effectuée chez tous les patients. Chez les patients présentant une insuffisance hypophysaire, un traitement substitutif standard doit être étroitement surveillé lors de l’administration du traitement par la somatropine.
La somatropine pouvant induire une résistance à l’insuline, la recherche d’une éventuelle intolérance au glucose doit être effectuée. Chez les patients diabétiques, la dose d'insuline peut nécessiter un ajustement après l’instauration du traitement par la somatropine. Chez les patients souffrant de diabète ou d'intolérance au glucose, une surveillance étroite doit être mise en place pendant le traitement par la somatropine.
ZOMACTON doit aussi être utilisé avec précaution chez les patients ayant des antécédents familiaux de diabète.
Chez les sujets présentant un déficit en hormone somatotrope secondaire à une lésion intracrânienne, il est recommandé de faire des examens réguliers pour surveiller la possibilité d’une évolution ou d‘une récidive de la lésion. Chez les patients ayant survécu à un cancer infantile, une augmentation du risque d’un second néoplasme a été rapporté chez ceux traités par la somatropine lors de leur premier néoplasme. Les tumeurs intracrâniennes, en particulier les méningiomes, chez les patients traités par radiothérapie au début de leur premier néoplasme, étaient les tumeurs plus fréquemment observées en second néoplasme.
Dans l’un ou l’autre cas, il convient d’arrêter l’administration de ZOMACTON.
Chez les patients ayant des antécédents d’affections malignes, l’apparition de signes et symptômes de récidive doivent être très attentivement surveillés.
Une scoliose peut progresser chez les enfants au cours d’une croissance rapide. Les signes de scoliose doivent être surveillés au cours du traitement par l’hormone de croissance.
Des luxations de la tête fémorale peuvent apparaître plus fréquemment chez les sujets présentant des désordres endocriniens. Tout patient traité par ZOMACTON et développant une claudication ou se plaignant d’une douleur de la hanche ou du genou doit être examiné par un médecin.
Les effets du traitement par l’hormone de croissance ont été étudiés dans le cadre de deux essais contrôlés versus placebo conduits chez 522 patients adultes gravement malades souffrant de complications à la suite d’une intervention chirurgicale abdominale ou à cœur ouvert, de poly-traumatismes accidentels ou d’une insuffisance respiratoire aiguë.
La mortalité a été supérieure (42 % contre 19 %) chez les patients traités par des hormones de croissance (à des doses comprises entre 5,3 et 8 mg/jour) comparativement aux patients ayant reçu un placebo. D’après ces informations, de tels patients ne doivent pas être traités par l’hormone de croissance. En l’absence de données sur l’innocuité de l’hormone de croissance de substitution chez les patients présentant une maladie grave aiguë, il convient d’évaluer les bénéfices pouvant être attendus de la poursuite du traitement avec ses risques potentiels.
Préalablement à l’autorisation de mise sur le marché, l’expérience sur la tolérance locale de l’administration de ZOMACTON 10 mg/ml avec ZOMAJET VISION X, dispositif d’injection sans aiguille, a été analysée dans une étude de 12 semaines incluant des enfants caucasiens uniquement.
Bien que rare, une pancréatite doit être envisagée chez les patients traités par la somatropine, spécialement chez les enfants, qui ont des douleurs abdominales.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Un traitement concomitant par les glucocorticoïdes inhibe l’effet de la somatropine sur la croissance. Chez les sujets présentant un déficit associé en ACTH, le traitement de substitution par glucocorticoïdes doit être soigneusement ajusté, afin d’éviter l’effet inhibiteur sur l’hormone de croissance.
Des doses élevées d’androgènes, d’œstrogènes ou de stéroïdes anabolisants peuvent accélérer la maturation osseuse et aller ainsi à l’encontre de la croissance staturale du patient.
La somatropine pouvant entraîner une résistance à l'insuline, on peut être amené à modifier la posologie de l'insuline chez les sujets qui reçoivent ZOMACTON.
Les données fournies par une étude d’interaction conduite chez des adultes présentant un déficit en hormone de croissance suggèrent que l’administration de somatropine pourrait augmenter la clairance de substances connues pour être métabolisées par les isoenzymes du cytochrome P450. En particulier, la clairance des substances métabolisées par le cytochrome P450 3A4 (telles que les stéroïdes sexuels, les corticostéroïdes, les antiépileptiques et la ciclosporine) pourrait être augmentée, entraînant une baisse de leur taux plasmatique. On ne connaît pas la signification clinique de ces observations.
Grossesse
Il n’existe pas de données sur l’utilisation de ZOMACTON chez la femme enceinte.
Il n’existe pas de données sur l’utilisation de ZOMACTON pendant la gestation chez l’animal. (Voir rubrique 5.3)
En conséquence, ZOMACTON n’est pas recommandé pendant la grossesse et chez la femme en âge de procréer n’utilisant pas de contraception.
Allaitement
Aucune étude clinique avec les produits contenant de la somatropine n’a été menée chez la femme qui allaite.
En l’absence de données sur la possibilité d’excrétion de la somatropine dans le lait maternel, des précautions doivent donc être prises lors de l’administration de produits contenant de la somatropine chez les femmes qui allaitent.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Aucun effet sur l’aptitude à conduire des véhicules et à utiliser des machines n’a été observé avec les produits contenant de la somatropine.
L'administration sous-cutanée d’hormone de croissance peut entraîner une raréfaction ou une augmentation du tissu adipeux au site d'injection, ainsi qu’une hémorragie ponctuelle et un bleu au site d’injection.
|
Classes de Système d’Organes |
Très fréquent (≥1/10)
|
Fréquent (≥1/100, <1/10) |
Peu fréquent (≥1/1000, <1/100) |
Rare (≥1/10 000, <1/1 000) |
Très rare (<1/10 000) |
|
Affections hématologiques et du système lymphatique |
|
|
Anémie |
|
|
|
Affections cardiaques |
|
|
Tachycardie, (adulte) hypertension |
(enfant) hypertension |
|
|
Affections de l’oreille et du labyrinthe |
|
|
Vertige |
|
|
|
Affections endocriniennes |
|
Hypothyroïdie |
|
|
|
|
Affections oculaires |
|
|
œdème papillaire, diplopie |
|
|
|
Affections gastro-intestinales |
|
|
Vomissements, douleur abdominale, flatulence, nausée |
Diarrhées |
|
|
Troubles généraux et anomalies au site d’administration |
(adulte) œdème, (adulte) œdème périphérique |
(enfant) œdème, (enfant) œdème périphérique, réactions au site d’injection, asthénie |
Faiblesse, atrophie au site d’injection, saignement au site d’injection, masse au site d’injection, hypertrophie |
|
|
|
Affections du système immunitaire |
|
Formation d’anticorps |
|
|
|
|
Investigations |
|
|
|
Test de la fonction rénale anormal |
|
|
Troubles du métabolisme et de la nutrition |
(adulte) hyperglycémie modérée |
(enfant) diminution de la tolérance au glucose |
Hypoglycémie, hyperphosphatémie |
Diabète de type II |
|
|
Affections musculo-squelettiques et systémiques
|
(adulte) arthralgie, (adulte) myalgie |
(enfant) arthralgie, (enfant) myalgie, (adulte) raideurs dans les extrémités |
Atrophie musculaire, douleur osseuse, syndrome du canal carpien, (enfant) raideurs dans les extrémités |
|
|
|
Tumeurs bénignes, malignes et non précisées |
|
|
Tumeurs malignes, tumeurs |
|
(enfant) leucémie |
|
Affection du système nerveux |
(adulte) céphalée, (adulte) paresthésie |
Maux de tête, hypertonie, (adulte) insomnie |
Somnolence, nystagmus |
Neuropathie, augmentation de la pression intracrânienne, (enfant) insomnie, (enfant) paresthésie |
|
|
Affections psychiatriques |
|
|
Trouble de la personnalité |
|
|
|
Affections du rein et des voies urinaires |
|
|
Incontinence urinaire, hématurie, polyurie, besoin fréquent d’uriner/pollakiurie, urine anormale |
|
|
|
Affections des organes de reproduction et du sein |
|
|
Pertes génitales, (adulte) gynécomastie |
|
(enfant) gynécomastie |
|
Affections de la peau et du tissu sous-cutané |
|
|
Lipodystrophie, atrophie de la peau, dermatite exfoliative, urticaire, hirsutisme, hypertrophie de la peau |
|
|
La survenue de pancréatite a été rapportée, après commercialisation, lors de traitement par hormone de croissance (de fréquence indéterminée)
· Anticorps anti-somatropine. La protéine somatropine peut donner lieu à la formation d'anticorps. La détermination du pourcentage de la population traitée chez laquelle des anticorps ont été identifiés dépend du produit concerné. Leur capacité de liaison et leurs dosages sont généralement faibles, sans conséquence clinique. Toutefois, la recherche d'anticorps anti-somatropine doit être effectuée en cas d'absence de réponse à la somatropine.
· Leucémie : des cas de leucémies (très rares) ont été rapportés chez les enfants présentant un déficit en hormone de croissance, dont certains traités par la somatropine, et ont été inclus dans l’expérience post-commercialisation. Toutefois, l’augmentation de l’incidence de la leucémie sans facteur de prédisposition n’a pas été montrée.
· Des cas de luxation de la tête fémorale et de la maladie de Legg-Calve-Perthes ont été rapportés chez des enfants traités par l’hormone de croissance. La luxation de la tête fémorale survient plus fréquemment en cas de désordres endocriniens et la maladie de Legg-Calve-Perthes en cas de petite taille. En revanche, on ne sait pas si la fréquence de ces 2 maladies est plus élevée ou non lors d’un traitement avec la somatropine. Un inconfort, une douleur au niveau de la hanche et du genou doivent évoquer leur diagnostic.
· D’autres réactions indésirables peuvent être considérées comme un effet de classe, comme l’hyperglycémie en raison de la diminution de la sensibilité à l’insuline, la baisse du taux de thyroxine libre et l’éventuelle hypertension intracrânienne bénigne.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé doivent déclarer tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (Ansm) et réseau des Centres Régionaux de Pharmacovigilance. Site internet : www.ansm.sante.fr
On ne doit pas dépasser la posologie recommandée de ZOMACTON.
Bien qu'il n'ait pas été rapporté de surdosage avec ZOMACTON, on peut supposer qu’un surdosage pourrait entraîner une hypoglycémie initiale, suivie d'une hyperglycémie.
Les effets d’une administration répétée à long terme des doses supérieures à celles qui sont recommandées, sont inconnus. Cependant, une telle administration peut conduire à des signes et symptômes similaires aux effets connus de l’excès d’hormone de croissance chez l’homme (par ex. acromégalie).
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : SOMATROPINE ET ANALOGUES,
Code ATC : H 01AC 01
Propriétés pharmacodynamiques
Du fait de la similitude de ZOMACTON avec l’hormone de croissance humaine d’origine hypophysaire (h-GH) en ce qui concerne la séquence des acides aminés, la longueur de la chaîne (191 A.A.) et le profil pharmacocinétique, on peut s'attendre à des effets pharmacologiques semblables à ceux de l'hormone endogène.
· Croissance osseuse
L’hormone de croissance entraîne une croissance harmonieuse du squelette chez l'homme. Chez des enfants présentant un déficit confirmé en h-GH, l’administration de ZOMACTON a provoqué une accélération linéaire de la croissance. L’augmentation de la taille observée après administration de ZOMACTON est due à un effet de l’hormone au niveau des cartilages de conjugaison des os longs.
Chez les enfants n’ayant pas une concentration de h-GH suffisante, ZOMACTON entraîne une accélération de la croissance, et une élévation des concentrations de IGF-1 (Insulin-like Growth Factor/Somatomedine-C) semblable à celle observée après un traitement par h-GH. On a également observé une augmentation de la concentration moyenne des phosphatases alcalines sériques.
· Croissance tissulaire
En réponse à l’administration de l’hormone de croissance, on observe également une augmentation de la taille des autres tissus, proportionnelle à l’augmentation du poids corporel.
Ces modifications comportent : une croissance accrue du tissu conjonctif, de la peau et des annexes ; un développement du muscle squelettique en augmentant à la fois le nombre et la taille des cellules musculaires; la croissance du thymus ; une augmentation du volume du foie avec prolifération des cellules et une légère augmentation de la taille des gonades, des surrénales et de la thyroïde.
La croissance disproportionnée de la peau et des os plats et une maturation sexuelle accélérée n’ont pas été rapportées en association avec le traitement par l’hormone de croissance.
· Métabolisme protéique, glucidique et lipidique
L’hormone de croissance a un effet d’épargne sur les protides, avec augmentation du transport des acides aminés dans les tissus. Ces deux actions se conjuguent pour augmenter la synthèse des protéines. Le catabolisme glucidique et la lipogenèse sont diminués sous l’action de l’hormone de croissance.
A dose élevée, ou en l'absence d'insuline, l’hormone de croissance agit comme un agent diabétogène, entraînant des effets typiquement observés au cours du jeûne (c’est-à-dire intolérance aux glucides, inhibition de la lipogenèse, mobilisation des graisses et production de corps cétoniques).
· Métabolisme des sels minéraux
Les concentrations en sodium, potassium et phosphore sont maintenues après traitement par l’hormone de croissance. L’élimination accrue de calcium par le rein est compensée par l’augmentation de son absorption intestinale. Les concentrations sériques en calcium ne sont pas significativement modifiées chez les sujets recevant ZOMACTON ou la h-GH. Une élévation de la concentration sérique des phosphates inorganiques a été observée après administration de ZOMACTON ou de h-GH. L’accumulation de ces électrolytes traduit une augmentation des besoins au cours de la synthèse tissulaire.
5.2. Propriétés pharmacocinétiques
24 sujets adultes sains ont reçu la somatropine à la dose de 1,67 mg par injection sous-cutanée classique ou par le dispositif d’injection sans aiguille ZOMAJET VISION X. Le pic de la concentration plasmatique d’environ 20 ng/ml est retrouvé 3,5 à 4 heures après l’administration.
Une demi-vie terminale de 2,6 heures est observée après administration du produit avec le dispositif d’injection sans aiguille ZOMAJET VISION X. Cette donnée est probablement liée au facteur limitant que représente le processus d’absorption.
Les données provenant d’autres produits contenant de la somatropine suggèrent que la biodisponibilité de la somatropine administrée par voie sous-cutanée est environ de 80% chez l’adulte sain et que le foie aussi bien que les reins sont des organes importants pour le catabolisme des protéines et l’élimination du produit.
5.3. Données de sécurité préclinique
Les données précliniques issues des études classiques de toxicité à doses répétées et de génotoxicité n’ont révélé aucun risque chez l’Homme.
La somatropine obtenue par génie génétique est identique à l’hormone de croissance humaine endogène. Elle possède les mêmes propriétés biologiques et est habituellement administrée aux doses physiologiques. En conséquence, en l’absence d’effet attendu, aucune étude de toxicité générale, de toxicité sur la fonction de la reproduction, en carcinogenèse n’a été effectuée.
Mannitol
Phosphate disodique dodécahydraté
Phosphate monosodique dihydraté
Solvant
Métacrésol
Eau pour préparations injectables
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
Après reconstitution la solution peut être conservée au maximum pendant 28 jours entre 2°C et 8°C (au réfrigérateur), à l’abri de la lumière.
Après reconstitution, le flacon doit être conservé en position verticale.
6.4. Précautions particulières de conservation
A conserver au réfrigérateur (entre 2°C et 8°C) dans l'emballage extérieur, à l'abri de la lumière.
Après reconstitution, le flacon doit être conservé en position verticale.
6.5. Nature et contenu de l'emballage extérieur
ZOMACTON est fourni dans différents emballages selon les pays :
a) nécessaires pour une utilisation en injection avec aiguille :
Poudre : en flacon (verre de type I), muni d’un bouchon (caoutchouc, polymère halobutyle) avec une bague de sertissage en aluminium et un capuchon amovible (plastique).
Solvant : seringue (verre de type I) avec un capuchon d’embout (caoutchouc, polymère halobutyle), un bouchon-piston (caoutchouc, polymère halobutyle) et un connecteur de transfert du solvant (polycarbonate) - Boîte de 1, 3,5.
b) nécessaires pour une utilisation avec un dispositif sans aiguille ZOMAJET VISION X :
Poudre : en flacon (verre de type I), muni d’un bouchon (caoutchouc, polymère halobutyle) avec une bague de sertissage en aluminium et un capuchon amovible (plastique).
Solvant : seringue (verre de type I) avec un capuchon d’embout (caoutchouc, polymère halobutyle), un bouchon-piston (caoutchouc, polymère halobutyle) et un adaptateur pour flacon (polycarbonate et caoutchouc siliconé) – Boîtes de 1, 3, 5.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
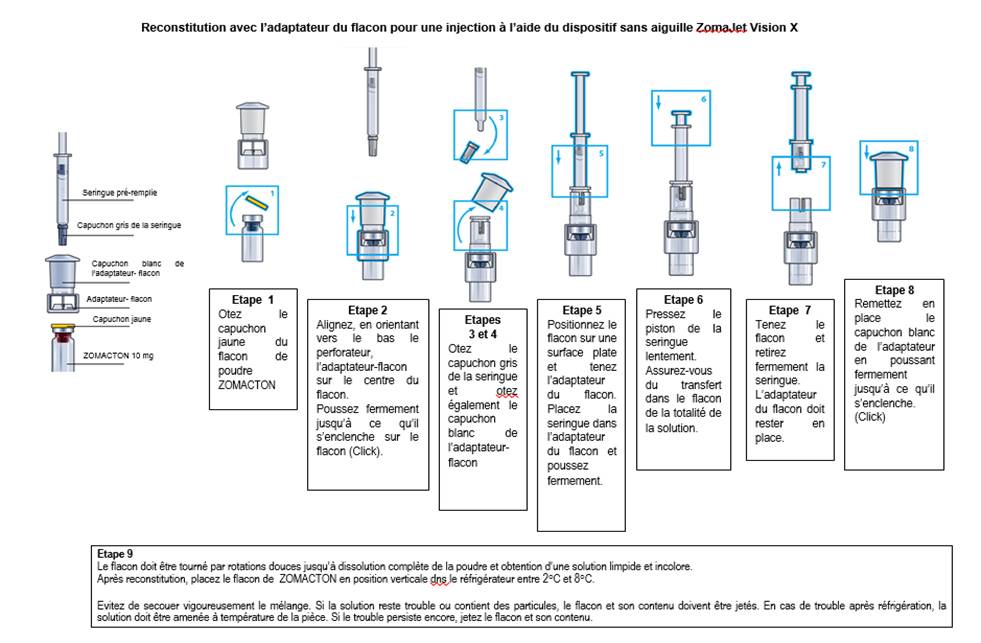
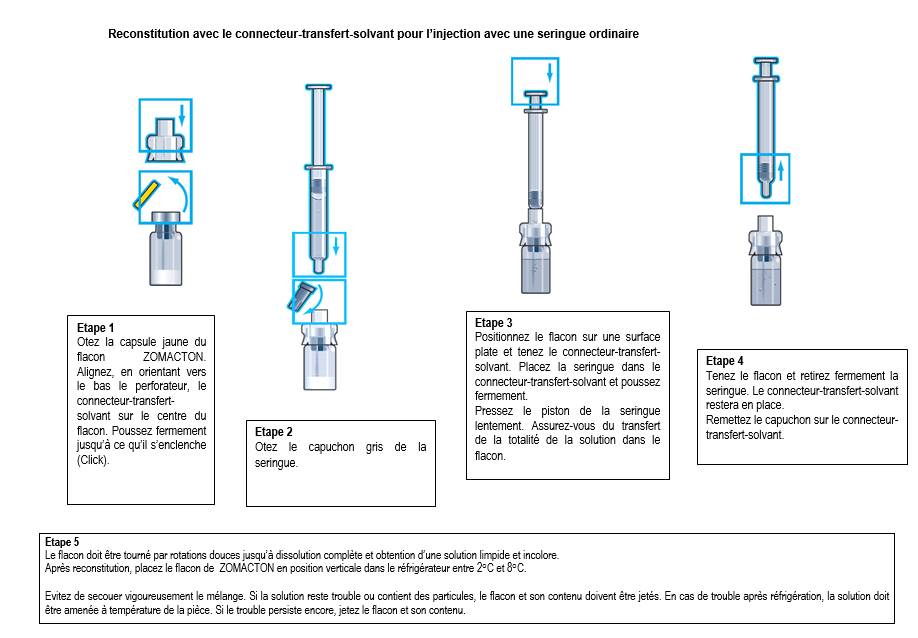
La poudre doit être exclusivement reconstituée en introduisant dans le flacon, le solvant fourni dans la seringue.
Voir la notice pour une description détaillée des instructions pour la reconstitution.
Une description générale de la reconstitution et du procédé d’administration est détaillée ci-dessous. La reconstitution doit être réalisée selon les règles de bonne pratique, en particulier dans le respect des conditions d’asepsie.
o Se laver les mains
o Enlever le capuchon de protection en plastique jaune du flacon
o Passer une solution antiseptique sur le haut du flacon afin d’éviter la contamination du contenu
o Positionner l’adaptateur-flacon ou le connecteur-transfert-solvant sur le centre du flacon, en orientant vers le bas le perforateur, puis pousser fermement jusqu’à ce qu’il s’enclenche. Enlever le capuchon de l’adaptateur
o Prendre la seringue et enlever le capuchon gris. Placer la seringue dans l’adaptateur / connecteur du flacon et injecter le solvant lentement en dirigeant le jet du liquide vers la paroi du flacon afin d’éviter la formation de mousse.
o Remettre le capuchon de l’adaptateur / du connecteur sur l’adaptateur / le connecteur.
o Faire tourner le flacon en rotations douces durant quelques minutes jusqu’à la dissolution complète du contenu. Ne pas secouer. Ceci pourrait provoquer la dénaturation de la substance active.
o Si la solution reste trouble ou contient des particules, elle ne doit pas être utilisée. En cas de trouble après réfrigération, le médicament doit être amené à température de la pièce. Si l’aspect trouble persiste, jeter le flacon et le contenu
o Le contenu doit être limpide et incolore après reconstitution.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.


7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
FERRING SAS
7, RUE JEAN-BAPTISTE CLEMENT
94250 GENTILLY
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 370 840-3: 10 mg de poudre en flacon (verre de type I), avec un bouchon (polymère halobutylique), muni d'une bague de sertissage (aluminium) et d'une capsule «Flip-off » (plastique) + 1 ml de solvant en seringue préremplie (verre de type I) munie d'un bouchon-piston (polymère halobutylique), avec adaptateur-flacon (polycarbonate et caoutchouc siliconé). Boîte de 1.
· 375 471-6: 10 mg de poudre en flacon (verre de type I), avec un bouchon (polymère halobutylique), muni d'une bague de sertissage (aluminium) et d'une capsule «Flip-off » (plastique) + 1 ml de solvant en seringue préremplie (verre de type I) munie d'un bouchon-piston (polymère halobutylique), avec adaptateur-flacon (polycarbonate et caoutchouc siliconé). Boîte de 3.
· 375 472-2: 10 mg de poudre en flacon (verre de type I), avec un bouchon (polymère halobutylique), muni d'une bague de sertissage (aluminium) et d'une capsule «Flip-off » (plastique) + 1 ml de solvant en seringue préremplie (verre de type I) munie d'un bouchon-piston (polymère halobutylique), avec adaptateur-flacon (polycarbonate et caoutchouc siliconé). Boîte de 5.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I.
Prescription initiale hospitalière annuelle réservée aux spécialistes en pédiatrie ou en endocrinologie et maladies métaboliques exerçant dans les services spécialisés en pédiatrie ou en endocrinologie et maladies métaboliques.