RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 16/06/2017
BRALTUS 10 microgrammes/dose, poudre pour inhalation en gélule
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Bromure de tiotropium............................................................................................ 16 microgrammes
Equivalant à tiotropium............................................................................................ 13 microgrammes
Pour une gélule.
La dose délivrée à la sortie de l’embout buccal du dispositif d’inhalation Zonda est de 10 microgrammes de tiotropium par gélule.
Excipient à effet notoire : chaque gélule contient 18 mg de lactose monohydraté.
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre pour inhalation en gélule.
Gélule de taille 3, incolore et transparente, contenant de la poudre blanche.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Voie inhalée.
Posologie :
Adultes âgés de 18 ans et plus : inhalation du contenu d’une gélule une fois par jour, à heure fixe, à l’aide du dispositif d’inhalation Zonda.
Ne pas dépasser la dose recommandée.
La dose délivrée par une seule gélule (10 microgrammes) est suffisante et constitue la dose usuelle du traitement par BRALTUS.
Les gélules de BRALTUS sont destinées à l'inhalation exclusivement et doivent être utilisées uniquement à l'aide du dispositif Zonda.
Ne pas avaler les gélules.
Populations spécifiques
Sujets âgés:
Le bromure de tiotropium peut être utilisé à la dose recommandée chez les patients âgés.
Insuffisance rénale:
Chez les patients présentant une insuffisance rénale légère (clairance de la créatinine > 50 ml/min), le bromure de tiotropium peut être utilisé à la dose recommandée. En cas d'insuffisance rénale modérée à sévère (clairance de la créatinine ≤ 50 ml/min) voir rubriques 4.4 et 5.2.
Insuffisance hépatique:
Le bromure de tiotropium peut être utilisé à la dose recommandée chez les patients présentant une insuffisance hépatique (voir rubrique 5.2).
Population pédiatrique
BRALTUS ne doit pas être utilisé chez les enfants et les adolescents âgés de moins de 18 ans. La sécurité et l’efficacité n’ont pas été établies pour cette tranche d'âge. Aucune donnée n’est disponible.
Il n'y a pas de justification à l'utilisation du bromure de tiotropium dans la population pédiatrique dans l’indication BPCO.
La sécurité et l’efficacité du bromure de tiotropium n’ont pas été établies chez les enfants et les adolescents âgés de moins de 18 ans dans le traitement de la mucoviscidose. Aucune étude n’est disponible.
Mode d’administration / Instructions pour la manipulation et l'utilisation du dispositif
Pour une administration correcte du médicament, le médecin prescripteur ou un autre professionnel de santé devra éduquer le patient au bon usage du dispositif d’inhalation.
Le dispositif d'inhalation Zonda est spécialement conçu pour les gélules de BRALTUS et ne doit pas être utilisé pour d'autres médicaments.
Le contenu des gélules de BRALTUS ne doit être inhalé qu'avec le dispositif d'inhalation Zonda. Ne pas utiliser un autre dispositif d’inhalation avec les gélules de BRALTUS.
Le dispositif d'inhalation Zonda doit être utilisé uniquement avec le flacon de gélules fourni. Ne pas réutiliser le dispositif d’inhalation avec un autre flacon de gélules. Eliminer le dispositif d'inhalation Zonda après 30 utilisations (15 utilisations pour la présentation contenant 15 gélules).
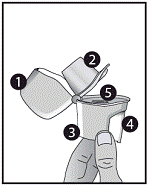
Dispositif Zonda:

1. Capuchon anti-poussière
2. Embout buccal
3. Base
4. Bouton-perforateur
5. Chambre centrale
1. Relever complètement le capuchon anti-poussière en le tirant vers le haut.

2. Tenir fermement la base du dispositif d’inhalation et ouvrir l’embout buccal en le tirant vers le haut, dans le sens de la flèche.
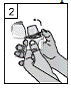
3. Prendre une gélule de BRALTUS dans le flacon, juste avant l’utilisation, et refermer soigneusement le flacon. Placer la gélule dans la chambre centrale (5) qui se situe dans la base du dispositif. Ne pas stocker de gélule à l’intérieur du dispositif d’inhalation Zonda.

4. Ne jamais placer une gélule directement dans l’embout buccal.
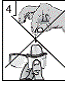
5. Refermer l'embout buccal jusqu'à entendre un clic et laisser le capuchon anti-poussière ouvert.

6. Tenir le dispositif verticalement, l'embout buccal dirigé vers le haut et enfoncer complètement le bouton-perforateur d'une seule pression, puis relâcher. Ceci perfore la gélule et libère le médicament que le patient inhalera lorsqu’il inspirera.

7. Expirer à fond. Il est important d’expirer à distance de l’embout buccal. Ne jamais expirer dans l'embout buccal.

8. Placer l’embout buccal entre les lèvres et maintenir la tête à la verticale. Refermer fermement les lèvres autour de l'embout buccal et inspirer lentement et profondément, avec un débit toutefois suffisant pour entendre ou sentir la gélule vibrer.
Inspirer jusqu'à remplir complètement les poumons, puis retenir sa respiration aussi longtemps que possible puis ôter le dispositif de la bouche. Reprendre une respiration normale et répéter les étapes 7 et 8, ce qui videra totalement la gélule de son contenu.
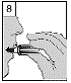
9. Après l'inhalation, ouvrir à nouveau l'embout buccal. Laisser tomber la gélule et la jeter. Refermer l'embout buccal et le capuchon anti-poussière pour ranger le dispositif d'inhalation Zonda.
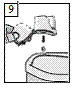
Les gélules de BRALTUS ne contiennent qu'une petite quantité de poudre et ne sont donc que partiellement remplies.
L’embout buccal du dispositif d'inhalation Zonda peut être essuyé à l’aide d’un chiffon sec.
4.4. Mises en garde spéciales et précautions d'emploi
Des réactions d'hypersensibilité immédiate peuvent apparaître après l'inhalation du bromure de tiotropium
En raison de son activité anticholinergique, le bromure de tiotropium doit être utilisé avec prudence en cas de glaucome à angle fermé, d'hypertrophie de la prostate ou de rétrécissement du col de la vessie (voir rubrique 4.8.).
Comme avec d'autres traitements par voie inhalée, un bronchospasme paradoxal peut survenir, se manifestant par une augmentation des sibilants et de la dyspnée immédiatement après l’inhalation de BRALTUS. Le bronchospasme paradoxal doit être immédiatement traité par un bronchodilatateur inhalé à action rapide. Le traitement par BRALTUS doit être arrêté immédiatement, et la conduite thérapeutique sera réévaluée pour envisager, si nécessaire, les alternatives thérapeutiques.
Le tiotropium doit être utilisé avec prudence chez les patients ayant des antécédents d'infarctus du myocarde dans les 6 mois précédents, une arythmie instable ou menaçant le pronostic vital, une arythmie ayant nécessité une intervention ou une modification du traitement médicamenteux dans les 12 mois précédents, ou chez les patients hospitalisés au cours de l’année précédente pour insuffisance cardiaque (class NYHA class III et IV). Les patients ayant de tels antécédents ont été exclus des essais cliniques et un retentissement lié à l'activité anticholinergique du tiotropium dans ces situations n'est pas exclu.
Les concentrations plasmatiques de bromure de tiotropium augmentent chez les patients présentant une fonction rénale altérée. Par conséquent, en cas d'insuffisance rénale modérée à sévère (clairance de la créatinine ≤ 50 ml/min), le bromure de tiotropium ne doit être utilisé que si le bénéfice attendu est supérieur au risque potentiel. A ce jour, il n'y a pas d'expérience à long terme avec le tiotropium chez les patients présentant une insuffisance rénale sévère (voir rubrique 5.2).
La poudre de tiotropium ne doit pas être mise en contact avec les yeux. Il conviendra d'avertir les patients du risque de déclenchement ou d'aggravation d'un glaucome à angle fermé pouvant se manifester par une douleur ou gêne oculaire, de vision floue transitoire avec halo visuel coloré associé à une rougeur et un œdème cornéo-conjonctival, en cas de projection intraoculaire de la poudre. En cas d'apparition d'un ou plusieurs de ces symptômes oculaires, l'utilisation du bromure de tiotropium doit être immédiatement arrêtée. Un avis médical est requis.
La sécheresse buccale observée avec les traitements anticholinergiques en général, peut à long terme favoriser la survenue de caries dentaires.
La posologie du bromure de tiotropium ne doit pas dépasser une prise par jour (voir rubrique 4.9).
Chaque gélule contient 18 mg de lactose monohydraté. Son utilisation est déconseillée chez les patients présentant une intolérance au galactose, un déficit en lactase de Lapp ou un syndrome de malabsorption du glucose ou du galactose (maladies héréditaires rares). Le lactose, qui est un excipient contenu dans la poudre de BRALTUS peut contenir des traces de protéines de lait qui peuvent provoquer des réactions chez les personnes allergiques aux protéines de lait.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L’utilisation des beta2-agonistes de longue durée d'action ou des corticoïdes inhalés n’a pas modifié de façon significative l’exposition au tiotropium.
L'administration concomitante de bromure de tiotropium et d'autres médicaments anticholinergiques n'a pas été étudiée et n’est, par conséquent, pas recommandée.
4.6. Fertilité, grossesse et allaitement
Fertilité
Aucune donnée clinique sur la fertilité n'est disponible avec le tiotropium. Une étude non-clinique effectuée chez l'animal avec du tiotropium n’a pas montré d’effets indésirables sur la fertilité (voir rubrique 5.3).
Grossesse
Les données disponibles sur l’utilisation du tiotropium chez la femme enceinte sont très limitées. Les études effectuées chez l’animal n’ont pas mis en évidence d’effets délétères directs ou indirects sur la reproduction avec des doses utilisées en thérapeutique clinique (voir rubrique 5.3). Par mesure de précaution, il est préférable d’éviter l’utilisation de BRALTUS pendant la grossesse.
Le passage du bromure de tiotropium dans le lait maternel n'a pas été étudié. Les études effectuées chez les rongeurs n'ont mis en évidence une excrétion du bromure de tiotropium qu'en très faible quantité dans le lait maternel. Néanmoins, par mesure de précaution, l'utilisation du bromure de tiotropium n'est pas recommandée au cours de l'allaitement. Le bromure de tiotropium est un principe actif de longue durée d'action. La décision de poursuivre ou non l'allaitement ou bien d'interrompre le traitement par BRALTUS doit tenir compte du bénéfice de l'allaitement chez l'enfant et du bénéfice du traitement par BRALTUS chez la femme.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
La plupart des effets indésirables rapportés peut être attribuée à l'activité anticholinergique du bromure de tiotropium.
Les fréquences de survenue des effets indésirables présentés ci-dessous ont été déterminées sur la base de l'incidence des effets indésirables observés chez les patients traités par tiotropium (9 647 patients) (c'est-à-dire les événements imputables au tiotropium), établie à partir du regroupement de 28 études cliniques contrôlées contre placebo, dont les durées de traitement étaient comprises entre 4 semaines et 4 ans.
La fréquence est définie selon la convention suivante :
Très fréquent (≥ 1/10) ; fréquent (≥ 1/100 à < 1/10) ; peu fréquent (≥ 1/1 000 à < 1/100) ; rare (≥ 1/10 000 à <1/1 000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classe de systèmes d’organes/Terme préférentiel MedDRA |
Fréquence de survenue |
|
Troubles du métabolisme et de la nutrition Déshydratation |
Fréquence indéterminée |
|
Troubles du système nerveux Etourdissements Céphalées Dysgueusie Insomnie |
Peu fréquent Peu fréquent Peu fréquent Rare |
|
Troubles oculaires Vision trouble Glaucome et augmentation de la pression intraoculaire |
Peu fréquent Rare |
|
Troubles cardiaques Fibrillation auriculaire Tachycardie supraventriculaire Tachycardie Palpitations |
Peu fréquent Rare Rare Rare |
|
Troubles respiratoires, thoraciques et médiastinaux Pharyngite Dysphonie Toux Bronchospasme Epistaxis Laryngite Sinusite |
Peu fréquent Peu fréquent Peu fréquent Rare Rare Rare Rare |
|
Troubles gastro-intestinaux Sécheresse buccale Reflux gastro-œsophagien Constipation Candidose oropharyngée Occlusion intestinale, y compris iléus paralytique Gingivite Glossite Dysphagie Stomatite Nausées Caries dentaires |
Fréquent Peu fréquent Peu fréquent Peu fréquent Rare Rare Rare Rare Rare Rare Fréquence indéterminée |
|
Troubles cutanés et du tissu sous-cutané, Troubles du système immunitaire Eruption cutanée Urticaire Prurit
Réactions d'hypersensibilité (y compris réactions d'hypersensibilité immédiate) Œdème de Quincke Réaction anaphylactique Infection cutanée, ulcération cutanée Sécheresse cutanée |
Peu fréquent Rare Rare Rare
Rare Fréquence indéterminée Fréquence indéterminée Fréquence indéterminée |
|
Troubles musculo-squelettiques et systémiques Articulations enflées |
Fréquence indéterminée |
|
Troubles rénaux et des voies urinaires Dysurie Rétention urinaire Infection urinaire |
Peu fréquent Peu fréquent Rare |
Réactions allergiques
Le lactose est un excipient qui peut contenir des traces de protéines de lait pouvant provoquer des réactions d'hypersensibilité chez les personnes allergiques aux protéines de lait.
En cas de survenue de réaction d’hypersensibilité ou allergique, le bromure de tiotropium doit être arrêté immédiatement et le patient doit être pris en charge de façon adaptée.
Bronchospasme paradoxal
Comme avec d'autres traitements par voie inhalée, un bronchospasme paradoxal peut survenir, se manifestant par une augmentation des sibilants et de la dyspnée immédiatement après l’inhalation de BRALTUS. Le bronchospasme paradoxal doit être immédiatement traité par un bronchodilatateur inhalé à action rapide. Le traitement par BRALTUS doit être arrêté immédiatement, et la conduite thérapeutique sera réévaluée pour envisager, si nécessaire, les alternatives thérapeutiques.
Description de certains effets indésirables :
Dans les essais cliniques contrôlés, les effets indésirables les plus fréquemment observés ont été des effets indésirables de type anticholinergiques tels que la sécheresse buccale survenue chez environ 4 % des patients. Dans 28 essais cliniques, la sécheresse buccale a été à l'origine de 18 arrêts de traitement parmi les 9 647 patients traités par le tiotropium (soit 0,2 % des patients traités).
Les effets indésirables graves attribués aux effets anticholinergiques incluent : glaucome, constipation et occlusion intestinale incluant iléus paralytique, ainsi que rétention urinaire.
Populations particulières :
Le risque de survenue d'effets anticholinergiques peut augmenter avec l'âge.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
L'administration de doses élevées de bromure de tiotropium peut déclencher l'apparition de symptômes de type anticholinergique.
Cependant, l'inhalation d'une dose unique allant jusqu'à 340 microgrammes de bromure de tiotropium n'a entrainé aucun effet indésirable de type anticholinergique systémique chez des volontaires sains. En outre, aucun effet indésirable significatif, hormis la sécheresse buccale, n'a été rapporté après 7 jours d'administration de doses de bromure de tiotropium allant jusqu'à 170 microgrammes chez des volontaires sains. Aucun effet indésirable significatif n'a par ailleurs été rapporté lors d'une étude de 4 semaines réalisée chez des patients présentant une BPCO, recevant des doses journalières maximales de 43 microgrammes de bromure de tiotropium.
En cas d'ingestion accidentelle de gélules de bromure de tiotropium, l'intoxication aiguë est peu probable compte tenu de la faible biodisponibilité orale.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Le bromure de tiotropium est un antagoniste spécifique des récepteurs muscariniques de longue durée d'action, souvent désigné en pratique clinique sous le terme "anticholinergique". En se fixant aux récepteurs muscariniques des muscles lisses des bronches, le bromure de tiotropium inhibe les effets cholinergiques (bronchoconstriction) de l'acétylcholine libérée à partir des terminaisons nerveuses parasympathiques. Il possède une affinité similaire pour les sous-types de récepteurs muscariniques M1 à M5. Au niveau des voies respiratoires, le bromure de tiotropium inhibe de façon réversible et compétitive les récepteurs M3, ce qui se traduit par une relaxation du muscle lisse bronchique. L'effet est dose-dépendant et persiste plus de 24 heures. La longue durée d'action est probablement due à la dissociation très lente des récepteurs M3, la demi-vie de dissociation étant significativement plus longue que celle observée avec l'ipratropium. Anticholinergique N-quaternaire, le bromure de tiotropium exerce un effet sélectif direct au niveau des bronches lorsqu'il est administré par inhalation; et offre ainsi une marge thérapeutique acceptable avant l'apparition d'effets anticholinergiques systémiques.
Effets pharmacodynamiques
La bronchodilatation est principalement due à un effet local (au niveau des voies respiratoires) et non pas à un effet systémique. Le tiotropium se dissocie plus rapidement des récepteurs M2 que des récepteurs M3, comme le suggèrent les études in vitro, marquant une sélectivité plus importante (exprimée de façon cinétique) pour les récepteurs de type M3 par rapport aux récepteurs de type M2. La fixation importante et prolongée aux récepteurs explique la bronchodilatation cliniquement significative et de longue durée chez les patients présentant une BPCO.
Electrophysiologie cardiaque
Electrophysiologie : lors d'une étude spécifique des effets du tiotropium sur l'intervalle QT conduite chez 53 volontaires sains, le tiotropium administré à la dose de 18 microgrammes et 54 microgrammes (soit trois fois la dose thérapeutique) pendant 12 jours n'a pas augmenté de façon significative l'intervalle QT sur l'électrocardiogramme.
Efficacité et sécurité clinique
Le programme de développement clinique du tiotropium a consisté en quatre études cliniques d'un an et deux études de 6 mois, toutes randomisées et en double aveugle, portant sur un total de 2 663 patients, dont 1 308 ont reçu le bromure de tiotropium. Parmi les études menées sur un an, deux étaient contrôlées contre placebo et deux contre un comparateur actif (ipratropium). Les deux études de 6 mois étaient contrôlées contre placebo et salmétérol. Ces études ont inclus des mesures de la fonction pulmonaire et des critères cliniques tels que dyspnée, exacerbations et qualité de vie.
Fonction pulmonaire
Dans ces études, le bromure de tiotropium était administré en dose unique quotidienne. Une augmentation significative de la fonction pulmonaire [volume expiré maximum lors de la première seconde (VEMS) et capacité vitale forcée (CVF)] était observée dans les 30 minutes suivant la première dose et pendant les 24 heures suivantes. L'état d'équilibre pharmacodynamique a été atteint en une semaine, l'effet bronchodilatateur maximal étant observé dès le troisième jour.
Une augmentation significative du DEP (débit expiratoire de pointe) du matin et du soir mesurés par les patients était observée dans le groupe traité par tiotropium. L'activité bronchodilatatrice du bromure de tiotropium était maintenue au cours de l'année pendant laquelle le produit était administré, sans épuisement de l'effet. Une étude clinique randomisée, contrôlée contre placebo, réalisée chez 105 patients présentant une BPCO, a mis en évidence un effet bronchodilatateur par rapport au placebo se maintenant pendant la totalité de l'intervalle de 24 heures entre deux prises, quel que soit le moment de l'administration, le matin ou le soir.
Etudes cliniques (jusqu’à 12 mois)
Dyspnée, tolérance à l’exercice
Une amélioration significative de la dyspnée (mesurée d'après l'indice de dyspnée transitionnel de Mahler), a été observée dans le groupe de patients traités par le bromure de tiotropium et s'est maintenue pendant toute la période de traitement.
Le retentissement de l'amélioration de la dyspnée sur la tolérance à l'exercice a été étudié dans deux essais cliniques randomisés, en double aveugle, contrôlés contre placebo chez 433 patients présentant une bronchopneumopathie chronique obstructive (BPCO) modérée à sévère. Au cours de ces essais, un traitement de 6 semaines avec le bromure de tiotropium a significativement amélioré le temps d'endurance au cours d'un exercice standardisé sur cycloergomètre à 75 % de la puissance maximale, de 19,7 % (essai A) et de 28,3 % (essai B) par rapport au placebo.
Qualité de vie liée à la santé
Lors d'un essai clinique randomisé, en double aveugle et contre placebo de 9 mois chez 492 patients, une amélioration du score total de la qualité de vie, évalué par le questionnaire respiratoire du Saint George's Hospital (SGRQ) a été observé dans le groupe de patients traités par le bromure de tiotropium. La proportion des patients traités par tiotropium chez lesquels le score total de ce questionnaire s'est cliniquement amélioré de plus de 4 unités, était de 10,9 % plus élevée que dans le groupe placebo (59,1 % dans le groupe bromure de tiotropium contre 48,2 % dans le groupe placebo (p = 0,029)). La différence moyenne entre les groupes était de 4,19 unités (p = 0,001 ; intervalle de confiance : 1,69 - 6,68). Les améliorations du score SGRQ étaient de 8,19 unités pour le domaine relatif aux « symptômes », de 3,91 unités pour le domaine « activité » et de 3,61 unités pour le domaine « impact sur la vie quotidienne ». Les améliorations de ces domaines distincts étaient statistiquement significatives.
Exacerbations de BPCO
Dans un essai clinique randomisé, en double aveugle, contrôlé contre placebo chez 1 829 patients atteints de bronchopneumopathie chronique obstructive (BPCO) modérée à très sévère, le bromure de tiotropium a réduit de façon statistiquement significative la proportion de patients présentant des exacerbations de BPCO (de 32,2 % à 27,8 %) et réduit de façon statistiquement significative le nombre d'exacerbations de 19 % (de 1,05 à 0,85 exacerbations par patient par an). De plus, 7,0 % des patients du groupe bromure de tiotropium contre 9,5 % des patients du groupe placebo ont été hospitalisés pour une exacerbation de BPCO (p = 0,056). Le nombre d'hospitalisation dû à la BPCO a été réduit de 30 % (de 0,25 à 0,18 par patient par an).
Un essai de 1 an, randomisé, en double aveugle, double placebo, en groupe parallèle, a comparé l’effet d’un traitement avec 18 microgrammes de tiotropium une fois par jour à celui de salmétérol 50 microgrammes en inhalateur doseur pressurisé deux fois par jour sur la survenue d’exacerbations modérées et sévères chez un total de 7 376 patients atteints de BPCO et ayant des antécédents d’exacerbations durant l’année précédant l'inclusion dans l'étude.
Tableau 1 : Résumé de l’analyse des exacerbations
|
Critères de jugement |
Tiotropium 18 microgrammes poudre pour inhalation4 N = 3 707 |
Salmétérol 50 microgrammes (inhalateur doseur pressurisé) N = 3 669 |
Risque relatif (« hazard ratio ») (IC à 95 %) |
Valeur de p |
|
Délai (jours) de survenue de la première exacerbation1 |
187 |
145 |
0,83 (0,77-0,90) |
< 0,001 |
|
Délai de survenue de la première exacerbation sévère (nécessitant une hospitalisation)2 |
- |
- |
0,72 (0,61-0,85) |
< 0,001 |
|
Patients avec ≥ 1 exacerbation, n (%)3 |
1 277 (34,4) |
1 414 (38,5) |
0,90 (0,85-0,95) |
< 0,001 |
|
Patients avec ≥ 1 exacerbation sévère (nécessitant une hospitalisation), n (%)3 |
262 (7,1) |
336 (9,2) |
0,77 (0,66-0,89) |
< 0,001 |
1 Le délai (en jours) se réfère au 1er quartile des patients. Le délai a été analysé en utilisant un modèle de Cox avec comme covariables le centre investigateur et le traitement. (Le risque relatif se réfère au rapport de risque : « Hazard ratio »).
2 Le délai a été analysé en utilisant un modèle de Cox avec comme covariables le centre et le traitement. Le délai (en jours) pour le 1er quartile de patients ne peut pas être calculé du fait d’un nombre trop faible de patients présentant une exacerbation sévère.
3 Le nombre de patients présentant un événement a été analysé par un test de Cochran-Mantel-Haenszel stratifié sur le centre. (Le risque se réfère au rapport de risque « Hazard ratio »)
4 Le tiotropium 18 microgrammes, poudre pour inhalation délivre 10 microgrammes de tiotropium.
Le délai moyen de survenue de la première exacerbation était supérieur dans le groupe bromure de tiotropium comparé au groupe de traitement par salmétérol (187 jours versus 145 jours), avec une réduction du risque de survenue de 17 % (Hazard ratio = 0,83 ; Intervalle de confiance (IC) à 95 % : 0,77 à 0,90 ; p < 0,001). Le délai moyen de survenue de la première exacerbation sévère (nécessitant une hospitalisation) était également supérieur dans le groupe bromure de tiotropium (Hazard ratio = 0,72 ; IC à 95 % : 0,61 à 0,85 ; p < 0,001).
Essais cliniques à long terme (plus d’1 an, jusqu’à 4 ans)
Dans un essai clinique de 4 ans, randomisé, en double aveugle, contrôlé contre placebo chez 5 993 patients randomisés (3 006 dans le groupe placebo et 2 987 dans le groupe bromure de tiotropium), l'amélioration du VEMS par rapport au placebo est restée constante tout au long de la période d'étude de 4 ans. Une plus grande proportion de patients ont pris au moins 45 mois de traitement dans le groupe bromure de tiotropium par rapport au groupe placebo (63,8 % vs. 55,4 %, p < 0,001). Le taux annuel de déclin du VEMS a été similaire entre le bromure de tiotropium et le placebo. Pendant la période de traitement, une réduction du risque de mortalité de l'ordre de 16 % était retrouvée. L'incidence de la mortalité a été de 4,79 pour 100 patients-années dans le groupe placebo contre 4,10 pour 100 patients-années dans le groupe tiotropium (hazard ratio (tiotropium/placebo) = 0,84, intervalle de confiance à 95 %: 0,73 - 0,97). Avec le traitement par tiotropium, la survenue de cas d'insuffisances respiratoires (déclarés en tant qu'évènements indésirables) a été plus faible par rapport au groupe placebo de 19 % (2,09 versus 1,68 cas pour 100 patients-années, risque relatif (tiotropium/placebo) = 0,81, intervalle de confiance à 95 %: 0,65 - 0,999).
Etude du tiotropium contrôlée par une substance active
Une étude à long terme menée à grande échelle, randomisée, en double aveugle, contrôlée et incluant une période d’observation de 3 ans, a comparé l’efficacité et la sécurité du bromure de tiotropium, poudre pour inhalation et du bromure de tiotropium, inhalateur « soft mist » (5 694 patients recevant le bromure de tiotropium, poudre pour inhalation ; 5 711 patients recevant le bromure de tiotropium, inhalateur « soft mist »). Les critères principaux d’évaluation ont été le délai de survenue de la première exacerbation de BPCO, le délai de survenue du décès toutes causes confondues et, dans un sous-groupe (906 patients), le VEMS résiduel (pré-dose).
Le délai avant la première exacerbation de BPCO a été numériquement similaire au cours de l’étude entre le bromure de tiotropium, poudre pour inhalation et le bromure de tiotropium, inhalateur « soft mist » (hazard ratio (bromure de tiotropium, poudre pour inhalation/bromure de tiotropium, inhalateur « soft mist ») de 1,02 avec un IC à 95% : 0,97 à 1,08). Le nombre médian de jours avant la première exacerbation a été de 719 jours pour le bromure de tiotropium, poudre pour inhalation et de 756 jours pour le bromure de tiotropium, inhalateur « soft mist ».
L’effet bronchodilatateur du bromure de tiotropium, poudre pour inhalation a été maintenu pendant 120 semaines, et a été similaire à celui du bromure de tiotropium, inhalateur « soft mist ». La différence moyenne du VEMS résiduel pour le bromure de tiotropium, poudre pour inhalation comparativement au bromure de tiotropium, inhalateur « soft mist » a été de 0,010 l (IC à 95% : -0,018 à 0,038 l).
Dans l’étude clinique conduite après la date de commercialisation et comparant le bromure de tiotropium, inhalateur « soft mist » et le bromure de tiotropium, poudre pour inhalation, la mortalité toutes causes confondues (incluant le suivi de la survie) a été similaire (hazard ratio bromure de tiotropium, poudre pour inhalation/bromure de tiotropium, inhalateur « soft mist » de 1,04 avec un IC à 95% : 0,91 à 1,19).
Population pédiatrique
L’Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec le bromure de tiotropium dans tous les sous-groupes de la population pédiatrique dans le cadre du traitement de la BPCO et de la mucoviscidose (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).
5.2. Propriétés pharmacocinétiques
Le bromure de tiotropium est un ammonium quaternaire non chiral, peu soluble dans l'eau. Il est administré par voie inhalée sous forme de poudre sèche. Après inhalation, la majorité de la dose délivrée se dépose au niveau du tractus digestif et, dans une plus faible proportion, au niveau du poumon. De nombreux résultats pharmacocinétiques décrits dans les paragraphes suivants ont été obtenus avec des doses plus élevées que celles recommandées en clinique.
Après inhalation de poudre sèche chez de jeunes volontaires sains, la biodisponibilité absolue est de 19,5 %, ce qui suggère que la fraction atteignant le poumon présente une biodisponibilité élevée. La biodisponibilité absolue des solutions orales de tiotropium est de 2 à 3 %. Les concentrations plasmatiques maximales de tiotropium ont été observées 5-7 minutes après l'inhalation.
À l’état d’équilibre, les concentrations plasmatiques maximales de tiotropium chez les patients présentant une BPCO ont été de 12,9 pg/ml et ont diminué rapidement selon un modèle à compartiments multiples. Les concentrations plasmatiques minimales à l’état d’équilibre ont été de 1,71 pg/ml. L’exposition systémique au tiotropium après inhalation par le bromure de tiotropium, poudre pour inhalation a été similaire à celle observée après inhalation de bromure de tiotropium, inhalateur « soft mist ».
Distribution
La liaison du tiotropium aux protéines plasmatiques est de 72 % et son volume de distribution est de 32 l/kg. Les concentrations pulmonaires locales n'ont pas été mesurées, mais compte tenu du mode d'administration, des concentrations beaucoup plus élevées sont attendues. Les études conduites chez le rat n'ont pas révélé de passage significative du bromure de tiotropium à travers la barrière hémato-encéphalique.
Métabolisme
Le métabolisme du bromure de tiotropium est faible. Chez des volontaires sains jeunes, l'excrétion urinaire de la substance non métabolisée a atteint 74 % de la dose après une administration intraveineuse. L'ester du bromure de tiotropium est clivé, de façon non enzymatique, en un dérivé alcool (N-méthylscopine) et un dérivé acide (acide dithiénylglycolique), inactifs sur les récepteurs muscariniques. Les études réalisées in vitro sur des microsomes hépatiques et des hépatocytes d'origine humaine montrent qu'une petite partie supplémentaire (< 20 % de la dose administrée par voie intraveineuse) est métabolisée par une réaction d'oxydation par le cytochrome P450 (CYP) puis par conjugaison avec le glutathion, donnant naissance à une série de métabolites de phase II.
Les études in vitro effectuées sur des microsomes hépatiques révèlent que la voie enzymatique peut être inhibée par les inhibiteurs du CYP 2D6 (et 3A4), la quinidine, le kétoconazole et le gestodène. Les iso-enzymes CYP 2D6 et 3A4 sont donc impliquées pour une part dans le métabolisme. Même à des concentrations supra-thérapeutiques, le bromure de tiotropium n'inhibe pas les iso-enzymes CYP 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 ou 3A dans les microsomes hépatiques d'origine humaine.
Élimination
La demi-vie du tiotropium est comprise entre 27 et 45 heures chez les patients atteints de BPCO. La clairance totale a été de 880 ml/min après une dose intraveineuse chez de jeunes volontaires sains. Le tiotropium administré par voie intraveineuse est essentiellement éliminé par voie urinaire sous forme inchangée (74 %). A l’état d’équilibre, après inhalation de la poudre par des patients atteints de BPCO, 7 % (1,3 microgrammes) est excrété sous forme inchangée par voie urinaire dans les 24 heures, le reste correspondant principalement à du produit non absorbé au niveau digestif et éliminé par voie fécale. La clairance rénale du tiotropium est supérieure à la clairance de la créatinine, ce qui indique une sécrétion urinaire. Après inhalation chronique une fois par jour chez des patients présentant une BPCO, l'état d'équilibre pharmacocinétique a été atteint au 7ème jour, sans accumulation par la suite.
Linéarité/non-linéarité
La pharmacocinétique du tiotropium est linéaire dans l’intervalle de doses thérapeutiques quelque soit la formulation.
Populations de patients particulières :
Sujets âgés : à l'instar des médicaments excrétés majoritairement par voie rénale, la clairance rénale de tiotropium diminue avec l'âge (365 ml/min chez des sujets de moins de 65 ans présentant une BPCO contre 271 ml/min chez des patients âgés de 65 ans ou plus présentant une BPCO). Cela n’a pas entraîné une augmentation des valeurs de l’ASC0-6h ou de la Cmax,SS.
Insuffisance rénale : après inhalation de la dose quotidienne de tiotropium chez des patients présentant une BPCO et une insuffisance rénale légère (CLCR 50-80 ml/min) les valeurs d’ASC0-6h,SS retrouvées à l’état d’équilibre étaient légèrement supérieures (de 1,8 à 30%) et les valeurs de Cmax,SS étaient similaires comparativement aux valeurs observées chez des patients ayant une fonction rénale normale (CLCR > 80 ml/min). Chez les patients présentant une BPCO et une insuffisance rénale modérée à sévère (CLCR < 50 ml/min), l’exposition totale après administration intraveineuse de tiotropium était doublée (augmentation de 82 % de l’ASC0-4h et de 52 % de la Cmax) comparativement aux patients présentant une fonction rénale normale. Ces résultats ont été confirmés par la mesure des concentrations plasmatiques après inhalation sous forme de poudre.
Insuffisance hépatique : l'insuffisance hépatique ne devrait pas avoir d'influence notable sur la pharmacocinétique de tiotropium, dans la mesure où il est essentiellement éliminé par voie rénale (74 % chez le jeune volontaire sain) et métabolisé par simple clivage non enzymatique des liaisons esters en produits pharmacologiquement inactifs.
Patients japonais présentant une BPCO : une comparaison entre différentes études a révélé des concentrations plasmatiques maximales moyennes de tiotropium 10 minutes après l’administration à l’état d’équilibre 20 % à 70 % supérieures chez les patients japonais présentant une BPCO comparativement aux patients caucasiens après inhalation de tiotropium, mais aucun signal d’une mortalité supérieure ou d’un risque cardiaque augmenté n’a été détecté chez les patients japonais. Les données pharmacocinétiques disponibles pour les populations d'origines ethniques différentes sont insuffisantes.
Relations pharmacocinétique/pharmacodynamique
Il n'existe aucune relation directe entre la pharmacocinétique et la pharmacodynamie.
5.3. Données de sécurité préclinique
Des effets délétères sur la gestation, le développement embryo-fœtal, la parturition ou le développement post-natal n'ont été observés qu'à des doses toxiques pour les mères. Le bromure de tiotropium n'a pas induit d'effets tératogènes chez le rat et le lapin.
Dans une étude de la reproduction et de la fertilité chez le rat, aucun effet indésirable n'a été observé sur la fertilité ou l'accouplement chez les parents et leur descendance aux doses administrées.
Les effets sur l'appareil respiratoire (irritation) et uro-génital (prostatite), ainsi que des effets délétères sur les fonctions de reproduction ont été observés après administration locale ou systémique de doses cinq fois supérieures à la dose thérapeutique. Les études de génotoxicité et de carcinogenèse n'ont pas révélé de risque particulier pour l'Homme.
Lactose monohydraté (contenant des protéines de lait).
Gélule composée d’hydroxypropylméthylcellulose (HPMC), connu sous le nom d’hypromellose.
2 ans.
Après la première ouverture : 30 jours (flacon de 15 gélules) ou 60 jours (flacon de 30 gélules).
6.4. Précautions particulières de conservation
Ne pas mettre au réfrigérateur. Ne pas congeler.
6.5. Nature et contenu de l'emballage extérieur
Flacon en polyéthylène haute densité (PEHD) fermé par un bouchon à vis en polypropylène (PP) avec bague de sécurité en polyéthylène (PE) et capsule de déshydratant en polyéthylène basse densité (PEBD) contenant un gel de silice. Chaque flacon contient 15 ou 30 gélules, fournies dans une boîte contenant un dispositif d’inhalation Zonda.
L’inhalateur Zonda est un dispositif unidose pour inhalation muni d’un corps et un capuchon verts et d’un bouton-perforateur blanc, en plastique (ABS) et en acier inoxydable.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
100-110, ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 938 1 8 :15 gélules dans un flacon (PEHD + dispositif d’inhalation Zonda
· 34009 300 938 2 5 :30 gélules dans un flacon (PEHD + dispositif d’inhalation Zonda
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I