
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 10/07/2017
AIRFLUSAL FORSPIRO 500 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque dose mesurée d’AIRFLUSAL FORSPIRO fournit :
Pour 50 microgrammes/500 microgrammes/dose, poudre pour inhalation, pré-dispensée :
50 microgrammes de salmétérol (sous forme de xinafoate) et 500 microgrammes de propionate de fluticasone.
Correspondant à une dose délivrée de :
45 microgrammes de salmétérol (sous forme de xinafoate de salmétérol) et 465 microgrammes de propionate de fluticasone.
Excipient à effet notoire : lactose monohydraté : 11,95 mg par dose mesurée.
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre pour inhalation, pré-dispensée.
Blanche, poudre homogène.
La poudre pré-dispensée, contenue dans un blister, est délivrée par un inhalateur de poudre sèche, en plastique violet.
4.1. Indications thérapeutiques
AIRFLUSAL FORSPIRO est indiqué en traitement continu de l'asthme, dans les situations où l'administration par voie inhalée d'un médicament associant un corticoïde et un bronchodilatateur β2-agoniste de longue durée d'action est justifiée :
· Chez des patients insuffisamment contrôlés par une corticothérapie inhalée et la prise d'un bronchodilatateur β2-agoniste de courte durée d'action par voie inhalée "à la demande"
ou
· Chez des patients contrôlés par l'administration d'une corticothérapie inhalée associée à un traitement continu par β2-agoniste de longue durée d'action par voie inhalée.
Bronchopneumopathie chronique obstructive (BPCO)
AIRFLUSAL FORSPIRO est indiqué en traitement symptomatique de la BPCO chez les patients dont le VEMS (mesuré avant administration d'un bronchodilatateur) est inférieur à 60 % de la valeur théorique et présentant des antécédents d'exacerbations répétées et des symptômes significatifs malgré un traitement bronchodilatateur continu.
4.2. Posologie et mode d'administration
AIRFLUSAL FORSPIRO doit être uniquement administré par voie inhalée.
Il conviendra d'informer le patient que pour observer un effet optimal du traitement, AIRFLUSAL FORSPIRO doit être administré quotidiennement même lorsque les symptômes sont améliorés.
Le médecin devra vérifier régulièrement que le dosage prescrit d’AIRFLUSAL FORSPIRO est bien adapté à l'état clinique du patient. La posologie ne sera modifiée que sur avis médical.
Il convient de toujours rechercher la posologie minimale efficace. Lorsque les symptômes sont contrôlés par la plus faible posologie recommandée en deux prises par jour, l'administration d'un corticoïde inhalé seul sera alors envisagée.
Il pourra être également envisagé de réduire la posologie d’AIRFLUSAL FORSPIRO à une prise par jour, si le médecin estime nécessaire de maintenir un traitement par β2-mimétique de longue durée d'action pour le contrôle des symptômes. L'horaire de la prise d’AIRFLUSAL FORSPIRO sera alors fonction de la fréquence d'apparition des symptômes. Si les symptômes sont à prédominance nocturne, AIRFLUSAL FORSPIRO sera administré le soir ; s’ils sont diurnes, AIRFLUSAL FORSPIRO sera administré le matin.
Le dosage d’AIRFLUSAL FORSPIRO qui sera prescrit au patient devra correspondre à la dose de propionate de fluticasone adaptée à la sévérité de son asthme. Si les dosages disponibles de cette association fixe ne répondent pas aux nécessités pour ajuster les posologies en fonction de l'état du patient, β2-agonistes et/ou corticoïdes devront être prescrits individuellement.
Posologie
Doses recommandées :
Asthme
Adultes et adolescents de 12 ans et plus :
Une inhalation de 500 µg de propionate de fluticasone et 50 µg de salmétérol 2 fois par jour.
AIRFLUSAL FORSPIRO peut être envisagé en traitement d'initiation pendant une courte période d'essai chez des adultes et adolescents ayant un asthme persistant modéré (défini par l'existence d'une symptomatologie diurne, l'utilisation quotidienne d'un bronchodilatateur de courte durée d'action en traitement symptomatique de secours et une obstruction bronchique modérée à sévère) et chez qui il apparaît essentiel d'obtenir un contrôle rapide de l'asthme. Dans ces cas, la dose initiale recommandée est une inhalation de 100 microgrammes de propionate de fluticasone et 50 microgrammes de salmétérol, deux fois par jour (donné individuellement ou en association fixe).
Lorsque le contrôle de l'asthme est obtenu, le traitement doit être réévalué afin d'envisager la réduction du traitement à un corticoïde inhalé seul. Il est important que les patients soient suivis régulièrement lors de la période de réduction du traitement.
Il n'a pas été établi de bénéfice évident d’AIRFLUSAL FORSPIRO utilisé en traitement d'initiation par rapport à un traitement inhalé par propionate de fluticasone seul, lorsque 1 à 2 des critères de sévérité évoqués ci-dessus ne sont pas présents. Dans la majorité des cas, le traitement de première intention demeure l'administration de corticoïdes inhalés seuls. AIRFLUSAL FORSPIRO n'est pas destiné au traitement de première intention de l'asthme léger. Le dosage 100 microgrammes /50 microgrammes de l’association propionate de fluticasone / salmétérol ne convient pas aux adultes et aux enfants atteints d'asthme sévère ; chez ces patients la dose appropriée de corticoïdes inhalés devra être ajustée individuellement avant d'instaurer un traitement par une association fixe.
Si le dosage d’AIRFLUSAL FORSPIRO ne répond pas aux nécessités pour ajuster la posologie requise, d’autres spécialités de dosages différents de salmétérol/fluticasone sont disponibles.
Bronchopneumopathie chronique obstructive
Adultes :
Une inhalation de 500 µg de propionate de fluticasone et 50 µg de salmétérol 2 fois par jour.
Populations à risque :
Il n'y a pas lieu d'ajuster les doses chez les sujets âgés ou atteints d'insuffisance rénale. Aucune donnée n'est disponible concernant l'utilisation d’AIRFLUSAL FORSPIRO chez les patients atteints d'insuffisance hépatique.
Population pédiatrique :
Asthme:
AIRFLUSAL FORSPIRO ne doit pas être utilisé chez les enfants.
Bronchopneumopathie chronique obstructive :
AIRFLUSAL FORSPIRO ne doit pas être utilisé chez les enfants et adolescents.
Instructions d’utilisation :
Les patients doivent être formés à l’utilisation de l’inhalateur Forspiro et la bonne utilisation doit être vérifiée régulièrement.
L’inhalateur contient 60 doses de médicament en poudre dans une bandelette d’aluminium enroulée. Il comporte un compteur de doses qui indique le nombre de doses restant en comptant de 60 à 0. Lorsque les 10 dernières doses sont atteintes les nombres apparaissent sur un fond rouge.
L’inhalateur n’est pas rechargeable – il doit être jeté lorsqu’il est vide et remplacé par un nouveau.

Avant d’utiliser l’inhalateur
· Le volet transparent de la chambre latérale doit être ouvert.
· La bandelette d’aluminium doit être retirée de la chambre latérale en tirant soigneusement toute la longueur de la bandelette contre les « dents » de la chambre latérale comme indiqué ci-dessous. La bandelette ne doit pas être tirée ou tiraillée.
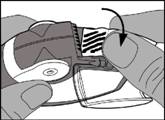
· Le volet de la chambre latérale doit être fermé et la bandelette utilisée doit être jetée.
Remarque : lorsque l’inhalateur est utilisé, la chambre latérale va se remplir progressivement avec la bandelette utilisée. La bandelette d’aluminium avec les barres noires ne contient pas de médicament. Finalement les sections numérotées de la bandelette vont apparaitre dans la chambre latérale. Il ne doit jamais y avoir plus de 2 sections de la bandelette d’aluminium dans la chambre latérale car elles pourraient boucher l’inhalateur. La bandelette doit être découpée soigneusement comme indiqué ci-dessus et jetée de manière sécurisée.
Utilisation de l’inhalateur
L’inhalateur doit être tenu dans les mains, comme indiqué sur les illustrations.
1 - Ouvert
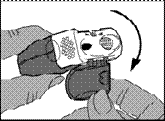
· Le couvercle de protection doit être ouvert vers le bas pour dégager l’embout buccal.
· Le compteur de doses doit être vérifié pour connaître le nombre de doses restantes.
2 - Préparation de la dose
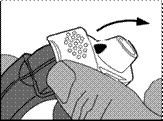
· Le bord du levier blanc doit être soulevé. La chambre latérale doit être fermée.
Remarque : le levier blanc ne doit être actionné que lorsque le patient est prêt à inhaler une dose du médicament. Des doses seront gaspillées si le patient joue avec le levier blanc.
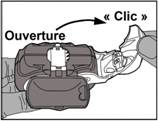
· Ouverture : le levier blanc doit être ouvert entièrement jusqu’au maximum et jusqu’au clic. Cette action déplace une nouvelle dose dans la position avec le numéro au-dessus.

· Fermeture : ensuite, le levier blanc doit être fermé complètement jusqu’à ce qu’il retrouve sa position d’origine en émettant un clic. L’inhalateur est maintenant prêt pour une utilisation immédiate.
3 - Inhalation de la dose
· À distance de l’embout buccal, le patient doit expirer le plus possible sans que cela lui soit inconfortable. Il ne doit jamais expirer directement dans l’inhalateur car cela pourrait affecter la dose.
· L’inhalateur doit être maintenu horizontal avec le couvercle de protection dirigé vers le bas.
· Les lèvres doivent être refermées fermement autour de l’embout buccal.
· Le patient doit inspirer régulièrement et profondément à travers l’inhalateur et non par le nez.

· L’inhalateur doit être retiré de la bouche et le souffle doit être retenu pendant 5 à 10 secondes ou aussi longtemps que possible sans que cela ne soit inconfortable.
· Ensuite le patient doit expirer lentement, mais pas dans l’inhalateur.
· Le couvercle de protection doit être refermé sur l’embout buccal.
· La bouche doit être rincée avec de l’eau qui doit être recrachée ensuite. Cela pourra aider à éviter une infection fongique buccale et un enrouement.
Nettoyage
· L’extérieur de l’embout buccal doit être essuyé avec un tissu propre et sec, si nécessaire.
· L’inhalateur ne doit pas être démonté pour le nettoyer ou pour toute autre raison.
· Les éléments de l’inhalateur ne doivent pas être nettoyés avec de l’eau ou des chiffons humides car l’humidité peut affecter la dose.
· Ne jamais insérer d’aiguilles ou d’objets pointus dans l’embout buccal ou tout autre élément car cela pourrait endommager l’inhalateur.
4.4. Mises en garde spéciales et précautions d'emploi
Le traitement par AIRFLUSAL FORSPIRO ne doit pas être initié pendant une phase d'exacerbation, ni en cas d'aggravation significative ou de détérioration aiguë de l'asthme.
Des évènements indésirables graves liés à l'asthme et des exacerbations peuvent survenir lors du traitement par AIRFLUSAL FORSPIRO. Il convient d'informer les patients que si les symptômes de l'asthme persistent ou s'aggravent au cours du traitement par AIRFLUSAL FORSPIRO, ils doivent continuer leur traitement mais prendre avis auprès de leur médecin.
Une augmentation de la consommation de bronchodilatateurs à action rapide et de courte durée pour traiter les symptômes, ou une diminution de la réponse à ceux-ci, est le signe d'une déstabilisation de la maladie. Dans ce cas, le patient devra consulter son médecin. Une détérioration plus ou moins rapide du contrôle des symptômes doit faire craindre une évolution vers un asthme aigu grave pouvant mettre en jeu le pronostic vital et, par conséquent, nécessite une consultation médicale urgente. Il conviendra alors d'envisager une augmentation de la corticothérapie.
Dès que les symptômes de l'asthme sont contrôlés, une diminution progressive de la dose d’AIRFLUSAL FORSPIRO doit être envisagée. Il est important que les patients soient suivis régulièrement lors de la période de réduction du traitement. La dose minimale efficace d’AIRFLUSAL FORSPIRO doit être utilisée (voir rubrique 4.2).
Chez les patients atteints de BPCO exacerbée, un traitement avec des corticostéroïdes systémiques est généralement indiqué, par conséquent, les patients doivent consulter un médecin si les symptômes s’aggravent avec AIRFLUSAL FORSPIRO.
Chez les patients asthmatiques, le traitement par AIRFLUSAL FORSPIRO ne devra pas être interrompu brusquement en raison d'un risque d'exacerbation. Par ailleurs, il conviendra de toujours rechercher la posologie minimale efficace sous contrôle médical. Chez les patients atteints de BPCO, l'arrêt du traitement peut aussi s'accompagner d'une détérioration symptomatique et doit donc être réalisée sous contrôle médical.
Comme d'autres corticoïdes destinés à être administrés par voie inhalée, AIRFLUSAL FORSPIRO doit être utilisé avec précaution chez les patients atteints de tuberculose pulmonaire évolutive ou latente et d’infections fongiques, virales ou d’autres infections des voies respiratoires. Un traitement approprié doit être instauré rapidement, si nécessaire.
Rarement, AIRFLUSAL FORSPIRO peut entraîner des troubles du rythme cardiaque tels que tachycardie supraventriculaire, extrasystoles et fibrillation auriculaire, ainsi qu'une baisse modérée et transitoire de la kaliémie à des doses thérapeutiques élevées. AIRFLUSAL FORSPIRO doit être utilisé avec prudence en cas de pathologies cardiovasculaires sévères ou de troubles du rythme cardiaque, et chez les patients atteints de diabète, d'hyperthyroïdie, d'hypokaliémie non corrigée ou chez les patients à risque d'hypokaliémie.
Des augmentations de la glycémie ont été très rarement rapportées (voir rubrique 4.8). Ceci doit être pris en compte lors de la prescription à des patients diabétiques.
Comme avec d'autres produits inhalés, un bronchospasme paradoxal peut apparaitre, associé à une augmentation immédiate de respiration sifflante et d'essoufflement après l'administration. .Le bronchospasme paradoxal répond à un bronchodilatateur d'action rapide et doit être traité immédiatement. Cela doit conduire à l'arrêt du traitement par AIRFLUSAL FORSPIRO et à un examen clinique du patient. Le traitement devra être réévalué pour envisager le cas échéant, une thérapeutique alternative.
Les effets secondaires pharmacologiques dus au traitement par des β2-agonistes, tels que les tremblements, les palpitations et maux de tête ont été rapportés, mais ont tendance à être transitoires et réduits avec une thérapie régulière.
AIRFLUSAL FORSPIRO contient jusqu'à 12,2 mg de lactose par dose. Cette quantité n'entraîne normalement pas de réaction chez les patients intolérants au lactose.
La corticothérapie inhalée peut entraîner des effets systémiques, en particulier lors de traitements à fortes doses au long cours. La survenue de ces effets reste cependant moins probable qu'au cours d'une corticothérapie orale. Il peut être observé un syndrome de Cushing, un tableau clinique cushingoïde, une inhibition de la fonction surrénale, une diminution de la densité minérale osseuse, une cataracte et un glaucome, et plus rarement des effets psychologiques ou des troubles de comportement incluant une hyperactivité psychomotrice, des troubles du sommeil, de l’anxiété, une dépression ou un comportement agressif (notamment chez les enfants) (voir la rubrique population pédiatrique ci-dessous pour des informations sur les effets systémiques des corticoïdes inhalés chez les enfants et les adolescents). En conséquence, il est important que le patient soit suivi régulièrement et la posologie minimale efficace devra toujours être recherchée.
L'administration prolongée de doses élevées de corticoïdes par voie inhalée peut provoquer une inhibition de la fonction surrénale en favorisant la survenue d'une insuffisance surrénale aiguë. Des cas d'inhibition de la fonction surrénale et d'insuffisance surrénale aiguë ont également été très rarement décrits avec des doses de propionate de fluticasone comprises entre 500 et 1000 microgrammes. Une insuffisance surrénale aiguë peut être déclenchée par un traumatisme, une intervention chirurgicale, une infection ou toute diminution rapide de la posologie. Le tableau clinique est généralement atypique pouvant comprendre anorexie, douleur abdominale, perte de poids, fatigue, maux de tête, nausées, vomissements, hypotension, troubles de la conscience, hypoglycémie et convulsions. En cas de stress ou lorsqu'une intervention chirurgicale est prévue, une corticothérapie de supplémentation par voie générale peut être nécessaire.
L'administration de propionate de fluticasone par voie inhalée favorise la diminution du recours aux corticoïdes oraux pour traiter l'asthme, mais elle ne prévient pas le risque d'apparition d'une insuffisance surrénale lors du sevrage des patients traités au long cours par une corticothérapie orale. Par conséquent, ces patients doivent être traités avec un soin particulier et la fonction corticosurrénale régulièrement surveillée. Ce risque existe également chez les patients ayant reçu de fortes doses de corticoïdes en urgence. Le risque de persistance d'une inhibition des fonctions surrénales doit rester présent à l'esprit dans les situations d'urgence et/ou susceptibles de déclencher un état de stress. Une corticothérapie substitutive adaptée devra être envisagée. Un avis spécialisé peut être requis.
Le ritonavir peut augmenter considérablement les concentrations plasmatiques de propionate de fluticasone. Par conséquent, il convient d'éviter de les administrer de façon concomitante, à moins que le bénéfice attendu pour le patient ne l'emporte sur le risque d'effets secondaires systémiques de la corticothérapie ; dans ce cas, les patients doivent être surveillés en vue de détecter les éventuels effets secondaires systémiques des corticostéroïdes. Le risque d'effets systémiques de la corticothérapie est également augmenté en cas d'administration concomitante de propionate de fluticasone avec d'autres inhibiteurs puissants du cytochrome P450 3A4, y compris les produits contenant du cobicistat (voir rubrique 4.5).
Pneumonie chez les patients présentant une BPCO
Une augmentation de l’incidence des cas de pneumonie, ayant ou non nécessité une hospitalisation, a été observée chez les patients présentant une BPCO et recevant une corticothérapie inhalée. Bien que cela ne soit pas formellement démontré dans toutes les études cliniques disponibles, ce risque semble augmenter avec la dose de corticoïdes administrés.
Les données disponibles ne permettent pas de conclure que le risque de survenue d’une pneumonie est lié au corticoïde inhalé utilisé.
Il convient de rester vigilant chez les patients présentant une BPCO, les symptômes de pneumonie pouvant s'apparenter aux manifestations cliniques d'une exacerbation de BPCO.
Les facteurs de risques de survenue d’une pneumonie sont : le tabagisme, un âge avancé, un faible indice de masse corporelle (IMC) ainsi que la sévérité de la BPCO.
Des données issues d'un essai clinique à grande échelle (« Salmeterol Multi-Center Asthma Research Trial, SMART ») ont suggéré une augmentation du risque de survenue d'évènements indésirables respiratoires graves ou de décès d'origine respiratoire chez les patients afro-américains traités par salmétérol par rapport au placebo (voir rubrique 5.1). Il n'a pu être déterminé si ces observations étaient d'origine pharmacogénétique ou résultaient d'autres facteurs intercurrents. Si les symptômes de l'asthme persistent ou s'aggravent au cours du traitement par AIRFLUSAL FORSPIRO, les patients d'origine noire africaine ou afro-caribéenne doivent continuer leur traitement par AIRFLUSAL FORSPIRO tout en prenant rapidement avis auprès de leur médecin.
L'administration concomitante de kétoconazole par voie systémique augmente de manière significative l'exposition systémique au salmétérol pouvant entraîner une augmentation du risque de survenue d'effets systémiques (par exemple : prolongation de l'intervalle QTc et palpitations). Par conséquent, il convient d'éviter l'administration concomitante de kétoconazole ou d'autres inhibiteurs puissants du cytochrome P450 3A4 sauf si les bénéfices attendus l'emportent sur le risque potentiel de survenue d'effets systémiques du salmétérol (voir rubrique 4.5).
Population pédiatrique
Les enfants et les adolescents de moins de 16 ans recevant de fortes doses de propionate de fluticasone (généralement ≥ 1000 microgrammes par jour) sont particulièrement à risque. Des effets systémiques peuvent survenir, en particulier lors de traitements à fortes doses au long cours. Il peut être observé un syndrome de Cushing, un tableau cushingoïde, une inhibition de la fonction surrénale, une insuffisance surrénale aiguë et un retard de croissance chez l'enfant et l'adolescent, et plus rarement des effets psychologiques ou comportemental incluant une hyperactivité psychomotrice, des troubles du sommeil, l’anxiété, la dépression ou l’agressivité. Il faut envisager d’envoyer l'enfant ou l'adolescent vers un spécialiste des maladies respiratoires pédiatriques.
La croissance des enfants recevant une corticothérapie inhalée à long terme devra être régulièrement surveillée. La corticothérapie inhalée devra être réduite à la plus faible dose assurant un contrôle efficace de l'asthme.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les β-bloquants adrénergiques peuvent diminuer l’effet ou avoir un effet antagoniste sur le salmétérol.
Les β-bloquants, sélectifs ou non, doivent être évités chez les patients atteints d'asthme sauf nécessité absolue.
Potentiellement une hypokaliémie sévère peut résulter du traitement par un β2-agoniste. Dans l’asthme sévère aigu, une précaution particulière est recommandée car cet effet peut être potentialisé avec la prise de traitement concomitant à base de dérivés de xanthine, de stéroïdes ou de diurétiques.
L'administration concomitante d'autres β-adrénergiques peut potentialiser les effets β2 - mimétiques.
Propionate de fluticasone
Dans les conditions normales d’utilisation, les concentrations plasmatiques de propionate de fluticasone atteintes après administration par voie inhalée sont faibles du fait d'un effet de premier passage métabolique important et d'une forte clairance plasmatique médiée par le cytochrome P450 3A4. Par conséquent, le risque d'interactions cliniquement significatives avec le propionate de fluticasone semble faible.
Néanmoins, une étude d'interaction chez des volontaires sains recevant du propionate de fluticasone par voie nasale a montré que le ritonavir (un inhibiteur très puissant du cytochrome P450 3A4) à la dose de 100 mg deux fois par jour augmentait de plusieurs centaines de fois les concentrations plasmatiques de propionate de fluticasone, entraînant une diminution marquée des concentrations en cortisol plasmatique. Il n'y a pas de donnée documentant l'interaction avec le propionate de fluticasone administré par voie inhalée, mais une augmentation importante des concentrations plasmatiques est attendue ; des cas de syndrome de Cushing et d'inhibition de la fonction surrénalienne ont été rapportés. Il convient donc d'éviter l'administration concomitante de propionate de fluticasone et de ritonavir, à moins que le bénéfice ne l'emporte sur le risque accru d'effets systémiques de la corticothérapie.
Une étude de faible effectif menée chez des volontaires sains a montré que le kétoconazole, inhibiteur un peu moins puissant du cytochrome P450 3A4 augmentait de 150 % l'exposition systémique d'une dose de propionate de fluticasone par voie inhalée. La réduction du cortisol plasmatique était plus importante que celle observée après l'administration de propionate de fluticasone seul. Une augmentation de l'exposition systémique et du risque d'effets indésirables systémiques est attendue en cas d'administration concomitante d'autres inhibiteurs puissants du cytochrome P450 3A comme l’itraconazole et les produits contenant du cobicistat et d’inhibiteurs modérés du CYP3A, tels que l'érythromycine. L’association doit être évitée, sauf si les bénéfices sont supérieurs au risque accru d’effets secondaires systémiques des corticostéroïdes ; dans ce cas, les patients doivent être surveillés en vue de détecter les éventuels effets secondaires systémiques des corticostéroïdes.
Salmétérol
Inhibiteurs puissants du cytochrome P450 3A4
L'administration concomitante de kétoconazole (400 mg par voie orale une fois par jour) et de salmétérol (50 µg par voie inhalée deux fois par jour) chez 15 volontaires sains pendant 7 jours a entraîné une augmentation significative des concentrations plasmatiques de salmétérol (Concentration maximale (Cmax) augmentée d'un facteur 1,4 et aire sous la courbe (ASC) augmentée d'un facteur 15). Cette observation suggère donc une augmentation du risque de survenue des effets systémiques du salmétérol, tels que prolongation de l'intervalle QT et palpitations, par rapport à l'administration de salmétérol ou de kétoconazole seuls (voir rubrique 4.4).
Il n'a pas été observé d'effet cliniquement significatif sur la pression artérielle, la fréquence cardiaque, la glycémie et la kaliémie. L'administration concomitante de kétoconazole n'a pas entraîné de prolongation de la demi-vie d'élimination du salmétérol ni son accumulation après administrations répétées.
Il convient d'éviter l'association de kétoconazole avec un traitement par salmétérol sauf si les bénéfices attendus l'emportent sur le risque potentiel de survenue d'effets systémiques du salmétérol. Un risque d'interaction du même ordre est attendu avec d'autres inhibiteurs puissants du cytochrome P450 3A4 (par exemple avec l'itraconazole, la télithromycine, le ritonavir).
Inhibiteurs modérés du cytochrome P450 3A4
L'administration concomitante d'érythromycine (500 mg par voie orale trois fois par jour) et de salmétérol (50 µg par voie inhalée deux fois par jour) chez 15 volontaires sains pendant 6 jours a entraîné une légère augmentation, non statistiquement significative, des concentrations plasmatiques du salmétérol (Cmax augmentée d'un facteur 1,4 et ASC augmentée d'un facteur 1,2). Aucun effet indésirable grave n'a été associé à l'administration concomitante avec l'érythromycine.
4.6. Fertilité, grossesse et allaitement
Grossesse
Une quantité modérée de données obtenues chez la femme enceinte (entre 300 et 1000 cas de grossesses exposées) ne rapportent pas de toxicité malformative ou fœtale/-néonatale du salmétérol et du propionate de fluticasone. Les études menées chez l'animal sur les fonctions de reproduction ont mis en évidence une toxicité des β2-mimétiques et des glucocorticoïdes (voir rubrique 5.3).
L'utilisation d’AIRFLUSAL FORSPIRO au cours de la grossesse ne devra être envisagée que si le bénéfice attendu pour la mère l'emporte sur les risques éventuels pour le fœtus.
Chez la femme enceinte, il conviendra de toujours rechercher la dose minimale efficace de propionate de fluticasone assurant un contrôle satisfaisant des symptômes de l'asthme.
Le passage dans le lait maternel du salmétérol et du propionate de fluticasone et de leurs métabolites n'est pas connu.
Des études ont mis en évidence que le salmétérol et le propionate de fluticasone, et leurs métabolites sont excrétés dans le lait des rates allaitantes.
Un risque pour les nouveau-nés/nourrissons nourris au sein ne peut être exclu. La décision d’interrompre l'allaitement ou le traitement par AIRFLUSAL FORSPIRO sera établie en fonction du bénéfice attendu de l'allaitement maternel pour l'enfant face à celui du traitement pour la femme qui allaite.
Fertilité
Il n'existe pas de donnée chez l'Homme. Cependant, les études menées chez l'animal n'ont montré aucun effet du salmétérol ou du propionate de fluticasone sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
AIRFLUSAL FORSPIRO contient du salmétérol et du propionate de fluticasone, dont les effets indésirables sont connus. Aucun effet indésirable nouveau n'est apparu lors de l'administration conjointe des deux principes actifs dans la même formulation.
Les effets secondaires, associés au salmétérol et au propionate de fluticasone sont cités ci-dessous, listés par classe de système d’organe et par fréquence. Les fréquences sont définies en : très fréquent (≥ 1/10), fréquent (≥ 1/100 et < 1/10), peu fréquent (≥ 1/1000 et < 1/100), rare (≥ 1/10000 et < 1/1000) et très rare (< 1/10000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Les fréquences ont été déterminées à partir des données issues des essais cliniques. L'incidence correspondante dans le bras placebo n'a pas été prise en compte.
|
Classes de système d’organe |
Effets indésirables |
Fréquence |
|
|
Infections et Infestations |
Candidose buccale et pharyngée |
Fréquent |
|
|
Pneumonie (chez les patients atteints de BPCO) |
Fréquent1,3,5 |
||
|
Bronchite |
Fréquent1,3 |
||
|
Candidose oesophagique |
Rare |
||
|
Troubles du système immunitaire |
Réactions d'hypersensibilité avec les réactions suivantes : |
|
|
|
Réactions cutanées d'hypersensibilité |
Peu fréquent |
||
|
Angio-œdème (principalement œdème facial et oropharyngé) |
Rare |
||
|
|
Symptômes respiratoires (dyspnée) |
Peu fréquent |
|
|
|
Symptômes respiratoires (bronchospasme) |
Rare |
|
|
|
Réactions anaphylactiques incluant le choc anaphylactique. |
Rare |
|
|
Troubles endocriniens |
Syndrome de Cushing, tableau cushingoïde, inhibition de la fonction surrénale, ralentissement de la croissance chez l'enfant et l'adolescent, diminution de la densité minérale osseuse |
Rare4 |
|
|
Troubles du métabolisme de la nutrition |
Hypokaliémie |
Fréquent3 |
|
|
Hyperglycémie |
Peu fréquent4 |
||
|
Troubles psychiatriques |
Anxiété |
Peu fréquent |
|
|
Troubles du sommeil |
Peu fréquent |
|
|
|
Modifications du comportement incluant hyperactivité et irritabilité (notamment chez les enfants) |
Rare
|
|
|
|
Dépression, agression (surtout chez les enfants) |
Fréquence indéterminée |
|
|
|
Troubles du système nerveux |
Maux de tête |
Très fréquent1 |
|
|
Tremblements |
Peu fréquent |
|
|
|
Troubles oculaires |
Cataracte, |
Peu fréquent4 |
|
|
Glaucome |
Rare |
|
|
|
Troubles cardiaques |
Palpitations |
Peu fréquent |
|
|
Tachycardie |
Peu fréquent |
|
|
|
Arythmies cardiaques (y compris, tachycardie supraventriculaire et extrasystoles) |
Rare |
|
|
|
Fibrillation auriculaire |
Peu fréquent |
|
|
|
Angine de poitrine |
Peu fréquent |
|
|
|
Troubles respiratoires, thoraciques et médiastinaux |
Rhino-pharyngite |
Très fréquent2,3 |
|
|
Gêne pharyngée |
Fréquent |
|
|
|
Raucité de la voix/dysphonie |
Fréquent |
|
|
|
Sinusite |
Fréquent1,3 |
|
|
|
Bronchospasme paradoxal |
rare4 |
|
|
|
Troubles cutanés et sous-cutanés |
Contusions |
Fréquent1,3 |
|
|
Troubles musculo-squelettiques et systémiques |
Crampes musculaires |
Fréquent |
|
|
Fractures traumatiques |
Fréquent1,3 |
|
|
|
Arthralgies |
Fréquent |
|
|
|
Myalgies |
Fréquent |
|
1. Rapportés fréquemment dans les groupes placebo.
2. Rapportés très fréquemment dans les groupes placebo.
3. Rapportés sur une période de 3 ans dans une étude dans la BPCO.
Description de certains effets indésirables
Des effets secondaires liés aux propriétés pharmacodynamiques β2-mimétiques du salmétérol, tels que tremblements, palpitations et maux de tête, ont été rapportés. Ils sont le plus souvent transitoires et diminuent avec la poursuite du traitement.
Comme avec d'autres traitements par inhalation, le bronchospasme paradoxal peut se produire avec une augmentation immédiate de respiration sifflante et d'essoufflement après l'administration.
Le bronchospasme paradoxal répond à l’administration d’un bronchodilatateur à action rapide et doit être traitée immédiatement.
AIRFLUSAL FORSPIRO doit être arrêté immédiatement, le patient doit être évalué et un traitement alternatif institué si nécessaire.
Des effets indésirables associés au propionate de fluticasone comme une raucité de la voix et une candidose (muguet) buccale et pharyngée, et rarement, de l’œsophage peuvent survenir chez certains patients. Elles peuvent être réduites par le rinçage de la bouche à l'eau et/ou nettoyage des dents après utilisation d’AIRFLUSAL FORSPIRO. Les candidoses symptomatiques de la bouche et de la gorge peuvent être traitées par des antifongiques locaux tout en continuant le traitement par AIRFLUSAL FORSPIRO.
Population pédiatrique
Les effets systémiques tels que Syndrome de Cushing, tableau clinique cushingoïde, inhibition de la fonction surrénale et ralentissement de la croissance chez l'enfant et chez l'adolescent, sont possibles (voir rubrique 4.4). Il peut également survenir chez les enfants une anxiété, des troubles du sommeil et des modifications du comportement, incluant une hyperactivité et une irritabilité.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé doivent déclarer tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (Ansm) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
Aucun surdosage n'a été décrit dans les essais cliniques menés avec AIRFLUSAL FORSPIRO : néanmoins, les signes de surdosage sont connus pour chacun des principes actifs :
Les symptômes d'un surdosage en salmétérol sont des étourdissements augmentant avec la pression artérielle systolique, des tremblements, des céphalées et une tachycardie. Si le traitement par AIRFLUSAL FORSPIRO doit être interrompu en raison d'une exposition excessive aux β2- mimétiques, il sera remplacé par un corticoïde seul. De plus une hypokaliémie peut se produire et par conséquent, le taux de potassium sérique doit être contrôlé. Elle devra être corrigée par un apport adapté de potassium.
Surdosage aigu : l'administration de propionate de fluticasone à des doses supérieures à celles recommandées par voie inhalée peut entraîner une inhibition temporaire de la fonction surrénale. Il n'y a pas lieu d'adopter une mesure d'urgence car la fonction surrénale se rétablit en quelques jours comme en témoignent les mesures du cortisol plasmatique.
Surdosage chronique de propionate de fluticasone inhalé : la réserve surrénale doit être surveillée et le traitement avec un corticostéroïde systémique peut être nécessaire. Une fois stabilisé, le traitement doit être poursuivi avec un corticoïde par inhalation à la dose recommandée. Se reporter à la rubrique 4.4 : risque d'inhibition des glandes surrénales :
En cas de surdosage aigu et chronique en propionate de fluticasone, le traitement par AIRFLUSAL FORSPIRO devrait être poursuivi en ajustant la posologie aux doses suffisantes pour un contrôle optimal des symptômes de l'asthme.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Code ATC: R03AK06.
Mécanisme d'action :
AIRFLUSAL FORSPIRO contient du salmétérol et du propionate de fluticasone qui possèdent des modes d'actions différents. Le mécanisme d’action respectif des 2 substances est discuté ci-dessous :
Salmétérol :
Le salmétérol est un agoniste sélectif de longue durée d'action (12 heures) des récepteurs β2- adrénergiques. Il possède une longue chaîne latérale qui le lie à l'exo-site du récepteur.
Le salmétérol produit une bronchodilatation qui persiste pendant environ 12 heures. Cette durée est supérieure à celle observée généralement avec les β2-mimétiques de courte durée d'action administrés aux posologies usuelles.
Propionate de fluticasone :
Le propionate de fluticasone administré par voie inhalée aux doses préconisées exerce une activité glucocorticoïde entraînant un effet anti-inflammatoire local au niveau de la muqueuse bronchique. En conséquence, les symptômes et les exacerbations d'asthme sont diminués alors que les effets systémiques sont limités comparativement à l'administration de corticoïdes par voie générale.
Etude clinique et sécurité :
Etudes cliniques de l’asthme
Une étude de 12 mois (Gaining Optimal Asthma controL, GOAL) réalisée chez 3416 patients adultes et adolescents atteints d'asthme persistant, a comparé la tolérance et l'efficacité de salmétérol/fluticasone propionate (FP) à une corticothérapie inhalée seule (propionate de fluticasone) afin d'évaluer la possibilité d'atteindre les objectifs de la prise en charge de l'asthme. La posologie du traitement était augmentée toutes les 12 semaines jusqu'à ce que le contrôle total** ait été obtenu ou que la posologie la plus forte de l'étude ait été atteinte. GOAL a montré qu'il y avait plus de patients qui atteignaient le contrôle de l'asthme lorsqu'ils étaient traités par AIRFLUSAL FORSPIRO que lors d'un traitement par corticoïdes inhalés seuls, ce contrôle étant obtenu avec une moindre dose de corticoïdes.
Un « Bon Contrôle »* de l'asthme a été obtenu plus rapidement chez les patients traités par salmétérol/FP que chez les patients traités par un corticoïde inhalé seul. Le temps nécessaire pour que 50 % des sujets inclus dans l'étude atteignent leur première semaine de « Bon Contrôle » a été de 16 jours pour les sujets traités par salmétérol/FP et de 37 jours pour ceux traités par corticostéroïdes inhalés (CSI). Dans le sous-groupe des patients asthmatiques non traités préalablement par des corticoïdes inhalés, ce temps était respectivement de 16 jours (salmétérol/FP) et de 23 jours (CSI).
Les résultats globaux de l'étude étaient les suivants :
|
Pourcentage de patients atteignant le *Bon Contrôle (BC) et le **Contrôle Total (CT) de l'asthme sur 12 mois |
|
||||
|
Traitement avant inclusion dans l'étude |
FP4/Salmétérol |
FP4 |
|
||
|
BC |
CT |
BC |
CT |
|
|
|
Aucun CSI1 (ß2 CDA2 seul) |
78 % |
50 % |
70 % |
40 % |
|
|
CSI à faible dose (≤ 500 µg de BDP3 ou équivalent par jour) |
75 % |
44 % |
60 % |
28 % |
|
|
CSI à dose moyenne (> 500-1000 µg de BDP3 ou équivalent par jour) |
62 % |
29 % |
47 % |
16 % |
|
|
Résultats globaux (quel que soit le traitement antérieur) |
71 % |
41 % |
59 % |
28 % |
|
1 CSI: corticostéroïdes par voie inhalée
2 ß2 CDA: β2- agoniste de courte durée d'action
3 BDP: Dipropionate de béclométasone
4 FP: Propionate de fluticasone
* Bon contrôle de l'asthme :
- «score d’évaluation des symptômes» supérieur à 1 durant maximum 2 jours (Le «score d’évaluation des symptômes» est égal à 1 lorsque la survenue de symptômes asthmatiques est occasionnelle.
- Utilisation occasionnelle d'un bronchodilatateur β2--agoniste de courte durée d'action (≤ 2 fois par jour et ≤ 4 fois par semaine), débit expiratoire maximal matinal ≤ 80 % de la valeur théorique, pas de réveil nocturne, pas d’exacerbation des symptômes de l’asthme, pas d’effet indésirable entraînant une modification de traitement.
** Contrôle total de l'asthme : pas de symptômes, pas d'utilisation d'un bronchodilatateur β2- agoniste de courte durée d'action, débit expiratoire maximal supérieure ou égale à 80 % des valeurs théoriques, sans réveil nocturne, ni exacerbation, ni effet indésirable entraînant une modification de traitement.
Les résultats de cette étude suggèrent que salmétérol/fluticasone 50/100 microgrammes/dose, deux fois par jour, peut être envisagé en initiation d'un traitement de fond chez des patients ayant un asthme persistant modéré chez qui il apparaît essentiel d'obtenir un contrôle rapide de l'asthme (voir rubrique 4.2).
Une étude en double aveugle, randomisée en groupes parallèles, conduite chez 318 patients d'au moins 18 ans, atteints d'asthme persistant, a évalué la sécurité et la tolérance de l'administration de deux inhalations deux fois par jour (double dose) d’AIRFLUSAL FORSPIRO pendant deux semaines. Cette étude a montré que le doublement de la dose d’AIRFLUSAL FORSPIRO (quel que soit le dosage), sur une durée allant jusqu'à 14 jours, entraîne par rapport à l'administration d'une inhalation deux fois par jour, une légère augmentation des effets indésirables liés à l'activité β-mimétique (tremblements : 1 patient [1 %] contre 0, palpitations : 6 [3 %] contre 1 [<1 %], crampes musculaires: 6 [3 %] contre 1 [<1 %]) et une incidence similaire des effets indésirables liés au corticoïde inhalé (candidose orale: 6 [6 %] contre 16 [8 %], raucité de la voix : 2 [2 %] contre 4 [2 %]). La faible augmentation des effets indésirables liés à l'activité β-mimétique doit être prise en considération, s'il est envisagé de doubler la dose prescrite d’AIRFLUSAL FORSPIRO chez des patients adultes qui nécessiteraient une augmentation de la corticothérapie inhalée pendant une courte période (jusqu'à 14 jours).
Dans l’essai clinique SAM101667, chez 158 enfants âgés de 6 à 16 ans avec des symptômes asthmatiques, la combinaison de salmétérol/fluticasone propionate est tout aussi efficace que de doubler la dose de fluticasone propionate quant au contrôle des symptômes et la fonction pulmonaire. Cette étude n’a pas été conçue pour étudier l’effet sur l’exacerbation.
Etudes cliniques menées avec AIRFLUSAL FORSPIRO dans la BPCO :
TORCH est une étude qui avait pour objectif la comparaison du taux de mortalité globale sur 3 ans de traitement par le propionate de fluticasone/salmétérol 500 µg/50 µg/dose 2 fois par jour, par le salmétérol 50 µg/dose 2 fois par jour, par propionate de fluticasone (FP) 500 µg/dose 2 fois par jour ou par un placebo chez des patients atteints de BPCO. Les patients atteints de BPCO présentant à l'inclusion, un VEMS (pré-bronchodilatateur) < 60 % de la valeur théorique ont été randomisés pour recevoir les traitements médicamenteux en double aveugle.
Pendant l'étude, les patients pouvaient utiliser leur traitement habituel de la BPCO à l'exception des autres corticoïdes inhalés, des bronchodilatateurs de longue durée d'action et des corticoïdes par voie systémique au long cours. La survie à 3 ans a été déterminée pour l'ensemble des patients y compris ceux ayant arrêté le traitement en cours d'étude. Le critère de jugement principal était la réduction de la mortalité globale à 3 ans avec le propionate de fluticasone/salmétérol par rapport au placebo.
|
|
Placebo |
Salmétérol |
Propionate de fluticasone (FP) |
FP/Salmétérol |
|
|
Mortalité globale à 3 ans |
|
||||
|
Nombre de décès |
231 |
205 |
246 |
193 |
|
|
( %) |
(15,2 %) |
(13,5 %) |
(16,0 %) |
(12,6 %) |
|
|
Risque relatif vs Placebo |
N/A |
0,879 |
1,060 |
0,825 |
|
|
(IC) |
|
(0,73 ; 1,06) |
(0,89 ; 1,27) |
(0,68 ; 1,00) |
|
|
valeur du « p » |
|
0,180 |
0,525 |
0,052* |
|
|
Risque relatif salmétérol/FP 50/500 vs chacun des principes actifs (salmétérol ou FP) |
N/A |
0,932 |
0,774 |
|
|
|
(IC) |
|
(0,77 ; 1,13) |
(0,64 ; 0,93) |
N/A |
|
|
valeur du « p » |
|
0,481 |
0,007 |
|
|
* p = statistiquement non significatif - valeur déterminée après ajustement prenant en compte les 2 analyses intermédiaires sur le critère principal d'efficacité - Analyse log-rank stratifiée en fonction du degré de tabagisme.
Il a été observé une tendance à une amélioration de la survie à 3 ans avec le propionate de fluticasone/salmétérol par rapport au placebo mais le seuil de significativité statistique (p≤0,05) n'a pas été atteint.
Le pourcentage de patients décédés d'une cause liée à leur BPCO durant les 3 ans était de 6,0 % pour le placebo ; 6,1 % pour le salmétérol ; 6,9 % pour le propionate de fluticasone (FP) et 4,7 % pour salmétérol/FP.
Le taux annuel moyen d'exacerbations modérées à sévères était significativement diminué dans le groupe des sujets traités par salmétérol/FP comparé aux groupes des sujets traités par salmétérol, par propionate de fluticasone (FP) et ceux recevant un placebo (taux moyen dans le groupe salmétérol/FP : 0,85 par rapport à 0,97 dans le groupe salmétérol ; 0,93 dans le groupe FP et 1,13 dans le groupe placebo). La réduction des taux observés d'exacerbations modérées à sévères était de 25% (IC 95 % [19 à 31 %], p<0,001) par rapport au placebo, de 12 % par rapport au salmétérol (IC 95 % [5 à 19 %], p=0,002) et de 9 % par rapport au propionate de fluticasone (FP) (IC 95 % [1 à 16 %], p=0,024). Le taux d'exacerbations avec le salmétérol et le propionate de fluticasone était significativement diminué par rapport au placebo, respectivement de 15% (IC 95% [7 à 22 %], p<0,001) et de 18 % (IC 95 % [11 % à 24 %], p<0,001).
La qualité de vie, mesurée à l'aide du Questionnaire Respiratoire de l'Hôpital St George (SGRQ), a été améliorée dans chacun des groupes des traitements actifs comparativement au placebo. Dans le groupe de patients traités par salmétérol/fluticasone, l'amélioration moyenne sur 3 ans était de -3,1 unités (IC 95 % [-4,1 à -2,1], p<0,001) par rapport au placebo, de -2,2 unités (p<0,001) par rapport au salmétérol et de -1,2 unités par rapport à FP (p=0,017). Une diminution de 4 unités est considérée comme cliniquement pertinente.
La probabilité estimée dans l'étude sur 3 ans, de la survenue d'une pneumonie rapportée en tant qu'évènement indésirable était de 12,3 % pour le placebo ; 13,3 % pour le salmétérol; 18,3 % pour le propionate de fluticasone et 19,6 % pour le propionate de fluticasone/salmétérol (Risque relatif pour le salmétérol/FP vs placebo : 1,64 (IC 95 % [1,33 à 2,01], p<0,001)). Il n'a pas été mis en évidence d'augmentation de la mortalité en relation avec la survenue de pneumonies. Le nombre de cas où la cause principale du décès a été attribuée à la survenue d'une pneumonie était de 7 pour le placebo, 9 pour le salmétérol, 13 pour le propionate de fluticasone et 8 pour le propionate de fluticasone/salmétérol. Aucune différence significative n'a été mise en évidence concernant le pourcentage d'apparition de fracture osseuse (placebo : 5,1 % ; salmétérol: 5,1 % ; FP : 5,4 % et le propionate de fluticasone/salmétérol : 6,3 % - Risque relatif pour salmétérol/FP vs placebo : 1,22 (IC 95 % [0,87 à 1,72], p=0,248)).
Les études cliniques contrôlées contre placebo, d'une durée de 6 ou 12 mois, ont montré qu'une prise régulière de salmétérol/FP 50/500 microgrammes/dose améliore la fonction respiratoire et réduit la dyspnée et la consommation des médicaments destinés au traitement des symptômes aigus.
Les études SCO40043 et SCO100250, conduites selon un protocole identique, étaient des études randomisées, en groupes parallèles comparant en double aveugle, les effets de salmétérol/FP 50/250 microgrammes/dose deux fois par jour (dose n'ayant pas été approuvée pour le traitement de la BPCO dans l'Union Européenne) à ceux de 50 microgrammes deux fois par jour de salmétérol sur le taux annuel d'exacerbations modérées/sévères chez des patients atteints de BPCO présentant un VEMS inférieur à 50 % de la valeur prédite et ayant des antécédents d'exacerbations. Les exacerbations modérées/sévères étaient définies comme une aggravation des symptômes nécessitant une corticothérapie orale et/ou une antibiothérapie ou une hospitalisation.
Les sujets en état clinique stable après une période de 4 semaines (période de « run-in ») de traitement standard, en ouvert, par l'association salmétérol/FP 50/250, étaient randomisés selon un ratio 1:1 pour recevoir en aveugle pendant 52 semaines, salmétérol/FP 50/250 (n total en ITT = 776) ou salmétérol (n total en ITT = 778). Les traitements antérieurs de la BPCO, à l'exception des bronchodilatateurs de courte durée d'action étaient interrompus avant la période de run-in préalable à la randomisation. L'utilisation concomitante des bronchodilatateurs de longue durée d'action par voie inhalée (β2-mimétiques et anticholinergiques), des associations d'ipratropium/salbutamol, des β-2 mimétiques oraux et des préparations à base de théophylline n'était pas autorisée pendant la période de traitement. Les corticoïdes oraux et les antibiotiques étaient autorisés pour le traitement des exacerbations de BPCO, selon des modalités d'utilisations spécifiques. Pendant les études, les patients utilisaient le salbutamol en traitement bronchodilatateurs pris «à la demande ».
Les résultats de ces deux études ont montré un taux annuel d'exacerbations modérées/sévères de BPCO significativement plus bas dans le groupe traité par salmétérol/FP 50/250 par rapport au groupe recevant le traitement par salmétérol (étude SCO40043 : respectivement 1,06 et 1,53 exacerbation par sujet et par an ; rapport : 0,70 ; IC à 95 % : 0,58 à 0,83 ; p<0,001 et étude SCO100250 : respectivement 1,10 et 1,59 exacerbation par sujet et par an ; rapport : 0,70 ; IC à 95 % : 0,58 à 0,83 ; p<0,001). Les résultats sur les critères d'efficacité secondaires (délai avant la survenue de la première exacerbation modérée/sévère, taux annuel d'exacerbations nécessitant une corticothérapie orale et VEMS matinal avant la prise) étaient significativement en faveur de salmétérol/FP 50/250 microgrammes/dose deux fois par jour par rapport au salmétérol. Les événements indésirables étaient similaires, à l'exception d'une incidence plus élevée des cas de pneumonie et des effets secondaires locaux bien connus (candidose et dysphonie) dans le groupe propionate de fluticasone/salmétérol 250 microgrammes/50 microgrammes/dose deux fois par jour par rapport au salmétérol. Des événements associés à une pneumonie ont été signalés par 55 (7 %) sujets dans le groupe salmétérol/FP 50/250 microgrammes/dose deux fois par jour et par 25 sujets (3 %) dans le groupe salmétérol. L'incidence accrue de cas de pneumonie signalés avec salmétérol/FP 50/250 microgrammes/dose deux fois par jour semble être du même ordre de grandeur que celle observée suite au traitement par salmétérol/FP 50/500 microgrammes/dose deux fois par jour dans l'étude TORCH.
Essai multicentrique dans l'asthme avec le salmétérol (« Salmeterol Multi-Center Asthma Research Trial, SMART »)
L'étude SMART était une étude multicentrique, randomisée, en double aveugle, en groupes parallèles, versus placebo, réalisée aux Etats-Unis sur 28 semaines. 13176 patients ont reçu du salmétérol (50 microgrammes deux fois par jour) et 13179 patients ont reçu du placebo administré en plus de leur traitement anti-asthmatique habituel. Pour être inclus dans l'étude, les patients devaient être âgés d'au moins 12 ans, être asthmatiques et avoir un traitement de l’asthme en cours (à l'exclusion d'un traitement par β2-agoniste de longue durée d'action). La corticothérapie inhalée n'était pas obligatoire pendant l'étude, la prise éventuelle de corticoïdes était néanmoins enregistrée à l'entrée dans l'étude. Le critère de jugement principal de l'étude SMART était un critère combiné associant le nombre de décès liés à une cause respiratoire et le nombre de détresses respiratoires mettant en jeu le pronostic vital.
Résultats de l'étude SMART sur le critère de jugement principal:
|
Groupes de patient |
Critère principal : |
Risque relatif |
|
|
|
salmétérol |
placebo |
|
||
|
Population globale incluse |
50/13176 |
36/13179 |
1,40 (0,91 ; 2,14) |
|
|
Patients utilisant des corticoïdes inhalés |
23/6127 |
19/6138 |
1,21 (0,66 ; 2,23) |
|
|
Patients n'utilisant pas de corticoïdes inhalés |
27/7049 |
17/7041 |
1,60 (0,87 ; 2,93) |
|
|
Sous-groupe des patients afro-américains |
20/2366 |
5/2319 |
4,10 (1,54 ; 10,90)** |
|
** Statistiquement significatif à 95 %.
Autres résultats de l'étude SMART en fonction de la prise ou non de corticoïdes par voie inhalée à l'inclusion:
|
|
Critères secondaires : |
Risque relatif |
|
|
|
|
salmétérol |
placebo |
|
|
|
Nombre de décès liés à une cause respiratoire |
|
|||
|
Patients utilisant des corticoïdes inhalés |
10/6127 |
5/6138 |
2,01 (0,69 ; 5,86) |
|
|
Patients n'utilisant pas de corticoïdes inhalés |
14/7049 |
6/7041 |
2,28 (0,88 ; 5,94) |
|
|
Critère combiné associant les épisodes d'asthme ayant entraîné le décès ou mettant en jeu le pronostic vital |
|
|||
|
Patients utilisant des corticoïdes inhalés |
16/6127 |
13/6138 |
1,24 (0,60 ; 2,58) |
|
|
Patients n'utilisant pas de corticoïdes inhalés |
21/7049 |
9/7041 |
2,39 (1,10 ; 5,22)** |
|
|
Nombre de décès liés à l'asthme |
|
|||
|
Patients utilisant des corticoïdes inhalés |
4/6127 |
3/6138 |
1,35 (0,30 ; 6,04) |
|
|
Patients n'utilisant pas de corticoïdes inhalés |
9/7049 |
0/7041 |
* |
|
* = risque relatif n'ayant pu être calculé en raison de l'absence d'événement dans le groupe placebo.
** Les résultats sont statistiquement significatifs à 95 %. Les critères secondaires dans le tableau ci-dessus ont atteint la significativité statistique dans l'ensemble de la population étudiée.
Les critères secondaires de « décès ou menaces vitales toutes causes confondues », « décès toutes causes confondues » ou « hospitalisation toutes causes confondues » n'ont pas atteint la significativité statistique sur l'ensemble de la population étudiée.
5.2. Propriétés pharmacocinétiques
La pharmacocinétique de chaque constituant peut donc être considérée séparément.
Salmétérol :
Le salmétérol agissant localement au niveau pulmonaire, les taux plasmatiques ne sont pas corrélés à l'effet thérapeutique. De plus, peu de données sont disponibles sur la pharmacocinétique du salmétérol après administration par voie inhalée car les concentrations plasmatiques observées aux doses thérapeutiques sont très faibles (au maximum 200 picogrammes/ml), et difficilement mesurables.
Propionate de fluticasone :
Absorption
La biodisponibilité absolue après administration d'une dose unique de propionate de fluticasone inhalé chez les volontaires sains varie approximativement entre 5 et 11 % de la dose nominale selon le dispositif d'inhalation utilisé. Une moindre exposition systémique au propionate de fluticasone a été observée chez les patients asthmatiques ou atteints de BPCO.
L'absorption est essentiellement pulmonaire. Elle est rapide dans un premier temps puis se poursuit plus lentement. Le reste de la dose peut être dégluti mais ne contribue qu'en faible partie à l'exposition systémique du fait d'une faible solubilité aqueuse et d'un important métabolisme de premier passage. La biodisponibilité orale est ainsi inférieure à 1 %. L'exposition systémique augmente de façon linéaire avec l'augmentation de la dose inhalée.
Distribution
L'élimination du propionate de fluticasone est caractérisée par une forte clairance plasmatique (1150 ml/min), un important volume de distribution à l'état d'équilibre (environ 300 litres) et une demi-vie terminale d'environ 8 heures.
La liaison aux protéines plasmatiques est de 91 %.
Biotransformation
Le propionate de fluticasone est éliminé très rapidement de la circulation systémique. Le produit est essentiellement métabolisé en un dérivé acide carboxylique inactif, par l'isoenzyme CYP3A4 du cytochrome P450. D'autres métabolites non identifiés sont également retrouvés dans les fèces.
Elimination
La clairance rénale du propionate de fluticasone est négligeable. Moins de 5 % de la dose est excrétée dans les urines, principalement sous forme de métabolites. La majorité de la dose est éliminée dans les fèces sous forme de métabolites et sous forme inchangée.
5.3. Données de sécurité préclinique
Au cours des études de reproduction menées chez l'animal, des malformations ont été observées après administration de glucocorticoïdes (fentes palatines, malformations osseuses). Cependant, ces résultats expérimentaux observés chez l'animal, ne semblent pas prédictifs d'un effet malformatif chez l'homme aux doses recommandées. Les études menées chez l'animal avec le xinafoate de salmétérol ont montré une toxicité embryofœtale seulement après exposition à de fortes doses.
Après administration concomitante des deux principes actifs, il a été observé chez des rats recevant des doses de glucocorticoïdes connues pour induire des anomalies, une augmentation de la fréquence d'apparition de transposition de l'artère ombilicale et d'ossifications incomplètes au niveau de l'occipital.
2 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
Inhalateur en plastique contenant un blister OPA/Al/PVC-Al avec 60 doses pré-dosées de poudre mélangée.
Boîtes :
1, 2, 3 ou 10 dispositifs contenant 60 doses.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la règlementation locale.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
49 avenue Georges Pompidou
92593 Levallois-Perret Cedex
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 550 062 2 0 : 2 dispositif(s) contenant une plaquette thermosoudée OPA/Aluminium/PVC-Aluminium de 60 doses.
· 34009 550 062 3 7 : 3 dispositif(s) contenant une plaquette thermosoudée OPA/Aluminium/PVC-Aluminium de 60 doses.
· 34009 550 062 4 4 : 10 dispositif(s) contenant une plaquette thermosoudée OPA/Aluminium/PVC-Aluminium de 60 doses.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament soumis à prescription médicale.
Liste I