RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 19/10/2017
NEO-CODION ADULTES, sirop
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Camphosulfonate de codéine……………………………………………………………….............. 0,17220 g
Quantité correspondante en codéine base…………………………………………………............ 0,10270 g
Pour 100 ml de sirop.
1 cuillère à soupe (15 ml) contient 15,4 mg de codéine.
Excipients à effet notoire : saccharose, alcool, parahydroxybenzoate de méthyle (E218), parahydroxybenzoate de propyle (E216), jaune orangé S (E110).
1 cuillère à soupe (15 ml) contient 8,7 g de saccharose et 0,4 g d’éthanol.
Titre alcoolique : 3,16 % (V/V).
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
Traitement symptomatique des toux non productives gênantes.
NEO-CODION ADULTES, sirop est indiqué chez les adultes.
4.2. Posologie et mode d'administration
RESERVE A L’ADULTE.
1 cuillère à soupe contient 15 mg de codéine base.
En l'absence d'autre prise médicamenteuse apportant de la codéine ou tout autre antitussif central, la dose quotidienne de codéine à ne pas dépasser est de 120 mg chez l'adulte.
La posologie usuelle est de :
Chez l’adulte : 1 cuillère à soupe par prise, à renouveler au bout de 6 heures en cas de besoin, sans dépasser 4 prises par jour.
Chez le sujet âgé ou en cas d'insuffisance hépatique : la posologie initiale sera diminuée de moitié par rapport à la posologie conseillée chez l'adulte et pourra éventuellement être augmentée en fonction de la tolérance et des besoins.
Les prises devront être espacées de 6 heures au minimum.
Mode d’administration
Voie orale.
Le traitement symptomatique doit être court (quelques jours) et limité aux horaires où survient la toux.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1 ;
Insuffisance respiratoire ;
Toux de l’asthmatique ;
Allaitement (voir rubrique 4.6).
Patients connus comme étant des métaboliseurs ultrarapides des substrats du CYP2D6 (voir rubrique 4.4) ;
Enfants âgés de moins de 12 ans, en raison d’un risque accru d’effets indésirables graves pouvant engager le pronostic vital.
Ce médicament est généralement déconseillé en association avec l’alcool (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
ATTENTION : Ce médicament contient 3,1% V/V d’éthanol (alcool), c’est-à-dire jusqu’à 0,4 g d’éthanol par cuillère à soupe (15 ml).
L’utilisation de ce médicament est dangereuse pour les sujets alcooliques et doit être prise en compte chez les femmes enceintes ou allaitant, les enfants et les groupes à haut risque tels que les insuffisants hépatiques ou les épileptiques.
Ce médicament contient du saccharose. Son utilisation est déconseillée chez les patients présentant une intolérance au saccharose.
Ce médicament contient du parahydroxybenzoate de méthyle (E218) et du parahydroxybenzoate de propyle (E216) et peut provoquer des réactions allergiques (éventuellement retardées).
Ce médicament contient un agent azoïque : jaune orangé S (E110) et peut provoquer des réactions allergiques.
Un traitement prolongé à forte dose peut conduire à un état de dépendance.
Les toux productives, qui sont un élément fondamental de la défense broncho-pulmonaire, sont à respecter.
Il est illogique d’associer un expectorant ou mucolytique à un antitussif.
Avant de prescrire un traitement antitussif, il convient de rechercher les causes de la toux qui requièrent un traitement spécifique.
Si la toux résiste à un antitussif administré à une posologie usuelle, on ne doit pas procéder à une augmentation des doses, mais à un réexamen de la situation clinique.
L’attention des sportifs sera attirée sur le fait que cette spécialité contient un principe actif pouvant induire une réaction positive des tests pratiqués lors des contrôles antidopage.
Métabolisme par le CYP2D6
La codéine est métabolisée en morphine, son métabolite actif, par le cytochrome CYP2D6 au niveau hépatique. En cas de déficit ou d’absence totale de cette enzyme, l'effet thérapeutique attendu ne sera pas obtenu. On estime que jusqu’à 7 % de la population caucasienne pourrait présenter ce déficit. Toutefois, si le patient est un métaboliseur important ou ultrarapide, le risque de survenue d'effets secondaires liés à la toxicité des opiacés est accru, même aux doses habituellement prescrites. Chez ces patients, le métabolisme de la codéine en morphine est plus rapide, ce qui entraîne des taux sériques de morphine plus élevés.
Les symptômes de la toxicité des opiacés comprennent : confusion mentale, somnolence, polypnée (respiration superficielle), myosis, nausées, vomissements, constipation et perte d’appétit. Dans les cas sévères, il peut survenir une défaillance circulatoire et respiratoire, pouvant engager le pronostic vital, avec une issue fatale rapportée dans de très rares cas.
Les estimations de la prévalence des métaboliseurs ultrarapides dans différentes populations sont résumées ci-dessous :
|
Population |
% de prévalence |
|
Africain/Éthiopien |
29% |
|
Afro-américain |
3,4% à 6,5% |
|
Asiatique |
1,2% à 2% |
|
Caucasien |
3,6% à 6,5% |
|
Grec |
6,0% |
|
Hongrois |
1,9% |
|
Européen du Nord |
1% à 2% |
Enfants dont la fonction respiratoire est altérée
L’utilisation de la codéine n’est pas recommandée chez les enfants dont la fonction respiratoire est altérée, y compris en cas de déficit neuromusculaire, d’affections cardiaques ou respiratoires sévères, d’infections des voies aériennes supérieures ou des poumons, de polytraumatisme ou d’interventions chirurgicales lourdes. Ces facteurs peuvent aggraver les symptômes liés à la toxicité de la morphine.
Précautions d’emploi
Prudence en cas d’hypertension intracrânienne qui pourrait être majorée.
La prise de boissons alcoolisées et d’autres médicaments contenant de l’alcool pendant le traitement, est déconseillée (voir rubrique 4.5).
Ce médicament contient 8,7 g de saccharose par cuillère à soupe dont il faut tenir compte dans la ration journalière en cas de régime pauvre en sucre ou de diabète.
Chez le patient cholécystectomisé, la codéine peut provoquer un syndrome douloureux abdominal aigu de type biliaire ou pancréatique, le plus souvent associé à des anomalies biologiques, évocateur d'un spasme du sphincter d'Oddi.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
+ Alcool
Majoration par l’alcool de l’effet sédatif des antitussifs centraux. L’altération de la vigilance peut rendre dangereuse la conduite de véhicules et l’utilisation de machines.
Eviter la prise de boissons alcoolisées et de médicaments contenant de l’alcool.
+ Morphiniques agonistes-antagonistes
Diminution de l'effet antalgique ou antitussif du morphinique, par blocage compétitif des récepteurs, avec risque d'apparition d'un syndrome de sevrage.
+ Morphiniques antagonistes partiels
Risque de diminution de l’effet antalgique.
Associations à prendre en compte
+ Autres analgésiques morphiniques agonistes : (alfentanil, dextromoramide, dihydrocodéine, fentanyl, hydromorphone, morphine, oxycodone, péthidine, phénopéridine, rémifentanil, sufentanil, tapentadol, tramadol), antitussifs morphine-like, antitussifs morphiniques vrais, benzodiazépines et apparentés, barbituriques, méthadone
Risque majoré de dépression respiratoire pouvant être fatale en cas de surdosage.
+ Autres médicaments sédatifs : dérivés morphiniques (analgésiques, antitussifs et traitements de substitution), neuroleptiques, barbituriques, benzodiazépines, anxiolytiques autres que benzodiazépines (méprobamate), hypnotiques, antidépresseurs sédatifs (amitriptyline, doxépine, miansérine, mirtazapine, trimipramine), antihistaminiques H1 sédatifs, antihypertenseurs centraux, baclofène et thalidomide.
Majoration de la dépression centrale. L'altération de la vigilance peut rendre dangereuse la conduite de véhicules et l'utilisation de machines.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les études effectuées chez l’animal ont mis en évidence un effet tératogène de la codéine.
En clinique, les données épidémiologiques menées sur des effectifs restreints de femmes n’ont cependant pas mis en évidence un risque malformatif particulier de la codéine.
Au cours des trois derniers mois de la grossesse, la prise chronique de codéine par la mère, et cela quelle que soit la dose, peut être à l’origine d’un syndrome de sevrage chez le nouveau-né.
En fin de grossesse, des posologies élevées, même en traitement bref, sont susceptibles d’entraîner une dépression respiratoire chez le nouveau-né.
En conséquence, l’utilisation de la codéine ne doit être envisagée ponctuellement au cours de la grossesse que si nécessaire.
NEO-CODION ADULTES, sirop est contre-indiqué pendant l’allaitement (voir rubrique 4.3).
Aux doses thérapeutiques habituelles, la codéine et son métabolique actif passent très faiblement dans le lait maternel, ce qui a priori, n'expose pas le nourrisson allaité au risque de survenue d'effets indésirables. Toutefois, si la femme qui allaite est un métaboliseur ultrarapide des substrats du CYP2D6, des taux plus élevés du métabolite actif, la morphine, peuvent être présents dans le lait maternel ce qui peut, dans de très rares cas, entraîner des effets des opiacés qui peuvent être fatals pour le nourrisson allaité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Aux doses thérapeutiques
Les effets indésirables de la codéine sont comparables à ceux des autres opiacés, mais ils sont plus rares et modérés.
Affections de la peau et du tissu sous-cutané : dermatite allergique
Affections du système nerveux : somnolence, sensation vertigineuse
Affections gastro-intestinales : nausées, vomissement, constipation, pancréatite.
Affections respiratoires, thoraciques et médiastinales : dépression respiratoire (voir rubrique 4.3), bronchospasme
Aux doses supra - thérapeutiques
Affections psychiatriques : dépendance, syndrome de sevrage, à l’arrêt brutal qui peut être observé chez l’utilisateur et chez le nouveau-né de mère intoxiquée à la codéine
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
Signes chez l’adulte
Dépression aiguë des centres respiratoires (cyanose, bradypnée), somnolence, rash, vomissements, prurit, ataxie, convulsions.
Signes chez l’enfant (seuil toxique : 2 mg/kg en prise unique)
Bradypnée, pauses respiratoires, myosis, convulsions, flush et œdème du visage, éruption urticarienne, collapsus, rétention d’urine.
Traitement
Assistance respiratoire
Naloxone en cas d’intoxication massive
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Alcaloides de l’opium et dérivés, code ATC : R05DA04.
Codéine : Alcaloïde de l’opium ; antitussif d’action centrale, ayant un effet dépresseur sur les centres respiratoires.
5.2. Propriétés pharmacocinétiques
· Codéine par voie orale
Le temps d’obtention du pic de concentration plasmatique est de l’ordre d’une heure.
Demi-vie plasmatique de l’ordre de 3 heures (chez l’adulte).
Distribution
Traverse le placenta et diffuse dans le lait maternel.
Biotransformation
Métabolisme hépatique.
Environ 10% de la codéine est déméthylée et transformée en morphine dans l’organisme.
5.3. Données de sécurité préclinique
3 ans.
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Flacon (verre brun de type III) de 180 ml, capsule (aluminium), joint (polyéthylène).
6.6. Précautions particulières d’élimination et de manipulation
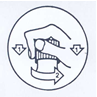
Le flacon est fermé par un bouchon de sécurité.
|
|
Pour ouvrir le flacon : poser le flacon sur un plan dur, puis appuyer sur le bouchon en le dévissant dans le sens indiqué par la flèche. Le flacon doit être refermé après chaque utilisation.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
IMMEUBLE LE WILSON
70 AVENUE DU GENERAL DE GAULLE
92 800 PUTEAUX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· n°34 009 307 100 6 7 : 180 ml en flacon (verre brun).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
<Date de première autorisation:{JJ mois AAAA}>
<Date de dernier renouvellement:{JJ mois AAAA}>
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
<{JJ mois AAAA}>
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM.
Liste I.