RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 14/03/2018
PHYSIOGINE 0,1 POUR CENT, crème vaginale
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Estriol...................................................................................... 0,10 g pour 100 g de crème vaginale
Excipients à effet notoire : alcool cétylique et alcool stéarylique
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
· Atrophie vaginale
· Prurit vulvaire
· Dyspareunie
· Ulcérations.
4.2. Posologie et mode d'administration
Posologie
Une application de crème jusqu'à régression des symptômes en moyenne au bout de trois semaines suivie d'un traitement d'entretien d'une application de crème deux jours par semaine.
La posologie doit être adaptée selon l'amélioration obtenue.
Des cures d'entretien peuvent être nécessaires.
· Il est recommandé de prendre PHYSIOGINE 0,1 POUR CENT, crème vaginale en combinaison avec un progestatif afin de prévenir l’hyperplasie de l’endomètre et le cancer de l’endomètre, comme c’est le cas avec les estrogènes administrés par voie systémique (orale, transdermique).
· Chez les femmes ayant subi une hystérectomie, il est déconseillé de compléter le traitement avec un progestatif, si aucun diagnostic d’endométriose n’a été préalablement établi.
· En cas d’oubli d’une dose: si la dose suivante est à moins de 12 heures prendre la dose manquée immédiatement. Si la prochaine dose est à plus de 12 heures, attendre le moment de la prochaine dose et la prendre à l’heure habituelle. L’oubli d’une dose peut augmenter la survenue de métrorragie et des « spottings ».
Mode d’administration
La crème doit être appliquée le soir au coucher dans le vagin. Un applicateur marqué d'un trait rouge permet l'application de 0,5 g de crème (soit 0,5 mg d'estriol). Cet applicateur doit être lavé à l'eau après chaque application.
Instructions d’emploi destinées à la patiente:
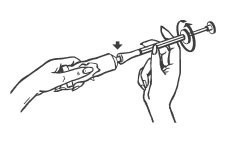
1. Dévissez le bouchon du tube, retournez-le et ouvrez le tube en perçant la cupule d’aluminium à l’aide de la pointe du bouchon.
2. Vissez l’embout de l’applicateur sur le tube. Assurez-vous que le piston est complètement inséré dans le tube.

3. Pressez lentement sur le tube, de façon à remplir l’applicateur de crème jusqu’au trait où le piston s’arrête (à la bague rouge, voir les flèches dans l’illustration ci-dessous).
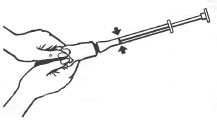
4. Dévissez l’applicateur du tube; remettez le bouchon sur le tube.
5. Pour mettre la crème, allongez-vous et introduisez l’embout de l’applicateur profondément dans le vagin.
6. Enfoncez lentement le piston de l’applicateur complètement jusqu’à ce que l’applicateur soit vide.
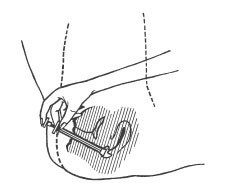
7. Après emploi, retirer complètement le piston de l’applicateur au-delà du point de résistance et laver le piston et l’applicateur dans de l’eau tiède savonneuse. Ne pas utiliser de détergent agressif. Bien rincer.
NE PLACEZ PAS L’APPLICATEUR DANS DE L’EAU CHAUDE OU BOUILLANTE.
8. L’applicateur peut être réassemblé en insérant le piston à fond dans le cylindre au-delà du point où une résistance est constatée.
Jetez l’applicateur lorsque le tube est vide. Chez les femmes qui n’utilisent pas de THS ou chez les femmes qui changent deTHS continu combiné, le traitement peut être débuté le jour souhaité. Chez les femmes qui changent de THS cyclique ou de THS continu séquentiel, le traitement doit débuter une semaine après le cycle précédent.
Pour l’initiation et la poursuite du traitement des symptômes de la ménopause, la plus petite dose efficace doit être utilisée pendant la durée la plus courte possible (voir aussi rubrique 4.4).
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· Cancer du sein connu ou suspecté ou antécédents de cancer du sein ;
· Tumeurs malignes œstrogéno-dépendantes connues ou suspectées (exemple: cancer de l'endomètre) ;
· Hémorragies génitales non diagnostiquées,
· Hyperplasie de l’endomètre non traitée ;
· Accident thromboembolique veineux idiopathique ancien ou en cours (thrombose veineuse profonde, embolie pulmonaire) ;
· Affections thrombophiliques connues (par exemple déficit en protéine C, en protéine S ou en antithrombine, voir rubrique 4.4) ;
· Maladie thromboembolique artérielle en évolution ou récente (par exemple angine de poitrine, infarctus du myocarde) ;
· Affection hépatique aiguë ou antécédents d’affection hépatique, aussi longtemps que les tests de la fonction hépatique restent anormaux ;
· Porphyrie ;
· Grossesse.
4.4. Mises en garde spéciales et précautions d'emploi
· Les données concernant le risque associé aux THS dans le traitement de la ménopause prématurée sont limitées. Toutefois, en raison du faible niveau de risque absolu chez les femmes plus jeunes, la balance bénéfice/risque pour ces femmes pourrait être plus favorable que chez les femmes plus âgées.
Examen clinique/surveillance
· Avant de débuter ou de recommencer un THS, il est indispensable de recueillir les antécédents médicaux personnels et familiaux de la patiente. Un examen clinique et gynécologique complet (avec examen mammaire et pelvien) doit être pratiqué, en tenant compte des antécédents médicaux de la patiente ainsi que des contre-indications et des mises en garde concernant le traitement. Il est recommandé d'effectuer des examens médicaux réguliers, pendant toute la durée du traitement, dont la nature et la fréquence seront adaptées à chaque femme. Les femmes doivent être informées du type d'anomalies mammaires à signaler à leur médecin ou à leur infirmière (voir « Cancer du sein »). Il est recommandé, que ces examens médicaux, y compris une mammographie, soient pratiqués selon les recommandations en vigueur, et adaptés à chaque patiente.
Conditions nécessitant une surveillance
· Si l'une des affections suivantes survient, est survenue précédemment, et/ou s'est aggravée au cours d'une grossesse ou d'un précédent traitement hormonal, la patiente devra être étroitement surveillée. Ces affections pouvant réapparaître ou s'aggraver au cours du traitement par PHYSIOGINE 0,1 POUR CENT, crème vaginale, en particulier:
· léiomyome (fibrome utérin) ou endométriose;
· antécédent ou présence de facteurs de risque thromboemboliques (voir rubrique «Accidents thromboemboliques veineux» ci-dessous)
· facteurs de risque de tumeurs œstrogéno-dépendantes, par exemple: 1er degré d'hérédité pour le cancer du sein;
· hypertension artérielle;
· troubles hépatiques (par exemple: adénome hépatique);
· diabète avec ou sans atteinte vasculaire;
· lithiase biliaire;
· migraines ou céphalées (sévères);
· lupus érythémateux disséminé (LED);
· antécédents d'hyperplasie endométriale (voir rubrique « hyperplasie endométriale »);
· épilepsie;
· asthme;
· otospongiose.
Arrêt immédiat du traitement
Le traitement doit être arrêté immédiatement, dans le cas où une contre-indication est découverte, et dans les cas suivants:
· ictère ou altération de la fonction hépatique;
· augmentation significative de la pression artérielle;
· céphalée de type migraine inhabituelle;
· grossesse.
Hyperplasie de l’endomètre et carcinome
· Chez les femmes dont l’utérus est intact, le risque d’hyperplasie endométriale et de carcinome est augmenté, lorsque les œstrogènes sont administrés seuls pendant des périodes prolongées. L’augmentation déclarée du risque de cancer de l’endomètre, chez les patientes prenant uniquement des œstrogènes, est de 2 à 12 fois plus élevé que chez les patientes non traitées ; en fonction de la durée du traitement et de la dose d’œstrogènes utilisée (voir rubrique 4.8). Après l'arrêt du traitement, le risque peut rester élevée pendant au moins 10 ans.
· L’ajout d’un progestatif pendant au moins 12 jours par cycle de 28 jours ou d’un traitement combiné continu d’œstrogène-progestérone chez les femmes non hystérectomisées, permet de prévenir l’excès du risque associé au THS par œstrogènes seuls.
· La survenue de métrorragies ou des « spottings » peut se produire pendant les premiers mois de traitement. Des examens médicaux complémentaires sont nécessaires, si la métrorragie ou les « spottings » surviennent après une certaine durée de traitement ou s’ils continuent après l’arrêt du traitement. Ces examens peuvent nécessiter une biopsie de l’endomètre afin d’exclure la présence d’une tumeur maligne de l’endomètre.
· La stimulation oestrogénique non compensée (THS par œstrogènes seuls) peut conduire à une transformation prémaligne ou maligne des foyers résiduels d'endométriose. Ce médicament doit donc être prescrit en combinaison avec des progestatifs, chez les femmes ayant subi une hystérectomie suite à une endométriose, notamment chez celles ayant une endométriose résiduelle.
Cancer du sein
· Les données globales suggèrent un risque accru de cancer du sein (dépendant de la durée du THS), chez les femmes prenant un traitement combiné d’œstrogènes et de progestatifs, et peut-être également avec un THS par œstrogènes seuls.
· L’étude Women’s Health Initiative (WHI), randomisée contrôlée contre placebo, n’a pas montré d’augmentation du risque de cancer du sein chez les femmes hystérectomisées prenant un THS par œstrogènes seuls. Les études d’observations ont surtout rapporté une légère augmentation de ce risque. Toutefois, ce risque reste nettement inférieur à celui observé chez les utilisatrices de traitements associant œstrogènes et progestatifs (voir rubrique 4.8).
· L’excès de risque associé au traitement devient évident après quelques années d’utilisation, mais il diminue et redevient au niveau du risque de référence quelques années (5 ans au plus) après l’arrêt du traitement.
· Le THS, surtout celui associant œstrogènes et progestatifs, augmentent la densité des images mammographiques, ce qui peut compromettre la détection radiologique du cancer du sein.
Cancer de l’ovaire
· Le cancer de l’ovaire est beaucoup plus rare que le cancer du sein.
· Les données épidémiologiques provenant d'une importante méta-analyse suggèrent une légère augmentation du risque chez les femmes prenant un THS par œstrogènes seuls ou par combinaison d'œstrogènes et de progestatifs. Ce risque apparaît dans les cinq ans suivant le début du THS et diminue progressivement après l'arrêt du traitement.
· D'autres études, y compris l'essai WHI (Women's Health Initiative), suggèrent qu'un risque similaire ou légèrement inférieur peut être associé avec une utilisation du THS combiné (voir rubrique 4.8).
Accidents thrombo-emboliques veineux
· Les THS sont associés à un risque accru de 1,3 à 3 fois plus élevé d’accidents thromboemboliques veineux (TEV), c’est-à-dire, la thrombose veineuse ou l’embolie pulmonaire. Le risque de TEV est accru pendant la première année d’utilisation (voir rubrique 4.8).
· Les patientes souffrant d’états thrombophiliques connus ont un risque accru de TEV et la prise d’un THS peut augmenter ce risque. La prise d’un THS est donc contre-indiquée chez ces patientes (voir rubrique 4.3).
· Les facteurs de risque généralement reconnus pour le TEV comprennent l’utilisation d’œstrogènes, un âge avancé, une chirurgie majeure, une immobilisation prolongée, l’obésité (IMC> 30kg/m2), une grossesse / post-partum, un lupus érythémateux systémique et un cancer. Il n’y a pas de consensus sur le rôle possible des varices dans les TEV.
· Comme chez tous les patients postopératoires, des mesures prophylactiques doivent être envisagées pour prévenir la survenue de TEV après une chirurgie. Si une immobilisation prolongée doit suivre une chirurgie programmée, il est recommandé d’arrêter temporairement le THS 4 à 6 semaines avant l’intervention. Le traitement ne doit être repris qu’après mobilisation complète de la patiente.
· Chez les femmes n’ayant pas d’antécédents personnels de TEV, mais avec un parent au premier degré ayant des antécédents de thrombose présenté à un jeune âge, le dépistage peut être proposé après un rappel attentif de ses limites (seule une partie des anomalies thromboemboliques peuvent être dépistée). Si un défaut thrombophilique autre que la thrombose est identifiée chez les membres de la famille ou si le défaut est « sévère » (par exemple déficit en protéine C, en protéine S, en antithrombine ou une combinaison de ces défauts), les THS sont contre-indiqués.
· Les femmes ayant déjà un traitement anticoagulant chronique exigent un examen attentif de la balance bénéfice/risque avant de commencer le traitement.
· Si un TEV se développe après l'initiation du traitement, il faut immédiatement arrêter le traitement. Les patientes doivent être informées qu'elles doivent contacter leur médecin immédiatement si elles remarquent les symptômes éventuels d'un TEV (en particulier gonflement douloureux d'un membre inférieur, douleur thoracique soudaine ou dyspnée).
Maladie des artères coronaires (AVC)
· Il n’y a aucune donnée provenant d’études contrôlées et randomisées concernant une protection contre l’infarctus du myocarde, chez les femmes avec ou sans maladie coronarienne existante, qui ont reçu un THS combiné ou par œstrogènes seuls.
· Les données des études contrôlées n’ont montré aucune augmentation de risque de survenue de maladie coronarienne chez les femmes hystérectomisées prenant un THS par œstrogènes seuls.
Accident vasculaire cérébral ischémique
· Les traitements combinant œstrogènes et progestérones sont associés à un risque jusqu'à 1,5 fois du risque d’AVC ischémique. Le risque relatif ne varie pas en fonction de l’âge ou de la durée écoulée depuis le début de la ménopause. Cependant, comme le risque d’AVC dépend fortement de l’âge, le risque d’AVC chez les femmes qui prennent un THS augmentera avec l’âge (voir rubrique 4.8).
Autres précautions d’emploi
· Les œstrogènes peuvent provoquer une rétention de liquides. Les patientes présentant une insuffisance cardiaque ou rénale doivent, par conséquent, être surveillées de près.
· Les femmes présentant une hypertriglycéridémie préexistante doivent être surveillées de près pendant le traitement substitutif ostrogénique ou hormonal, en effet de rares cas avec une élévation importante des taux plasmatiques de triglycérides entraînant une pancréatite ont été observés.
· Les œstrogènes augmentent la globuline liée à la thyroïde (TBG), ce qui conduit à une augmentation de l’hormone thyroïdienne totale circulante, mesurée par le taux d’iode lié aux protéines (PBI), le taux de T4 (par colonne ou par radio-immunodosage) ou le taux de T3 (par radio-immunodosage). L’absorption de T3 sur la résine est diminuée, reflétant une TBG élevée. Les concentrations de T3 libre et de T4 libre sont inchangées. D’autres protéines de liaison peuvent avoir un taux sérique élevé, comme la globuline liée aux corticoïdes (CBG), la protéine liée aux hormones sexuelles (SHBG), ce qui entraîne une augmentation du taux des corticostéroïdes circulants et du taux des stéroïdes sexuels. Les concentrations d’hormones actives libres sont inchangées. D’autres taux de protéines plasmatiques peuvent être augmentés (angiotensine, alpha-I-antitrypsine, céruloplasmine).
· L’utilisation d’un THS n’améliore pas la fonction cognitive. Il existe des données concernant une augmentation du risque de démence chez les femmes après l’âge de 65 ans, qui ont commencé à prendre un THS combiné en continu ou un THS par œstrogènes seuls.
· L’utilisation d’œstriol induit une faible diminution de FSH et LH. L’influence de l’œstriol sur les autres résultats des tests endocriniens de laboratoire est inconnue.
· Au cours d'essais cliniques menés sur le schéma thérapeutique combiné ombitasvir hydraté/paritaprévir hydraté/ritonavir, avec ou sans dasabuvir, les augmentations du taux d'ALAT dépassant par plus de cinq fois la limite normale supérieure étaient significativement plus fréquentes chez les femmes qui recevaient des médicaments contenant de l'éthinylestradiol. D'autre part, les femmes qui utilisaient une autre forme d'œstrogène que l'éthinylestradiol (par exemple, œstradiol, œstriol ou œstrogènes conjugués) présentaient une augmentation du taux d'ALAT comparable à celles qui ne prenaient aucun œstrogène. Cependant, en raison du nombre limité de sujets qui utilisent ces autres formes d'œstrogène, la prudence est de mise lorsqu'elles sont administrées en combinaison avec le schéma thérapeutique combiné ombitasvir hydraté/paritaprévir hydraté/ritonavir avec ou sans dasabuvir (voir rubrique 4.5). Une tension mammaire persistante ou la production excessive de glaire cervicale sont les signes d’une posologie trop élevée.
Ce médicament contient de l'alcool cétylique et de l'alcool stéarylique et peut provoquer des réactions cutanées locales (par exemple eczéma).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aux doses recommandées, l'estriol pour usage local n'est pas susceptible de causer des interactions médicamenteuses significatives d'un point de vue médical.
Le ritonavir et le nelfinavir, bien que connus comme des inhibiteurs enzymatiques puissants, se comportent comme des inducteurs quand ils sont utilisés de façon concomitante avec des hormones stéroïdiennes.
Les préparations à base de plantes contenant du millepertuis (Hypericum perforatum) peuvent induire le métabolisme des œstrogènes.
Cliniquement, une augmentation du métabolisme des œstrogènes et des progestatifs peut conduire à un effet diminué et à des modifications du profil de saignement utérin.
Après administration vaginale, l'effet de premier passage dans le foie est évité et donc, l’application d’estrogènes par cette voie est moins affectée par les inducteurs enzymatiques, que dans le cas de leur administration par voie orale.
Au cours d'essais cliniques menés sur le schéma thérapeutique combiné ombitasvir hydraté/paritaprévir hydraté/ritonavir, avec ou sans dasabuvir, les augmentations du taux d'ALAT dépassant par plus de cinq fois la limite normale supérieure étaient significativement plus fréquentes chez les femmes qui recevaient des médicaments contenant de l'éthinylestradiol. D'autre part, les femmes qui utilisaient une autre forme d'œstrogène que l'éthinylestradiol (par exemple, œstradiol, œstriol ou œstrogènes conjugués) présentaient une augmentation du taux d'ALAT comparable à celles qui ne prenaient aucun œstrogène. Cependant, en raison du nombre limité de sujets qui utilisent ces autres formes d'œstrogènes, la prudence est de mise lorsqu'elles sont administrées en combinaison avec le schéma thérapeutique combiné ombitasvir hydraté/paritaprévir hydraté/ritonavir avec ou sans dasabuvir (voir rubrique 4.4)
Association déconseillé :
+ Spermicides il est probable que les traitements vaginaux locaux puissent inactiver une contraception locale avec un spermicide.
4.6. Fertilité, grossesse et allaitement
Grossesse
En clinique, à la différence du diéthylstilbestrol, les résultats de nombreuses études épidémiologiques permettent d'écarter à ce jour, un risque malformatif des estrogènes seuls ou en association en début de grossesse. En cas de prise accidentelle au cours d'une grossesse, interrompre le traitement sans autre mesure.
Allaitement
PHYSIOGINE 0,1 POUR CENT, crème vaginale, n'a pas d'indication au cours de l'allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Comme tous les produits destinés à être appliqués sur les muqueuses, PHYSIOGINE 0,1 POUR CENT, crème vaginale peut dans de rares cas entraîner une irritation ou un prurit en début de traitement.
Une mastodynie peut éventuellement apparaître de façon transitoire en début de traitement.
Les effets indésirables suivants ont été rapportés dans la littérature et pendant la surveillance post-marketing.
|
Classe de systèmes d’organes |
Fréquence |
Effets indésirables |
|
Troubles du métabolisme et de la nutrition |
Peu fréquent (≥ 1/1 000, < 1/100) |
Rétention hydrique Rétention liquidienne |
|
Affections gastro-intestinales |
Peu fréquent (≥ 1/1 000, < 1/100) |
Nausées |
|
Affections des organes de reproduction et du sein |
Peu fréquent (≥ 1/1 000, < 1/100) |
Sensibilité mammaire, inconfort ou douleur dans les seins Saignements post-ménopausiques Sécrétions cervicales |
|
Troubles généraux et anomalies au site d'administration |
Peu fréquent (≥ 1/1 000, < 1/100) |
Irritation et prurit local |
|
Fréquence indéterminée |
Symptômes pseudo-grippaux |
Ces effets indésirables sont généralement transitoires mais ils peuvent également indiquer l’utilisation d’une posologie trop élevée.
Risque de cancer du sein
Les femmes prenant un traitement combinant œstrogènes et progestatifs pendant plus de 5 ans ont un risque jusqu’à deux fois supérieur d’avoir un cancer du sein diagnostiqué.
L’augmentation du risque avec les traitements œstrogéniques seuls est nettement inférieure à celle observée avec la prise de traitements combinant œstrogènes et progestatifs.
Le niveau de risque dépend de la durée d’utilisation (voir rubrique 4.4).
Les résultats de la plus vaste étude randomisée, contrôlée par placebo (étude WHI) et de la plus vaste étude épidémiologique (MWS) sont présentés ci-dessous.
Etude Million Women (MWS) – Risque de cancer du sein augmenté estimé après 5 ans d’utilisation
|
Age (années) |
Cas supplémentaires pour 1000 patientes n’ayant jamais pris de THS pendant plus de 5 ans* |
Risque relatif & IC95%# |
Cas supplémentaires pour 1000 patientes ayant pris un THS plus de 5 ans (IC95%) |
|
|
THS œstrogénique |
||
|
50-65 |
9-12 |
1.2 |
1-2 (0-3) |
|
|
THS combinant œstrogènes et progestatifs |
||
|
50-65 |
9-12 |
1.7 |
6 (5-7) |
|
#Risque relatif global. Le risque relatif n’est pas constant mais il augmente avec la durée d’utilisation. Note : Etant donné que l’incidence du cancer du sein varie d’un pays de l’UE à l’autre, le nombre de cas supplémentaires de cancer du sein changera proportionnellement. |
|||
*Tiré des taux d’incidence de référence dans les pays développés.
Etude WHI US – risque augmenté de cancer du sein après 5 ans de prise
|
Age (année) |
Incidence pour 1000 patientes prenant un placebo pendant plus de 5 ans |
Risque relatif & IC95% |
Cas supplémentaires pour 1000 patientes ayant pris un THS plus de 5 ans (IC95%) |
|
|
Œstrogène seul |
||
|
50-79 |
21 |
0.8 (0.7-1.0) |
-4 (-6-0)** |
|
|
Œstrogène et progestatif‡ |
||
|
50-79 |
17 |
1.2 (1.0-1.5) |
+4 (0-9) |
**Etude WHI chez des femmes hystérectomisées, qui ne montre pas d’augmentation du risque de cancer du sein
‡Quand l’analyse est limitée aux femmes qui n’ont pas pris de THS avant l’étude, il n’y a pas d’augmentation du risque apparent pendant les 5 années de traitement : après 5 ans, le risque est plus élevé que chez les non-traitées.
Risque de cancer endométrial
Femmes ménopausées avec un utérus
Le risque de cancer endométrial est d’environ 5/1000 femmes avec un utérus ne prenant pas de THS.
Chez les femmes avec un utérus, la prise de THS avec œstrogènes seuls n’est pas recommandée car cela augmente le risque de cancer endométrial (voir rubrique 4.4).
Les études épidémiologiques ont montré que l’augmentation du risque de cancer endométrial varie entre 5 et 55 cas diagnostiqués supplémentaires pour 1000 femmes âgées entre 50 et 65 ans, en fonction de la durée de traitement par œstrogènes seuls et en fonction de la dose d’œstrogènes
L’ajout d’un progestatif au traitement par œstrogènes seuls pendant au moins 12 jours par cycle peut prévenir cette augmentation du risque. L’étude MWS, a montré que la prise d’un THS combiné (séquentiel ou continu) pendant 5 ans n’augmentait pas le risque de cancer endométrial (RR de 1.0 (0.8-1.2)).
Cancer de l’ovaire
L'utilisation d'un THS par œstrogènes seuls ou par une combinaison d'œstrogènes et de progestatifs a été associée à une légère augmentation du risque de cancer ovarien diagnostiqué (voir rubrique 4.4).
Une méta-analyse portant sur 52 études épidémiologiques a démontré un risque accru de cancer de l’ovaire chez les femmes prenant actuellement un THS par rapport aux femmes n’ayant jamais pris de traitement (RR 1.43, IC 95 % 1.31-1.56).
Chez les femmes âgées de 50 à 54 ans, la prise d’un THS pendant cinq ans entraîne l'apparition d'un cas supplémentaire pour 2000 utilisatrices. Chez les femmes âgées entre 50 à 54 ans qui ne prennent pas de THS, environ 2 femmes sur 2000 auront un diagnostic de cancer de l’ovaire sur une période de cinq ans.
Risque d’accidents thromboemboliques veineux
Les THS sont associés à un risque accru de 1,3 à 3 fois plus élevé d’évènements thromboemboliques veineux (TEV), comme la thrombose veineuse ou l’embolie pulmonaire. Le risque de TEV est accru pendant la première année d’utilisation (voir rubrique 4.4).
Etude WHI – Risque augmenté de TEV après 5 ans de prise
|
Age (années) |
Incidence pour 1000 patientes prenant un placebo pendant plus de 5 ans |
Risque relatif et IC95% |
Cas supplémentaires pour 1000 patientes ayant pris un THS |
|
Œstrogènes seuls per os* |
|||
|
50-59 |
7 |
1.2 (0.6-2.4) |
1 (-3-10) |
|
Combinaison œstrogènes et progestatifs per os |
|||
|
50-59 |
4 |
2.3 (1.2-4.3) |
5 (1-13) |
*Etude chez les femmes hystérectomisées
Risque de maladie coronarienne
Le risque de maladie coronarienne est légèrement augmenté chez les femmes de plus de 60 ans prenant des THS combinant œstrogènes et progestatifs (voir rubrique 4.4).
Risque d’AVC ischémique
Le traitement œstrogénique seul ou les traitements associant œstrogènes et progestatifs sont associés à une augmentation du risque relatif d’AVC ischémique d’environ 1,5 fois. Le risque d’AVC hémorragique n’est pas augmenté par la prise de THS.
Ce risque relatif ne dépend pas de l’âge ou de la durée de traitement, mais comme le risque de référence est fortement lié à l’âge, le risque global d’AVC ischémique chez les femmes qui prennent un THS augmente avec l’âge (voir rubrique 4.4).
Etudes combinées WHI – Risque supplémentaire d’AVC ischémique* pour une durée de traitement de plus de 5 ans
|
Age (années) |
Incidence pour 1000 patientes prenant un placebo pendant plus de 5 ans |
Risque relatif et IC95% |
Cas supplémentaires pour 1000 patientes ayant pris un THS |
|
50-59 |
8 |
1.3 (1.1-1.6) |
3 (1-5) |
*Aucune différence n’a été faite entre les AVC ischémique et hémorragique
D’autres effets indésirables ont été rapportés lors de l’administration d’un traitement œstroprogestatif.
Thromboembolie veineuse (c.-à-d.: thrombose veineuse profonde pelvienne ou des membres inférieurs et embolie pulmonaire) est plus fréquente chez les femmes sous THS que chez les non-utilisatrices. En l’absence de données on ne sait pas si PHYSIOGINE 0,1 POUR CENT, crème vaginale est différent à cet égard. Pour des informations complémentaires, voir rubriques 4.3 “Contre-indications“ et 4.4 « Mises en garde spéciales et précautions d’emploi »;
Infarctus du myocarde et accident vasculaire cérébral;
Affections biliaires;
Troubles cutanés et sous cutanés: chloasma, érythème polymorphe, érythème noueux, purpura vasculaire;
Démence probable (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
La toxicité aiguë de l'estriol chez l'animal est très faible. La survenue de symptômes toxiques n'est donc pas attendue, même si plusieurs comprimés ont été pris simultanément. Dans le cas d'un surdosage aigu, des nausées, vomissements et saignements génitaux chez la femme peuvent survenir. Aucun antidote spécifique n'est connu. Si nécessaire, un traitement symptomatique peut être administré.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
PHYSIOGINE 0,1 POUR CENT, crème vaginale contiennent de l’estriol, une hormone féminine naturelle. C’est un estrogène d’action courte et d’élimination rapide qui n’a pas d’action sur l’endomètre à la posologie préconisée.
L’estriol en applications locales soulage les symptômes et affections dus au déficit estrogénique de la post-ménopause.
Il induit la normalisation de l’épithélium vaginal et ainsi restaure le pH physiologique du vagin. La résistance à l’infection et à l’inflammation est, de ce fait, augmentée.
Efficacité et sécurité cliniques
· Un soulagement des symptômes de ménopause était obtenu pendant les premières semaines du traitement
· Des saignements vaginaux n’ont été que rarement signalés après le traitement par PHYSIOGINE 0,1 POUR CENT, crème vaginale.
5.2. Propriétés pharmacocinétiques
L’estriol administré localement sous forme de PHYSIOGINE est très bien absorbé comme en témoigne l’élévation rapide des taux sériques d’estriol.
Distribution
La concentration plasmatique est maximale 1 à 2 heures après l’application puis décroît pour revenir aux valeurs de base en 24 heures. Après administration vaginale de 0,5 mg d’estriol la Cmax est environ 100 ng/ml, la Cmin environ 25 ng/ml et la Cmoyenne environ 70 ng/ml. Après 3 semaines d’administration journalière de 0,5 mg d’estriol par voie vaginale, la Cmoyenne a diminué jusqu’à 40 pg/ml.
Biotransformation
L’estriol se lie presque en totalité (90 %) à l’albumine plasmatique. Contrairement à d’autres estrogènes, l’estriol se lie très peu à la SHBG (sex hormone binding globulin). Le métabolisme de l’estriol consiste essentiellement en conjugaison et déconjugaison au cours du cycle entéro-hépatique.
Élimination
L’estriol, qui est un produit final de dégradation métabolique, est essentiellement excrété dans les urines sous forme conjuguée après 24 heures. Une petite partie (2 % environ) est excrétée dans les fèces, principalement sous forme d’estriol non conjugué.
5.3. Données de sécurité préclinique
3 ans
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas +25°C. Ne pas congeler.
6.5. Nature et contenu de l'emballage extérieur
15 g en tube (aluminium verni) avec applicateur (styrène acrylonitrile) muni d'une bague (polyéthylène).
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
3016 LAKE DRIVE
CITYWEST BUSINESS CAMPUS
DUBLIN 24
IRLANDE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· CIP 329 691-7 ou 34009 329 691 7 3 : 15 g en tube (aluminium verni) avec applicateur (styrène acrylonitrile) muni d’une bague (polyéthylène)
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
Date de première autorisation:09 juin 1987
Date de dernier renouvellement:
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
<{JJ mois AAAA}>
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste II