RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 30/05/2018
Oxinate d'indium (111In) Mallinckrodt, solution pour marquage in vitro des éléments figurés du sang.
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Pour 1 mL de solution.
Oxinate d'indium [111In]....................................................................... 37 MBq à la date de calibration
Oxine (quantité exprimée en oxine)..................................................................................... 0,025 mg
La préparation ne contient pas d'agent bactériostatique.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour marquage en flacon multidose.
4.1. Indications thérapeutiques
Ce médicament est à usage diagnostique uniquement.
Marquage in vitro des éléments figurés du sang administrés ensuite par voie intraveineuse pour différents examens scintigraphiques et pour des mesures d'échantillons sanguins.
Les indications principales des cellules sanguines marquées à l'indium-111 sont :
· Scintigraphie aux leucocytes marqués à l’indium-111, en complément d’autres techniques d’imagerie :
- localisation des sites inflammatoires ou d’abcès, notamment, abdominaux ;
- confirmation d’infection osseuse sur prothèse ;
- localisation de foyers infectieux dans le cas de fièvre inexpliquée ;
- diagnostic et suivi des maladies inflammatoires intestinales.
· Plaquettes marquées à l’indium-111 (thrombocytes) :
- détermination de la durée de vie des plaquettes et de leur biodistribution, en particulier dans la rate et le foie en cas de thrombocytopénie ;
- scintigraphie pour le diagnostic de thromboses artérielles ou veineuses, d’anévrismes, de rejets de greffes rénales ou pancréatiques par exemple.
· Erythrocytes marqués à l'indium-111 :
- diagnostic et localisation d'une hémorragie digestive occulte.
4.2. Posologie et mode d'administration
Leucocytes marqués à l’indium-111
L’activité recommandée chez l’adulte et la personne âgée est comprise entre 7 et 30 MBq, administrée au cours d’une injection unique après marquage in vitro.
Plaquettes marquées à l’indium-111
L’activité recommandée pour l’adulte et le sujet âgé est comprise entre 2 et 4 MBq pour les études de la durée de vie des plaquettes et de 4 à 20 MBq pour les études de distribution plaquettaire.
Erythrocytes marquées à l’indium-111
L’activité recommandée pour l’adulte et le sujet âgé est comprise entre 4 et 20 MBq par injection intraveineuse.
Posologie
- Posologie pédiatrique
- Utilisation chez l’enfant
- L’activité administrée chez l’enfant peut être calculée à partir de l’activité administrée chez l’adulte en ajustant en fonction du poids, de la surface corporelle ou de l’âge de l’enfant. Pour les nourrissons et les bébés n’ayant pas un an, la taille de l’organe cible par rapport à l’organisme doit également être pris en compte.
- Chez le très jeune enfant (âge supérieur à un an), l’activité minimale pour obtenir des images de qualité suffisante correspond à 10 % de l’activité adulte (voir rubrique 11).
Mode d’administration
L’indium-114m peut être présent en tant qu’impureté radionucléidique dans l’indium-111. Cet isotope a une durée de vie plus longue (49,5 jours) que l’indium-111 (2,8 jours) et contribuera à une augmentation de la dose absorbée (voir 11). Les cellules sanguines marquées à l’indium-111 ne peuvent être administrées que si la présence d’indium-114m reste inférieure à 0,2 %.
Administration par voie intraveineuse stricte.
Plaquettes marquées à l’indium-111
Dans les études de la durée de vie des plaquettes, le nombre et la chronologie des prélèvements sont fonction de l’indication de l’examen. Il est conseillé que les prélèvements soient réalisés au moins 20 minutes, deux, trois et quatre heures après l’injection, puis chaque jour durant 10 jours.
Acquisition des données
Une fixation pulmonaire diffuse ou localisée de leucocytes marqués à l'indium-111 doit toujours être interprétée avec précaution, celle-ci peut être due à une localisation marginale physiologique.
Leucocytes marqués à l’indium-111
Il est possible de détecter des foyers de fixation des leucocytes marqués à l’indium-111 sur des images réalisées entre 3 à 6 heures après l’administration. Cependant le rapport signal/bruit des lésions inflammatoires est beaucoup plus marqué sur les scintigraphies réalisées 24 heures après l’injection.
Plaquettes marquées à l’indium-111
Les scintigraphies sont habituellement réalisées deux à six heures après leur administration. Il est recommandé que les images soient acquises séquentiellement jusqu’à 48 ou 72 heures après l’injection.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Risque de réactions d’hypersensibilité ou de réactions anaphylactiques.
En cas de réaction d’hypersensibilité ou de réaction anaphylactique, l’administration du produit médicamenteux doit être immédiatement interrompue et un traitement par voie intraveineuse doit être débuté, si nécessaire. Afin de permettre une prise en charge rapide en cas d’urgence, il convient d’avoir à disposition immédiate les médicaments et le matériel nécessaires, notamment des sondes d’intubation trachéale et du matériel de ventilation.
Justification du bénéfice/risque individuel
Pour chaque patient, l’exposition aux rayonnements ionisants doit se justifier sur la base du bénéfice attendu. L’activité administrée doit être déterminée en limitant autant que possible la dose de radiation résultante tout en permettant d’obtenir l’information diagnostique recherchée.
Population pédiatrique
Pour plus d’information sur l’utilisation dans la population pédiatrique, voir rubrique 4.2.
Une attention particulière doit être portée à l’indication de l’examen puisque la dose efficace par MBq est plus élevée que chez les adultes (voir rubrique11).
Mises en garde spécifiques
Le contenu du flacon de solution d'oxine indiée (111In) n'est fourni que pour le marquage in vitro des éléments figurés du sang, et ne peut être administré directement au patient.
Les produits utilisés dans la séparation cellulaire peuvent causer des réactions d’hypersensibilité. Il est essentiel que les cellules soient lavées et exemptes d’agent de sédimentation avant de les réinjecter au patient.
Les références bibliographiques relatives à des utilisations cliniques de cellules sanguines marquées à l'indium-111 font état principalement de l'utilisation des cellules sanguines autologues : de toute évidence, il y a un risque potentiel associé avec l'administration de cellules d’un autre donneur.
Précautions particulières
Ce médicament contient moins de 1 mmol de sodium (23 mg) par flacon c’est à dire pratiquement sans sodium.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
Il a été rapporté que les corticostéroïdes et les antibiotiques diminuaient la fixation des leucocytes marqués à l'indium-111 dans les abcès. Les antibiotiques pourraient altérer la migration des leucocytes par diminution du stimulus chimiotactique.
4.6. Fertilité, grossesse et allaitement
Femmes en âge de procréer / Contraception chez l’homme et la femme
Lorsqu'il est nécessaire d'administrer des produits radiopharmaceutiques à une femme en âge de procréer, il est indispensable de s’informer de toute éventualité de grossesse. Toute femme n'ayant pas eu ses règles doit être considérée comme enceinte jusqu'à preuve du contraire. Dans le doute, il est important que l'exposition aux radiations soit réduite au minimum pour obtenir les informations cliniques souhaitées. D'autres techniques n'impliquant pas l'emploi de radiations ionisantes doivent être envisagées si elles n’altèrent pas la qualité diagnostique.
Grossesse
Aucune donnée n'est disponible quant à l'utilisation des cellules sanguines marquées à l'indium-111, chez la femme enceinte.
Il semble d'après les études chez l'animal que l'indium ait un effet tératogène.
Une technique d’imagerie nucléaire utilisée chez une femme enceinte entraîne également l’irradiation du fœtus. Il ne faut réaliser au cours de la grossesse que les investigations absolument nécessaires, lorsque le bénéfice de l’examen justifie les risques encourus par la mère et le fœtus.
Il n’est pas recommandé d’interrompre l’allaitement suite à l’administration des cellules sanguines marquées à l'indium-111. La plus faible activité requise sera administrée chez la femme allaitante.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont pas été étudiés.
Le tableau suivant décrit les groupes de fréquence utilisés dans cette rubrique :
|
Très fréquent (³ 1/10) |
|
Fréquent (³ 1/100 à < 1/10) |
|
Peu fréquent (³ 1/1 000 à < 1/100) |
|
Rare (³ 1/10 000 à < 1/1 000) |
|
Très rare (< 1/10 000) |
|
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) |
Les effets indésirables suivants sont décrits suite à l’injection de globules rouges marqués à l’indium-111 (i.e, la suspension de globules rouges marqués réinjectée).
|
Affections du système immunitaire Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) |
Réactions anaphylactiques, hypersensibilité. |
Très peu de réactions d’hypersensibilité cutanées ou généralisées, probablement de nature anaphylactique, ont été rapportées après l’administration de cellules sanguines marquées à l’indium-111.
Il faut noter également que les matériaux utilisés dans la séparation cellulaire peuvent causer des réactions d’hypersensibilité. Il est essentiel que les cellules soient lavées et exemptes d’agent de sédimentation avant de les réinjecter au patient (voir rubrique 4.4).
L’exposition aux rayonnements ionisants peut potentiellement induire des cancers et/ou développer des déficiences héréditaires.
La dose efficace après administration de l’activité maximale recommandée de 30 MBq lors du marquage des leucocytes (de 18,5 MBq lors du marquage des plaquettes) est de 10,8 mSv (de 7,2 mSv lors des plaquettes marquées), la probabilité de survenue de ces événements indésirables est jugée faible.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : produit radiopharmaceutique à usage diagnostique
Code ATC : V09HB01
<Mécanisme d’action>
<Effets pharmacodynamiques>
<Efficacité et sécurité clinique>
<Population pédiatrique>
<L’Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec <{Nom (de fantaisie)}> [ou pour les génériques: <le médicament de référence contenant {nom de la (des) substance(s) active(s)}>] dans tous les sous-groupes de la population pédiatrique {conformément à la décision du Plan d’investigation pédiatrique, dans l’indication autorisée} (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).>
<L’Agence européenne des médicaments a différé l’obligation de soumettre les résultats d’études réalisées avec <{Nom (de fantaisie)}> [ou pour les génériques: <le médicament de référence contenant {nom de la (des) substance(s) active(s)}>] dans un ou plusieurs sous-groupes de la population pédiatrique {conformément à la décision du Plan d’investigation pédiatrique, dans l’indication autorisée} (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).>
<Une autorisation de mise sur le marché « sous circonstances exceptionnelles » a été délivrée pour ce médicament. Cela signifie <qu’en raison de la rareté de cette maladie> <que pour des raisons scientifiques> <que pour des raisons éthiques> il n’a pas été possible d’obtenir des informations complètes concernant ce médicament. {L’ANSM} réévaluera chaque année toute nouvelle information qui pourrait être disponible, et, si nécessaire, ce RCP sera mis à jour.>
5.2. Propriétés pharmacocinétiques
L’indium forme un complexe saturé (1 : 3) avec la 8-hydroxyquinoléine (oxine) : le complexe est neutre et liposoluble, ce qui lui permet de traverser la membrane cellulaire. A l’intérieur de la cellule, l’indium se fixe solidement aux composants du cytoplasme, l’hydroxyquinoléine étant relarguée par la cellule. Il est probable que le mécanisme des cellules marquées avec l’oxinate d’indium-111 implique une réaction d’échange entre le porteur l’hydroxyquinoléine et les composants cellulaires qui chélatent l’indium plus fortement que l’hydroxyquinoléine. La constante de stabilité faible du complexe d’oxine indiée, approximativement estimée à 10-10, soutient cette théorie.
Les cellules sanguines marquées à l’indium-111, lorsqu’elles sont réinjectées, suivent le cycle des cellules non marquées et permettent ainsi de visualiser leur accumulation.
Les érythrocytes ou globules rouges marqués à l’indium-111 sont robustes et après réinjection se comportent comme des cellules non marquées. Ils restent dans le système vasculaire et ne le quittent que par hémolyse ou hémorragie. L’indium-111 est lié fortement aux cellules et n’est pas relargué dans les sécrétions gastro-intestinales dans l’intestin, permettant ainsi la visualisation du système vasculaire jusqu’à plus de 72 heures. Les globules rouges marqués permettent de mettre en évidence et/ou de localiser les hémorragies digestives occultes.
Fixation dans les organes
Après injection de leucocytes marqués chez le volontaire sain, environ 60 % de l’activité est fixée immédiatement par le foie, la rate, la moelle osseuse et les autres tissus. Il n’existe qu’une très faible fixation pulmonaire. L’activité circulante est éliminée de façon exponentielle à partir du sang circulant, avec une période comprise entre 5 et 10 heures et une fixation finale d’environ 20 % dans le foie, 25 % dans la rate, 30 % dans la moelle osseuse et 25 % dans les autres organes.
Après l’injection intraveineuse de plaquettes marquées à l’indium-111 chez le sujet sain, quelque unes sont rapidement captées par le foie et la rate, en équilibre avec le compartiment cellulaire de réserve de ces organes. Les autres cellules restent en circulation pendant leur durée de vie.
Les leucocytes marqués à l’indium-111 s’accumuleront dans les sites inflammatoires et les abcès.
Les plaquettes marquées à l’indium-111 s’accumulent aussi aux sites de formation de thrombus dans les greffes en rejet aigu.
Élimination
La clairance sanguine et la biodistribution peuvent varier considérablement en fonction de l’individu, selon les conditions d’injection des cellules et les techniques de marquage utilisées.
Après l’injection intraveineuse de plaquettes marquées à l’indium-111, approximativement 30 % de l’activité injectée est immédiatement retrouvée dans la rate et environ 10 % dans le foie. L’activité restante est éliminée dans la circulation avec une période de 4 jours et se distribue dans la rate (5 %), le foie (20 %), la moelle osseuse (25 %) et les autres tissus (10 %). Les plaquettes survivent normalement dans le sang pendant environ 9 jours et sont alors détruites en fonction de leur âge, principalement dans la rate et la moelle osseuse. Des durées de vie courtes sont associées à des états pathologiques tels qu’une thrombocytopénie.
L’activité des plaquettes et des leucocytes marqués dans le foie et la rate est éliminée très lentement. De plus, il n’existe qu’une très faible élimination urinaire ou fécale. Il est probable que le mode de disparition soit principalement celui d’une décroissance physique en cadmium stable, cependant pour les calculs de dosimétrie, la clairance de l’organisme est considérée comme analogue à celle de l’ion indium (période de 70 jours).
5.3. Données de sécurité préclinique
Quelques aberrations chromosomiques ont été signalées dans les lymphocytes humains marqués à l’indium-111 par l’oxinate d’indium-111.
Après marquage, la 8-hydroxyquinoléine, libérée des cellules marquées et qui n’a pas réagi, est éliminée par lavage avant l'administration. Néanmoins, les études réalisées ne montrent pas de signe de toxicité lorsque l'oxinate d'indium-111 (équivalent à 0,3 mg d'oxine/kg) est administré à des rats.
Acétate de sodium, chlorure de sodium, acide chlorhydrique, eau pour préparation injectable.
Tampon Tris : Acide chlorhydrique, trometamol, eau pour préparation injectable
Oxinate d’indium-111 : 9 jours à compter de la date de fabrication.
Tampon TRIS : trois ans après la date de fabrication.
6.4. Précautions particulières de conservation
Conserver le produit à une température ne dépassant pas 25°C.
Pour les conditions de conservation du médicament après premier prélèvement, voir la rubrique 6.3.
Le produit ne contient pas d’agent bactériostatique. Après le premier prélèvement, la solution pour marquage doit être utilisée immédiatement.
Le stockage doit être effectué conformément aux réglementations nationales relatives aux produits radioactifs.
6.5. Nature et contenu de l'emballage extérieur
Oxinate d’Indium (111In): flacon de verre de 10 mL, type I, fermé par un bouchon en bromobutyle et scellé par une capsule d’aluminium, dans une protection plombée.
Tampon TRIS : flacon de verre de 10 mL, type I, fermé par un bouchon en bromobutyle et scellé.
6.6. Précautions particulières d’élimination et de manipulation
Les produits radiopharmaceutiques ne doivent être réceptionnés, utilisés et administrés que par des personnes autorisées dans les services agréés. Leur réception, stockage, utilisation, transfert et élimination sont soumis à la réglementation en vigueur et/ou aux autorisations appropriées des autorités locales compétentes.
Les produits radiopharmaceutiques doivent être préparés de manière à satisfaire à la fois aux normes de radioprotection et de qualité pharmaceutique. Les précautions appropriées d’asepsie doivent être prises afin de satisfaire aux exigences des Bonnes Pratiques de Fabrication pharmaceutique.
Si l’intégrité des flacons est compromise lors de la préparation du produit, ceux-ci ne doivent pas être utilisés.
Des procédures d’administration du produit doivent être mises en place afin de minimiser le risque de contamination du produit et d’irradiation du personnel. Un blindage adapté est indispensable.
L’administration de produits radiopharmaceutiques présente des risques pour l’entourage du patient en raison de l’irradiation externe ou de la contamination par les urines, les vomissements, les expectorations. Par conséquent, il faut donc prendre les mesures de protection contre les radiations conformément aux règlementations nationales.
Instructions pour l’élimination des déchets :
L’oxinate d’indium (111In) non utilisé doit être stockés pour décroissance jusqu’à un niveau d’activité tel que, selon les réglementations nationales, le produit ne soit plus considéré comme radioactif. Il peut alors être éliminé avec les déchets ordinaires. Les flacons de tampon TRIS inutilisés peuvent être éliminés comme des déchets ordinaires.
L’élimination des déchets doit se faire en accord avec les règlementations nationales et internationales.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Westerduinweg 3
1755 LE PETTEN – PAYS-BAS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
Date de première autorisation:{JJ mois AAAA}
Date de dernier renouvellement:{JJ mois AAAA}
10. DATE DE MISE A JOUR DU TEXTE
- Leucocytes marqués à l’indium-111
|
Organe |
DOSE ABSORBEE PAR UNITE D’ACTIVITE ADMINISTREE (mGy/MBq) |
||||
|
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Surrénale |
0,31 |
0,40 |
0,59 |
0,82 |
14 |
|
Paroi vésicale |
0,072 |
0,10 |
0,16 |
0,24 |
0,41 |
|
Surfaces osseuses |
0,35 |
0,50 |
0,80 |
1,4 |
2,9 |
|
Seins |
0,09 |
0,09 |
0,15 |
0,23 |
0,39 |
|
Tractus gastro-intestinal |
|
|
|
|
|
|
Paroi gastrique |
0,28 |
0,33 |
0,49 |
0,68 |
1,1 |
|
Intestin grêle |
0,16 |
0,19 |
0,29 |
0,43 |
0,71 |
|
Paroi supérieure |
0,16 |
0,19 |
0,30 |
0,47 |
0,78 |
|
Paroi inférieure |
0,13 |
0,16 |
0,24 |
0,33 |
0,54 |
|
Coeur |
0,17 |
0,21 |
0,30 |
0,43 |
0,73 |
|
Reins |
0,33 |
0,39 |
0,60 |
0,87 |
1,4 |
|
Foie |
0,71 |
0,88 |
1,3 |
1,8 |
3,2 |
|
Poumons |
0,16 |
0,21 |
0,31 |
0,46 |
0,81 |
|
Ovaires |
0,12 |
0,17 |
0,24 |
0,35 |
0,56 |
|
Pancréas |
0,52 |
0,61 |
0,91 |
1,3 |
2,1 |
|
Moelle osseuse |
0,69 |
0,88 |
1,3 |
2,3 |
4,5 |
|
Rate |
5,5 |
7,6 |
11 |
17 |
30 |
|
Testicules |
0,045 |
0,064 |
0,099 |
0,15 |
0,28 |
|
Thyroïde |
0,061 |
0,090 |
0,30 |
0,21 |
0,38 |
|
Utérus |
0,12 |
0,31 |
0,31 |
0,31 |
0,31 |
|
Autres tissus |
0,11 |
0,14 |
0,20 |
0,30 |
0,53 |
|
Dose efficace (mSv/MBq) |
0,37 |
0,49 |
7,2 |
1,1 |
2,0 |
- Plaquettes marquées à l’indium-111
|
Organe |
DOSE ABSORBÉE PAR UNITÉ D’ACTIVITÉ ADMINISTRÉE (mGy/MBq) |
||||
|
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Surrénales |
0,37 |
0,47 |
0,72 |
1,0 |
1,8 |
|
Paroi vésicale |
0,066 |
0,92 |
0,14 |
0,22 |
0,39 |
|
Surfaces osseuses |
0,23 |
0,32 |
0,51 |
0,87 |
1,8 |
|
Seins |
0,10 |
0,11 |
1,18 |
0,29 |
0,49 |
|
Tractus gastro-intestinal |
|
|
|
|
|
|
Paroi gastrique |
0,35 |
0,41 |
0,60 |
0,83 |
1,4 |
|
Intestin grêle |
0,14 |
0,17 |
0,27 |
0,42 |
0,74 |
|
Paroi supérieure |
0,14 |
0,18 |
0,29 |
0,47 |
0,80 |
|
Paroi inférieure |
0,97 |
0,13 |
0,20 |
0,29 |
0,50 |
|
Coeur |
0,39 |
0,48 |
0,71 |
1,0 |
1,8 |
|
Reins |
0,41 |
0,50 |
0,76 |
1,1 |
1,8 |
|
Foie |
0,73 |
0,91 |
1,3 |
1,9 |
3,4 |
|
Poumons |
0,28 |
0,36 |
0,55 |
0,85 |
1,5 |
|
Ovaires |
0,098 |
0,13 |
0,20 |
0,31 |
0,53 |
|
Pancréas |
0,66 |
0,75 |
1,1 |
1,6 |
2,1 |
|
Moelle osseuse |
0,36 |
0,46 |
6,8 |
1,1 |
2,1 |
|
Rate |
7,5 |
1,0 |
15 |
23 |
41 |
|
Testicules |
0,043 |
0,060 |
0,091 |
0,14 |
0,27 |
|
Thyroïde |
0,081 |
0,011 |
0,18 |
0,29 |
0,54 |
|
Utérus |
0,95 |
0,12 |
0,18 |
0,28 |
0,49 |
|
Autres tissus |
0,12 |
0,14 |
0,21 |
0,31 |
0,56 |
|
Dose efficace (mSv/MBq) |
0,40 |
0,52 |
7,8 |
1,2 |
2,1 |
Selon la CIPR 80, la dose efficace résultant de l’administration chez l’adulte de leucocytes marqués à l’indium-111 est de 0.36 mSv/MBq. La dose efficace résultant de l’administration de 30 MBq de leucocytes marqués à l’indium-111 est de 10.8 mSv.
Selon la CIPR 80, la dose efficace résultant de l’administration chez l’adulte de plaquettes marquées à l’indium-111 est de 0.39 mSv/MBq. La dose efficace résultant de l’administration de 18.5 MBq de plaquettes marquées à l’indium-111 est de 7,2 mSv. Ces doses efficaces restent dans les mêmes limites de celles résultant d’examens radiographiques réalisés en routine
L’administration d’une activité de 3 MBq de leucocytes marqués à l’indium-111 à de très jeunes enfants (âge supérieur à 1 an) entraîne à la rate une dose absorbée de 90 mGy et une dose efficace de 6,0 mSv. L’administration de 1,85 MBq de plaquettes marquées à l’indium-111 entraîne également à la rate une dose absorbée de 76 mGy et une dose efficace de 3,9 mSv.
La dose efficace pour les leucocytes et les plaquettes marquées à l’indium-114m est donnée par les CIPR 53 et 60 comme suit :
|
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Dose efficace (mSv/MBq) |
|
|
|
|
|
|
Leucocytes marquées à l’indium [114mIn] |
69 |
93 |
150 |
250 |
490 |
|
Plaquettes marquées l’indium [114mIn] |
83 |
120 |
200 |
320 |
620 |
Dans l’hypothèse de la présence de 0,2% d’114mIn au moment de l’administration, la dose efficace mSv/MBq devient :
|
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
|
Leucocytes marqués |
0,46 |
0,50 |
0,92 |
1,4 |
26 |
|
Plaquettes marquées |
0,49 |
0,65 |
1 |
16 |
2,8 |
Il n’y a aucune donnée disponible dans les CIPR 53 et 60 concernant la dosimétrie des érythrocytes marqués à l’indium-111, la dose efficace suivante a été calculée :
|
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Dose efficace (mSv/MBq) |
0,40 |
0,40 |
0,70 |
1,1 |
2,0 |
La dose efficace résultant d’une administration d’activité de 18,5 MBq d’érythrocytes marqués à l’indium-111 est de 7,4 mSv.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Il est recommandé d’ajouter la solution de tampon Tris juste avant l’étape de marquage des cellules sanguines afin d’éviter toute risque d’adsorption sur les parois du flacon ou de la seringue
Instructions pour le marquage des cellules du sang :
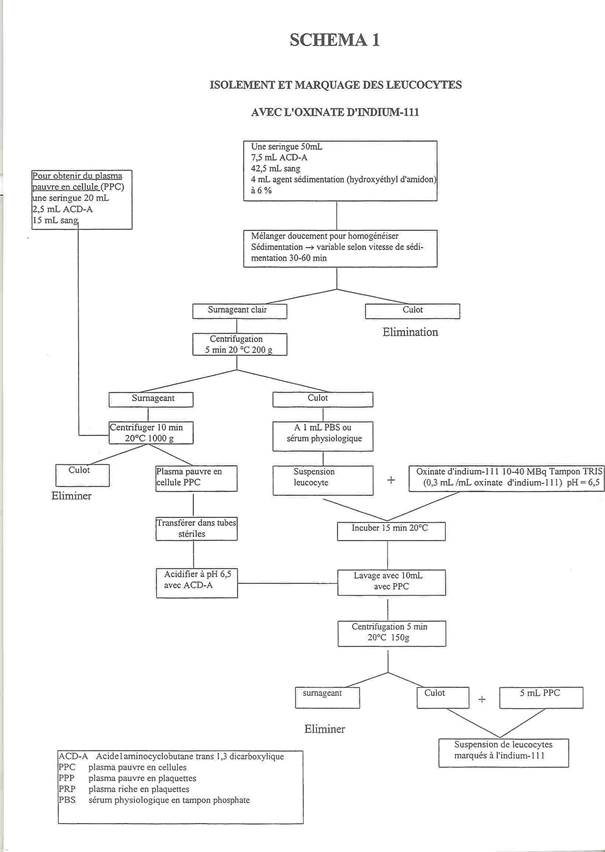
Marquage des leucocytes : schéma 1
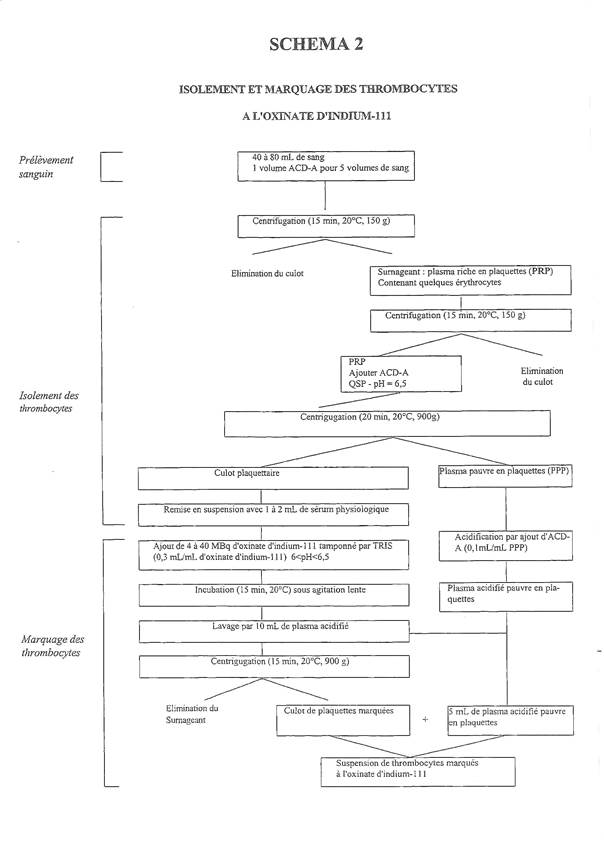
Marquage des plaquettes : schéma 2
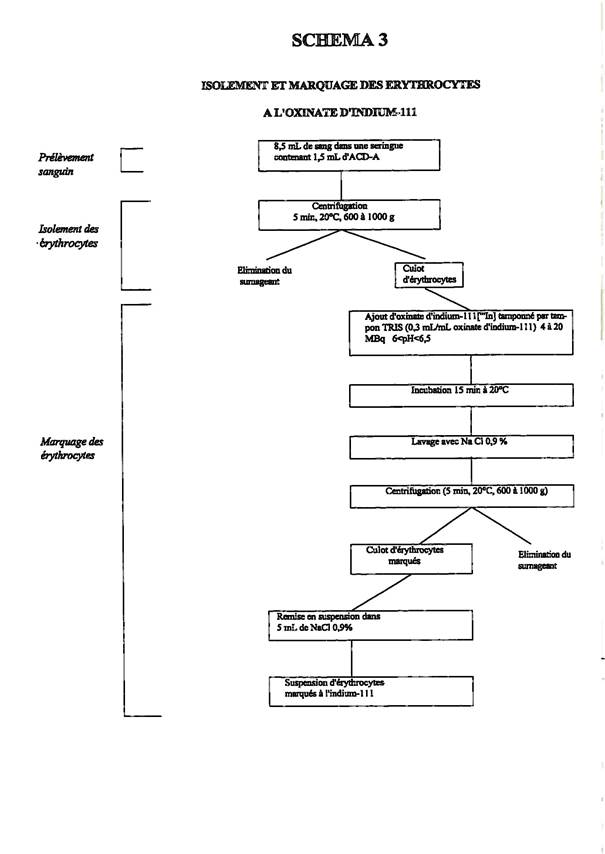
Marquage des érythrocytes : schéma 3

Médicament réservé à l’usage hospitalier.
Liste I.
Les produits radiopharmaceutiques ne doivent être utilisés que par des personnes qualifiées. Ils ne peuvent être délivrés qu’à des praticiens ayant obtenu l’autorisation spéciale prévue à l’article R 1333-24 du code de la Santé Publique.