RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 11/10/2018
1. DENOMINATION DU MEDICAMENT
INFANRIXQUINTA, poudre et suspension pour suspension injectable
Vaccin diphtérique (D), tétanique (T), coquelucheux (acellulaire, multicomposé) (Ca), poliomyélitique (inactivé) (P) et conjugué de l’Haemophilus influenzae type b (Hib), adsorbé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Après reconstitution, une dose (0,5 ml) contient la totalité de la suspension de la seringue préremplie (valences diphtérique, tétanique, coquelucheuse acellulaire, poliomyélitique) et la poudre du flacon (valence Haemophilus influenzae type b) :
· Composition de la suspension de la seringue préremplie :
Anatoxine diphtérique1 ......................................................... ³ 30 Unités Internationales (UI) (25Lf)
Anatoxine tétanique1 ............................................................... ³ 40 Unités Internationales (UI) (10Lf)
Antigènes de Bordetella pertussis :
- anatoxine pertussique (PT)1 .............................................................................. 25 microgrammes
- hémagglutinine filamenteuse (FHA)1 .................................................................... 25 microgrammes
- pertactine (PRN)1 ................................................................................................ 8 microgrammes
Virus de la poliomyélite (inactivés) (P)
type 1 (souche Mahoney)².............................................................................. 40 Unités antigènes D
type 2 (souche MEF-1)²..................................................................................... 8 Unités antigènes D
type 3 (souche Saukett)².................................................................................. 32 Unités antigènes D
· Composition de la poudre du flacon :
Polyoside d’Haemophilus influenzae type b (Hib).................................................... 10 microgrammes
(phosphate de polyribosylribitol) (PRP)
Conjugué à l’anatoxine tétanique en tant que protéine vectrice..................... environ 25 microgrammes
1adsorbé sur hydroxyde d’aluminium hydraté (Al(OH)3)....................................... 0,5 milligrammes Al3+
² produit sur des cellules VERO
Pour la liste complète des excipients, voir rubrique 6.1.
INFANRIXQUINTA peut contenir des traces de sulfate de néomycine, sulfate de polymyxine B et de polysorbate 80 utilisés lors du procédé de fabrication (voir rubrique 4.3).
3. FORME PHARMACEUTIQUE
Poudre et suspension pour suspension injectable.
La suspension est blanche et trouble.
La poudre est blanche.
4. DONNEES CLINIQUES
4.1. Indications thérapeutiques
Ce vaccin est indiqué dans la prévention conjointe des infections invasives à Haemophilus influenzae type b (méningites, septicémies, cellulites, arthrites, épiglottites, …), de la diphtérie, du tétanos, de la coqueluche et de la poliomyélite, en primovaccination chez les nourrissons à partir de 2 mois et en rappel à l’âge de 11 mois.
Ce vaccin ne protège pas contre les infections dues aux autres types d’Haemophilus influenzae, ni contre les méningites dues à d’autres micro-organismes.
Ce vaccin n’a été étudié que chez les enfants de moins de 3 ans.
4.2. Posologie et mode d'administration
INFANRIXQUINTA doit être administré selon les recommandations officielles en vigueur.
Posologie
Primovaccination : 2 injections à l’âge de 2 et 4 mois.
Rappel : 1 injection à l’âge de 11 mois.
Mode d’administration
Administrer par voie intramusculaire.
L’administration se fera de préférence dans la face antérolatérale de la cuisse (tiers moyen), en des sites distincts à chaque injection.
Ne pas injecter par voie intravasculaire.
INFANRIXQUINTA doit être administré avec précaution chez les sujets présentant une thrombocytopénie ou un trouble de la coagulation en raison du risque de saignement qui peut survenir lors de l’administration intramusculaire du vaccin chez ces sujets.
Modalités de reconstitution (voir rubrique 6.6)
4.3. Contre-indications
Antécédent d'hypersensibilité suivant une vaccination antérieure par des vaccins contre la diphtérie, le tétanos, la coqueluche, la poliomyélite ou Hib, aux substances actives, ou à l'un des excipients, ou aux résidus à l’état de traces (exemple : polysorbate 80, glycine, formaldéhyde, sulfate de néomycine et sulfate de polymyxine B) (voir rubrique 6.1).
INFANRIXQUINTA est contre-indiqué chez les nourrissons ayant présenté une encéphalopathie d’étiologie inconnue, survenue dans les 7 jours suivant une vaccination antérieure par un vaccin contenant la valence coquelucheuse. Dans ce cas, la vaccination anticoquelucheuse doit être suspendue et la vaccination doit être poursuivie avec des vaccins diphtérique-tétanique, poliomyélitique et Hib.
Comme pour les autres vaccins, l’administration d’INFANRIXQUINTA doit être différée chez les sujets atteints d’infections fébriles sévères aiguës. La présence d’une infection bénigne n’est pas une contre-indication.
4.4. Mises en garde spéciales et précautions d'emploi
La vaccination doit être précédée d’une recherche des antécédents médicaux (notamment pour les vaccinations antérieures et les événements indésirables ayant pu survenir) et d’un examen clinique.
Si la survenue de l’un des événements suivants est chronologiquement liée à l’administration d’un vaccin contenant la valence coquelucheuse, la décision d’administrer d’autres doses de vaccins contenant la valence coquelucheuse doit être soigneusement évaluée :
· fièvre ³ 40,0°C, dans les 48 heures, sans autre cause identifiable;
· collapsus ou état de choc (syndrome d’hypotonie-hyporéactivité) dans les 48 heures après la vaccination;
· cris persistants, inconsolables pendant une durée ³ 3 heures, survenant dans les 48 heures après la vaccination;
· convulsions, avec ou sans fièvre, survenant dans les 3 jours après la vaccination.
Il peut exister certaines circonstances, notamment en cas d’incidence élevée de coqueluche, où les bénéfices potentiels de la vaccination dépassent les risques éventuels.
Comme pour toute vaccination, le rapport bénéfice risque de réaliser une vaccination par INFANRIXQUINTA ou de la reporter, chez un nourrisson ou un enfant souffrant d’une maladie neurologique sévère qu’elle soit nouvelle ou évolutive doit être évalué avec attention.
En cas de réactions œdémateuses des membres inférieurs survenues dans les suites d’une injection d’un vaccin contenant la valence Haemophilus Influenzae type b, l’administration du vaccin diphtérique-tétanique-coquelucheux-poliomyélitique et du vaccin Haemophilus Influenzae type b conjugué devra être effectuée en deux sites d’injection séparés et sur deux jours différents.
Comme avec tous les vaccins injectables, il est recommandé de toujours disposer d’un traitement médical approprié et d’assurer une surveillance pour le cas rare où surviendrait une réaction anaphylactique suivant l’administration du vaccin.
INFANRIXQUINTA doit être administré avec précaution chez les sujets présentant une thrombocytopénie ou un trouble de la coagulation en raison du risque de saignement qui peut survenir lors de l’administration intramusculaire du vaccin chez ces sujets.
INFANRIXQUINTA ne doit en aucun cas être administré par voie intravasculaire.
Des antécédents de convulsions fébriles nécessitent une attention particulière. Des antécédents familiaux de convulsions ou de syndrome de mort subite du nourrisson ne sont pas des contre-indications.
L’infection par le VIH n’est pas considérée comme une contre-indication. La réponse immunitaire attendue risque de ne pas être obtenue après vaccination chez les patients immunodéprimés.
Chez les enfants traités par des immunodépresseurs (corticothérapie, chimiothérapie antimitotique, etc....), il est recommandé d’attendre la fin du traitement pour vacciner.
Le risque potentiel d'apnée avec nécessité de surveillance respiratoire pendant 48-72 h doit être soigneusement pris en compte lors de l'administration des doses de primovaccination chez les grands prématurés (nés à 28 semaines de grossesse ou moins) et particulièrement chez ceux ayant des antécédents d'immaturité respiratoire. En raison du bénéfice élevé de la vaccination chez ces nourrissons, l'administration ne doit pas être suspendue ou reportée.
L’élimination urinaire de l’antigène polysaccharidique capsulaire a été décrite après administration du vaccin Hib et, par conséquent, la détection d’antigène 1 à 2 semaines après la vaccination ne permet pas le diagnostic d’une éventuelle infection.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
En pédiatrie, il est de pratique courante d'administrer plusieurs vaccins lors de la même consultation. Dans ce cas, les vaccins injectables doivent toujours être administrés en des sites d'injection différents.
INFANRIXQUINTA peut être administré en même temps que le vaccin contre l'hépatite B, si les sites d'injection sont différents.
Comme avec les autres vaccins, l'immunogénicité peut être diminuée chez les patients traités par des immunosuppresseurs ou présentant un déficit immunitaire.
4.6. Fertilité, grossesse et allaitement
Grossesse
INFANRIXQUINTA n'étant pas destiné à l'adulte, les données de tolérance concernant l'utilisation du vaccin chez la femme durant la grossesse ne sont pas disponibles.
Allaitement
INFANRIXQUINTA n'étant pas destiné à l'adulte, les données de tolérance concernant l'utilisation du vaccin chez la femme allaitante ne sont pas disponibles.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Sans objet.
4.8. Effets indésirables
Données d’essais cliniques
Résumé du profil de tolérance
Le profil de tolérance présenté ci-dessous est basé sur des données issues de plus de 3500 sujets (plus de 4400 doses en primovaccination et plus de 2000 doses en rappel).
Liste des effets indésirables
Les effets indésirables rapportés sont classés selon les fréquences suivantes :
Très fréquent : ³ 1/10
Fréquent : ³ 1/100 à < 1/10
Peu fréquent : ³ 1/1000 à < 1/100
Rare : ³ 1/10000 à < 1/1000
Très rare : < 1/10000
Infections et infestations :
Peu fréquent : infection des voies respiratoires hautes.
Affections hématologiques et du système lymphatique :
Peu fréquent : lymphadénopathie.
Troubles du métabolisme et de la nutrition :
Très fréquent : perte d'appétit.
Affections psychiatriques :
Très fréquents : irritabilité, cris inhabituels, agitation.
Affections du système nerveux :
Très fréquent : somnolence.
Affections respiratoires, thoraciques et médiastinales :
Peu fréquent : toux, bronchite, rhinorrhée.
Affections gastro intestinales :
Fréquents : diarrhée, vomissements.
Affections de la peau et du tissu sous-cutané :
Peu fréquent : éruption cutanée, urticaire.
Rare : prurit.
Troubles généraux et anomalies au site d’administration :
Très fréquents : réactions au site d’injection telles que douleur, rougeur, érythème gonflement (£ 50 mm), fièvre (³ 38°C).
Fréquents : réactions au site d’injection telles que induration, et gonflement (> 50 mm)1
Peu fréquent : fièvre2 > 39.5°C, fatigue, gonflement diffus du membre vacciné, se propageant parfois à l’articulation adjacente1.
Une augmentation de la réactogénicité locale et de la fièvre a été rapportée après la dose de rappel d’INFANRIXQUINTA comparée aux doses de primovaccination, comme cela a été observé avec les vaccins combinés contenant les valences diphtérique-tétanique-coquelucheuse acellulaire.
Données de surveillance post commercialisation
Affections respiratoires, thoraciques et médiastinales :
Apnée3 (voir rubrique 4.4. pour l’apnée chez les grands prématurés nés à 28 semaines de grossesse ou moins).
Affections du système immunitaire :
Réactions allergiques (incluant des réactions anaphylactiques3 et anaphylactoïdes).
Affections du système nerveux :
Convulsions3 (avec ou sans fièvre), épisodes d’hypotonie-hyporéactivité.
Affections de la peau et du tissu sous-cutané :
Œdème de Quincke3
Troubles généraux et anomalies au site d’administration :
Lors de l'administration de vaccins contenant la valence Haemophilus type b, des réactions œdémateuses des membres inférieurs ont été rapportées. Il s'agit d'un œdème avec cyanose ou purpura fugace atteignant tout le membre vacciné et quelquefois le membre controlatéral, apparaissant dans les heures suivant la vaccination, pouvant durer plusieurs heures et disparaissant spontanément sans séquelles. Ces réactions s'accompagnent quelquefois de fièvre, de douleur et de pleurs.
Gonflement du membre vacciné dans sa totalité1, vésicules au site d’injection4.
1 Les enfants ayant reçu une primo-vaccination par des vaccins coquelucheux acellulaires développent plus fréquemment une réaction locale de gonflement après l’administration d’une dose de rappel comparé à ceux ayant reçu une primo-vaccination par des vaccins coquelucheux à germes entiers.
Ces réactions surviennent généralement dans les 48 heures et disparaissent spontanément sans séquelle en 4 jours en moyenne.
2Fréquent lors du rappel.
3Observés aussi avec les vaccins GSK contenant les valences diphtérique, tétanique, coquelucheuse acellulaire.
4Observée aussi avec les vaccins GSK contenant les valences diphtérique, tétanique, coquelucheuse acellulaire, poliomyélitique.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
4.9. Surdosage
Des cas de surdosage ont été rapportés pendant la surveillance après commercialisation. Les effets indésirables suite à un surdosage, quand ils ont été rapportés, sont similaires à ceux rapportés après une administration recommandée d’INFANRIXQUINTA.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
VACCIN CONTRE LA DIPHTERIE, LE TETANOS, LA COQUELUCHE, LA POLIOMYELITE ET LES INFECTIONS A HAEMOPHILUS INFLUENZAE TYPE b.
Classe pharmacothérapeutique : J: Anti-infectieux ; code ATC : J07CA06
Les résultats obtenus dans les études cliniques pour chacun des composés sont résumés dans le tableau ci-dessous :
Pourcentage de sujets avec des titres en anticorps ³ au seuil défini dans l’étude, 1 mois après primovaccination avec INFANRIXQUINTA :
|
Anticorps
(seuil)
|
3-5 mois
N= 86
(1 essai)
%
|
1,5-3,5-6
mois
N= 62
(1 essai)
%
|
2-3-4
mois
N= 337
(3 essais)
%
|
2-4-6
mois
N= 624
(6 essais)
%
|
3-4-5
mois
N= 127
(2 essais)
%
|
3-4,5-6
mois
N=198
(1 essai)
%
|
|
Anti-diphtérique
(0,1 UI/ml)*
|
94,1
|
100
|
98,8
|
99,3
|
94,4
|
99,5
|
|
Anti-tétanique
(0,1 UI/ml)*
|
100,0**
|
100
|
99,7
|
99,8
|
99,2
|
100
|
|
Anti-toxine pertussique
(5 U.EL/ml)
|
99,5**
|
100
|
99,4
|
100
|
98,4
|
100
|
|
Anti-hémagglutinine filamenteuse
(5 U.EL/ml)
|
99,7**
|
100
|
100
|
100
|
100
|
100
|
|
Anti-pertactine
(5 U.EL/ml)
|
99,0**
|
100
|
100
|
100
|
100
|
100
|
|
Anti-poliomyélitique type 1
(1/8 dilution)*
|
93,0
|
ND
|
99,1
|
99,5
|
100
|
100
|
|
Anti-poliomyélitique type 2
(1/8 dilution)*
|
95,3
|
ND
|
95,7
|
99,0
|
99,2
|
100
|
|
Anti-poliomyélitique type 3
(1/8 dilution)*
|
98,8
|
ND
|
100
|
100
|
99,2
|
99,4
|
|
Anti-PRP (Hib)
(0,15 μg/ml)*
|
83,7
|
100
|
98,5
|
98,5
|
100
|
98,4
|
|
Anti-PRP (Hib)
(1,0 μg/ml)
|
51,2
|
87,1
|
68,5
|
76,0
|
97,6
|
81,2
|
* seuil considéré comme indicateur de protection
** résultats après 2 doses, issus d’une étude dans laquelle le vaccin DTCa-P-HepB+Hib était administré à 3, 5 et 11 mois.
N = nombre de sujets
ND = non déterminé
Pourcentage de sujets avec des titres en anticorps ³ au seuil défini dans l’étude, 1 mois après rappel avec INFANRIXQUINTA :
|
Anticorps
(seuil)
|
Rappel à 11/12 mois, après une primovaccination à 3-5 mois
N=184 (1 essai)
%
|
Rappel durant la 2ème année de vie, après une primovaccination en 3 doses
N=1326 (9 essais)
%
|
|
Anti-diphtérique
(0,1 UI/ml)*
|
100
|
99,8
|
|
Anti-tétanique
(0,1 UI/ml)*
|
99,9**
|
99,9
|
|
Anti-toxine pertussique
(5 U.EL/ml)
|
99,9**
|
99,7
|
|
Anti-hémagglutinine filamenteuse
(5 U.EL/ml)
|
99,9**
|
100
|
|
Anti-pertactine
(5 U.EL/ml)
|
99,5**
|
99,9
|
|
Anti-poliomyélitique type 1
(1/8 dilution)*
|
99,4
|
99,9
|
|
Anti-poliomyélitique type 2
(1/8 dilution)*
|
100
|
100
|
|
Anti-poliomyélitique type 3
(1/8 dilution)*
|
99,4
|
100
|
|
Anti-PRP (Hib)
(0,15 μg/ml)*
|
100
|
100
|
|
Anti-PRP (Hib)
(1,0 μg/ml)
|
96,7
|
99,2
|
* seuil considéré comme indicateur de protection
** résultats après 3 doses, issus d’une étude dans laquelle le vaccin DTCa-P-HepB+Hib était administré à 3, 5 et 11 mois.
N = nombre de sujets
L’efficacité du composant Hib (lorsqu’il est associé à DTCa, DTCa-P ou DTCa-P-HepB) a été étudiée dans le cadre d’une étude de surveillance post-commercialisation réalisée en Allemagne. Après une période de suivi de 4,5 ans, l’efficacité des vaccins DTCa+Hib ou DTCa-P+Hib était de 96,7% après un schéma complet de primovaccination et de 98,5% après un rappel (quel que soit le nombre de doses reçues en primovaccination). Après une période de suivi de sept ans, l’efficacité du composant Hib de deux vaccins hexavalents était de 89,6% après un schéma complet de primovaccination et de 100% après un schéma complet de primovaccination plus rappel (quelque soit le vaccin Hib utilisé pour la primovaccination).
5.2. Propriétés pharmacocinétiques
L’évaluation des propriétés pharmacocinétiques n’est pas requise pour les vaccins.
5.3. Données de sécurité préclinique
Les données non cliniques basées sur des études conventionnelles de sécurité, toxicologie spécifique, toxicologie par administration réitérée et compatibilité des composants n’ont pas révélé de risque particulier pour l'Homme.
6. DONNEES PHARMACEUTIQUES
6.1. Liste des excipients
Poudre Hib
Lactose anhydre
Suspension DTCa-P
Chlorure de sodium
Milieu M 199 (contenant des acides aminés, des sels minéraux et des vitamines)
Eau pour préparations injectables.
Pour les adjuvants voir rubrique 2.
6.2. Incompatibilités
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
6.3. Durée de conservation
3 ans.
Après reconstitution, le vaccin doit être utilisé immédiatement.
6.4. Précautions particulières de conservation
A conserver au réfrigérateur (entre +2°C et +8°C).
Ne pas congeler.
A conserver dans l’emballage extérieur d’origine à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
Poudre en flacon (verre de type I) muni d’un bouchon (butyle) + 0,5 ml de suspension en seringue préremplie (verre de type I) munie d’un bouchon-piston (butyle) - boîte de 1 ou de 20.
Poudre en flacon (verre de type I) muni d’un bouchon (butyle) + 0,5 ml de suspension en seringue préremplie (verre de type I) munie d’un bouchon-piston (butyle) sans aiguille - boîte de 1 ou de 20.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Durant la conservation, un dépôt blanc avec un surnageant limpide peut être observé dans la seringue préremplie. Ceci n’est pas un signe de détérioration.
Avant reconstitution :
Un dépôt blanc pouvant se former durant le stockage, la seringue préremplie doit être bien agitée afin d’obtenir une suspension opalescente blanche homogène.
La poudre Hib contenue dans le flacon, la suspension DTCa-P contenue dans la seringue préremplie et le vaccin reconstitué doivent être inspectés visuellement pour mettre en évidence la présence de toute particule étrangère et/ou altération de l’aspect physique. Dans l’un ou l’autre de ces cas, le vaccin ne doit pas être utilisé.
Reconstitution :
Le vaccin est reconstitué en ajoutant la totalité du contenu de la seringue préremplie au flacon contenant la poudre Hib. Agiter jusqu’à dissolution complète de la poudre. Le vaccin reconstitué se présente comme une suspension légèrement plus trouble que le composant liquide seul. Ceci est normal et n’a aucune conséquence sur la qualité du vaccin. Dans les autres cas, le vaccin ne doit pas être utilisé.
Le vaccin doit être administré immédiatement après reconstitution. Prélever la totalité du flacon.
La seringue préremplie peut être fournie soit avec un embout ‘Luer’ à revêtement céramique (CCT) soit avec un adaptateur ‘Luer Lock’ à embout plastique rigide (PRTC).
· Instructions d’utilisation d’une seringue préremplie fournie avec un adaptateur ‘Luer Lock’ PRTC
|
Aiguille
|
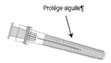
|
|
|
Seringue
|
|
|
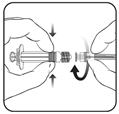
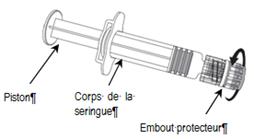
1. En tenant le corps de la seringue d’une main (éviter de tenir le piston), dévisser l’embout protecteur de la seringue en le tournant dans le sens inverse des aiguilles d’une montre.
2. Pour fixer l’aiguille à la seringue, visser l’aiguille dans le sens des aiguilles d’une montre sur la seringue jusqu’à sentir un blocage (voir image ci-dessus).
3. Enlever le protège aiguille, qui peut quelquefois opposer une certaine résistance.
4. Reconstituer le vaccin comme décrit ci-dessus.
|
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
LABORATOIRE GLAXOSMITHKLINE
23 RUE FRANÇOIS JACOB
92500 RUEIL-MALMAISON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 355 247 3 7 : Poudre en flacon (verre de type I) muni d’un bouchon (butyle) + 0,5 ml de suspension en seringue préremplie (verre de type I) munie d’un bouchon-piston (butyle) - boîte de 1
· 34009 343 768 3 2 : Poudre en flacon (verre de type I) muni d’un bouchon (butyle) + 0,5 ml de suspension en seringue préremplie (verre de type I) munie d’un bouchon-piston (butyle) - boîte de 20
· 34009 300 957 2 0 : Poudre en flacon (verre de type I) muni d’un bouchon (butyle) + 0,5 ml de suspension en seringue préremplie (verre de type I) munie d’un bouchon-piston (butyle) sans aiguille – boîte de 1.
· 34009 300 957 1 3 : Poudre en flacon (verre de type I) muni d’un bouchon (butyle) + 0,5 ml de suspension en seringue préremplie (verre de type I) munie d’un bouchon-piston (butyle) sans aiguille – boîte de 20.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
Date de première autorisation : 27/06/1997
Date de dernier renouvellement : 27/06/2012
10. DATE DE MISE A JOUR DU TEXTE
Sans objet.
11. DOSIMETRIE
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Médicament non soumis à prescription médicale.


