
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 15/04/2019
SPORANOX 10 mg/ml, solution buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Pour 100 ml de solution.
1 dose de 10 ml de solution correspond à 100 mg d'itraconazole.
Excipients à effet notoire : sorbitol
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Traitement des candidoses orales et/ou œsophagiennes: 200 mg (20 ml) par jour de préférence en 2 prises, ou éventuellement en 1 prise pendant 1 semaine. En l'absence de réponse après 1 semaine, le traitement doit être poursuivi pendant une semaine supplémentaire.
Traitement des candidoses orales et/ou œsophagiennes résistantes au fluconazole: 100 à 200 mg (10 à 20 ml) 2 fois par jour pendant 2 semaines. En l'absence de réponse après deux semaines de traitement, le traitement doit être poursuivi pendant 2 semaines supplémentaires. En l'absence de signes d'amélioration clinique, la dose de 400 mg par jour ne doit pas être utilisée pendant une durée supérieure à 14 jours.
Mode d’administration
Afin d'assurer une absorption optimale, la prise de ce médicament doit s'effectuer en dehors des repas.
La solution doit être laissée en contact avec la bouche pendant quelques instants (environ 20 secondes), puis avalée. Ne pas rincer après avoir avalé (il est recommandé aux patients de s'abstenir de toute prise alimentaire pendant au moins 1 heure après l'administration).
Populations particulières
Utilisation dans la population pédiatrique
Les données cliniques disponibles chez les enfants âgés de moins de 18 ans étant limitées, ce médicament ne sera utilisé chez ces patients que si le bénéfice attendu l’emporte sur les risques potentiels (voir rubrique 5.2).
Utilisation chez le sujet âgé
Les données cliniques sur l’utilisation de SPORANOX solution buvable chez les patients âgés étant limitées, ce médicament ne sera utilisé chez ces patients que si le bénéfice attendu l’emporte sur les risques potentiels.
Utilisation chez l'insuffisant hépatique
Les données disponibles sur l’utilisation de l’itraconazole par voie orale chez les patients insuffisants hépatiques sont limitées. La prudence est recommandée lors de l’administration de ce médicament à cette population de patients (voir rubrique 4.4 et 5.2).
Utilisation chez l'insuffisant réna
L’hémodialyse ou la dialyse rétropéritonéale résulte en une extraction minimale de l’itraconazole.
Les données disponibles sur l’utilisation de l’itraconazole par voie orale chez les patients insuffisants rénaux sont limitées. L’exposition à l’itraconazole peut être plus faible chez certains patients atteints d’une insuffisance rénale. La prudence est recommandée lors de l’administration de ce médicament à cette population de patients et un ajustement de la dose peut être envisagé (voir rubrique 4.4 et 5.2).
· SPORANOX solution buvable ne doit pas être administré aux patients ayant une dysfonction ventriculaire démontrée tels qu’une insuffisance cardiaque congestive ou des antécédents d’insuffisance cardiaque congestive sauf en cas d’infections sévères ou mettant en jeu le pronostic vital. (voir rubrique 4.4.)
· La co-administration d’un grand nombre de substrats du CYP3A4 est contre-indiquée avec SPORANOX solution buvable. Une augmentation de la concentration plasmatique de ces médicaments, provoquée par la co-administration avec l’itraconazole, peut augmenter ou prolonger les effets thérapeutiques ou indésirables à un tel niveau que des situations potentiellement graves peuvent survenir. Par exemple l’augmentation de la concentration plasmatique de certains de ces médicaments peut entrainer un allongement de l’intervalle QT et des tachycardies ventriculaires incluant la survenue de torsades de pointes, une arythmie potentiellement létale. (voir rubrique 4.5)
· SPORANOX solution buvable ne doit pas être administré en association avec : les alcaloïdes de l’ergot de seigle vasoconstricteurs (tels que dihydroergotamine, ergotamine, méthylergométrine, methysergide), l’alfuzosine, l’aliskiren, l’atorvastatine, l’avanafil, la colchicine (chez les sujets avec insuffisance rénale sévère ou insuffisance hépatique sévère), le dabigatran, la dapoxétine, la dompéridone, la dronédarone, l’éplérénone, la fésotérodine (chez les sujets ayant une atteinte de la fonction rénale modérée à sévère ou un trouble de la fonction hépatique modéré à sévère), l’ivabradine, le lomitapide, la lurasidone, le millepertuis, la mizolastine, l’association ombitasvir + paritaprévir, le pimozide, la quétiapine, la quinidine, la ranolazine, le sildénafil (dans l’indication du traitement de l’hypertension artérielle pulmonaire), la simvastatine, la solifénacine (chez les sujets ayant une insuffisance rénale modérée à sévère ou une insuffisance hépatique modérée à sévère), la télithromycine (chez les sujets ayant une insuffisance rénale sévère ou une insuffisance hépatique sévère), le ticagrélor, le vardénafil (chez l’homme de plus de 75 ans) (voir rubrique 4.5).
· SPORANOX solution buvable ne doit pas être utilisé pendant la grossesse pour des pathologies ne mettant pas en jeu le pronostic vital (voir rubrique 4.6).
Les femmes en âge de procréer, et traitées par SPORANOX doivent utiliser un moyen de contraception efficace. Une contraception efficace doit être poursuivie jusqu’au début des règles suivant l’arrêt du traitement par SPORANOX.
4.4. Mises en garde spéciales et précautions d'emploi
De très rares cas de toxicité hépatique grave, incluant quelques cas d’insuffisance hépatique aiguë d’évolution fatale ont été rapportés chez des patients traités par SPORANOX. La plupart de ces cas sont survenus chez des patients ayant une maladie hépatique pré-existante, traités pour des mycoses systémiques, ayant des pathologies concomitantes significatives et/ou traités par d’autres médicaments hépatotoxiques. Quelques patients ne présentaient pas de facteurs de risque patents de maladie hépatique. Quelques cas ont été observés au cours du 1er mois de traitement, et pour certains au cours de la 1ère semaine de traitement. Il est recommandé de surveiller la fonction hépatique chez les patients traités par SPORANOX. Les patients doivent être informés qu’ils doivent avertir très rapidement leur médecin en cas d’apparition de signes et de symptômes suggérant une atteinte hépatique en particulier anorexie, nausées, vomissements, asthénie, douleurs abdominales ou urines foncées. En cas de survenue de l’un de ces symptômes, le traitement doit être immédiatement interrompu et des examens de la fonction hépatique doivent être réalisés.
Chez les patients ayant une élévation des enzymes hépatiques ou présentant une maladie hépatique active, ou chez qui d'autres médicaments ont déjà entraîné une toxicité hépatique, le traitement ne doit pas être débuté à moins que le patient se trouve dans une situation grave ou mettant en jeu le pronostic vital pour laquelle le bénéfice attendu de SPORANOX l’emporte sur le risque d’atteinte hépatique. Si le traitement est débuté, la fonction hépatique doit être surveillée.
Effets cardiaques
Une étude réalisée chez le volontaire sain avec SPORANOX IV a montré une diminution transitoire asymptomatique de la fraction d'éjection ventriculaire gauche ; se résolvant avant la perfusion suivante. La signification clinique de cette observation, pour les formes orales, n'est pas connue.
L'itraconazole a montré un effet inotrope négatif et SPORANOX a été associé à des cas d'insuffisance cardiaque congestive après administration par voie orale.
Dans les notifications spontanées, les insuffisances cardiaques ont été plus fréquemment rapportées lorsque la dose journalière totale d’itraconazole était de 400 mg par rapport à une dose journalière totale plus faible, ce qui suggère que le risque d’insuffisance cardiaque peut être dose-dépendant.
SPORANOX ne doit être utilisé chez des patients présentant une insuffisance cardiaque congestive ou des antécédents d'insuffisance cardiaque congestive que si le bénéfice est nettement supérieur aux risques. L'évaluation individuelle du rapport bénéfice/risque doit prendre en compte des facteurs tels que la sévérité de l'indication, la posologie (i.e. la dose totale journalière) et les facteurs de risques individuels d'insuffisance cardiaque congestive. Ces facteurs de risque comprennent des maladies cardiaques telles que les maladies ischémiques et valvulaires, des maladies pulmonaires significatives telles que la bronchopneumopathie chronique obstructive, l'insuffisance rénale et d'autres troubles œdémateux. Ces patients doivent être informés des signes et symptômes de l'insuffisance cardiaque congestive, ils doivent être traités avec précautions et doivent faire l'objet d'un suivi des signes et symptômes de l'insuffisance cardiaque congestive au cours du traitement. Si de tels signes ou symptômes apparaissent au cours du traitement, SPORANOX doit être arrêté.
Les inhibiteurs calciques peuvent avoir des effets inotropes négatifs qui peuvent s'ajouter à ceux de l'itraconazole ; l'itraconazole peut inhiber le métabolisme des inhibiteurs calciques. En conséquence, la prudence s'impose en cas de co-administration d'itraconazole et d'inhibiteurs calciques en raison d’un risque augmenté d’insuffisance cardiaque congestive (voir rubrique 4.5).
Hypersensibilité croisée
Les informations relatives à une hypersensibilité croisée entre l’itraconazole et d’autres antifongiques azolés sont limitées. La prudence est de rigueur lorsque ce médicament est prescrit à des patients ayant présenté une hypersensibilité à d’autres azolés.
Excipients à effet notoire
Ce médicament contient du sorbitol. Son utilisation est déconseillée chez les patients présentant une intolérance au fructose (maladie héréditaire rare).
Allaitement
L’allaitement est déconseillé en cas de traitement par ce médicament.
Interactions médicamenteuses
Ce médicament est déconseillé dans les cas suivants en association avec : l’apixaban, la bédaquiline, la buspirone, le busulfan, la colchicine (sauf chez les sujets avec insuffisance rénale sévère ou insuffisance hépatique sévère : association contre-indiquée, voir rubrique 4.5), la darifénacine, l’ébastine les inhibiteurs des tyrosines kinases suivants : [axitinib, bosutinib, dabrafénib, dasatinib, ibrutinib, nilotinib, sunitinib], l’halofantrine, l’halopéridol, les immunosuppresseurs [ciclosporine, évérolimus, sirolimus, tacrolimus, temsirolimus], les inducteurs enzymatiques suivants : [carbamazépine, dabrafénib, éfavirenz, enzalutamide, esclicarbazépine, fosphénytoïne, névirapine, oxcarbazépine, phénobarbital, phénytoïne, primidone, rifabutine, rifampicine], l’irinotécan, la lercanidipine, la luméfantrine, le midazolam per os, l’oxycodone, le régorafénib, le rivaroxaban, le riociguat, le siméprévir, le tadalafil (dans le traitement de l’hypertension artérielle pulmonaire ou des symptômes et signes de l’hypertrophie bénigne de la prostate), la tamsulosine, la toltérodine, la trabectédine, le vardénafil (chez l’homme jusqu’à 75 ans) et les vinca-alcaloïdes cytotoxiques (voir rubrique 4.5).
Insuffisance rénale
L’hémodialyse ou la dialyse rétropéritonéale résulte en une extraction minimale de l’itraconazole.
Les données disponibles sur l’utilisation de l’itraconazole par voie orale chez les insuffisants rénaux sont limitées. L’exposition à l’itraconazole peut être plus faible chez certains patients atteints d’une insuffisance rénale. La prudence est recommandée lors de l’administration de ce médicament à cette population de patients et un ajustement de la dose peut être envisagé (voir rubriques 4.2 et 5.2).
Insuffisance hépatique
Les données relatives à l’utilisation de l’itraconazole par voie orale chez les patients insuffisants hépatiques sont limitées. La prudence est recommandée lors de l’administration de ce médicament à cette population de patients. Il est préconisé de surveiller étroitement les patients insuffisants hépatiques en cas de prise d’itraconazole (voir rubrique 4.2).
Lors de la décision d’initier un traitement avec d’autres médicaments métabolisés par le CYP3A4, il est recommandé de prendre en compte la prolongation de la demi-vie d’élimination de l’itraconazole observée dans un essai clinique conduit avec l’itraconazole administré à dose unique sous forme de gélules chez des patients cirrhotiques (voir rubrique 5.2).
Sujets immunodéprimés (par exemple : patients neutropéniques, patients infectés par le VIH+)
Les concentrations à l’état stationnaire sont généralement plus faibles chez les immunodéprimés et justifient l’utilisation de posologies élevées (400 mg/jour). La surveillance des concentrations plasmatiques peut être utile en début de traitement surtout s’il existe des éléments susceptibles de modifier l’absorption (prise à jeun, réaction du greffon contre l’hôte, diarrhée, mucite), et en cas de suspicion d’échec.
Traitement des patients atteints de neutropénie sévère
Ce médicament, dans le traitement des candidoses orales et/ou œsophagiennes, n’a pas été étudié chez les patients atteints de neutropénie sévère. Du fait de ses propriétés pharmacocinétiques (voir rubrique 5.2), ce médicament n’est pas recommandé en initiation de traitement chez des patients présentant un risque immédiat de candidose systémique.
Mucoviscidose
Chez les patients atteints de mucoviscidose, une variabilité des concentrations plasmatiques d’itraconazole a été observée à l’état d’équilibre avec la solution buvable d’itraconazole administrée à la posologie de 2,5 mg/kg 2 fois par jour. A l’état d’équilibre, des concentrations supérieures à 250 ng/ml ont été atteintes chez environ 50 % des patients de plus de 16 ans mais chez aucun patient de moins de 16 ans. En l’absence de réponse au traitement par SPORANOX, solution buvable une alternative thérapeutique doit être envisagée.
Perte auditive
Des cas de perte auditive transitoire ou permanente ont été rapportés chez des patients traités par de l’itraconazole. Plusieurs de ces cas comprenaient l’administration concomitante de quinidine, qui est une association contre-indiquée (voir rubriques 4.3 et 4.5). La perte auditive se dissipe généralement à l’arrêt du traitement, mais elle peut persister chez certains patients.
Neuropathie
En cas d’apparition d’une neuropathie qui pourrait être imputée à ce médicament, il convient d’interrompre le traitement.
Résistance croisée
En cas de candidoses systémiques, si des souches de Candida sont suspectées résistantes au fluconazole, on ne peut prédire leur sensibilité à l'itraconazole; donc celle-ci devra être testée avant d’initier le traitement par l’itraconazole.
Interchangeabilité
Il n’est pas recommandé d’interchanger SPORANOX gélule et SPORANOX solution buvable car pour une même dose administrée l’exposition à ce médicament est supérieure avec la solution buvable qu’avec les gélules.
Par ailleurs, les effets topiques de l’exposition de la muqueuse digestive à l’itraconazole peuvent être différents entre les 2 formulations. Seule la solution buvable est indiquée dans le traitement de la candidose orale/et /ou œsophagienne chez les patients infectés par le VIH.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Associations contre-indiquées (voir rubrique 4.3)
+ Alcaloïdes de l’ergot de seigle vasoconstricteurs (tels que dihydroergotamine, ergotamine, méthylergométrine et méthysergide) :
Risque de vasoconstriction coronaire ou des extrémités (ergotisme), ou de poussées hypertensives.
+ Alfuzosine
Risque d’augmentation des concentrations plasmatiques de l’alfuzosine et de ses effets indésirables.
+ Aliskiren
Augmentation, de près de 6 fois des concentrations plasmatiques d’aliskiren et majoration du risque de ses effets indésirables.
+ Atorvastatine
Risque majoré d’effets indésirables (concentration-dépendants) à type de rhabdomyolyse (diminution du métabolisme hépatique de l’atorvastatine).
+ Avanafil
Augmentation très importante des concentrations plasmatiques de l’avanafil avec risque d’hypotension.
+ Colchicine chez les sujets avec insuffisance rénale sévère ou insuffisance hépatique sévère
Augmentation des effets indésirables de la colchicine aux conséquences potentiellement fatales.
+ Dabigatran
Augmentation de plus du double des concentrations plasmatiques de dabigatran, avec majoration du risque de saignement.
+ Dapoxétine
Risque de majoration des effets indésirables notamment à type de vertiges ou de syncopes.
+ Dompéridone
Augmentation des concentrations plasmatiques de dompéridone par diminution de son métabolisme hépatique par l’itraconazole.
+ Dronédarone
Augmentation importante des concentrations de dronédarone par diminution de son métabolisme.
+ Eplérénone
Risque d’augmentation des concentrations plasmatiques de l’éplérénone par l’itraconazole et de ses effets indésirables, notamment l’hyperkaliémie.
+ Fésotérodine chez les sujets avec insuffisance rénale modérée à sévère ou insuffisance hépatique modérée à sévère
Risque de majoration des effets indésirables, notamment à type de troubles du rythme cardiaque.
+ Ivabradine
Augmentation des concentrations plasmatiques de l’ivabradine et par conséquent de ses effets indésirables (inhibition de son métabolisme hépatique par l’itraconazole).
+ Lomitapide
Augmentation des concentrations plasmatiques du lomitapide par diminution de son métabolisme hépatique par l’itraconazole.
+ Lurasidone
Augmentation des concentrations plasmatiques de la lurasidone par diminution de son métabolisme hépatique par l’itraconazole.
+ Millepertuis
Risque de diminution importante des concentrations plasmatiques d’itraconazole, avec risque de perte d’efficacité, par augmentation de son métabolisme hépatique par le millepertuis.
+ Mizolastine
Risque de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Ombitasvir + Paritaprévir
Augmentation des concentrations plasmatiques de la bithérapie par diminution de son métabolisme hépatique par l’itraconazole.
+ Pimozide
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Quétiapine
Augmentation importante des concentrations de quétiapine, avec risque de surdosage.
+ Quinidine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes, ainsi que d'acouphènes et/ou de diminution de l'acuité auditive (cinchonisme), par diminution du métabolisme hépatique de la quinidine.
+ Ranolazine
Augmentation des concentrations de ranolazine par diminution de son métabolisme par l’itraconazole.
+ Sildénafil (dans le traitement de l’hypertension artérielle pulmonaire)
Augmentation très importante des concentrations plasmatiques du sildénafil, avec risque d’hypotension.
+ Simvastatine
Risque majoré d’effets indésirables (concentration-dépendants) à type de rhabdomyolyse (diminution du métabolisme hépatique de la simvastatine).
+ Solifénacine chez les sujets avec insuffisance rénale modérée à sévère ou insuffisance hépatique modérée à sévère
Risque de majoration des effets indésirables, notamment à type de troubles du rythme cardiaques.
+ Télithromycine chez les sujets avec insuffisance rénale sévère ou insuffisance hépatique sévère
Risque de majoration des effets indésirables, notamment à type de troubles du rythme cardiaque.
+ Ticagrélor
Augmentation des concentrations plasmatiques de ticagrélor par diminution de son métabolisme hépatique par l’itraconazole.
+ Vardénafil (chez l’homme de plus de 75 ans)
Augmentation très importante des concentrations plasmatiques de vardénafil, avec risque d’hypotension sévère.
Associations déconseillées (voir rubrique 4.4)
+ Apixaban
Augmentation des concentrations plasmatiques de l’apixaban par l’itraconazole avec majoration du risque de saignement.
+ Bédaquiline
Augmentation des concentrations plasmatiques de bédaquiline par diminution de son métabolisme hépatique par l’itraconazole.
Si l’association est nécessaire, une surveillance ECG plus fréquente et une surveillance des transaminases sont recommandées.
+ Buspirone
Augmentation des concentrations plasmatiques de la buspirone par diminution de son métabolisme hépatique, avec majoration importante de la sédation.
+ Busulfan
Avec le busulfan à fortes doses : doublement des concentrations de busulfan par l’itraconazole.
+ Colchicine (sauf chez les sujets avec insuffisance rénale sévère ou insuffisance hépatique sévère : voir association contre-indiquée)
Augmentation des effets indésirables de la colchicine aux conséquences potentiellement fatales.
+ Darifénacine
Augmentation des concentrations de darifénacine avec risque de majoration de ses effets indésirables.
Surveillance clinique et adaptation éventuelle de la posologie de darifénacine.
+ Ebastine
Risque majoré de troubles du rythme ventriculaire chez les sujets prédisposés (syndrome du QT long congénital).
+ Inhibiteurs des tyrosines kinases : axitinib, bosutinib, dabrafénib, dasatinib, ibrutinib, nilotinib, sunitinib
Pour les autres inhibiteurs de tyrosine kinase, voir en associations faisant l’objet d’une précaution d’emploi
Risque de majoration des effets indésirables de l’inhibiteur de tyrosine kinase par diminution de son métabolisme.
Avec l’ibrutinib, si l’association ne peut être évitée, adaptation de la posologie d’ibrutinib ou interruption temporaire (7 jours).
+ Halofantrine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes. Si cela est possible, interrompre l'azolé antifongique. Si l'association ne peut être évitée, contrôle préalable du QT et surveillance ECG monitorée.
+ Halopéridol
Risque de troubles du rythme ventriculaire notamment de torsade de pointes, par diminution du métabolisme de l’halopéridol par l’itraconazole.
+ Immunosuppresseurs (ciclosporine, évérolimus, sirolimus, tacrolimus, temsirolimus)
Augmentation très importante des concentrations sanguines de l’immunosuppresseur par inhibition de son métabolisme hépatique. En cas d’association, contrôle strict de la fonction rénale, dosage des concentrations sanguines de l’immunosuppresseur et adaptation éventuelle de la posologie
+ Inducteurs enzymatiques (carbamazépine, dabrafénib, éfavirenz, enzalutamide, esclicarbazépine, fosphénytoïne, névirapine, oxcarbazépine, phénobarbital, phénytoïne, primidone, rifabutine, rifampicine)
Diminution des concentrations plasmatiques d’itraconazole, avec risque de perte d’efficacité, par augmentation de son métabolisme hépatique par l’inducteur.
+ Irinotécan
Risque de majoration des effets indésirables de l’irinotécan par augmentation des concentrations plasmatiques de son métabolite actif.
+ Lercanidipine
Risque majoré d'effets indésirables, notamment d’œdèmes, par diminution du métabolisme hépatique de la dihydropyridine.
+ Luméfantrine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes. Si cela est possible, interrompre le torsadogène associé. Si l’association ne peut être évitée, contrôle préalable du QT et surveillance ECG monitorée.
+ Midazolam per os
Augmentation des concentrations plasmatiques de midazolam par diminution de son métabolisme hépatique avec majoration de la sédation.
+ Oxycodone
Augmentation des concentrations plasmatiques de l’oxycodone. Surveillance clinique et adaptation éventuelle de la posologie d’oxycodone pendant la durée du traitement par l’itraconazole.
+ Régorafénib
Augmentation des concentrations plasmatiques de régorafénib par diminution de son métabolisme hépatique par l’itraconazole.
+ Riociguat
Augmentation des concentrations plasmatiques de riociguat par diminution de son métabolisme hépatique par l’itraconazole.
+ Rivaroxaban
Augmentation des concentrations plasmatiques de rivaroxaban, avec majoration du risque de saignement.
+ Siméprévir
Risque d’augmentation des concentrations plasmatiques de siméprévir par diminution de son métabolisme hépatique par l’itraconazole.
+ Tadalafil (dans le traitement de l’hypertension artérielle pulmonaire ou des symptômes et signes de l’hypertrophie bénigne de la prostate)
Augmentation des concentrations plasmatiques du tadalafil, avec risque d’hypotension.
+ Tamsulosine
Risque de majoration des effets indésirables de la tamsulosine, par inhibition de son métabolisme hépatique.
+ Toltérodine
Risque de majoration des effets indésirables.
+ Trabectédine
Risque d’augmentation des concentrations plasmatiques de la trabectédine par l’itraconazole. Si l’association est nécessaire, surveillance clinique et adaptation éventuelle de la posologie de la trabectédine pendant la durée du traitement par l’itraconazole.
+ Vardénafil (chez l’homme jusqu’à 75 ans)
Augmentation très importante des concentrations plasmatiques de vardénafil, avec risque d’hypotension sévère.
+ Vinca-alcaloïdes cytotoxiques
Majoration de la neurotoxicité de l’antimitotique, par diminution de son métabolisme hépatique par l’itraconazole.
Associations faisant l'objet de précautions d’emploi
+ Alfentanil, fentanyl
Augmentation de l’effet dépresseur respiratoire de l’analgésique opiacé par diminution de son métabolisme hépatique. Surveillance clinique et adaptation de la posologie de l’analgésique opiacé en cas de traitement par l’itraconazole.
+ Antagonistes des canaux calciques (diltiazem, vérapamil, classe des dihydropyridines) sauf lercanidipine (voir en associations déconseillées)
Majoration des effets indésirables de l’antagoniste des canaux calciques, le plus souvent à type d’hypotension notamment chez le sujet âgé. Surveillance clinique et adaptation posologique pendant le traitement par l’itraconazole et après son arrêt.
De plus avec le vérapamil, bradycardie et/ou troubles de la conduction auriculo-ventriculaire, par diminution du métabolisme hépatique du vérapamil par l’itraconazole. Surveillance clinique et ECG. S’il y a lieu, adaptation de la posologie du vérapamil pendant le traitement par l’itraconazole, et après son arrêt, le cas échéant.
+ Antivitamines K
Augmentation de l'effet de l'antivitamine K et du risque hémorragique. Contrôle plus fréquent de l'INR. Adaptation éventuelle de la posologie de l'antivitamine K pendant le traitement par l'itraconazole et 8 jours après son arrêt.
+ Aripiprazole
Risque d’augmentation des concentrations plasmatiques d’aripiprazole par l’itraconazole. Surveillance clinique et éventuellement adaptation de la posologie d’aripiprazole pendant et après l’arrêt du traitement par l’itraconazole.
+ Bortézomib
Risque de majoration des effets indésirables, notamment neurologiques du bortézomib par diminution de son métabolisme. Surveillance clinique et adaptation éventuelle de la posologie du bortézomib pendant la durée du traitement par l’itraconazole.
+ Bosentan
Risque majoré des effets indésirables du bosentan, notamment d’atteintes hépatiques, par diminution de son métabolisme par l’itraconazole. Surveillance clinique et biologique pendant l’association.
+ Buprénorphine
Augmentation des concentrations de buprénorphine par diminution de son métabolisme hépatique, avec risque de majoration de ses effets indésirables. Surveillance clinique et adaptation de la posologie de la buprénorphine pendant le traitement par l’itraconazole et, le cas échéant, après son arrêt.
+ Cabazitaxel
Risque de majoration des effets indésirables dose-dépendants du cabazitaxel par inhibition de son métabolisme par l’itraconazole Surveillance clinique et adaptation éventuelle de la posologie du cabazitaxel pendant le traitement par l’itraconazole.
+ Daclatasvir
Augmentation des concentrations de daclatasvir par l’itraconazole. La dose de daclatasvir doit être diminuée à 30 mg 1 fois par jour en cas de co-administration avec l’itraconazole.
+ Digoxine
Augmentation de la digoxinémie avec nausées, vomissements, troubles du rythme. Surveillance clinique et, s'il y a lieu, de l'ECG et de la digoxinémie avec adaptation de la posologie de la digoxine pendant le traitement par l’itraconazole et après son arrêt.
+ Disopyramide
Risque d’augmentation des concentrations du disopyramide et de ses effets indésirables par l’itraconazole. Surveillance clinique et éventuellement adaptation de la posologie du disopyramide.
+ Docétaxel
Risque de majoration des effets indésirables dose-dépendants du docétaxel par inhibition de son métabolisme par l’itraconazole. Surveillance clinique et adaptation éventuelle de la posologie du docétaxel pendant le traitement par l’itraconazole.
+ Fésotérodine (sauf chez les sujets avec insuffisance rénale modérée à sévère ou insuffisance hépatique modérée à sévère : voir association contre-indiquée)
Risque de majoration des effets indésirables, notamment à type de troubles du rythme cardiaque. Limiter la dose maximale de fésotérodine à 4 mg par jour lors de la co-administration avec l’itraconazole.
+ Hydroquinidine
Risque d'acouphènes et/ou de diminution de l'acuité auditive : cinchonisme lié à une diminution du métabolisme hépatique de l'antiarythmique par l'itraconazole. Surveillance des concentrations plasmatiques de l'antiarythmique et diminution éventuelle de sa posologie si nécessaire.
+ Inhibiteurs de protéases boostés par ritonavir ou cobicistat
Risque d’augmentation des concentrations plasmatiques de l’itraconazole. Surveillance clinique. L’administration de doses élevées d’itraconazole n’est pas recommandée (>200 mg par jour).
+ Inhibiteurs des tyrosines kinases (sauf bosutinib, ibrutinib, axitinib, dabrafénib, dasatinib, nilotinib, sunitinib : voir en association déconseillée) : cabozantinib, crizotonib, erlotinib, géfitinib, imatinib, lapatinib, pazopanib, ponatinib, ruxolitinib, sorafénib.
Risque de majoration des effets indésirables de l’inhibiteur de tyrosine kinase par diminution de son métabolisme. Surveillance clinique.
+ Ivacaftor
Augmentation importante des concentrations d’ivacaftor avec risque de majoration des effets indésirables. Réduire la dose du quart, soit 150 mg 1 jour sur 2.
+ Maraviroc
Augmentation des concentrations de maraviroc par l’itraconazole. La dose de maraviroc doit être diminuée à 150 mg deux fois par jour en cas de co-administration avec l’itraconazole.
+ Midazolam IV
Augmentation des concentrations plasmatiques de midazolam par diminution de son métabolisme hépatique, avec majoration de la sédation. Surveillance clinique et réduction de la posologie de midazolam en cas de traitement par l’itraconazole.
+ Quinine
Risque de majoration des effets indésirables de la quinine, notamment troubles du rythme ventriculaire et troubles neurosensoriels (cinchonisme). Surveillance clinique et ECG. Adaptation éventuelle de la posologie de la quinine pendant le traitement par l’itraconazole et après son arrêt.
+ Sildénafil (dans le traitement de la dysfonction érectile)
Augmentation des concentrations plasmatiques du sildénafil, avec risque d’hypotension.
Débuter le traitement par sildénafil à la dose minimale en cas d’association avec l’itraconazole.
+ Solifénacine (sauf chez les sujets avec insuffisance rénale modérée à sévère ou insuffisance hépatique modérée à sévère : voir association contre-indiquée)
Risque de majoration des effets indésirables, notamment à type de troubles du rythme cardiaques. Limiter la dose maximale de solifénacine à 5 mg par jour lors de la co-administration avec l’itraconazole.
+ Sufentanil
Augmentation de l’effet dépresseur respiratoire de l’analgésique opiacé par diminution de son métabolisme hépatique. Surveillance clinique et adaptation de la posologie de l’analgésique opiacé en cas de traitement par l’itraconazole.
+ Tadalafil (dans le traitement de la dysfonction érectile)
Augmentation des concentrations plasmatiques du tadalafil, avec risque d’hypotension. Débuter le traitement par tadalafil à la dose minimale en cas d’association avec l’itraconazole.
+ Topiques gastro-intestinaux et adsorbants
Risque de diminution de l’absorption de l’itraconazole. Prendre les topiques ou les adsorbants à distance de l’itraconazole (plus de 2 heures si possible).
Associations à prendre en compte
+ Alprazolam
Possible augmentation de l’effet sédatif de l’alprazolam.
+ Aprépitant
Augmentation des concentrations d’aprépitant par diminution de son métabolisme hépatique par l’itraconazole.
+ Corticoïdes, notamment inhalés (budésonide, fluticasone, mométasone, ciclésonide, dexaméthasone, méthyprednisolone)
En cas d’utilisation prolongée par voie orale ou inhalée, augmentation des concentrations plasmatiques du corticoïde par diminution de son métabolisme hépatique par l'itraconazole, avec risque d'apparition d'un syndrome cushingoïde voire d’une insuffisance surrénalienne.
+ Idélalisib
Augmentation des concentrations plasmatiques d’idélalisib par diminution de son métabolisme hépatique par l’itraconazole.
+ Oxybutynine
Risque de majoration des effets indésirables de l’oxybutynine.
+ Salmétérol
Augmentation importante des concentrations de salmétérol par diminution de son métabolisme hépatique par l’itraconazole.
+ Venlafaxine
Augmentation des concentrations de venlafaxine avec risque de surdosage.
+ Zolpidem
Légère augmentation de l’effet sédatif du zolpidem.
+ Zopiclone
Légère augmentation de l’effet sédatif de la zopiclone.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les études effectuées chez l’animal ont mis en évidence un effet tératogène (voir rubrique 5.3).
Il a été montré que l’itraconazole traverse le placenta dans un modèle chez le rat.
Des cas d'anomalies congénitales ont été rapportés au cours de la commercialisation de SPORANOX, sans qu’aucun lien de cause à effet avec la prise de SPORANOX n'ait été établi. Ces cas incluaient notamment des malformations du squelette et des altérations chromosomiques.
Les données cliniques sur l'utilisation de SPORANOX pendant la grossesse sont globalement limitées. Par conséquent, SPORANOX solution buvable ne doit pas être utilisé pendant la grossesse, sauf dans les pathologies mettant en jeu le pronostic vital, où le bénéfice potentiel pour la mère l'emporte sur le préjudice potentiel pour le fœtus (voir rubrique 4.3).
Femmes en âge de procréer
Les femmes en âge de procréer, et traitées par SPORANOX, solution buvable doivent utiliser un moyen de contraception efficace. Une contraception efficace doit être poursuivie jusqu’au début des règles suivant l’arrêt du traitement par SPORANOX.
Allaitement
En raison de l’excrétion de l’itraconazole dans le lait maternel et compte-tenu de son profil d’effets secondaires, l’allaitement est déconseillé en cas de traitement par ce médicament.
Fertilité
Les données animales chez le rat n’ont pas mis en évidence un effet de l’itraconazole sur la fertilité mâle ou femelle.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de tolérance
Les effets indésirables les plus fréquemment rapportés au cours du traitement par SPORANOX solution buvable dans les essais cliniques et/ou à partir des notifications spontanées ont été sensation de vertige, céphalées, dysgueusie, dyspnée, toux, troubles gastro-intestinaux (diarrhée, nausée, vomissement, douleur abdominale, dyspepsie), rash et pyrexie. Les effets indésirables les plus sévères ont été les réactions allergiques sévères, l’insuffisance cardiaque/l’insuffisance cardiaque congestive/œdème pulmonaire, les pancréatites, l’hépatotoxicité sévère (incluant quelques cas d’insuffisance hépatique aiguë d’issue fatale) et réactions cutanées sévères. Se référer à la sous-rubrique « Liste tabulée des effets indésirables » pour les fréquences et pour les autres effets indésirables observés. Se référer à la rubrique 4.4 pour des informations complémentaires sur les autres effets sévères.
Liste tabulée des effets indésirables
Les effets indésirables décrits dans le tableau suivant ont été observés lors des études cliniques réalisées avec SPORANOX solution buvable chez 889 patients dans le traitement des candidoses œsophagiennes et oropharyngées, et/ou sont issus des notifications spontanées rapportées après la commercialisation de l’itraconazole, toute formulation confondue.
Le tableau ci-dessous présente les effets indésirables classés par Système organe et fréquence selon la convention suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classe de systèmes organes |
Effets indésirables |
||
|
Fréquent (≥ 1/100 à < 1/10) |
Peu fréquent (≥ 1/1 000 à < 1/100) |
Fréquence indéterminée |
|
|
Affections hématologiques et du système lymphatique |
|
Leucopénie, Neutropénie, Thrombopénie |
|
|
Affections du système immunitaire |
|
Hypersensibilité* |
Maladie sérique, Œdème de Quincke, Réaction anaphylactiques et anaphylactoïdes |
|
Troubles du métabolisme et de la nutrition |
|
Hypokaliémie |
Hypertriglycéridémie, |
|
Affections du système nerveux |
Sensation vertigineuse, Céphalées, Dysgueusie |
Neuropathie périphérique*, Paresthésie, Hypoesthésie |
Tremblements, Vertiges** |
|
Affections oculaires |
|
Troubles visuels (incluant diplopie et vision floue) |
|
|
Affections de l'oreille et du labyrinthe |
|
Acouphène |
Perte auditive passagère ou permanente* |
|
Affections cardiaques |
|
Insuffisance cardiaque |
Insuffisance cardiaque congestive* |
|
Affections respiratoires, thoraciques et médiastinales |
Dyspnée, Toux |
|
Œdème pulmonaire, |
|
Affections gastro-intestinales |
Douleurs abdominales, Diarrhées, Vomissements, Nausées, Dyspepsie |
Constipation |
Pancréatite, Flatulence** |
|
Affections hépatobiliaires |
|
Augmentation des enzymes hépatiques (notamment ALAT, ASAT), Insuffisance hépatique*, Hépatite*, Hyperbilirubinémie |
Hépatotoxicité sévère (incluant quelques cas d’insuffisance hépatique aiguë d’issue fatale)* |
|
Affections de la peau et du tissu sous-cutané |
Rash |
Urticaire, Prurit |
Nécrolyse épidermique toxique, Syndrome de Stevens-Johnson, Pustulose exanthématique aiguë généralisée, Erythème polymorphe, Dermatite exfoliative, Vascularite leucocytoclasique, Alopécie, Photosensibilité, |
|
Affections musculo-squelettiques et systémiques |
|
Myalgie, Arthralgie |
|
|
Affections du rein et des voies urinaires |
|
|
Pollakiurie, Incontinence urinaire |
|
Affections des organes de reproduction et du sein |
|
Troubles menstruels |
Dysfonction érectile |
|
Troubles généraux et anomalies au site d'administration |
Pyrexie |
Œdème |
|
|
Investigations |
|
|
Augmentation de la créatine phosphokinase sanguine |
* Voir rubrique 4.4
** Effet(s) indésirables associés à l’itraconazole dans les essais cliniques avec SPORANOX gélule
Population pédiatrique
Le profil de sécurité d’emploi de SPORANOX solution buvable a été évalué chez 250 patients pédiatriques âgés de 6 mois à 14 ans ayant participé à cinq essais cliniques en ouvert.
Sur la base des données de sécurité poolées issues de ces essais cliniques, les effets indésirables très fréquemment rapportés chez les patients pédiatriques ayant reçu au moins une dose de SPORANOX solution buvable en prophylaxie des infections fongiques ou pour le traitement d’un muguet buccal ou d’infections fongiques systémiques ont été vomissement (36,0%), pyrexie (30,8%), diarrhée (28,4%), inflammation des muqueuses (23,2%), rash (22,8%), douleur abdominale (17,2%), nausée (15,6%), hypertension (14,0%) et toux (11,2%). La nature des effets indésirables chez les patients pédiatriques est similaire à celle observée chez les patients adultes, mais la fréquence est plus élevée chez les patients pédiatriques.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
De manière générale, les effets indésirables rapportés en cas de surdosage ont été cohérents avec ceux rapportés lors de l’utilisation de l’itraconazole (voir rubrique 4.8).
Traitement
En cas de surdosage, un traitement symptomatique sera mis en place.
Du charbon activé peut être administré, si nécessaire.
L'itraconazole n'est pas éliminé par hémodialyse.
Il n'existe aucun antidote spécifique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Antimycosiques à usage systémique, dérivés triazolés
Code ATC : J02A C02
Mécanisme d’action
L’itraconazole inhibe l’enzyme fongique lanosterol 14 alpha-demethylase (CYP51), qui catalyse une étape indispensable de la biosynthèse de l’ergostérol, un constituant essentiel de la membrane fongique.
Relation pharmacocinétique (PK) / pharmacodynamique (PD)
Pour les agents triazolés antifongiques, incluant l’itraconazole, le ratio de l’aire sous la courbe des concentrations en fonction du temps/concentration minimale inhibitrice (ASC/CMI) est le paramètre le plus étroitement associé à l’efficacité.
Microbiologie
L’itraconazole a démontré être actif in vitro contre les microorganismes suivants :
Candida spp. (dont Candida albicans, C. tropicalis, C. parapsilosis et Candida dubliniensis).
Candida krusei, Candida glabrata et Candida guillermondii sont généralement les espèces de Candida les moins sensibles, avec quelques isolats ayant montré in vitro une résistance sans équivoque à l’itraconazole
Résistance
Les principaux mécanismes de résistance incluent l’acquisition de mutations entrainant la surexpression du gène codant pour l’enzyme cible lanosterol 14 alpha-demethylase, des mutations ponctuelles résultant en une substitution d’acides aminés de l’enzyme cible conduisant à une diminution de l’affinité pour la cible et/ou une surexpression du transporteur, responsables d’une augmentation de l’efflux.
Concentrations critiques
Les concentrations minimales inhibitrices critiques établies par la méthode EUCAST pour l’itraconazole sont:
Candida albicans: S ≤0.06 mg/L, R >0.06 mg/L
Candida parapsilosis: S ≤0.12 mg/L, R >0.12 mg/L
Candida tropicalis: S ≤0.12 mg/L, R >0.12 mg/L
5.2. Propriétés pharmacocinétiques
Caractéristiques pharmacocinétiques générales
Le pic plasmatique des concentrations d’itraconazole est atteint 2,5 heures après administration de la solution buvable.
En raison de sa pharmacocinétique non linéaire, l’itraconazole s’accumule dans le plasma après administrations répétées. Les concentrations plasmatiques à l’état d’équilibre sont généralement atteintes en approximativement 15 jours avec des valeurs Cmax et ASC 4 à 7 fois plus élevées que celles observées après administration unique. A l’état d’équilibre, une valeur Cmax d’environ 2 µg/ml est atteinte après administration orale de 200 mg par jour.
La demi-vie d’élimination terminale de l’itraconazole varie généralement de 16 à 28 heures après une administration unique et augmente pour atteindre 34 à 42 heures après administrations répétées. Lorsque le traitement est arrêté, les concentrations plasmatiques en itraconazole diminuent pour atteindre des concentrations presque indétectables en 7 jours à 14 jours, suivant la dose et de la durée du traitement.
La clairance plasmatique totale moyenne de l’itraconazole après administration intraveineuse est de 278 ml/min. La clairance de l’itraconazole diminue aux doses élevées, du fait d’une saturation de son métabolisme hépatique.
Absorption
L’itraconazole est rapidement résorbé après administration de la solution buvable. Le pic plasmatique de l’itraconazole est atteint environ 2,5 heures après administration à jeun de la solution buvable.
La biodisponibilité absolue observée de l’itraconazole administré en présence de nourriture est d’environ 55% et augmente de 30% quand la solution buvable est administrée à jeun.
L’exposition à l’itraconazole est plus élevée avec la solution buvable qu’avec les gélules lorsque la même dose est administrée. (voir rubrique 4.4)
Dans certains groupes de patients, la biodisponibilité de l’itraconazole est diminuée d’un facteur 1,5 à 2,5 (sujet HIV, neutropénique, mycose systémique à Aspergillus) pouvant atteindre 3 à 5 (dialyse péritonéale, mycose systémique à Cryptococcus). L’ensemble de ces données se traduit par une très forte variabilité interindividuelle du paramètre biodisponibilité.
Distribution
La majorité de l’itraconazole est liée aux protéines plasmatiques (99,8%) et plus particulièrement à l’albumine (99,6% pour le métabolite hydroxylé). Il présente également une affinité pour les lipides. Seulement 0,2% de l’itraconazole plasmatique est libre.
Le volume de distribution est élevé (700 l) et indique une large pénétration tissulaire associée à un fort tropisme cellulaire.
Les concentrations dans les poumons, les reins, le foie, les os, l’estomac, la rate et les muscles trouvées ont été deux à trois plus élevées que celles dans le plasma. La recapture par les tissus kératineux, et plus particulièrement par la peau est jusqu’à 4 fois plus importante que dans le plasma.
Les concentrations dans le liquide cérébrospinal sont bien plus faibles que dans le plasma.
Biotransformation
L’itraconazole est métabolisé de façon extensive dans le foie en de nombreux métabolites. Les études in vitro ont montré que le CYP 3A4 est la principale enzyme impliquée dans le métabolisme de l’itraconazole.
Le métabolite principal est l’hydroxy-itraconazole qui possède in vitro une activité antifongique comparable à celle de l’itraconazole. Les taux plasmatiques de ce métabolite sont environ 2 fois plus élevés que ceux de l’itraconazole.
Excrétion
L’itraconazole est principalement éliminé sous forme de métabolites inactifs dans les urines (35%) et dans les fécès (54%) dans la semaine après l’administration d’une dose sous forme de solution buvable. L’excrétion rénale de l’itraconazole et de son métabolite actif, l’hydroxy-itraconazole, représente moins de 1% de la dose intraveineuse administrée. Sur la base d’une dose orale d’itraconazole radio marquée, l’excrétion fécale du produit inchangé varie entre 3 et 18% de la dose administrée.
Populations particulières
Insuffisants hépatiques
L’itraconazole est principalement métabolisé par le foie. Une étude pharmacocinétique a été conduite chez 6 sujets sains et 12 sujets cirrhotiques ayant reçu une seule dose d’itraconazole (gélule de 100 mg). Une diminution statistiquement significative de la Cmax moyenne de l’itraconazole (47%) et un doublement de sa demi-vie d’élimination (37± 17 heures versus 16 ± 5 heures) ont été observés chez les sujets cirrhotiques comparativement aux sujets sains. Toutefois, l’exposition globale à l’itraconazole, calculée sur la base de l’ASC était similaire chez les patients cirrhotiques et chez les sujets sains. Les données sur l’utilisation à long terme de l’itraconazole chez des patients cirrhotiques ne sont pas disponibles (voir rubriques 4.2 et 4.4).
Insuffisants rénaux
Les données disponibles sur l’utilisation de l’itraconazole par voie orale chez des patients insuffisants rénaux sont limitées. Une étude pharmacocinétique dans laquelle l’itraconazole a été administré à la dose unique de 200 mg (quatre gélules de 50 mg) a été conduite dans trois groupes de patients ayant une insuffisance rénale (urémie : n=7 ; hémodialyse : n=7 ; et dialyse péritonéale continue ambulatoire: n=5). Chez les patients urémiques avec une clairance de la créatinine moyenne de 13 ml/min x 1,73 m2, l’exposition, calculée sur la base de l’ASC, était légèrement réduite comparée à celle de la population normale. Cette étude n’a pas montré d’effet significatif de l’hémodialyse ou de la dialyse péritonéale continue ambulatoire sur la pharmacocinétique de l’itraconazole (Tmax, Cmax et ASC0-8h). Les profils des concentrations plasmatiques en fonction du temps ont montré une large variation interindividuelle entre les trois groupes.
Après administration intraveineuse d’une seule dose, les demi-vies d’élimination terminale moyennes de l’itraconazole chez les patients atteints d’une insuffisance rénale légère (définie dans l’étude par une ClCr de 50-79 ml/min), modérée (définie dans l’étude par une ClCr de 20-49 ml/min), et sévère (définie dans l’étude par une ClCr < 20 ml/min) étaient similaires à celles des sujets sains (intervalle de 42-49 heures chez les patients insuffisants rénaux versus 48 heures chez les patients sains). L’exposition globale à l’itraconazole, calculée sur la base de l’ASC, diminuait d’approximativement 30% et 40 % chez les patients insuffisants rénaux modérés et sévères respectivement, comparée aux sujets avec une fonction rénale normale.
Les données sur l’utilisation à long terme de l’itraconazole chez des patients insuffisants rénaux ne sont pas disponibles La dialyse n’a pas d’effet sur la demi-vie ou la clairance de l’itraconazole ou de l’hydroxy-itraconazole (voir rubriques 4.2 et 4.4).
Population pédiatrique
Deux études de pharmacocinétiques ont été conduites chez des enfants neutropéniques âgés de 6 mois à 14 ans. Lors de ces études, l’itraconazole en solution buvable a été administré à la dose de 5 mg/kg une ou deux fois par jour. L’exposition à l’itraconazole a été quelques peu plus élevée chez les enfants plus âgés (6 à 14 ans) comparés aux enfants plus jeunes. Chez tous les enfants, les concentrations plasmatiques efficaces d’itraconazole ont été atteintes entre 3 et 5 jours après l’instauration du traitement et ont été maintenues pendant toute la durée du traitement.
Hydroxypropyl-ß-Cyclodextrine
La biodisponibilité orale de l’hydroxypropyl-β-cyclodextrine utilisée en tant qu’agent solubilisant est en moyenne plus faible que 0,5% et est similaire à celle de l’hydroxypropyl-β-cyclodextrine seule. Cette faible biodisponibilité orale de l’hydroxypropyl-β-cyclodextrine n’est pas modifiée par la présence de nourriture et est similaire après administration unique et administrations répétées.
5.3. Données de sécurité préclinique
· Hydroxypropyl-β-cyclodextrine (HP-β-CD)
Chez la souris, le rat et le chien, les études de toxicité aiguë et de toxicité par administration réitérée montrent une importante marge de sécurité de l'HP-β-CD administrée par voies orale et intraveineuse. La majorité des effets observés sont de caractère adaptatif (modifications histologiques du tractus urinaire, ramollissement des fécès dû à une rétention osmotique aqueuse au niveau du gros intestin, activation du système phagocytaire mononucléaire) et montrent une réversibilité satisfaisante.
De légères modifications hépatiques ont été observées à des doses correspondant à 30 fois la dose d'HP-β-CD proposée en clinique. L'HP-β-CD n'a pas d'effets sur la fertilité, ni d'effets embryotoxiques ou tératogènes directs et est dépourvue d'effets mutagènes.
Dans l'étude de carcinogénèse chez le rat, une augmentation de l'incidence des néoplasmes du gros intestin (à 5000 mg/kg/jour) et du pancréas exocrine (à 500 mg/kg/jour) a été observée.
Chez le rat, le développement de tumeurs du pancréas est dû à l'effet mitogène de la cholécystokine.
Ce phénomène n'a pas été observé dans l'étude de cancérogénèse réalisée chez la souris, ni dans l'étude de toxicité à 12 mois chez le chien ou dans l'étude de 2 ans chez le singe cynomolgus femelle. La cholécystokine ne semble pas avoir d'effet mitogène chez l'homme.
Lorsque l'on tient compte des surfaces corporelles, l'exposition à l'HP-β-CD chez l'homme à la posologie initiale recommandée en clinique pour ce médicament correspond à environ 1,7 fois l'exposition observée à la dose la plus basse dans l'étude réalisée chez le rat.
Bien qu'hypothétique, la survenue d'une telle pathologie chez l'homme ne peut être totalement éliminée.
En conséquence, une surveillance de l'amylasémie chez les sujets traités à long terme (pendant plusieurs mois) paraît nécessaire.
· Itraconazole
L'itraconazole a été étudié dans une batterie standard de tests de sécurité non clinique.
Différentes études de toxicité aiguë, conduites par voie orale chez la souris, le rat, le cobaye et le chien, à des doses d’itraconazole allant de 20 à 320 mg/kg ont mis en évidence des marges de sécurité importantes (allant de 8 à 38 fois la dose maximale recommandée chez l’homme en mg/m2).
Les études de toxicité sub-chronique, conduites par voie orale chez le rat et le chien, à des doses d’itraconazole allant de 2,5 à 160 mg/kg/jour, ont révélé plusieurs organes /tissus cibles dont notamment le cortex surrénal, les ovaires, le foie et le système phagocytaire mononucléé. Des anomalies du métabolisme lipidique ont également été notées, se traduisant par des cellules xanthomateuses dans divers organes.
Aux doses de 40 et 80 mg/kg/jour chez le rat (2 et 4 fois la dose maximale recommandée chez l’homme en mg/m2), les analyses histologiques du cortex surrénal ont montré un gonflement réversible avec une hypertrophie cellulaire de la zone réticulée et fasciculée, parfois associée à un amincissement de la zone glomérulée. Au niveau hépatique, des altérations réversibles de type vacuolisation des hépatocytes, ont été observées aux doses de 40 et 160 mg/kg/jour. Les modifications histologiques observées au niveau du système phagocytaire mononucléé consistent en la présence de macrophages présentant un contenu protéique accru dans divers tissus parenchymateux (poumons, foie, tissus lymphoïdes).
Dans une étude de toxicité par administration répétée conduite chez le chien juvénile, une baisse de la densité minérale osseuse globale a été observée après administration chronique de doses de 30 mg/kg/jour (6 fois la dose maximale recommandée chez l’homme en mg/m2) d'itraconazole.
De même, dans plusieurs études de toxicité chronique conduites chez le rat, à des doses d’itraconazole allant de 10 à 80 mg/kg, des anomalies osseuses ont été observées, se caractérisant par une diminution de l’activité des plaques osseuses, un amincissement du tissu osseux compact des os longs et une augmentation de la fragilité osseuse.
Cancérogénicité et mutagénicité
L’itraconazole ne s’est pas révélé génotoxique dans différents essais in vitro et in vivo.
Une étude de 23 mois conduite chez la souris n’a pas révélé de potentiel cancérogène de l’itraconazole jusqu’à la dose de 80 mg/kg/jour. Une autre étude de 24 mois conduite chez le rat n’a pas révélé de potentiel cancérogène de l’itraconazole jusqu’à la dose de 20 mg/kg/jour ; cependant à la dose la plus forte testée (80 mg/kg/jour), une augmentation de l’incidence de sarcome des tissus mous a été observée chez les rats mâles, pouvant possiblement être attribuée à des réactions inflammatoires, secondaires à une accumulation de cholestérol dans le tissu conjonctif.
Toxicologie de la reproduction
Chez le rat, l'itraconazole entraîne à des doses allant de 40 à 160 mg/kg/jour (2 à 10 fois la dose maximale recommandée chez l’homme en mg/m²), une augmentation dose-dépendante de la toxicité maternelle, de l'embryotoxicité et de la tératogénicité. Chez la souris, les mêmes observations sont faites pour des doses de 80 mg/kg/jour (2 fois la dose maximale recommandée chez l’homme en mg/m²).
Chez le rat, des anomalies majeures du squelette ont été observées dans la descendance ; et chez la souris, des encéphalocèles et des macroglossies.
Aucun effet tératogène n’a été mis en évidence chez le lapin jusqu’à une dose de 80 mg/kg (9 fois la dose maximale recommandée chez l’homme en mg/m2).
Fertilité
Les données animales disponibles chez le rat n’ont pas mis en évidence d’effet délétère de l'itraconazole sur la fertilité mâle ou femelle (voir rubrique 4.6).
2 ans.
Après première ouverture du flacon, ce médicament doit être conservé maximum un mois.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
150 ml en flacon (verre brun) avec fermeture de sécurité enfant (polypropylène) et joint (PE) avec gobelet doseur gradué (polypropylène).
6.6. Précautions particulières d’élimination et de manipulation
SPORANOX solution buvable est fourni en flacon pourvu d'un bouchon avec fermeture de sécurité enfant. Pour l'ouvrir : appuyer sur le bouchon de plastique tout en le dévissant dans le sens inverse des aiguilles d'une montre.

Un gobelet-doseur gradué est fourni avec SPORANOX solution buvable. Utiliser ce gobelet-doseur dans le sens où il est posé sur le flacon. S’assurer que le côté avec les graduations (le côté avec le plus petit contenant) soit en haut. Si la flèche sur le côté pointe vers le haut, le gobelet-doseur est dans le bon sens.
Verser la solution buvable jusqu’à la graduation correspondant à la quantité à administrer prescrite.
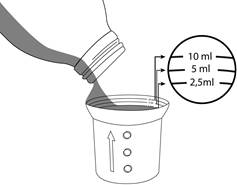
Après chaque usage, laver le gobelet-doseur soigneusement à l'eau tiède.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1, RUE CAMILLE DESMOULINS
TSA 91003
92787 ISSY LES MOULINEAUX CEDEX 9
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 345 020 6 4: 150 ml en flacon (verre brun) avec gobelet-doseur gradué (polypropylène).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Prescription initiale hospitalière annuelle.