RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 14/11/2019
THALIDOMIDE ACCORD 50 mg, gélule
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Thalidomide........................................................................................................................... 50 mg
Pour une gélule.
Excipients à effet notoire :
Chaque gélule contient approximativement 1,81 mg de sodium et 28,8 mg d’isomalt.
Pour la liste complète des excipients, voir rubrique 6.1.
Gélules blanches opaques de taille 4.
Les gélules contiennent une poudre blanche.
4.1. Indications thérapeutiques
THALIDOMIDE ACCORD doit être prescrit et délivré conformément au Programme de Prévention de la Grossesse de THALIDOMIDE ACCORD (voir rubrique 4.4).
4.2. Posologie et mode d'administration
Posologie
La dose recommandée de thalidomide est de 200 mg par jour, par voie orale.
Un nombre maximum de 12 cycles de 6 semaines (42 jours) doit être pratiqué.
Tableau 1 : Doses initiales de thalidomide en association au melphalan et à la prednisone
|
Age (ans) |
PNN* (/μL) |
|
Numération plaquettaire (/μL) |
Thalidomidea,b |
Melphalanc,d,e |
Prednisonef |
|
≤ 75 |
≥ 1 500 |
ET |
≥ 100 000 |
200 mg par jour |
0,25 mg/kg par jour |
2 mg/kg par jour |
|
≤ 75 |
< 1 500 mais ≥ 1 000 |
OU |
< 100 000 mais ≥ 50 000 |
200 mg par jour |
0,125 mg/kg par jour |
2 mg/kg par jour |
|
> 75 |
≥ 1 500 |
ET |
≥ 100 000 |
100 mg par jour |
0,20 mg/kg par jour |
2 mg/kg par jour |
|
> 75 |
< 1 500 mais ≥ 1 000 |
OU |
< 100 000 mais ≥ 50 000 |
100 mg par jour |
0,10 mg/kg par jour |
2 mg/kg par jour |
* PNN : polynucléaires neutrophiles
a Le thalidomide est administré une fois par jour au coucher les jours 1 à 42 de chaque cycle de 42 jours.
b En raison de l’effet sédatif associé au thalidomide, l’administration au coucher améliore généralement la tolérance.
c Melphalan est administré une fois par jour les jours 1 à 4 de chaque cycle de 42 jours.
d Posologie du melphalan : réduire la dose de 50 % en cas d’insuffisance rénale modérée (clairance de la créatinine : ≥ 30 mais < 50 mL/min) ou sévère (ClCr : < 30 mL/min).
e Dose quotidienne maximale de melphalan : 24 mg (âge ≤ 75 ans) ou 20 mg (âge > 75 ans).
f Prednisone est administrée une fois par jour les jours 1 à 4 de chaque cycle de 42 jours.
Une surveillance des patients est particulièrement recommandée dans les domaines suivants : risques thrombo-emboliques veineux, neuropathies périphériques, réactions cutanées sévères, bradycardie, syncope, somnolence, neutropénie et thrombocytopénie (voir rubriques 4.4 et 4.8). Une prise différée, une réduction de dose ou une interruption de traitement peut être nécessaire, selon le grade des critères NCI-CTC (National Cancer Institute Common Toxicity Criteria).
Si moins de 12 heures se sont écoulées depuis l’oubli de la dose, le patient peut prendre la dose oubliée. Si plus de 12 heures se sont écoulées depuis l’oubli de la dose à l’heure normale, le patient ne doit pas prendre la dose ; il doit attendre le lendemain et prendre la dose suivante à l’heure habituelle.
Risques thrombo-emboliques
Une thromboprophylaxie doit être administrée au moins pendant les 5 premiers mois du traitement, en particulier chez les patients présentant des facteurs de risque de thrombose supplémentaires. La prescription d’anti-thrombotiques en prophylaxie tels que les héparines de bas poids moléculaire ou la warfarine, est recommandée. La décision de mettre en place des mesures prophylactiques antithrombotiques devra être prise au cas par cas en fonction des facteurs de risque individuels supplémentaires (voir rubriques 4.4, 4.5 et 4.8).
L’apparition d’une thrombose veineuse impose l’interruption du traitement et la mise en place d’un traitement anticoagulant. Après stabilisation de l’état du patient sous traitement anticoagulant, et après maîtrise des complications liée à l’évènement thrombo-embolique, le traitement par le thalidomide peut être repris à la dose initiale, après évaluation du rapport bénéfice/risque. Le patient doit continuer le traitement anticoagulant durant toute la durée du traitement par le thalidomide.
Neutropénie
La numération formule leucocytaire doit être surveillée régulièrement, conformément aux recommandations en oncologie, en particulier chez les patients qui peuvent être plus sujets à une neutropénie. Une prise différée, une réduction de dose ou une interruption de traitement peut être nécessaire, selon le grade des critères NCI-CTC.
Thrombocytopénie
La numération plaquettaire doit être surveillée régulièrement, conformément aux recommandations en oncologie. Une prise différée, une réduction de dose ou une interruption de traitement peut être nécessaire, selon le grade des critères NCI-CTC.
Neuropathie périphérique
Le tableau 2 décrit les ajustements de posologie consécutifs à une neuropathie périphérique.
Tableau 2 : Ajustements de la posologie recommandés en cas de neuropathie périphérique en rapport avec le traitement de première ligne du myélome multiple par thalidomide
|
Gravité de la neuropathie |
Modification de la posologie |
|
Grade 1 (paresthésie, faiblesse et/ou perte des réflexes) sans perte de fonction |
Poursuivre la surveillance du patient à l’aide d’un examen clinique. En cas d’aggravation des symptômes, il convient d’envisager une réduction de la dose. Cependant, une réduction de la dose n’est pas nécessairement suivie d’une amélioration des symptômes. |
|
Grade 2 (fonction altérée mais pas d’impact sur les activités quotidiennes) |
Réduire la dose ou interrompre le traitement et poursuivre la surveillance du patient par examen clinique et neurologique. Interrompre le traitement en cas d’absence d’amélioration ou D’aggravation continue de la neuropathie. En cas de résolution ou de retour au grade 1, le traitement peut être repris si le rapport bénéfice/risque est favorable. |
|
Grade 3 (activités quotidiennes perturbées) |
Interrompre le traitement. |
|
Grade 4 (neuropathie invalidante) |
Interrompre le traitement. |
Sujets âgés
Aucun ajustement spécifique de la posologie n’est recommandé pour les patients âgés ≤ 75 ans. Pour les patients âgés > 75 ans, la dose initiale recommandée de thalidomide est de 100 mg par jour. La dose initiale de melphalan doit être réduite chez les patients âgés > 75 ans en tenant compte de la réserve médullaire avant le traitement et de la fonction rénale. La dose initiale recommandée de melphalan est de 0,1 à 0,2 mg/kg par jour en fonction de la réserve médullaire avec une réduction supplémentaire de la dose de 50 % en cas d’insuffisance rénale modérée (clairance de la créatinine : ≥ 30 mais < 50 ml/minute) ou sévère (ClCr : < 30 mL/minute). La dose quotidienne maximale de melphalan est de 20 mg chez les patients âgés > 75 ans (voir tableau 1).
Patients souffrant d’insuffisance rénale ou hépatique
THALIDOMIDE ACCORD n’ayant pas été étudié chez les patients souffrant d’insuffisance rénale ou hépatique, il n’existe aucune recommandation de posologie spécifique pour ces populations de patients. Les patients présentant une insuffisance hépatique ou rénale sévère doivent être étroitement suivis pour détecter toute survenue de réactions indésirables.
Population pédiatrique
Il n’existe pas d’utilisation justifiée de THALIDOMIDE ACCORD dans la population pédiatrique dans l’indication du myélome multiple.
Mode d’administration
La prise de THALIDOMIDE ACCORD se fera de préférence le soir, en prise unique, afin de réduire l’impact de la somnolence. Les gélules ne doivent pas être ouvertes ou écrasées (voir rubrique 6.6).
Il est recommandé d’appuyer sur une extrémité seulement de la gélule pour la sortir de la plaquette, ce qui réduit le risque de déformation ou de rupture de la gélule.
· Hypersensibilité au thalidomide ou à l’un des excipients mentionnés à la rubrique 6.1.
· Femmes enceintes (voir rubrique 4.6).
· Femmes en âge de procréer, à moins que toutes les conditions requises par le Programme de
· Prévention de la Grossesse ne soient remplies (voir rubriques 4.4 et 4.6).
· Patients masculins dans l’incapacité de respecter les mesures de contraception exigées (voir
· rubrique 4.4).
4.4. Mises en garde spéciales et précautions d'emploi
Le thalidomide est un tératogène puissant, provoquant des anomalies congénitales graves, potentiellement létales chez l’enfant à naître après exposition pendant la grossesse. Le thalidomide ne doit en aucun cas être utilisé chez la femme enceinte ou susceptible de l’être, sauf si toutes les conditions du Programme de Prévention de la Grossesse sont remplies. Les conditions du Programme de Prévention de la Grossesse doivent être remplies par tous les patients, et concernent à la fois les hommes et les femmes.
Critères permettant de définir qu’une femme est dans l’impossibilité de procréer
Toute patiente ou partenaire de patient est considérée comme en âge de procréer sauf si elle présente au moins l’un des critères suivants :
· âge ≥ 50 ans et aménorrhée depuis au moins 1 an ou plus (l’aménorrhée faisant suite au traitement d’un cancer ou survenant pendant l’allaitement ne suffit pas à exclure un risque de grossesse).
· ménopause précoce confirmée par un gynécologue spécialisé.
· salpingo-ovariectomie bilatérale ou hystérectomie.
· génotype XY, syndrome de Turner, agénésie utérine.
Information des patients
Chez la femme en âge de procréer, l’utilisation du thalidomide est contre-indiquée à moins que toutes les conditions suivantes ne soient remplies :
· La patiente comprend les risques tératogènes pour l’enfant à naître en cas d’exposition au cours de la grossesse.
· Elle comprend la nécessité d’une contraception efficace, sans interruption, commencée au moins 4 semaines avant le traitement, poursuivie pendant toute sa durée et jusqu’à au moins 4 semaines après l’arrêt de celui-ci.
· Même en cas d’aménorrhée, toute femme en âge de procréer doit suivre toutes les mesures de contraception efficaces.
· Elle doit être en mesure de respecter des mesures de contraception efficaces.
· Elle est informée et comprend les conséquences potentielles d’une grossesse et la nécessité de consulter rapidement son médecin s’il existe un risque de grossesse.
· Elle comprend la nécessité de devoir débuter le traitement dès que le thalidomide lui a été délivré après un test de grossesse négatif.
· Elle comprend la nécessité et accepte de faire un test de grossesse toutes les 4 semaines durant le traitement sauf en cas de stérilisation tubaire confirmée.
· Elle confirme avoir bien compris les risques et les mesures de précaution nécessaires pour l’utilisation du thalidomide.
En raison du passage possible du thalidomide dans le sperme, par précaution, tous les hommes traités par le thalidomide doivent :
· Comprendre les risques tératogènes en cas de rapport sexuel avec une femme enceinte ou en âge de procréer.
· Comprendre qu’il est nécessaire d’utiliser des préservatifs en cas de rapport sexuel avec une femme enceinte ou en âge de procréer qui n’utilise pas de contraception efficace (même si l’homme a eu une vasectomie) pendant le traitement, pendant l’interruption du traitement et pendant au moins 7 jours après la fin du traitement.
· Comprendre que si la partenaire débute une grossesse pendant la prise de thalidomide par l’homme ou 7 jours après l’arrêt du traitement par le thalidomide, l’homme doit le signaler immédiatement à son médecin traitant et qu’il est conseillé d’adresser la partenaire à un médecin spécialiste ou expérimenté en tératologie pour évaluation et conseil.
Le médecin prescripteur doit s’assurer que :
· Les patient(e)s remplissent les conditions requises par le Programme de Prévention de la Grossesse, et notamment, que leur niveau de compréhension est adapté.
· Les patient(e)s reconnaissent avoir compris les conditions susmentionnées.
Contraception
Les femmes en âge de procréer doivent utiliser une méthode de contraception efficace pendant au moins 4 semaines avant le début du traitement, pendant toute la durée de celui-ci et jusqu’à au moins 4 semaines après l’arrêt du thalidomide, même en cas d’interruption du traitement, à moins qu’elles ne déclarent une abstinence totale et continue, qui sera confirmée de façon mensuelle. Si la patiente n’utilise aucun moyen contraceptif efficace, elle devra être orientée de préférence vers un médecin compétent pour être conseillée et afin qu’une contraception adaptée soit instaurée.
Voici des exemples de méthodes de contraception adaptées :
· Implant contraceptif.
· Dispositif intra-utérin (DIU) au lévonorgestrel.
· Acétate de médroxyprogestérone retard.
· Stérilisation tubaire.
· Rapports sexuels exclusivement avec un partenaire vasectomisé ; la vasectomie doit avoir été confirmée par deux spermogrammes négatifs.
· Pilules progestatives inhibant l’ovulation (c’est-à-dire désogestrel).
En raison du risque accru d’accidents thrombo-emboliques veineux chez les patients atteints de myélome multiple (MM), l’utilisation de pilules oestroprogestatives n’est pas recommandée (voir rubrique 4.5). Si la patiente est sous pilule oestroprogestative, elle devra utiliser une autre méthode contraceptive, c’est-à-dire une des méthodes citées ci-dessus. Le risque thrombo-embolique persiste pendant 4 à 6 semaines après l’arrêt du contraceptif oral oestroprogestatif.
Test de grossesse
Le type de test utilisé doit être d’une sensibilité d’au moins 25 mUI/ml et pratiqué chez les femmes en âge de procréer, sous la responsabilité d’un médecin comme indiqué ci-dessous. Cette exigence inclut les femmes en âge de procréer qui pratiquent l’abstinence absolue en permanence.
Avant de commencer le traitement
Un test de grossesse doit être effectué sous contrôle médical lors de la consultation ou dans les 3 jours précédant la consultation lorsque le thalidomide est prescrit si la patiente utilise une contraception efficace depuis au moins 4 semaines. Le test doit confirmer que la patiente n’est pas enceinte au moment où elle débute le traitement par le thalidomide.
Suivi et arrêt du traitement
Un nouveau test de grossesse sous contrôle médical doit être effectué toutes les 4 semaines et jusqu’à 4 semaines après l’arrêt du traitement sauf en cas de stérilisation tubaire confirmée. Ces tests de grossesse doivent être effectués le jour de la consultation dédiée à la prescription ou dans les 3 jours précédents.
Chez l’homme
En raison du passage possible du thalidomide dans le sperme, par précaution, tous les hommes doivent utiliser des préservatifs pendant toute la durée du traitement, pendant l’interruption du traitement et pendant au moins 7 jours après l’arrêt du traitement, si leur partenaire est enceinte ou en âge de procréer et n’utilise pas de méthode contraceptive.
Les hommes ne doivent pas faire de don de sperme pendant le traitement par thalidomide (y compris pendant les interruptions du traitement) et pendant au moins 7 jours après l’arrêt du traitement.
Restrictions en matière de prescription et de délivrance
Chez les femmes en âge de procréer, les prescriptions de thalidomide doivent se limiter au maximum à 4 semaines de traitement et la poursuite du traitement nécessite une nouvelle prescription. Idéalement, le test de grossesse, la prescription et la délivrance auront lieu le même jour. La délivrance du thalidomide devrait avoir lieu au plus tard 7 jours après la prescription.
Pour tous les autres patients, les prescriptions de thalidomide doivent se limiter au maximum à 12 semaines de traitement et la poursuite du traitement nécessite une nouvelle prescription.
Précautions supplémentaires
Les patients doivent être informés de ne jamais donner leur médicament à quelqu’un d’autre et de rapporter les gélules non utilisées à leur pharmacien en fin de traitement.
Les patients ne doivent pas faire de don de sang pendant le traitement par thalidomide (y compris pendant les interruptions du traitement) et pendant au moins 7 jours après l’arrêt du traitement.
Documents d’information
Afin d’aider les professionnels de la santé à éviter toute exposition fœtale au thalidomide, le titulaire de l’autorisation de mise sur le marché leur fournira des documents d’information visant à renforcer les mises en garde relatives à la tératogénicité du thalidomide, à donner des conseils pour la mise en place d’une contraception préalable au traitement et à fournir des explications sur les tests de grossesse nécessaires.
Dans le cadre du Programme de Prévention de la Grossesse, le médecin prescripteur doit informer les patients hommes et femmes du risque tératogène attendu et des mesures strictes de prévention de la grossesse et leur fournir un carnet éducatif, une carte patient et/ou tout outil équivalent conformément au système de carte d’information destinée aux patients en vigueur dans le pays. Un système de distribution contrôlé à l’échelle nationale a été mis en place en collaboration avec chaque autorité compétente au niveau national. Ce système de distribution contrôlée comprend l’utilisation d’une carte patient et/ou d’un outil équivalent pour le contrôle de la prescription et/ou de la délivrance, et le recueil de données précises concernant l’indication afin de surveiller de près l’utilisation hors indications sur le territoire national. Dans l’idéal, le test de grossesse, la délivrance de l’ordonnance et celle du médicament doivent avoir lieu le même jour. La délivrance de thalidomide aux femmes en âge de procréer doit avoir lieu au cours des 7 jours suivant la prescription et après l’obtention d’un résultat négatif à un test de grossesse contrôlé médicalement.
Aménorrhée
Le traitement par le thalidomide peut être associé à des troubles menstruels, incluant une aménorrhée.
En cas d’aménorrhée pendant le traitement par le thalidomide, celle-ci doit être considérée comme étant due à une grossesse jusqu’à ce que l’absence de grossesse soit médicalement confirmée. Le mécanisme exact par lequel le thalidomide peut induire une aménorrhée n’est pas élucidé. Les évènements rapportés chez des femmes jeunes (non ménopausées) (âge médian : 36 ans) recevant le thalidomide, dans des indications autres que le myélome multiple, sont survenus dans les 6 mois suivant l’instauration du traitement et ont été réversibles après l’arrêt du thalidomide. Dans les cas confirmés pour lesquels des dosages hormonaux étaient disponibles, l’évènement d’aménorrhée a été associé à un taux faible d’œstradiol et à des taux élevés de FSH et de LH. Lorsque les résultats étaient fournis, la recherche d’anticorps anti-ovariens était négative et le taux de prolactine était dans les limites normales.
Affections cardiovasculaires
Infarctus du myocarde
Des cas d’infarctus du myocarde (IDM) ont été rapportés chez des patients recevant du thalidomide, notamment chez ceux qui présentent des facteurs de risque connus. Une surveillance étroite s’impose chez les patients présentant des facteurs de risque connus d’IDM, parmi lesquels un antécédent de thrombose. Des mesures doivent être prises pour essayer de réduire au minimum tous les facteurs de risque modifiables (par exemple le tabagisme, l’hypertension et l’hyperlipidémie).
Évènements thrombo-emboliques veineux et artériels
Le risque de thrombo-embolie veineuse (tels que thrombose veineuse profonde, embolie pulmonaire) et de thrombo-embolie artérielle (tels qu’infarctus du myocarde, accident vasculaire cérébral) est majoré chez les patients traités par le thalidomide (voir rubrique 4.8). Le risque semble plus important au cours des 5 premiers mois du traitement. Des recommandations relatives à la thromboprophylaxie et au traitement anticoagulant figurent à la rubrique 4.2.
Des antécédents d’évènements thrombo-emboliques ou d’administration concomitante d’agents érythropoïétiques ou d’autres agents tels qu’un traitement hormono-substitutif, peuvent aussi accroître le risque thrombo-embolique chez ces patients. De ce fait, il convient d’utiliser ces agents avec prudence chez des patients atteints d’un myélome multiple qui reçoivent le thalidomide en même temps que la prednisone et le melphalan. En particulier, une concentration d'hémoglobine supérieure à 12 g/dl doit conduire à l’arrêt des agents érythropoïétiques. Des mesures doivent être prises pour réduire au minimum tous les facteurs de risque modifiables (par exemple le tabagisme, l’hypertension et l’hyperlipidémie).
Il est conseillé aux patients et aux médecins d’être attentifs à la survenue éventuelle des signes et symptômes d’une thrombo-embolie. Il sera demandé aux patients de consulter leur médecin s’ils développent des symptômes tels qu’essoufflement, douleurs thoraciques, œdème dans les bras ou les jambes.
Neuropathie périphérique
La neuropathie périphérique est un effet indésirable très fréquent, potentiellement grave, associé au traitement par le thalidomide, pouvant entraîner des lésions irréversibles (voir rubrique 4.8). Dans une étude de phase 3, le temps médian avant le premier évènement de neuropathie était de 42,3 semaines.
Si le patient présente une neuropathie périphérique, il convient de suivre les instructions relatives aux modifications de dose et de schéma thérapeutique fournies à la rubrique 4.2.
Il est recommandé de suivre étroitement les patients afin de détecter tout symptôme de neuropathie. Les symptômes incluent la paresthésie, la dysesthésie, la gêne, la coordination anormale ou la faiblesse.
Des examens neurologiques et cliniques avant le début du traitement par le thalidomide et une surveillance régulière pendant le traitement sont recommandés.
Les médicaments associés à un risque de neuropathie doivent être utilisés avec précaution chez les patients recevant du thalidomide (voir rubrique 4.5).
Le thalidomide risque également d’aggraver une neuropathie existante. Il ne doit donc pas être administré à des patients présentant des signes ou des symptômes cliniques de neuropathie périphérique à moins que les bénéfices cliniques ne soient supérieurs aux risques.
Syncope, bradycardie et bloc auriculo-ventriculaire
Les patients doivent faire l’objet d’une surveillance en raison du risque de syncope, de bradycardie et de bloc auriculo-ventriculaire, effets pouvant nécessiter une réduction de la dose ou un arrêt du traitement.
Hypertension artérielle pulmonaire
Des cas d’hypertension artérielle pulmonaire, parfois d’issue fatale, ont été rapportés chez des patients traités par le thalidomide. Les signes et symptômes de maladie cardiopulmonaire sous-jacente doivent être évalués avant l’instauration du traitement et pendant le traitement par le thalidomide.
Affections hématologiques
Neutropénie
Chez les patients présentant un myélome multiple, la fréquence de neutropénies de grade 3 ou 4 rapportées en tant qu’effets indésirables a été plus élevée chez ceux recevant l’association MPT (melphalan, prednisone, thalidomide) que chez ceux qui recevaient l’association MP (melphalan, prednisone) : 42,7 % versus 29,5 % respectivement (étude IFM 99-06). Dans le cadre de la pharmacovigilance, des effets indésirables tels que neutropénie fébrile et pancytopénie ont été rapportés avec le thalidomide. Les patients doivent être surveillés et une prise différée, une réduction de la dose ou l’interruption du traitement peut être nécessaire (voir rubrique 4.2).
Thrombocytopénie
Des thrombocytopénies incluant des cas de grade 3 ou 4 rapportées en tant qu’effets indésirables ont été observées chez des patients présentant un myélome multiple recevant l’association MPT. Les patients doivent être surveillés et une prise différée, une réduction de la dose ou l’interruption du traitement peut être nécessaire (voir rubrique 4.2). Il est conseillé aux patients et à leurs médecins d’être attentifs aux signes et symptômes évocateurs d’une hémorragie, y compris pétéchies, épistaxis et hémorragies digestives, notamment en cas de prise concomitante d’un médicament ayant tendance à induire des saignements (voir rubriques 4.5 et 4.8).
Affections hépatiques
Des troubles hépatiques, essentiellement des anomalies des paramètres hépatiques, ont été rapportés.
Aucun profil particulier n’a été identifié concernant ces anomalies : hépatite cytolytique, hépatite cholestatique et hépatite mixte cytolytique/cholestatique ont été rapportées. Dans la majorité des cas, ces anomalies sont survenues au cours des deux premiers mois de traitement et se sont corrigées spontanément sans traitement après l’arrêt du thalidomide. La fonction hépatique doit être surveillée, en particulier en cas d’hépatopathie préexistante ou de traitement concomitant par des médicaments susceptibles d’induire une toxicité hépatique (voir rubrique 4.8).
Réactions cutanées sévères
Dans l’éventualité où le patient présente une réaction cutanée toxique, comme par exemple le syndrome de Stevens-Johnson (SSJ) et le syndrome de nécrolyse épidermique toxique (NET), le traitement doit être définitivement interrompu (voir rubrique 4.8).
Réactions allergiques
Des cas de réactions allergiques/angio-oedème ont été rapportés. Le traitement par thalidomide doit être arrêté en cas d’éruption cutanée et le traitement ne doit être repris seulement après une évaluation clinique appropriée. En cas d’angio-oedème, le traitement par thalidomide ne doit pas être repris.
Somnolence
Il arrive très fréquemment que le thalidomide provoque de la somnolence. Les patients doivent être informés de ce risque de somnolence et demander un avis médical avant de prendre d’autres médicaments connus pour provoquer une somnolence. Les patients doivent faire l'objet d'un suivi et une réduction de dose peut s’avérer nécessaire. Les patients doivent être informés quant à la possibilité d’affaiblissement des capacités mentales et/ou physiques nécessaires à l’exécution des tâches dangereuses (voir rubrique 4.7).
Syndrome de lyse tumorale
Les patients présentant des risques de syndrome de lyse tumorale sont ceux qui ont une charge tumorale élevée avant le traitement. Ces patients doivent être étroitement surveillés et les précautions appropriées doivent être prises.
Infections
Les patients doivent faire l’objet d’une surveillance en raison du risque d’infections graves incluant septicémie et choc septique.
Des cas de réactivation virale ont été rapportés chez des patients traités par le thalidomide, y compris des cas graves de réactivation du virus de la varicelle et du zona et du virus de l’hépatite B (VHB).
Dans certains des cas, la réactivation du virus de la varicelle et du zona a entraîné un zona disséminé, nécessitant une suspension temporaire du traitement par le thalidomide et un traitement antiviral adéquat.
Certains cas de réactivation du virus de l’hépatite B ont évolué vers une insuffisance hépatique aiguë et conduit à l’arrêt du traitement par le thalidomide. La sérologie VHB doit être déterminée avant l’instauration du traitement par le thalidomide. Chez les patients présentant un résultat positif au test de dépistage de l’infection par le VHB, une consultation avec un médecin spécialisé dans le traitement de l’hépatite B est recommandée.
Les patients préalablement infectés doivent être étroitement surveillés pendant toute la durée du traitement afin de détecter des signes et symptômes de réactivation virale, notamment d’infection active par le VHB.
Leucémie aiguë myéloblastique (LAM) et syndromes myélodysplasiques (SMD)
Une augmentation statistiquement significative des cas de LAM et de SMD a été observée dans une étude clinique chez des patients présentant un myélome multiple non préalablement traité recevant l’association de melphalan, prednisone et thalidomide (MPT). Le risque a augmenté au cours du temps et il était d’environ 2 % après deux ans et d’environ 4 % après trois ans. Une fréquence plus élevée de cancers secondaires (CS) a également été observée chez les patients présentant un myélome multiple de novo traités par le lénalidomide. Parmi les CS invasifs, des cas de LAM/SMD ont été observés chez des patients recevant le lénalidomide en association avec le melphalan ou immédiatement après melphalan à forte dose et autogreffe de cellules souches.
Le bénéfice obtenu avec le thalidomide et le risque de LAM et de SMD doivent être pris en compte avant d’instaurer un traitement par le thalidomide en association avec le melphalan et la prednisone.
Les médecins doivent évaluer soigneusement les patients avant et pendant le traitement en utilisant les méthodes habituelles de dépistage des cancers et instaurer un traitement s’il est indiqué.
Patients atteints d’insuffisance rénale ou hépatique
Les études menées chez des volontaires sains et des patients atteints d’un myélome multiple semblent indiquer que la fonction rénale ou hépatique n’influe pas de façon significative sur le thalidomide (voir rubrique 5.2).
Cependant, cela n’a pas été étudié formellement chez les patients atteints d’insuffisance rénale ou hépatique. Par conséquent, les patients présentant une insuffisance rénale ou hépatique sévère doivent être suivis étroitement afin de détecter toute survenue d’effets indésirables.
Excipients
Ce médicament contient moins de 1 mmol (23 mg) de sodium par gélule, c’est-à-dire qu’il est essentiellement « sans sodium ».
THALIDOMIDE ACCORD contient de l’isomalt. Les patients présentant des problèmes héréditaires rares d’intolérance au fructose ne doivent pas prendre ce médicament.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Le thalidomide ne représente pas un bon substrat pour les isoenzymes du cytochrome P450. Par conséquent, il est peu probable que des interactions avec des médicaments qui sont des inhibiteurs et/ou des inducteurs de cette enzyme se produisent. Le métabolisme par hydrolyse non enzymatique du thalidomide, qui est le principal mécanisme de clairance, suggère que le potentiel d’interactions du thalidomide avec d’autres médicaments est faible.
Augmentation des effets sédatifs d’autres médicaments
Le thalidomide possède des propriétés sédatives susceptibles d’augmenter la sédation due aux anxiolytiques, aux hypnotiques, aux antipsychotiques, aux antihistaminiques H1, aux dérivés d’opiacés, aux barbituriques et à l’alcool. Il convient d’utiliser le thalidomide avec précaution lors de l’association à des médicaments susceptibles d’entraîner une somnolence.
Effet bradycardique
Les médicaments, tels que les substances actives connues pour induire des torsades de pointe, les bêtabloquants ou les anticholinestérasiques ayant le même effet pharmacodynamique que le thalidomide (connu pour être à l’origine de bradycardie) doivent être utilisés avec précaution.
Médicaments connus pour leur risque de neuropathie périphérique
Les médicaments possédant un risque de neuropathie périphérique (par exemple la vincristine et le bortézomib) doivent être utilisés avec précaution chez les patients recevant du thalidomide.
Contraceptifs hormonaux
Le thalidomide ne présente pas d’interaction avec les contraceptifs hormonaux, comme l’a montré l’étude du profil pharmacocinétique de l’association de 1,0 mg d’acétate de noréthindrone et de 0,75 mg d’éthinylestradiol, administrés en dose unique chez 10 sujets sains de sexe féminin. Les résultats ont en effet été similaires (temps à la concentration maximale) avec et sans la coadministration de 200 mg/jour de thalidomide. Cependant, l’administration concomitante de contraceptifs hormonaux n’est pas recommandée en raison du risque accru de maladie thromboembolique veineuse.
Warfarine
L’administration de plusieurs doses de 200 mg de thalidomide par jour pendant 4 jours n’a eu aucun effet sur le Temps de Quick exprimé en INR (International Normalized Ratio) chez des volontaires sains. Cependant, en raison du risque accru de thrombose chez les patients atteints d’un cancer et d’accélération du métabolisme de la warfarine avec les corticostéroïdes, une surveillance étroite du Temps de Quick, exprimé en INR, est recommandée pendant l’administration concomitante de thalidomide-prednisone et pendant les premières semaines suivant l’arrêt de ces traitements.
Digoxine
Le thalidomide ne présente pas d’interaction avec la digoxine. L’administration de plusieurs doses de 200 mg de thalidomide à 18 volontaires sains de sexe masculin n’a eu aucun effet apparent sur la pharmacocinétique de la digoxine administrée en dose unique. En outre, l’administration d’une dose unique de digoxine de 0,5 mg n’a eu aucun effet apparent sur la pharmacocinétique du thalidomide. On ne sait pas si l’effet sera différent chez les patients atteints de myélome multiple.
4.6. Fertilité, grossesse et allaitement
Femmes en âge de procréer/Contraception chez les hommes et les femmes
Les femmes en âge de procréer doivent recourir à une méthode de contraception efficace au moins 4 semaines avant le début du traitement, pendant toute la durée du traitement, y compris pendant les interruptions du traitement, et jusqu’à au moins 4 semaines après l’arrêt du traitement par le thalidomide (voir rubrique 4.4). En cas de survenue d’une grossesse chez une femme traitée par le thalidomide, le traitement doit être immédiatement arrêté et la patiente doit être adressée à un médecin spécialiste ou expérimenté en tératologie pour évaluation et conseil.
En raison du passage de thalidomide dans le sperme, par précaution, tous les hommes doivent utiliser des préservatifs pendant toute la durée du traitement, pendant l’interruption du traitement et pendant au moins 7 jours après la fin du traitement quand ils ont des rapports sexuels avec une femme enceinte ou une femme susceptible de l’être et qui n’utilise pas de méthode de contraception. Ces précautions s’appliquent même si l’homme a eu une vasectomie.
Si une grossesse survient chez la partenaire d’un patient prenant du thalidomide, la partenaire doit être orientée vers un médecin qui est spécialisé ou a de l’expérience en tératologie pour évaluation et conseil.
Grossesse
Le thalidomide est contre-indiqué pendant la grossesse et chez les femmes en âge de procréer à moins que toutes les conditions du Programme de Prévention de la Grossesse ne soient remplies (voir rubrique 4.3).
Le thalidomide est un tératogène puissant, induisant une fréquence élevée (environ 30 %) d’anomalies congénitales graves, potentiellement létales telles que : ectromélie (amélie, phocomélie, hémimélie) des membres supérieurs et/ou inférieurs, microtie avec anomalie de l’orifice externe du conduit auditif (totale ou partielle), lésions de l’oreille moyenne et interne (moins fréquentes), lésions oculaires (anophtalmie, microphtalmie), cardiopathie congénitale, anomalies rénales. D’autres anomalies moins fréquentes ont été également décrites.
Allaitement
On ne sait pas si le thalidomide est excrété dans le lait maternel. Les études chez l’animal ont mis en évidence l’excrétion de thalidomide dans le lait maternel. Par conséquent, l’allaitement doit être interrompu pendant le traitement par le thalidomide.
Fertilité
Une étude sur les lapins n’a démontré aucun effet sur les indices de fertilité chez les mâles ou les femelles, bien qu’une dégénérescence des testicules ait été observée chez les mâles.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
THALIDOMIDE ACCORD à la posologie recommandée a une influence modérée sur l’aptitude à conduire des véhicules et à utiliser des machines. Le thalidomide peut entraîner de la fatigue (très fréquent), des étourdissements (très fréquent), une somnolence (très fréquent) et des troubles de la vision (fréquent) (voir rubrique 4.8). Il faut donc déconseiller aux patients la conduite de véhicules, l’utilisation de machines ou la réalisation de tâches dangereuses durant le traitement par le thalidomide s’ils ressentent des effets indésirables tels que de la fatigue, des vertiges, de la somnolence ou des troubles de la vision.
Résumé du profil de sécurité
La majorité des patients prenant du thalidomide sont susceptibles de présenter des effets indésirables.
Les effets indésirables les plus fréquemment observés chez les patients ayant reçu du thalidomide en association au melphalan et à la prednisone sont : neutropénie, leucopénie, constipation, somnolence, paresthésie, neuropathie périphérique, anémie, lymphopénie, thrombocytopénie, vertiges, dysesthésie, tremblements et oedème périphérique.
Outre les effets indésirables listés ci-dessus, on a observé dans d’autres études cliniques que l’association de thalidomide et de dexaméthasone peut être à l’origine d’effets indésirables très fréquents : fatigue ; fréquents : accident ischémique transitoire, syncope, vertiges, hypotension, troubles de l’humeur, anxiété, vision trouble, nausées et dyspepsie ; peu fréquents : accident vasculaire cérébral, perforation diverticulaire, péritonite, hypotension orthostatique et bronchite.
Les effets indésirables les plus graves observés chez les patients ayant reçu du thalidomide en association au melphalan et à la prednisone ou à la dexaméthasone sont : thrombose veineuse profonde et embolie pulmonaire, neuropathie périphérique, réactions cutanées sévères comprenant syndrome de Stevens-Johnson et nécrolyse épidermique toxique, syncope, bradycardie et vertiges (voir rubriques 4.2, 4.4 et 4.5).
Liste tabulée des effets indésirables
Le tableau 3 indique uniquement les effets indésirables pour lesquels une relation avec le médicament peut être raisonnablement établie. Ces effets indésirables ont été observés dans l’étude pivot et lors du suivi post commercialisation du médicament. Les fréquences indiquées sont basées sur des observations réalisées au cours d’une étude clinique comparative pivot portant sur l’effet du thalidomide en association au melphalan et à la prednisone chez des patients souffrant de myélome multiple traités pour la première fois.
Les fréquences sont définies comme suit : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque fréquence de groupe, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Tableau 3 : Effets indésirables du médicament signalés dans l’étude pivot du thalidomide administré en association au melphalan et à la prednisone et lors du suivi post commercialisation du médicament
|
Classe de systèmes d’organes |
Fréquence |
Effet indésirable |
|
Infections et infestations |
Fréquent |
Pneumonie |
|
Fréquence indéterminée |
Infections graves (p. ex. sepsis fatal, dont choc septique) †, Infections virales, dont zona et réactivation du virus de l’hépatite B † |
|
|
Tumeurs bénignes, malignes et non précisées (incl kystes et polypes) |
Fréquent |
Leucémie myéloïde aiguë*,^ |
|
Peu fréquent |
Syndrome myélodysplasique*,^ |
|
|
Fréquence indéterminée |
Syndrome de lyse tumorale† |
|
|
Affections hématologiques et du système lymphatique |
Très fréquent |
Neutropénie, leucopénie, anémie, lymphopénie, thrombocytopénie |
|
Fréquent |
Neutropénie fébrile†, pancytopénie† |
|
|
Affections du système immunitaire |
Fréquence indéterminée |
Réactions allergiques (hypersensibilité, angio-oedème, urticaire)† |
|
Affections endocriniennes |
Fréquence indéterminée |
Hypothyroïdie† |
|
Affections psychiatriques |
Fréquent |
État confusionnel, dépression |
|
Affections du système nerveux |
Très fréquent |
Neuropathie périphérique*, tremblements, sensation vertigineuse, paresthésie, dysesthésie, somnolence |
|
Fréquent |
Convulsions†, coordination anormale |
|
|
Fréquence indéterminée |
Syndrome d’encéphalopathie postérieure réversible (SEPR)*, †, aggravation des symptômes de la maladie de Parkinson† |
|
|
Affections de l’oreille et du labyrinthe |
Fréquent |
Détérioration de l’audition ou surdité† |
|
Affections cardiaques |
Fréquent |
Insuffisance cardiaque, bradycardie |
|
Peu fréquent |
Infarctus du myocarde†, fibrillation auriculaire†, bloc auriculoventriculaire† |
|
|
Affections vasculaires |
Fréquent |
Thrombose veineuse profonde* |
|
Affections respiratoires, thoraciques et médiastinales |
Fréquent |
Embolie pulmonaire*, pneumopathie interstitielle, bronchopneumopathie, dyspnée |
|
Fréquence indéterminée |
Hypertension pulmonaire† |
|
|
Affections gastro-intestinales |
Très fréquent |
Constipation |
|
Fréquent |
Vomissements, bouche sèche |
|
|
Peu fréquent |
Occlusion intestinale† |
|
|
Fréquence indéterminée |
Perforation gastro-intestinale†, pancréatite†, hémorragie gastro-intestinale† |
|
|
Affections hépatobiliaires |
Fréquence indéterminée |
Troubles hépatiques† |
|
Affections de la peau et du tissu sous-cutané |
Fréquent |
Toxidermie, éruption cutanée, sécheresse cutanée |
|
Fréquence indéterminée |
Syndrome de Stevens-Johnson*,†, nécrolyse épidermique toxique*,†, vascularite leucocytoclasique† |
|
|
Affections du rein et des voies urinaires |
Fréquent |
Insuffisance rénale† |
|
Affections des organes de reproduction et du sein |
Fréquence indéterminée |
Dysfonction sexuelle†, troubles menstruels, dont aménorrhée† |
|
Troubles généraux et anomalies au site d’administration |
Très fréquent |
Œdème périphérique |
|
Fréquent |
Pyrexie, asthénie, malaise |
* Voir rubrique 4.8 Description de certains effets indésirables
† Identifiés sur la base des données de pharmacovigilance après commercialisation
^ La Leucémie aiguë myéloïde et le Syndrome myélodysplasique ont été signalés dans une étude clinique chez des patients présentant un MM non préalablement traité recevant l’association de melphalan, prednisone et thalidomide (MPT)
Description de certains effets indésirables
Affections hématologiques et du système lymphatique
Les effets indésirables hématologiques sont présentés comparativement à ceux observés avec le comparateur, en raison des effets indésirables significatifs de celui-ci dans ces affections (Tableau 4).
Tableau 4 : Comparaison des affections hématologiques pour les associations melphalan-prednisone (MP) et melphalan-prednisone-thalidomide (MPT) dans l’étude IFM 99-06 (voir rubrique 5.1)
|
|
n (% de patients) |
|
|
|
MP (n=193) |
MPT (n=124) |
|
|
Grades 3 et 4* |
|
|
Neutropénie |
57 (29,5) |
53 (42,7) |
|
Leucopénie |
32 (16,6) |
32 (25,8) |
|
Anémie |
28 (14,5) |
17 (13,7) |
|
Lymphopénie |
14 (7,3) |
15 (12,1) |
|
Thrombocytopénie |
19 (9,8) |
14 (11,3) |
* Critères de l’OMS
Une neutropénie fébrile et une pancytopénie, non observées dans l’étude pivot, ont été rapportées comme effets indésirables supplémentaires lors du suivi post commercialisation du thalidomide.
Tératogénicité
Le risque de morts in utero ou d’anomalies congénitales graves, principalement la phocomélie, est extrêmement élevé. Le thalidomide ne doit en aucun cas être administré pendant la grossesse (voir rubriques 4.4 et 4.6).
Évènements thrombo-emboliques veineux et artériels
Un risque accru de thrombo-embolie veineuse (tels que thrombose veineuse profonde, embolie pulmonaire) et de thrombo-embolie artérielle (tels qu’infarctus du myocarde et accident vasculaire cérébral) a été décrit chez les patients recevant du thalidomide (voir rubrique 4.4).
Neuropathie périphérique
La neuropathie périphérique est un effet indésirable très fréquent, potentiellement grave, associé au traitement par le thalidomide, pouvant entraîner des lésions irréversibles (voir rubrique 4.4). La neuropathie périphérique se produit généralement à la suite d’une administration prolongée sur plusieurs mois. Toutefois, certains cas ont été observés après une utilisation de courte durée. La fréquence des évènements neuropathiques menant à l’arrêt, à la réduction ou à l’interruption de la dose augmente avec une dose cumulée et avec la durée du traitement. Les symptômes peuvent apparaître un certain temps après l’arrêt du traitement par le thalidomide. Ils peuvent disparaître lentement ou pas du tout.
Syndrome d’encéphalopathie postérieure réversible (SEPR)/syndrome de leucoencéphalopathie postérieure réversible (SLPR)
Des cas de SEPR/SLPR ont été rapportés. Les signes et symptômes étaient des troubles visuels, des céphalées, des convulsions et une altération de l’état mental, avec ou sans hypertension associée. Le diagnostic de SEPR/SLPR doit être confirmé par imagerie cérébrale. Dans la majorité des cas rapportés, les patients présentaient des facteurs de risque reconnus de SEPR/SLPR, notamment hypertension, insuffisance rénale et corticothérapie à dose élevée et/ou chimiothérapie concomitantes.
Leucémie aiguë myéloblastique (LAM) et syndromes myélodysplasiques (SMD)
Des cas de LAM et de SMD ont été rapportés dans une étude clinique chez des patients présentant un myélome multiple non préalablement traité recevant l’association de melphalan, prednisone et thalidomide (voir rubrique 4.4).
Réactions cutanées sévères
Des réactions cutanées sévères, dont le syndrome de Stevens-Johnson et la NET ont été signalées en association avec un traitement par thalidomide. Si l’on soupçonne la présence d’un syndrome de Stevens-Johnson ou d’une NET, le traitement par thalidomide ne doit pas être repris (voir rubrique 4.4).
Sujets âgés
Le profil des effets indésirables rapportés chez les patients âgés > 75 ans traités par le thalidomide 100 mg une fois par jour a été comparable à celui observé chez les patients âgés ≤ 75 ans traités par le thalidomide 200 mg une fois par jour (voir tableau 3). Toutefois la fréquence de survenue des effets indésirables graves est plus élevée chez les patients âgés > 75 ans.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Dix-huit cas de surdosage ont été signalés dans la littérature concernant des doses allant jusqu’à 14,4 grammes. Dans treize de ces cas, les patients avaient pris du thalidomide seul ; les quantités allaient de 350 mg à 4000 mg. Ces patients ne présentaient pas de symptômes ou présentaient des symptômes tels que somnolence, irritabilité, malaise et/ou céphalées. Chez un enfant de 2 ans ayant pris 700 mg, on a observé une réponse plantaire anormale associée à de la somnolence et de l’irritabilité. Aucun décès n’a été signalé et aucun cas de surdosage n’a été à l’origine de séquelles. Il n’existe aucun antidote spécifique en cas de surdosage au thalidomide. En cas de surdosage, les signes vitaux du patient doivent être surveillés et un traitement symptomatique approprié doit être prodigué pour maintenir une pression artérielle et un état respiratoire normaux.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Immunosuppresseurs, autres immunosuppresseurs, Code ATC : L04AX02.
Le thalidomide est une molécule chirale. C’est le racémate (+)-(R)- et (-)-(S)-thalidomide qui est utilisé. Le spectre d’activité du thalidomide n’est pas entièrement caractérisé.
Mécanisme d’action
Le thalidomide présente des propriétés anti-inflammatoires, immunomodulatrices et potentiellement antitumorales. Les essais in vitro et les études cliniques suggèrent que les effets immunomodulateurs, anti-inflammatoires et antitumoraux du thalidomide sont liés à l’inhibition de la production excessive de TNF-α (Tumor Necrosis Factor-alpha), à une intervention sur les molécules de surface impliquées dans la migration des leucocytes et à une activité antiangiogénique. Le thalidomide possède également des propriétés hypnotiques et sédatives d’origine centrale, différentes de celles des barbituriques. Il n’a aucun effet antibactérien.
Efficacité et sécurité cliniques
Les résultats de l’étude multicentrique, en groupes parallèles, ouverte et randomisée de phase 3 IFM 99-06 ont fait apparaître un gain de survie quand le thalidomide est utilisé en association au melphalan et à la prednisone pendant 12 cycles de 6 semaines pour le traitement du myélome multiple de novo. Dans cette étude, les patients étaient âgés de 65 à 75 ans, avec 41 % (183/447) des patients âgés de 70 ans ou plus. La dose médiane de thalidomide était de 217 mg et > 40 % des patients ont reçu 9 cycles. Le melphalan et la prednisone ont été administrés à une dose de respectivement 0,25 mg/kg/jour et 2 mg/kg/jour les jours 1 à 4 de chaque cycle de 6 semaines.
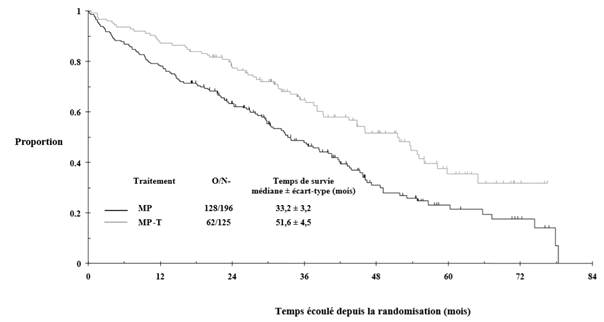
Suite à l’analyse per protocole, une actualisation a été réalisée pour l’étude IFM 99-06, fournissant des données de suivi supplémentaires de 15 mois. La survie globale médiane était de 51,6 ± 4,5 et 33,2 ± 3,2 mois dans les groupes MPT et MP, respectivement (IC à 97,5 % 0,42 à 0,84). Cette différence de 18 mois était statistiquement significative, avec un hazard ratio de réduction du risque de décès dans le groupe MPT de 0,59, intervalle de confiance à 97,5 % de 0,42-0,84 et valeur p de < 0,001 (voir Figure 1).
Figure 1 : Taux de survie globale selon le traitement

Population pédiatrique
L’Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec le thalidomide dans tous les sous-groupes de la population pédiatrique dans l’indication du myélome multiple (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).
5.2. Propriétés pharmacocinétiques
L’absorption du thalidomide est lente après administration par voie orale. Les concentrations plasmatiques maximales sont atteintes entre 1 et 5 heures après l’administration. L’ingestion concomitante d’aliments retarde l’absorption mais n’a pas d’incidence sur le niveau d’absorption.
Distribution
Le taux de liaison avec les protéines plasmatiques des énantiomères (+)-(R) et (-)-(S) est respectivement de 55 % et 65 %. Le thalidomide est présent dans le sperme à des niveaux similaires aux concentrations plasmatiques (voir rubrique 4.4). L’âge, le sexe, la fonction rénale et les paramètres biologiques cliniques n’ont pas d’effet significatif sur la distribution du thalidomide.
Biotransformation
Le thalidomide est métabolisé presque exclusivement par hydrolyse non enzymatique. Dans le plasma, le thalidomide sous forme inchangée représente 80 % des composants en circulation. Le thalidomide sous forme inchangée est un composant mineur (moins de 3 % de la dose) dans les urines. En plus du thalidomide, les produits hydrolytiques N-(o-carboxybenzoyle) glutarimide et phthaloyl-isoglutamine, issus de processus non enzymatiques, sont également retrouvés dans le plasma et en majorité dans les urines. Le métabolisme oxydatif ne contribue pas de façon significative au métabolisme global du thalidomide. Le thalidomide subit une métabolisation hépatique limitée, catalysée par le cytochrome P450. Des données in vitro indiquent que la prednisone peut donner lieu à une induction enzymatique susceptible de réduire l’exposition systémique des médicaments pris en concomitance. La pertinence in vivo de ces observations n’est pas connue.
Élimination
La demi-vie d’élimination moyenne du thalidomide dans le plasma après des doses uniques comprises entre 50 et 400 mg administrées par voie orale était de 5,5 à 7,3 heures. Après administration d’une dose orale unique de 400 mg de thalidomide radiomarqué, la récupération moyenne totale, au jour 8, a été de 93,6 % de la dose administrée. La majorité de la dose radioactive a été excrétée dans les 48 heures suivant l’administration. La voie rénale a été la voie principale d’élimination (plus de 90 %), tandis que l’excrétion fécale a été mineure.
Il existe une relation linéaire entre le poids et la clairance estimée du thalidomide. Chez des patients atteints d’un myélome multiple pesant de 47 à 133 kg, la clairance du thalidomide a été d’environ 6 à 12 l/h, ce qui représente une augmentation de la clairance de 0,621 l/h pour chaque augmentation du poids de 10 kg.
Linéarité/non-linéarité
L’exposition systémique totale (ASC) est proportionnelle à la dose pour des doses uniques. La pharmacocinétique ne dépend pas du facteur temps.
Insuffisance rénale et hépatique
Le métabolisme du thalidomide par le système du cytochrome P450 est minime et le thalidomide sous forme inchangée n’est pas éliminé par voie rénale. Les mesures de la fonction rénale (ClCr) et de la fonction hépatique (paramètres sanguins) indiquent un effet minime de ces fonctions sur la pharmacocinétique du thalidomide. De ce fait, le métabolisme du thalidomide n’est pas susceptible d’être modifié en cas d’insuffisance hépatique ou rénale. Les données chez des patients atteints d’insuffisance rénale terminale semblent indiquer l’absence d’effet de la fonction rénale sur la pharmacocinétique du thalidomide.
5.3. Données de sécurité préclinique
Une diminution du nombre de plaquettes a été observée dans les études menées sur la souris et le rat. Cette diminution semble être liée au thalidomide et a été observée à des expositions supérieures à 2,4 fois l’exposition humaine. Cette diminution n’a pas induit de signes cliniques.
Dans une étude d’un an menée sur des chiens, on a observé une hypertrophie et/ou une coloration bleuâtre des glandes mammaires et un cycle œstral prolongé chez les femelles soumises à des expositions de respectivement 1,8 fois l’exposition humaine ou supérieures à 3,6 fois l’exposition humaine. La pertinence pour les êtres humains est inconnue.
L’effet du thalidomide sur la fonction thyroïdienne a été évalué chez des rats et des chiens. Aucun effet n’a été observé chez les chiens. Toutefois, une baisse apparente liée à la dose des taux de T4 libre et totale a été observée chez les rats, plus particulièrement chez les femelles.
Aucun effet mutagène ni génotoxique n’a été mis en évidence lors des essais de génotoxicité menés sur le thalidomide. Aucune preuve de cancérogénicité n’a été observée après une exposition d’environ 15, 13 et 39 fois la dose de départ recommandée chez les souris, les rats mâles et les rats femelles respectivement.
L’effet tératogène du thalidomide chez l’animal dépend des espèces. Le thalidomide est tératogène chez l’homme.
Une étude sur les lapins n’a démontré aucun effet sur les indices de fertilité chez les mâles ou les femelles, bien qu’une dégénérescence des testicules ait été observée chez les mâles.
Une étude péri- et postnatale menée sur les lapins et évaluant le thalidomide administré à des doses allant jusqu’à 500 mg/kg/jour a provoqué des avortements, une augmentation du nombre de mort nés et une baisse de viabilité de la descendance pendant l’allaitement. Chez les lapins dont la mère a reçu du thalidomide, on a observé une hausse de la fréquence des avortements, un ralentissement de la prise de poids, des troubles d’apprentissage et de mémoire, une baisse de fertilité et une baisse d’indice de gestation.
Isomalt (E953), croscarmellose sodique, fumarate de stéaryle sodique
Enveloppe des gélules :
Gélatine, dioxyde de titane (E171).
2 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 30°C.
6.5. Nature et contenu de l'emballage extérieur
Plaquettes (PVC/PCTFE/Aluminium) contenant 14 gélules. Les gélules sont conditionnées dans des étuis « portefeuille » contenant 28 gélules (2 plaquettes).
Plaquettes prédécoupées unitaires (PVC/PCTFE/Aluminium) contenant 1x7 gélules. Les gélules sont conditionnées dans des boîtes en carton contenant 1x28 gélules (4 plaquettes).
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Les gélules ne doivent pas être ouvertes ou écrasées. Si de la poudre de thalidomide entre en contact avec la peau, laver immédiatement et abondamment la peau au savon et à l’eau. En cas de contact avec les muqueuses, rincer abondamment à l’eau.
Retourner toutes les gélules non utilisées au pharmacien à la fin du traitement.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
45 RUE DU FAUBOURG DE ROUBAIX
59000 LILLE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 550 696 4 5 : 14 gélules sous plaquettes (PVC/PCTFE/Aluminium). Boîte de 2 plaquettes.
· 34009 550 696 5 2 : 7 gélules sous plaquettes prédécoupées unitaires (PVC/PCTFE/Aluminium). Boîte de 4 plaquettes.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Médicament soumis à prescription hospitalière.
Prescription réservée aux spécialistes en oncologie ou en hématologie, ou aux médecins compétents en cancérologie ou en maladies du sang.
Médicament nécessitant une surveillance particulière pendant le traitement :
· Pour tous les patients :
o la première prescription nécessite le recueil de l'accord de soins, la remise d'un carnet patient et d'une fiche de renseignement complétés ;
o la première délivrance doit être accompagnée de l'envoi immédiat au laboratoire de la fiche de recueil d'informations complétée.
· Pour les femmes susceptibles de procréer :
o la prescription est limitée à 1 mois de traitement ; elle est subordonnée à l'obtention d'un résultat négatif de test de grossesse, qui doit être réalisé tous les mois, dans les 3 jours précédant la prescription ; la date et le résultat du test de grossesse doivent être mentionnés dans le carnet patient ;
o la délivrance doit être effectuée au plus tard 7 jours après la prescription et après avoir vérifié la date et le résultat du test de grossesse ; la date de délivrance doit être mentionnée dans le carnet patient.
o après la première délivrance, les délivrances suivantes doivent être accompagnées de l'envoi immédiat au laboratoire d’une copie du carnet patient complété en ce qui concerne la date et le résultat du test de grossesse mensuel.