RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 08/01/2020
1. DENOMINATION DU MEDICAMENT
VARILRIX, poudre et solvant pour solution injectable
Vaccin varicelleux vivant
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Après reconstitution, une dose (0,5 ml) contient :
Virus de la varicelle* souche OKA (vivant atténué) au minimun 103.3 UFP**
* Produit sur cellules diploïdes humaines (MRC-5).
** UFP = unité formant plages.
Excipient à effet notoire : Ce vaccin contient 6 mg de sorbitol, voir rubrique 4.4.
Ce vaccin contient des traces de néomycine. Voir rubrique 4.3.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre et solvant pour solution injectable.
Poudre de couleur légèrement crème à légèrement jaune ou rosé.
Solvant limpide et incolore.
4. DONNEES CLINIQUES
4.1. Indications thérapeutiques
VARILRIX est indiqué chez les sujets à partir de 12 mois pour la prévention de la varicelle.
VARILRIX peut aussi être administré aux sujets « réceptifs » exposés à la varicelle. Une vaccination dans les 3 jours suivant l’exposition à un patient avec éruption peut réduire le risque de complications liées à la varicelle.
VARILRIX doit être utilisé selon les recommandations officielles applicables.
4.2. Posologie et mode d'administration
Posologie
Les sujets à partir de 12 mois doivent recevoir deux doses de VARILRIX pour une protection optimale contre la varicelle (voir rubrique 5.1). Il est préférable d’administrer la seconde dose au moins 6 semaines après la première dose mais en aucun cas avant 4 semaines.
Interchangeabilité
Une dose unique de VARILRIX peut être administrée chez les sujets ayant reçu une première dose d’un autre vaccin varicelleux. De même, une dose de VARILRIX peut être complétée par l’administration d’une dose d’un autre vaccin varicelleux.
Mode d’administration
Le vaccin doit être injecté par voie sous-cutanée, de préférence dans la région deltoïdienne.
Pour les instructions concernant la reconstitution du vaccin avant administration, voir la rubrique 6.6.
4.3. Contre-indications
VARILRIX ne doit pas être administré à des sujets ayant une hypersensibilité connue à la néomycine ou à tout autre constituant du vaccin mentionné à la rubrique 6.1. Un antécédent de dermatite de contact à la néomycine n’est pas une contre-indication.
VARILRIX est contre-indiqué chez les sujets ayant présenté des signes d’hypersensibilité après une précédente administration du vaccin varicelleux.
VARILRIX est contre-indiqué chez les patients ayant :
Un traitement immunosuppresseur (y compris de fortes doses de corticostéroïdes).
Déficit sévère de l'immunité humorale ou cellulaire (primaire ou acquis), par exemple déficit immunitaire combiné sévère, agammaglobulinémie et SIDA, ou infection symptomatique due au VIH ou avec un taux âge-dépendant de lymphocytes T CD4+ chez les enfants de moins de 12 mois : CD4 + < 25% ; enfants de 12 à 35 mois : CD4 + < 20% ; enfants de 36 à 59 mois : CD4 + < 15% (voir rubrique 4.4).
Grossesse. De plus, une grossesse doit être évitée dans le mois suivant la vaccination (voir rubriques 4.4 et 4.6).
Comme pour les autres vaccins, l’administration de VARILRIX doit être différée chez les sujets atteints d’infections fébriles sévères aiguës. La présence d’une infection bénigne n’est pas une contre-indication.
4.4. Mises en garde spéciales et précautions d'emploi
Comme pour tous les vaccins injectables, dans la mesure où de rares cas de réactions anaphylactiques peuvent survenir, il est recommandé de disposer d’un traitement médical approprié et d’effectuer une surveillance.
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, comme réaction psychogène à l’injection avec une aiguille. Ceci peut s’accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d’éviter des blessures en cas d’évanouissement.
Attendre l’évaporation de l’alcool ou d’autres agents désinfectants appliqués sur la peau avant toute injection du vaccin, car ils peuvent inactiver les virus atténués du vaccin.
Les personnes vaccinées doivent éviter l’utilisation de salicylés dans les 6 semaines suivant la vaccination (voir rubrique 4.5).
Comme pour tout vaccin, une réponse immunitaire protectrice peut ne pas être obtenue chez tous les sujets vaccinés.
Comme avec d’autres vaccins varicelleux, des cas de varicelle peuvent survenir chez des sujets antérieurement vaccinés par VARILRIX. Ces varicelles sont habituellement peu sévères, avec un nombre plus faible de lésions et une fièvre moins importante comparées à celles observées chez les sujets non vaccinés.
Très rarement, la transmission du virus vaccinal OKA peut survenir dans l’entourage non immunisé du sujet vacciné présentant une éruption cutanée. Il ne peut être exclu qu’un sujet vacciné qui ne développe pas d’éruptions cutanées soit à l’origine de la transmission du virus vaccinal OKA dans l’entourage non-immunisé.
Patients immunodéprimés
La vaccination peut être envisagée chez les patients présentant certains déficits immunitaires chez qui les bénéfices attendus sont supérieurs aux risques (par exemple sujets infectés par le VIH asymptomatiques, déficits en sous-classe d'IgG, neutropénie congénitale, maladie granulomateuse chronique, déficits en complément).
Les patients immunodéprimés ne présentant pas de contre-indication à cette vaccination (voir rubrique 4.3) peuvent ne pas répondre aussi bien que les sujets immunocompétents, par conséquent, certains de ces patients peuvent contracter la varicelle en cas de contact, malgré l'administration appropriée du vaccin. Ces patients doivent être attentivement surveillés, afin de détecter tout signe de varicelle.
Quelques rares cas de varicelle disséminée avec atteinte des organes internes suite à la vaccination avec un virus vaccinal OKA existent, principalement chez les sujets immunodéprimés.
Ce médicament contient du sorbitol. Son utilisation est déconseillée chez les patients présentant une intolérance au fructose (maladie héréditaire rare).
VARILRIX ne doit pas être administré par voie intravasculaire ou par voie intradermique.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Si un test tuberculinique doit être fait, il est préférable de l’effectuer avant ou en même temps que la vaccination, car les vaccins à virus vivants peuvent entraîner une diminution temporaire de la sensibilité cutanée à la tuberculine. Etant donné que cette anergie peut durer au maximum 6 semaines, le test tuberculinique ne doit pas être réalisé pendant cette période post-vaccinale afin d’éviter les résultats faussement négatifs.
Chez les sujets ayant reçu des immunoglobulines ou une transfusion sanguine, la vaccination devra être repoussée d’au moins 3 mois, en raison du risque d’échec vaccinal dû aux anticorps dirigés contre la varicelle, acquis de façon passive.
La prise de salicylés doit être évitée dans les 6 semaines suivant la vaccination par VARILRIX, un syndrome de Reye ayant été rapporté suite à la prise de salicylés lors d’une varicelle naturelle.
VARILRIX peut être administré en même temps que d’autres vaccins, si les sites d’injection sont différents.
Si le vaccin combiné rougeole-oreillon et/ou rubéole n’est pas administré en même temps que VARILRIX, un intervalle d’au moins un mois doit être respecté entre les deux injections.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les femmes enceintes ne doivent pas être vaccinées avec VARILRIX.
Toutefois, aucun effet délétère sur le fœtus n'a été documenté après l'administration chez la femme enceinte de vaccins contre la varicelle.
Toute grossesse doit être évitée dans le mois suivant la vaccination. Il convient de conseiller aux femmes ayant l’intention de débuter une grossesse de différer leur projet.
Allaitement
En raison du risque théorique de transmission de la souche virale du vaccin de la mère à l’enfant, VARILRIX n’est généralement pas recommandé pour les femmes qui allaitent (voir aussi rubrique 4.4). La vaccination des femmes exposées n’ayant pas d’antécédent de varicelle ou connues pour être séronégatives devra être évaluée au cas par cas.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Sans objet.
4.8. Effets indésirables
Les effets indésirables rapportés lors des essais cliniques sont listés à la fréquence définie comme :
Très fréquent (≥ 1/10),
Fréquent (de ≥ 1/100 à < 1/10),
Peu fréquent (de ≥ 1/1000 à < 1/100),
Rare (de ≥ 1/10000 à < 1/1000),
Très rare (< 1/10000).
Données issues des essais cliniques
Le profil de tolérance présenté ci-dessous est basé sur un total de 5369 doses de VARILRIX administrées seules à des enfants, adolescents et adultes.
|
Système Organe-Classe
|
Fréquence
|
Effets indésirables
|
|
Infections et infestations
|
Peu fréquent
|
Infection des voies respiratoires supérieures, pharyngite
|
|
Affections hématologiques et du système lymphatique
|
Peu fréquent
|
Lymphadénopathie
|
|
Affections psychiatriques
|
Peu fréquent
|
Irritabilité
|
|
Affections du système nerveux
|
Peu fréquent
|
Céphalées, somnolence
|
|
Affections oculaires
|
Rare
|
Conjonctivite
|
|
Affections respiratoires, thoraciques et médiastinales
|
Peu fréquent
|
Toux, rhinite
|
|
Affections gastro-intestinales
|
Peu fréquent
|
Nausées, vomissements
|
|
Rare
|
Douleur abdominale, diarrhée
|
|
Affections de la peau et du tissu sous-cutané
|
Fréquent
|
Eruption cutanée
|
|
Peu fréquent
|
Eruption de type varicelle, prurit
|
|
Rare
|
Urticaire
|
|
Affections musculo-squelettiques et systémiques
|
Peu fréquent
|
Arthralgie, myalgie
|
|
Troubles généraux et anomalies au site d’administration
|
Très fréquent
|
Douleur, rougeur
|
|
Fréquent
|
Gonflement au site d’injection*, fièvre (température orale/axillaire ≥ 37,5°C ou température rectale ≥ 38,0°C)*
|
|
Peu fréquent
|
Fièvre (température orale/axillaire > 39,0°C ou température rectale > 39,5°C), fatigue, malaise
|
*Un gonflement au site d’injection accompagné de fièvre a été très fréquemment rapporté lors d’essais cliniques chez les adolescents et les adultes. Le gonflement a aussi été rapporté très fréquemment après la deuxième dose chez les enfants de moins de 13 ans.
Une tendance à une incidence plus élevée de la douleur, de la rougeur et du gonflement a été observée après la seconde dose comparée à la première dose.
Aucune différence de tolérance n'a été observée entre les sujets initialement séropositifs et les sujets initialement séronégatifs.
Données de surveillance post-commercialisation
Durant la surveillance post-commercialisation, les effets indésirables supplémentaires suivants ont été rapportés après la vaccination contre la varicelle :
|
Système Organe-Classe
|
Fréquence
|
Effets indésirables
|
|
Infections et infestations
|
Rare
|
Zona
|
|
Affections hématologiques et du système lymphatique
|
Rare
|
Thrombocytopénie
|
|
Affections du système immunitaire
|
Rare
|
Hypersensibilité, réactions anaphylactiques
|
|
Affections du système nerveux
|
Rare
|
Encéphalite, accident vasculaire cérébral, cérébellite, syndrome cérébelleux (incluant une perturbation transitoire de la marche et une ataxie transitoire), convulsions
|
|
Affections vasculaires
|
Rare
|
Vascularite (incluant le purpura de Henoch-Schönlein et le syndrome de Kawasaki)
|
|
Affections de la peau et du tissu sous-cutané
|
Rare
|
Erythème polymorphe
|
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
4.9. Surdosage
Le très faible nombre de cas rapportés d’administration accidentelle d’une dose de VARILRIX supérieure à la dose recommandée ne permet pas d’évaluer le profil de tolérance de VARILRIX dans ces conditions.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : vaccins viraux, code ATC : J07BK01
Efficacité et sécurité clinique
L’efficacité du vaccin monovalent Oka (VARILRIX) et du vaccin Priorix-Tetra dans la prévention de la varicelle confirmée (par Polymerase Chain Reaction (PCR) ou suite à l’exposition à un cas de varicelle) a été évaluée dans un large essai clinique randomisé international utilisant le vaccin combiné rougeole - oreillons - rubéole de GSK (Priorix) comme témoin actif. Cet essai a été conduit dans des pays Européens où la vaccination généralisée contre la varicelle n’est pas recommandée. Les enfants âgés de 12 à 22 mois ont reçu deux doses de Priorix-Tetra (Oka) à six semaines d’intervalle ou une dose de VARILRIX. L’efficacité d’une dose de VARILRIX contre une varicelle confirmée modérée ou sévère a été montrée après une première période de suivi de 2 ans (durée médiane de 3,2 ans) et une persistance de l’efficacité a été observée à partir de la même étude après des périodes de suivi à long terme de 6 ans (durée médiane de 6,4 ans) et 10 ans (durée médiane 9,8 ans). Les données sont présentées dans le tableau ci-dessous.
|
Groupe
|
Période de suivi
|
Efficacité contre une varicelle confirmée, quelle que soit la sévérité
|
Efficacité contre une varicelle confirmée modérée ou sévère
|
|
Varilrix
(1 dose)
N = 2 487
|
Suivi à 2 ans
|
65,4%
(97,5% IC: 57,2;72,1)
|
90,7%
(97,5% IC: 85,9;93,9)
|
|
Suivi à 6 ans(1)
|
67,0%
(95% IC: 61,8;71,4)
|
90,3%
(95% IC: 86,9;92,8)
|
|
Suivi à
10 ans(1)
|
67.2%
(95% IC: 62.3;71.5)
|
89.5%
(95% IC: 86.1;92.1)
|
|
Vaccin combiné rougeole - oreillons – rubéole – varicelle (Oka) (2 doses)
N = 2 489
|
Suivi à 2 ans
|
94,9%
(97,5% IC: 92,4;96,6)
|
99,5%
(97,5% IC : 97,5 ;99,9)
|
|
Suivi à 6 ans(1)
|
95,0%
(95% IC: 93,6;96,2)
|
99,0%
(95% IC: 97,7;99,6)
|
|
Suivi à
10 ans(1)
|
95.4%
(95% IC: 94.0;96.4)
|
99.1%
(95% IC: 97.9;99.6)
|
N = nombre de sujets recrutés et vaccinés
(1) analyse descriptive
Efficacité sur le terrain
Les données d’efficacité suggèrent un niveau de protection plus élevé et une diminution des cas de varicelle chez les sujets antérieurement vaccinés avec deux doses de vaccin contenant la varicelle comparées à ceux vaccinés avec une dose.
L'efficacité d'une dose de Varilrix a été estimée dans des contextes différents (épidémies, études cas-témoins et de base de données) et variait de 20% à 92% contre toutes formes de varicelle et de 86% à 100% contre la forme modérée ou sévère.
Réponse immunitaire
Chez les sujets non immunisés, VARILRIX entraîne une varicelle atténuée cliniquement inapparente.
Il est accepté que la présence d’anticorps témoigne d’une protection.
Chez les enfants âgés de 11 à 21 mois, le taux de séroconversion mesuré par ELISA (méthode immuno-enzymatique) (50 mUI/ml) était de 89,6% six semaines après l’administration d’une première dose de vaccin et de 100% après l’administration d’une seconde dose de ce vaccin.
Chez les enfants âgés de 9 mois jusqu’à 12 ans, le taux de séroconversion, mesuré par immunofluorescence indirecte (IFA), était supérieur à 98 %, six semaines après une première dose de vaccin.
Chez les enfants âgés de 9 mois à 6 ans, le taux de séroconversion mesuré par IFA était de 100 %, six semaines après une seconde dose de vaccin. Une augmentation importante des titres en anticorps (GMT) a été observée suite à l’administration de la seconde dose (augmentation des GMT de 5 à 26 fois par rapport à la première dose).
A partir de 13 ans, le taux de séroconversion mesuré par IFA était de 100 %, six semaines après la seconde dose. Un an après la vaccination, tous les sujets testés étaient toujours séropositifs.
Dans des essais cliniques, la majorité des sujets vaccinés exposés à des virus sauvages étaient soit complètement protégés contre la varicelle, soit développaient une forme plus légère de la maladie (nombre réduit de vésicules, absence de fièvre).
5.2. Propriétés pharmacocinétiques
Sans objet.
5.3. Données de sécurité préclinique
Sans objet.
6. DONNEES PHARMACEUTIQUES
6.1. Liste des excipients
Poudre : lactose, sorbitol, mannitol, acides aminés.
Solvant : eau pour préparations injectables.
6.2. Incompatibilités
Ce vaccin ne doit pas être mélangé avec d’autres vaccins dans la même seringue.
6.3. Durée de conservation
2 ans lorsqu’il est conservé entre +2°C et +8°C. Après reconstitution le vaccin doit être utilisé immédiatement. Cependant, il a été démontré que le vaccin reconstitué peut être conservé jusqu’à 90 minutes à température ambiante (environ 25°C) et jusqu’à 8 heures au réfrigérateur (entre 2°C et 8°C).
6.4. Précautions particulières de conservation
A conserver au réfrigérateur (entre 2°C et 8°C).
Pour les conditions de conservation du médicament après reconstitution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Poudre en flacon (verre, type I) muni d’un bouchon (bromobutyl) et recouvert d’une capsule flip-off (aluminium) + solvant en seringue préremplie (verre type I) munie d’un bouchon piston (bromobutyl) avec ou sans aiguille(s). Boîte de 1.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
En raison de variations mineures de pH, la couleur du vaccin reconstitué peut varier de pêche claire à rose sans détérioration de l’activité du vaccin.
Le solvant et le vaccin reconstitué doivent être inspectés visuellement pour mettre en évidence la présence de particules étrangères et/ou tout changement de l’aspect physique avant reconstitution ou administration. Dans l’un et/ou l’autre de ces cas, n’utilisez pas le solvant ou le vaccin reconstitué.
Instructions pour la reconstitution du vaccin
Les contacts avec les désinfectants doivent être évités.
VARILRIX doit être reconstitué en ajoutant la totalité du contenu en solvant de la seringue préremplie au flacon contenant la poudre.
Pour fixer l’aiguille à la seringue, lire attentivement les instructions illustrées par les images 1 et 2. Cependant, la seringue fournie avec VARILRIX peut être légèrement différente de la seringue de l’illustration.
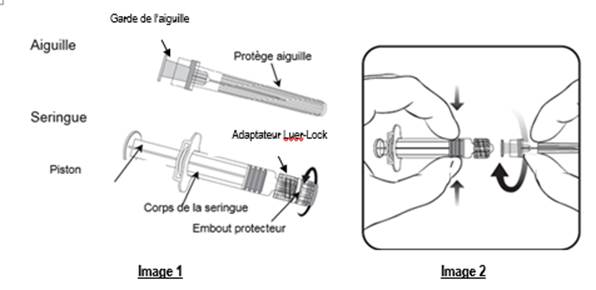 Toujours tenir la seringue par le corps, et non par le piston ou l’adaptateur Luer-Lock (LLA), et maintenir l’aiguille dans l’axe de la seringue (comme illustré dans l’image 2). Si vous ne respectez pas ces consignes, le LLA risque de se déformer et d’occasionner une fuite.
Toujours tenir la seringue par le corps, et non par le piston ou l’adaptateur Luer-Lock (LLA), et maintenir l’aiguille dans l’axe de la seringue (comme illustré dans l’image 2). Si vous ne respectez pas ces consignes, le LLA risque de se déformer et d’occasionner une fuite.
Lors de l’assemblage de la seringue, si le LLA se détache, une nouvelle dose de vaccin (nouvelle seringue et nouveau flacon) doit être utilisée.
1. Dévisser l’embout protecteur de la seringue en le tournant dans le sens inverse des aiguilles d’une montre (comme illustré dans l’image 1).
2. Veuillez suivre les étapes ci-dessous, que le LLA tourne ou pas autour de l’axe de la seringue :Fixer l’aiguille sur la seringue en connectant doucement la garde de l’aiguille sur le LLA et tourner d’un quart de tour dans le sens des aiguilles d’une montre jusqu’à sentir un blocage (comme illustré dans l’image 2).
3. Retirer le protège aiguille, ce qui peut être difficile.
4. Ajouter le solvant à la poudre. Le mélange doit être bien agité, jusqu’à ce que la poudre soit complètement dissoute dans le solvant.
Après reconstitution, le vaccin doit être utilisé rapidement.
5. Prélever la totalité du contenu du flacon.
6. Une nouvelle aiguille doit être utilisée pour administrer le vaccin. Dévisser l’aiguille du corps de la seringue et fixer l’aiguille d’injection en répétant l’étape 2 ci-dessus.
Avant l’injection, attendre l’évaporation de l’alcool ou autres agents utilisés pour la désinfection de la peau, car ils pourraient inactiver les virus atténués du vaccin.
Injecter la totalité du contenu du flacon.
Injecter le vaccin par voie sous cutanée.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
LABORATOIRE GLAXOSMITHKLINE
23 RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
FRANCE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
34009 362 772 2 9 : Poudre en flacon (verre, type I) muni d’un bouchon (bromobutyl) et recouvert d’une capsule flip-off (aluminium) + solvant en seringue préremplie (verre type I) munie d’un bouchon piston (bromobutyl) + 2 aiguilles. Boîte de 1.
34009 301 283 8 1 : Poudre en flacon (verre, type I) muni d’un bouchon (bromobutyl) et recouvert d’une capsule flip-off (aluminium) + solvant en seringue préremplie (verre type I) munie d’un bouchon piston (bromobutyl) sans aiguille. Boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
11. DOSIMETRIE
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Médicament non soumis à prescription médicale.
 Toujours tenir la seringue par le corps, et non par le piston ou l’adaptateur Luer-Lock (LLA), et maintenir l’aiguille dans l’axe de la seringue (comme illustré dans l’image 2). Si vous ne respectez pas ces consignes, le LLA risque de se déformer et d’occasionner une fuite.
Toujours tenir la seringue par le corps, et non par le piston ou l’adaptateur Luer-Lock (LLA), et maintenir l’aiguille dans l’axe de la seringue (comme illustré dans l’image 2). Si vous ne respectez pas ces consignes, le LLA risque de se déformer et d’occasionner une fuite.