RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 24/01/2020
1. DENOMINATION DU MEDICAMENT
TROPHICREME 0,1 POUR CENT, crème vaginale
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Estriol..................................................................................................................................... 0,1 g
Pour 100 g.
Excipient à effet notoire : acide sorbique.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Crème vaginale.
4. DONNEES CLINIQUES
4.1. Indications thérapeutiques
Traitement des symptômes d’atrophie vaginale due à une déficience en oestrogènes chez les femmes ménopausées.
4.2. Posologie et mode d'administration
Posologie
Pour l’instauration et la poursuite du traitement des symptômes post ménopausiques, la dose efficace la plus faible pendant la durée la plus courte (voir rubrique 4.4) doit être utilisée.
Pendant la première semaine de traitement, 1 fois par jour : une application vaginale, à introduire profondément à l'aide de l'applicateur doseur, de 1 g de crème (jusqu'à la marque « 1 g ») et une application en couche mince de cette crème sur la vulve.
Puis, jusqu'à régression des symptômes (en moyenne au bout de 3 semaines) : une application tous les deux jours.
La posologie doit être adaptée en fonction de l'amélioration obtenue ; des cures d'entretien peuvent être nécessaires.
Pour les produits à base d’œstrogènes pour application vaginale dont l’exposition systémique à l’œstrogène reste dans les valeurs normales de la ménopause, il n’est pas recommandé d’ajouter un progestatif (voir rubrique 4.4).
Mode d’administration
Ce médicament s'administre par voie vaginale, en application à l'aide d'un applicateur doseur strictement réservé à l'administration de TROPHICRÈME 0,1 POUR CENT, crème vaginale.
· Nettoyage de l'applicateur doseur avant la 1ère utilisation :
o Retirez complètement le piston rose de la canule.
o Lavez soigneusement les deux éléments à l'eau savonneuse. Ne pas utiliser de détergent.
o Rincez abondamment les 2 éléments à l'eau chaude jusqu'à nettoyage complet.
o Après séchage, replacez le piston à l'intérieur de la canule.
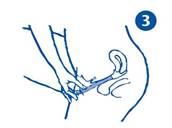
· Pour une bonne application, veuillez suivre les indications suivantes :
|
|
1. Fixez l’applicateur doseur sur le tube en le vissant à fond (schéma 1).
2. Maintenir l’ensemble verticalement (tube en bas). Appuyez doucement sur le tube jusqu’à remplissage de l’applicateur doseur au niveau de la marque 1 g, le piston rose se déplacera automatiquement jusqu’à la butée (schéma 2). L’applicateur doseur contient alors la quantité de crème nécessaire (1 g).
3. Une fois rempli, dévissez l’applicateur doseur. Glissez-le dans le vagin en prenant une position accroupie (schéma 3), pour faciliter une introduction aussi profonde que possible. Appuyer doucement sur le piston rose pour que la crème se dépose uniformément puis retirer l’applicateur doseur.
|
|
|
|
|
|
|
|
|
· Après l'application :
o Retirez complètement le piston rose de la canule.
o Lavez soigneusement les deux éléments à l'eau savonneuse. Ne pas utiliser de détergent.
o Rincez abondamment les 2 éléments à l'eau chaude jusqu'à nettoyage complet.
o Après séchage, replacez le piston à l'intérieur de la canule.
o Rangez ensuite le tube bien fermé avec son bouchon et l'applicateur doseur dans leur boîte.
4.3. Contre-indications
Ce médicament est contre-indiqué dans les situations suivantes :
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1,
· Cancer du sein connu ou suspecté ou antécédents de cancer du sein,
· Tumeurs malignes dépendantes des œstrogènes connues ou suspectées (par exemple : cancer endométrial),
· Hyperplasie de l’endomètre non traitée,
· Métrorragies d'origine non diagnostiquée,
· Antécédent d'accident thrombo-embolique veineux ou accident thrombo-embolique veineux en évolution (thrombose veineuse profonde, embolie pulmonaire),
· Troubles thrombophiliques connus (par exemple : carence en protéine C, en protéine S ou en antithrombine, voir rubrique 4.4),
· Maladie thromboembolique artérielle active ou récente (par exemple, angor, infarctus du myocarde),
· Affection hépatique aiguë ou antécédents d’affection hépatique, jusqu'à normalisation des tests hépatiques,
· Porphyrie
Ce médicament est généralement déconseillé en association avec des produits spermicides.
4.4. Mises en garde spéciales et précautions d'emploi
Une tension mammaire persistante ou la production excessive de glaire cervicale sont les signes d'une posologie trop élevée.
Durant un traitement prolongé par les œstrogènes, des examens médicaux périodiques sont recommandés portant essentiellement sur : seins, utérus, frottis cervico-vaginaux, poids.
Pour le traitement des symptômes post ménopausiques, le traitement hormonal substitutif (THS) ne doit être instauré que si ces symptômes altèrent la qualité de vie de la patiente. Dans tous les cas, une évaluation minutieuse de la balance bénéfice/risque doit être effectuée au moins une fois par an. Le THS ne peut être poursuivi que tant que le bénéfice est supérieur aux risques encourus.
Les données concernant les risques associés au THS dans le traitement de la ménopause précoce sont limitées. En raison du faible niveau de risque absolu chez les femmes plus jeunes, la balance bénéfice/risque pour ces femmes pourrait être plus favorable que pour les femmes plus âgées
Examen médical/surveillance
Avant d’initier ou de réinstaurer un traitement hormonal substitutif (THS), il convient de procéder à un examen complet des antécédents médicaux personnels et familiaux. Un examen clinique (avec examen pelvien et mammaire) doit être pratiqué, en tenant compte des antécédents médicaux de la patiente, ainsi que des contre-indications et des mises en garde. Il est recommandé d’effectuer des examens médicaux réguliers, pendant toute la durée du traitement, dont la nature et la fréquence seront adaptées à chaque femme. Les femmes doivent être informées du type d’anomalies mammaires à signaler à leur médecin ou à leur infirmière (voir « Cancer du sein » ci-dessous).. Des examens, y compris d’imagerie appropriée comme la mammographie, doivent être pratiqués selon les recommandations en vigueur et adaptés aux besoins cliniques de chaque patiente.
Pathologies ou facteurs de risques nécessitant un contrôle particulier
Si l’une des affections suivantes survient, est survenue antérieurement et/ou s'est aggravée au cours d’une grossesse ou d’un traitement hormonal antérieur, la patiente doit être étroitement surveillée. Il doit être pris en compte que ces affections puissent récidiver ou s'aggraver pendant le traitement par TROPHICREME 0,1 POUR CENT, en particulier :
· Le léiomyome (fibromes utérins) ou l'endométriose
- Les
antécédents ou facteurs de risque de troubles thromboemboliques (voir
ci-après, rubrique « Thromboembolie veineuse »)
· Les facteurs de risque de tumeurs dépendantes des œstrogènes, p. ex., hérédité du 1er degré pour le cancer du sein
· L’hypertension artérielle
· Les affections hépatiques (p. ex., l'adénome hépatique)
· Le diabète sucré avec ou sans atteinte vasculaire
· La lithiase biliaire
· La migraine ou les céphalées (sévères)
· Le lupus érythémateux systémique.
· Les antécédents d’hyperplasie endométriale (voir ci-après, rubrique « Hyperplasie de l’endomètre et carcinome »)
· L’épilepsie
· L’asthme
· L’otosclérose ou l’otospongiose
Cas justifiant une interruption immédiate du traitement
Le traitement doit être interrompu en cas de découverte d’une contre-indication et dans les situations suivantes :
· ictère ou détérioration de la fonction hépatique
· augmentation significative de la pression artérielle
· survenue de céphalées de type migraine inhabituelle
· grossesse.
TROPHICREME 0,1 POUR CENT est une préparation d’estriol à faible dose et agissant localement. Par conséquent, la survenue des affections mentionnées ci-dessous est moins probable qu’avec un traitement systémique aux estrogènes.
Hyperplasie de l’endomètre et carcinome
· Chez les femmes dont l'utérus est intact, le risque d’hyperplasie de l’endomètre et de carcinome est accru lorsque les œstrogènes systémiques sont administrés seuls pendant des périodes prolongées.
· Pour les produits à base d'œstrogènes destinés à une application vaginale dont l'exposition systémique à l'œstrogène reste dans les valeurs normales de la ménopause, il n’est pas recommandé d’ajouter un progestatif.
· La sécurité d’emploi pour l’endomètre des œstrogènes administrés par voie vaginale lors d’une utilisation à long terme (plus d’un an) ou répétée est incertaine. Par conséquent, en cas de traitement répété, il doit être réévalué au moins une fois par an.
· Une stimulation oestrogénique « non opposée » (sans progestérone) peut entraîner une transformation prémaligne ou maligne dans des foyers résiduels d’endométriose. Par conséquent, la prudence est recommandée lors de l’utilisation de ce produit chez les femmes ayant subi une hystérectomie suite à une endométriose, en particulier si une endométriose résiduelle est connue.
· Si des saignements ou « spotting » surviennent pendant le traitement à quelque moment que ce soit, il faut en rechercher la cause ; il peut être nécessaire de pratiquer une biopsie de l’endomètre afin d’exclure une affection endométriale maligne.
Les risques suivants ont été associés à un THS systémique et s’appliquent dans une moindre mesure aux produits à base d’œstrogènes avec application vaginale dont l’exposition systémique à l’œstrogène reste dans les valeurs normales de la ménopause. Cependant, ils doivent être pris en compte en cas d’utilisation à long terme ou répétée de ce produit.
Cancer du sein
· Les données globales suggèrent un risque accru de cancer du sein chez les femmes prenant un THS combiné œstrogène-progestatif, mais éventuellement aussi chez celles utilisant un THS systémique par œstrogènes seuls. Ce risque est dépendant de la durée d’utilisation du THS.
· L’excès de risque devient apparent après quelques années d’utilisation, mais revient au niveau du risque de référence quelques années (cinq ans maximum) après l’arrêt du traitement.
Cancer ovarien
Le cancer ovarien est beaucoup plus rare que le cancer du sein.
Les données épidémiologiques d'une importante méta-analyse suggèrent un risque légèrement accru chez les femmes prenant un THS systémique à base d’œstrogènes seuls qui apparaît dans les cinq années suivant le début de l‘utilisation et diminue progressivement après l'arrêt du traitement.
Thromboembolie veineuse
· Le THS systémique est associé à un risque de 1,3 à 3 plus élevé d’accidents thromboemboliques veineux (TEV), c.-à-d. de thrombose veineuse profonde ou d’embolie pulmonaire. La survenue d’un tel évènement est plus probable au cours de la première année d’utilisation duTHS (voir rubrique 4.8).
· Les patientes présentant des troubles thrombophiliques connus ont un risque accru de TEV et le THS peut augmenter ce risque. Le THS est donc contre-indiqué chez ces patientes (voir rubrique 4.3).
· Les facteurs de risque généralement reconnus pour la TEV comprennent l’utilisation d’œstrogènes, un âge avancé, une chirurgie majeure, une immobilisation prolongée, l’obésité (IMC > 30 kg/m2), une grossesse/période postpartum, un lupus érythémateux systémique (LES) et un cancer. Il n’existe aucun consensus quant au rôle possible des varices dans la TEV.
· Comme pour tous les patients en postopératoire, des mesures prophylactiques doivent être envisagées pour prévenir la survenue d’une TEV après une chirurgie. Si une immobilisation prolongée doit suivre une chirurgie programmée, il est recommandé d’arrêter temporairement le THS 4 à 6 semaines avant l’intervention. Le traitement ne doit être repris qu’après mobilisation complète de la patiente.
· Chez les femmes sans antécédents personnels de TEV, mais dont un parent au premier degré a des antécédents de thrombose à un jeune âge, le dépistage peut être proposé après un conseil avisé concernant ses limites (seule une partie des troubles de thrombophilie peut être identifiée par le dépistage).
· Si un trouble thrombophilique est identifié, en plus d’antécédents de thrombose chez des membres de la famille, ou si le trouble est « sévère » (par exemple, carence en antithrombine, en protéine S ou en protéine C ou une combinaison de plusieurs troubles), le THS est contre-indiqué.
· Les femmes qui suivent déjà un traitement anticoagulant chronique nécessitent un examen attentif de la balance bénéfice/risque d’un THS.
· Si un TEV se développe après l’instauration du traitement, le médicament doit être arrêté. Les patientes doivent être informées de contacter immédiatement leurs médecins si elles remarquent les symptômes d’un éventuel TEV thromboembolique (p. ex., tuméfaction douloureuse d’un membre inférieur, douleur thoracique soudaine, dyspnée).
Maladie des artères coronaires
Œstrogènes seuls :
Les données issues d’études randomisées contrôlées n’ont révélé aucune augmentation du risque de maladie coronarienne chez les femmes hystérectomisées prenant un traitement systémique à base d’œstrogènes seuls.
Accident ischémique cérébral
Le traitement systémique à base d’œstrogènes seuls est associé à une augmentation jusqu’à 1,5 fois supérieure au risque d’accident ischémique cérébral. Le risque relatif ne varie ni avec l’âge, ni avec le temps écoulé depuis la ménopause. Cependant, le risque de référence d’accident vasculaire cérébral étant fortement dépendant de l’âge, le risque global d’accident vasculaire cérébral chez les femmes sous THS augmentera avec l’âge (voir rubrique 4.8).
Autres précautions d’emploi
· Les œstrogènes peuvent provoquer une rétention liquidienne ; les patientes atteintes d’insuffisance cardiaque ou rénale doivent, par conséquent, être surveillées de près.
· Les femmes présentant une hypertriglycéridémie préexistante doivent être surveillées de près pendant la prise d’œstrogène substitutive ou d'un traitement hormonal substitutif ; en effet, de rares cas d’élévation importante des taux de triglycérides plasmatiques entraînant une pancréatite ont été rapportés.
· Les œstrogènes augmentent la globuline liant la thyroxine (« thyroxine binding globulin » ou « TBG »), ce qui entraîne une augmentation de l’hormone thyroïdienne circulante, telle que mesurée par l’iode lié aux protéines, les taux de T4 (par colonne ou par radio-immunodosage) ou les taux de T3 (par radio-immunodosage). L'absorption de la résine T3 est réduite, ce qui reflète l'augmentation de la TBG. Les concentrations de T4 libre et de T3 libre ne sont pas altérées. D'autres protéines de liaison peuvent être élevées dans le sérum, comme la globuline liant les corticoïdes (« corticoid binding globulin » ou« CBG »), la protéine transporteuse d’hormones sexuelles (« sex-hormone-binding globulin » ou « SHBG »), conduisant à une augmentation respectivement des corticoïdes et des stéroïdes sexuels circulants. Les concentrations d’hormone libre ou biologiquement actives sont inchangées. D’autres protéines plasmatiques peuvent être augmentées (substrat de rénine/angiotensinogène, alpha-I-antitrypsine, céruloplasmine).
· L’utilisation d’un THS n’améliore pas la fonction cognitive. Il existe des données d’augmentation du risque de démence probable chez les femmes qui commencent à utiliser un THS combiné ou THS par œstrogènes seuls après l’âge de 65 ans.
Ce médicament contient de l’acide sorbique et peut provoquer des réactions cutanées locales (par exemple : dermatite de contact).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
En raison de l’administration par voie vaginale et d’une absorption systémique minimale, il est peu probable qu’une interaction médicamenteuse quelconque cliniquement pertinente se produise avec TROPHICREME 0,1 POUR CENT. Cependant, la possibilité d‘interactions avec d’autres traitements vaginaux appliqués localement doit être prise en compte.
Les essais n'ont montré aucune modification des caractéristiques physiques et mécaniques des préservatifs masculins par TROPHICREME 0,1 POUR CENT.
Associations déconseillées
+ Spermicides et médicaments utilisés par voie vaginale (antifongiques, antitrichomonas, antibactériens, antiseptiques, antiherpétiques et estrogènes locaux).
Tout traitement local vaginal est susceptible d'inactiver une contraception locale spermicide.
4.6. Fertilité, grossesse et allaitement
Grossesse
Ce médicament n'est pas indiqué pendant la grossesse. Si une grossesse survient pendant le traitement par TROPHICREME 0,1 POUR CENT, le traitement doit être interrompu immédiatement.
À ce jour, les résultats de la plupart des études épidémiologiques concernant l’exposition fœtale accidentelle aux œstrogènes n’indiquent aucun effet tératogène ou fœtotoxique.
En cas de prise accidentelle au cours d'une grossesse, interrompre le traitement sans autre mesure.
Allaitement
TROPHICREME 0,1 POUR CENT n’est pas indiqué pendant l’allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Sans objet.
4.8. Effets indésirables
Comme tous les produits destinés à être appliqués sur les muqueuses, TROPHICREME 0,1 POUR CENT, crème vaginale peut, dans de rares cas, entraîner une irritation ou un prurit en début de traitement.
Des mastodynies peuvent éventuellement apparaître de façon transitoire en début de traitement.
Effets de classe associés au THS systémique
Les risques suivants ont été associés à un THS systémique et s’appliquent dans une moindre mesure aux produits à base d’œstrogènes avec application vaginale (TROPHICREME 0,1 POUR CENT) dont l’exposition systémique à l’œstrogène reste dans lesvaleurs normales de la ménopause.
Risque de cancer du sein
· Un risque multiplié par 2 de développer un cancer du sein diagnostiqué est rapporté chez les femmes prenant un traitement combiné œstrogène-progestatif pendant plus de 5 ans.
· L’augmentation du risque avec les traitements oestrogéniques seuls est nettement inférieure à celle observée avec la prise de traitements combinant œstrogènes et progestatifs.
· Le niveau de risque dépend de la durée d’utilisation (voir rubrique 4.4).
· Les résultats d’un important essai randomisé contrôlé par placebo (étude WHI) et d’une importante étude épidémiologique (Million Women Study, MWS) sont présentés ci-après.
Etude « MWS » - Risque de cancer du sein augmenté estimé après 5 ans d’utilisation
|
Age (années)
|
Cas supplémentaires pour 1 000 patientes n’ayant jamais pris de THS sur une période de 5 ans*
|
Rapport de risque et IC à 95 % #
|
Cas supplémentaires pour 1 000 patientes ayant pris un THS sur une période de 5 ans (IC à 95 %)
|
|
|
THS à base d’œstrogènes seuls
|
|
50-65
|
9-12
|
1.2
|
1-2 (0-3)
|
*Tiré des taux d'incidence à la référence dans les pays développés
# Rapport de risque global. Le rapport de risque n’est pas constant, mais augmente avec une durée d’utilisation accrue.
Remarque : Étant donné que l’incidence d’antécédents du cancer du sein varie selon le pays de l’Union Européenne, le nombre de cas supplémentaires de cancer du sein changera également proportionnellement.
Etude américaines WHI – Risque augmenté de cancer du sein après 5 ans d’utilisation
|
Age (années)
|
Incidence pour 1 000femmes ayant pris un placebo sur une période de 5 ans
|
Rapport de risque et IC à 95 %
|
Cas supplémentaires pour 1 000 patientes ayant pris un THS sur une période de 5 ans (IC à 95 %)
|
|
|
CEE œstrogènes seuls
|
|
50-79
|
21
|
0.8 (0.7 – 1.0)
|
-4 (-6-0)*
|
*Étude WHI chez des femmes hystérectomisées, qui n’a pas montré d’augmentation du risque de cancer du sein
Cancer ovarien
L’utilisation d’un THS systémique a été associée à un risque légèrement accru de cancer ovarien diagnostiqué (voir rubrique 4.4).
Une méta-analyse provenant de 52 études épidémiologiques a rapporté un risque accru de cancer ovarien chez les femmes actuellement sous THS systémique par rapport aux femmes n’en ayant jamais pris (RR 1,43, IC à 95 % : 1,31–1,56). Chez les femmes âgées de 50 à 54 ans sous THS pendant 5 ans, cela représente environ 1 cas supplémentaire pour 2 000 utilisatrices. Chez les femmes âgées de 50 à 54 ans qui ne prennent pas de THS, un diagnostic de cancer ovarien sera posé chez environ 2 femmes sur 2000 sur une période de cinq ans.Risque d’accidents thromboemboliques veineux
Le THS systémique est associé à un risque relatif multiplié par 1,3 à 3 d’évènement thromboembolique veineux (TEV), comme une thrombose veineuse profonde ou une embolie pulmonaire. La survenue d’un tel évènement est plus probable au cours de la première année sous THS (voir rubrique 4.4). Les résultats des études WHI sont présentés :
Études WHI - Risque augmenté de TEV après 5 ans d’utilisation
|
Age (années)
|
Incidence pour 1 000 femmes ayant pris un placebo sur une période de 5 ans
|
Rapport de risque et IC à 95 %
|
Cas supplémentaires pour 1 000 patientes ayant pris un THS
|
|
Œstrogènes seuls par voie orale
|
|
50-59
|
7
|
1.2 (0.6 – 2.4)
|
1 (-3-10)
|
*Étude chez des femmes hystérectomisées
Risque d’accident ischémique cérébral
Le THS systémique est associée à un risque relatif 1,5 fois plus élevé d’accident ischémique cérébral. Le risque d’accident vasculaire cérébral hémorragique n’augmente pas pendant l’utilisation du THS.
Ce risque relatif ne dépend pas de l’âge ou de la durée d’utilisation, mais comme le risque de référence est fortement dépendant de l’âge, le risque global d’accident vasculaire cérébral chez les femmes sous THS augmente avec l’âge (voir rubrique 4.4.)
Études WHI combinées - Risque augmenté d’accident ischémique cérébral* après 5 ans d’utilisation
|
Age (années)
|
Incidence pour 1 000 femmes ayant pris un placebo sur une période de 5 ans
|
Rapport de risque et IC à 95 %
|
Cas supplémentaires pour 1 000 patientes ayant pris un THS
|
|
50-59
|
8
|
1.3 (1.1 – 1.6)
|
3 (1-5)
|
*Aucune différence n’a été faite entre les accidents vasculaires cérébraux ischémiques et hémorragiques
D’autres réactions indésirables ont été rapportées en association avec un traitement systémique à base d'œstrogènes/progestatifs :
· maladie de la vésicule biliaire.
· affections cutanées et sous-cutanées : chloasma, érythème polymorphe, érythème noueux, purpura vasculaire.
· démence probable après l’âge de 65 ans (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
4.9. Surdosage
Sans objet.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ESTROGENES PAR VOIE LOCALE, code ATC : G03CA04.
(G : Système génito-urinaire et hormones sexuelles).
Traitement des symptômes vaginaux d’une déficience en œstrogènes : les œstrogènes appliqués par voie vaginale atténuent les symptômes d’atrophie vaginale due à une déficience en œstrogènes chez les femmes ménopausées.
5.2. Propriétés pharmacocinétiques
L'estriol, administré localement est très bien absorbé comme en témoigne l'élévation rapide des taux sériques d'estriol.
La concentration plasmatique est maximale 1 à 2 heures après l'application, puis décroît pour revenir aux valeurs de base en 24 heures. L'élimination urinaire sous forme conjuguée est totale après 24 heures.
5.3. Données de sécurité préclinique
Sans objet.
6. DONNEES PHARMACEUTIQUES
6.1. Liste des excipients
Vaseline, cire émulsionnable non ionique au cétamacrogol 1000, paraffine liquide, glycine, solution concentrée d'hydroxyde de sodium, acide sorbique, eau purifiée.
6.2. Incompatibilités
Sans objet.
6.3. Durée de conservation
3 ans.
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
30 g en tube (Aluminium verni) avec applicateur doseur composé d'une canule (PE) et d'un piston.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
SANOFI-AVENTIS France
82 AVENUE RASPAIL
94250 GENTILLY
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
34009 329 553 3 6 : 30 g en tube (Aluminium verni) avec applicateur doseur (PE).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
11. DOSIMETRIE
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste II.

