RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 23/07/2020
1. DENOMINATION DU MEDICAMENT
BERINERT 3000 UI, poudre et solvant pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Substance active : Inhibiteur de la C1 estérase humaine, sous cutanée
BERINERT 3000 UI contient 3000 UI d’inhibiteur de la C1 estérase par flacon à injecter.
L’activité en inhibiteur de la C1 estérase est exprimée en Unité Internationale (UI), conformément au standard actuel de l’OMS pour les inhibiteurs de la C1 estérase.
BERINERT 3000 UI contient 500 UI/ml d’inhibiteur de la C1 estérase après reconstitution avec 6 ml d'eau pour préparations injectables.
La teneur en protéines totales de la solution reconstituée est de 65 mg/ml.
Excipient(s) à effet notoire :
Sodium jusqu'à 486 mg (approximativement 21 mmol) pour 100 ml de solution.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre et solvant pour solution injectable
Poudre blanche
4. DONNEES CLINIQUES
4.1. Indications thérapeutiques
BERINERT pour injection sous cutanée est indiqué dans la prévention des crises récidivantes d’angiœdème héréditaire (AOH) chez les patients adolescents et adultes présentant un déficit en inhibiteur de la C1 estérase.
4.2. Posologie et mode d'administration
BERINERT est destiné à l'auto-administration par injection sous-cutanée. Le patient ou l’entourage soignant doit être formé sur la manière d'administrer BERINERT le cas échéant.
Posologie
La dose recommandée de BERINERT SC est de 60 UI/kg de poids corporel, deux fois par semaine (tous les 3-4 jours)
Population pédiatrique
La posologie chez l’adolescent est la même que chez l’adulte.
Mode d’administration
L’administration se fait uniquement par voie sous-cutanée.
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique 6.6.
Il est recommandé de réaliser l’injection sous-cutanée de BERINERT dans la région abdominale. Au cours des essais cliniques, un seul site d'injection a été utilisé pour l’administration de BERINERT.
La préparation reconstituée doit être administrée par injection sous-cutanée à un débit toléré par le patient.
4.3. Contre-indications
Ce médicament est contre-indiqué chez les patients qui ont développé des réactions d’hypersensibilité engageant le pronostic vital, y compris une anaphylaxie, aux préparations à base d’inhibiteur de la C1 estérase ou à l’un des excipients mentionnés dans la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
En cas de survenue d'une réaction allergique d’intensité sévère, il convient d'arrêter immédiatement l’administration de BERINERT (par exemple, en arrêtant l’injection) et d'instaurer un traitement médical approprié.
En cas de crise d’AOH aiguë, un traitement personnalisé doit être instauré.
Évènements thromboemboliques (ETE)
Une thrombose est survenue lors d’essais de traitement avec de fortes doses d’inhibiteur de la C1 estérase administrées par voie I.V. dans le cadre de la prophylaxie ou du traitement du syndrome de fuite capillaire, avant, pendant ou après une chirurgie cardiaque réalisée sous circulation extracorporelle (utilisation hors indication et doses autorisées). L’existence d’un lien de causalité entre l’administration par voie S.C. d’une solution d’inhibiteur de la C1 estérase aux doses recommandées et la survenue d’un ETE n’a pas pu être établie.
Sécurité virale
Les mesures habituelles de prévention du risque de transmission d’agents infectieux par les médicaments préparés à partir de sang ou de plasma humain comprennent la sélection des donneurs, la recherche des marqueurs spécifiques d’infection sur chaque don et sur les mélanges de plasma ainsi que la mise en œuvre dans le procédé de fabrication d’étapes efficaces pour l’inactivation/élimination virale. Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission d’agents infectieux ne peut pas être totalement exclu. Ceci s’applique également aux virus inconnus ou émergents et aux autres agents pathogènes.
Les mesures prises sont considérées comme efficaces vis à vis des virus enveloppés tels que le virus de l’immunodéficience humaine (VIH), le virus de l’hépatite B (VHB), le virus de l’hépatite C (VHC) et vis-à-vis des virus non enveloppés tels que le VHA et le parvovirus B19.
Il est fortement recommandé de noter le nom et le numéro de lot du produit lors de chaque administration de BERINERT afin d’assurer la traçabilité du lot reçu par le patient.
Une vaccination appropriée (hépatite A et B) doit être envisagée chez les patients qui reçoivent régulièrement ou à plusieurs reprises des produits dérivés du plasma humain.
BERINERT contient jusqu'à 486 mg de sodium (approximativement 21 mmol) pour 100 ml de solution. Ceci doit être pris en compte pour les patients contrôlant leur apport alimentaire en sodium.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
4.6. Fertilité, grossesse et allaitement
Grossesse
Peu de données existent relatives à l’absence d’augmentation du risque lors de l'utilisation de produits à base d’inhibiteur de la C1 estérase humaine chez la femme enceinte. L’inhibiteur de la C1 estérase est un composant physiologique du plasma humain. Aucune étude de toxicité sur la reproduction et sur le développement n’a été réalisée avec BERINERT chez les animaux. Aucun effet indésirable sur la fertilité ou sur le développement pré et post-natal n'est attendu chez l'Homme. BERINERT ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue.
Allaitement
Il n’y a pas de donnée sur le passage de l’inhibiteur de la C1 estérase dans le lait maternel. BERINERT ne doit être utilisé chez les femmes qui allaitent qu'en cas de nécessité absolue.
Fertilité
L’inhibiteur de la C1 estérase est un composant physiologique du plasma humain. Aucune étude sur la reproduction ou sur la toxicité liée au développement n’a été menée chez l’animal avec BERINERT.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
BERINERT n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
4.8. Effets indésirables
Les réactions indésirables ont été recueillies à partir de l’étude pivot de phase 3 CSL830_3001 qui a été menée chez des patients (n = 86) atteints d’AOH et recevant BERINERT par voie sous-cutanée. La fréquence des réactions indésirables s’appuie sur les événements qui sont associés à l’administration de BERINERT. Elle a été estimée en fonction de chaque patient et classée de la manière suivante :
Très fréquent : (≥ 1/10)
Fréquent : (≥ 1/100 et < 1/10)
Peu fréquent : (≥ 1/1 000 et < 1/100)
Rare : (≥ 1/10 000 et < 1/1 000)
Très rare : (< 1/10 000)
|
Classification MedDRA par classe de systèmes d’organes
|
Réaction indésirable
|
Fréquence
|
|
Infections et infestations
|
Rhinopharyngite
|
Très fréquent
|
|
Affections du système immunitaire
|
Hypersensibilité
(Hypersensibilité, prurit, éruption cutanée et urticaire)
|
Fréquent
|
|
Affections du système nerveux
|
Vertiges
|
Fréquent
|
|
Troubles généraux et anomalies au site d’administration
|
Réactions au site d’injectiona
|
Très fréquent
|
|
a Contusion au site d’injection, Sensation de froid au site d’injection, Écoulement au site d’injection, Érythème au site d’injection, Hématome au site d’injection, Hémorragie au site d’injection, Induration au site d’injection, Œdème au site d’injection, Douleur au site d’injection, Prurit au site d’injection, Éruption cutanée au site d’injection, Réaction au site d’injection, Cicatrice au site d’injection, Gonflement au site d’injection, Urticaire au site d’injection, Sensation de chaleur au site d’injection.
|
Pour la sécurité vis-à-vis des agents transmissibles, voir la rubrique 4.4.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
4.9. Surdosage
Aucun cas de surdosage n'a été rapporté. Dans une étude clinique à doses fixes, des doses allant jusqu’à 117 UI/kg ont été administrées par voie S.C. deux fois par semaine et elles ont été bien tolérées par les patients.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Autres agents hématologiques, médicaments utilisés dans le traitement de l’angiœdème héréditaire : Inhibiteur de la C1 estérase, dérivés du plasma, code ATC : B06AC01
L'inhibiteur de la C1 estérase est une glycoprotéine de plasma dont le poids moléculaire est égal à 105 kD et le taux d'hydrate de carbone à 40 %. Sa concentration dans le plasma humain est d’environ 240 mg/l. En plus du plasma humain, le placenta, les cellules hépatiques, les monocytes et les plaquettes contiennent également de l'inhibiteur de la C1 estérase.
L'inhibiteur de la C1 estérase appartient au système inhibiteur de protéase à sérine (serpine) du plasma humain, tout comme d'autres protéines : antithrombine III, alpha-2 antiplasmine, alpha-1-antitrypsine et d’autres.
Mécanisme d’action
Dans les conditions physiologiques, l’inhibiteur de la C1 estérase inhibe la voie classique du système du complément en inactivant les composants enzymatiques actifs C1s et C1r. L’enzyme actif et l’inhibiteur forment un complexe stœchiométrique 1:1.
Par ailleurs, l’inhibiteur de la C1 estérase joue un rôle majeur dans l’activation de contact de la coagulation car il inhibe le facteur XIIa et ses fragments. De plus, il inhibe avec la macroglobuline alpha-2 la kallicréine plasmatique.
L'effet de BERINERT dans le traitement de l'angiœdème héréditaire est induit par la substitution de l'activité déficiente de l'inhibiteur de la C1 estérase.
5.2. Propriétés pharmacocinétiques
Les caractéristiques pharmacocinétiques (PK) de BERINERT sous-cutanée ont principalement été décrites à l’aide de méthodes de PK de population appliquées sur des données regroupées issues de 3 essais cliniques menés auprès de sujets sains et de sujets présentant un AOH.
Absorption
Après administration par voie sous-cutanée deux fois par semaine, BERINERT est absorbé lentement ; le temps médian (IC à 95 %) écoulé avant l’obtention de la concentration maximale (tmax) étant d’environ 59 heures (23 à 134 heures). D’après la demi-vie plasmatique apparente médiane (IC à 95 %) de 69 heures (24 à 250 heures), l’état d’équilibre de l'inhibiteur de la C1 estérase devrait être obtenu au bout de 3 semaines d’administration. L’état d’équilibre fonctionnel minimal moyen (IC à 95 %) de l'inhibiteur de la C1 estérase devrait atteindre un taux de 48 % (25,1 à 102 %) suite à une administration de BERINERT par voie S.C. deux fois par semaine à une dose de 60 UI/kg. La biodisponibilité relative (F) moyenne (IC à 95 %) de BERINERT après une administration S.C. était estimée à environ 43 % (35,2 à 50,2 %).
Distribution et Élimination
Dans la population, la clairance moyenne (IC à 95 %) et le volume de distribution apparent de BERINERT étaient estimés à environ 83 ml/h (72,7 à 94,2 ml/h) et 4,33 l (3,5 à 5,15 l), respectivement. Il a été observé que la clairance de l'inhibiteur de la C1 estérase était directement proportionnelle au poids corporel total. À l’état d’équilibre, il a été observé que les paramètres PK de BERINERT en administration S.C. étaient indépendants de la dose chez les patients présentant un AOH qui recevaient des doses se situant entre 20 et 80 UI/kg.
Les paramètres PK de l'inhibiteur de la C1 estérase n’ont fait l’objet d’aucune étude menée au sein de populations particulières de patients stratifiées selon le sexe, la race, l’âge ou la présence d’une insuffisance rénale ou hépatique. Il a été observé que l’analyse de la population, qui comprenait des patients âgés de 12 à 72 ans, n’a eu aucune influence sur les paramètres PK de l'inhibiteur de la C1 estérase.
5.3. Données de sécurité préclinique
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration unique et répétée, tolérance locale et thrombogénicité n’ont pas révélé de risque particulier pour l’Homme après administration intraveineuse ou sous-cutanée.
Aucune étude destinée à évaluer la cancérogénicité et la toxicité reproductrice n'a été réalisée.
6. DONNEES PHARMACEUTIQUES
6.1. Liste des excipients
Poudre :
Glycine, chlorure de sodium, citrate de sodium
Solvant :
Eau pour préparations injectables
6.2. Incompatibilités
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé avec d’autres médicaments.
6.3. Durée de conservation
36 mois
Après reconstitution, la stabilité physico-chimique a été démontrée pendant 48 heures à température ambiante (max. + 30°C). D’un point de vue microbiologique et dans la mesure où BERINERT ne contient aucun conservateur, le produit reconstitué doit être utilisé immédiatement. Si le produit n’est pas administré immédiatement, la durée de conservation ne doit pas dépasser 8 heures à température ambiante. Le produit reconstitué doit être conservé uniquement dans le flacon d’origine.
6.4. Précautions particulières de conservation
À conserver à une température ne dépassant pas 30 °C.
Ne pas congeler.
Conserver le flacon dans l'emballage extérieur à l'abri de la lumière.
Pour les conditions de conservation du médicament après reconstitution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Conditionnements primaires
Poudre (3000 UI) dans un flacon (verre de type II) avec un bouchon (caoutchouc de bromobutyle), un opercule en aluminium et un capuchon amovible en plastique.
6 ml de solvant dans un flacon (verre de type I) avec un bouchon (caoutchouc de chlorobutyle), un opercule en aluminium et un capuchon amovible en plastique.
Présentations :
Une boîte contient :
1 flacon de poudre
1 flacon de solvant (BERINERT 3000 UI : 6 ml)
1 dispositif de transfert de filtre 20/20
Un set d’administration (boîte intérieure) contient :
1 seringue à usage unique (BERINERT 3000 : 10 ml)
1 aiguille hypodermique
1 dispositif d’injection sous-cutanée
2 tampons imbibés d’alcool,
1 pansement
Emballage multiple contenant 5 flacons de 3000 UI et 20 flacons de 3000 UI.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Mode d’administration
Instructions générales
· La solution reconstituée de BERINERT doit être incolore et limpide ou légèrement opalescente.
· Après filtration/prélèvement (voir ci-dessous), le produit reconstitué doit être inspecté visuellement afin de mettre en évidence la présence de particules ou un changement de coloration avant administration.
· N’utilisez pas de solutions troubles ou contenant des dépôts.
· La reconstitution et le prélèvement doivent être effectués dans des conditions aseptiques. Utilisez la seringue fournie avec le produit.
Reconstitution
Amenez le solvant à température ambiante. Pensez à retirer les capuchons protecteurs des flacons de produit et de solvant et à nettoyer les bouchons avec une solution antiseptique puis à les laisser sécher avant de procéder à l’ouverture de l’emballage du dispositif Mix2vial.
|
 1 1
|
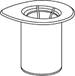
1. Ouvrez l’emballage du dispositif Mix2Vial en retirant l’opercule. N’enlevez pas le dispositif Mix2Vial de son emballage!
|
|
 2 2
|
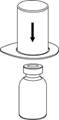
2. Placez le flacon de solvant sur une surface plane et propre et maintenez-le fermement. Saisissez le dispositif Mix2Vial avec son emballage thermoformé et enfoncez l’extrémité bleue de l’adaptateur tout droit à travers le bouchon du flacon de solvant.
|
|
 3 3
|
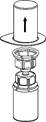
3. Retirez délicatement l’emballage thermoformé du dispositif Mix2Vial en le tenant par les bords et en tirant verticalement vers le haut. Veiller à retirer uniquement l’emballage thermoformé en laissant le dispositif Mix2Vial en place.
|
|
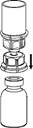 4 4
|
4. Posez le flacon de produit sur une surface plane et rigide. Retournez le flacon de solvant muni du dispositif Mix2Vial et enfoncez l’extrémité transparente de l’adaptateur tout droit à travers le bouchon du flacon de produit. Le solvant coule automatiquement dans le flacon de produit.
|
|
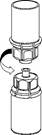 5 5
|
5. En maintenant la partie produit du dispositif Mix2Vial d’une main et la partie solvant de l’autre, dévissez soigneusement le dispositif dans le sens inverse des aiguilles d’une montre afin de séparer les deux flacons.
Jetez le flacon de solvant muni de la partie bleue de l’adaptateur Mix2Vial.
|
|
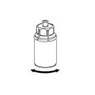 6 6
|
6. Agitez délicatement le flacon de produit muni de la partie transparente de l’adaptateur jusqu’à ce que la substance soit totalement dissoute. Ne secouez pas le flacon.
|
|
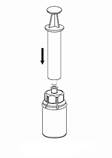 7 7
|
7. Remplissez d’air une seringue stérile vide. Utilisez la seringue fournie avec le produit. Tout en maintenant verticalement le flacon de produit, connectez la seringue au raccord Luer Lock du dispositif Mix2Vial en le vissant dans le sens des aiguilles d'une montre. Injectez de l’air dans le flacon de produit.
|
Prélèvement et administration
|
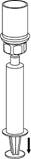 8 8
|
8. Tout en maintenant le piston de la seringue enfoncé, retournez le système et prélevez la solution dans la seringue en tirant lentement sur le piston.
|
|
 9 9
|
9. Une fois la solution transférée dans la seringue, tenez fermement le corps de la seringue (en maintenant le piston de la seringue dirigé vers le bas) et déconnectez la partie transparente de l’adaptateur Mix2Vial de la seringue en dévissant dans le sens inverse des aiguilles d’une montre.
|
Administration
Le produit peut être administré à l’aide d'une aiguille hypodermique ou d’un kit de perfusion sous-cutanée.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
CSL Behring GmbH
Emil-von-Behring-Strasse 76
35041 Marburg
ALLEMAGNE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 550 537 4 3 : 3000 UI de poudre en flacon (verre de type II) muni d’un bouchon (bromobutyle) + 6 ml de solvant en flacon (verre de type I) muni d’un bouchon (chlorobutyle) + un set d’administration. Boite de 1.
· 34009 550 537 5 0 : 3000 UI de poudre en flacon (verre de type II) muni d’un bouchon (bromobutyle) + 6 ml de solvant en flacon (verre de type I) muni d’un bouchon (chlorobutyle) + un set d’administration. Boite de 5.
· 34009 550 537 6 7 : 3000 UI de poudre en flacon (verre de type II) muni d’un bouchon (bromobutyle) + 6 ml de solvant en flacon (verre de type I) muni d’un bouchon (chlorobutyle) + un set d’administration. Boite de 20.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
11. DOSIMETRIE
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I
Médicament soumis à prescription hospitalière.
 1
1 2
2 6
6 7
7