RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 27/10/2020
BOCEAL, solution pour pulvérisation buccale
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Plantago major TM.................................................................................................................. 2 mL
Echinacea angustifolia TM....................................................................................................... 2 mL
Pour 20 mL de solution.
Excipient à effet notoire : éthanol. 20 mL de solution contiennent 2,22 g d’éthanol 96% V/V.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour pulvérisation buccale.
4.1. Indications thérapeutiques
Médicament homéopathique traditionnellement utilisé dans les maux de gorge modérés et sans fièvre, les aphtes et les petites plaies de la bouche.
4.2. Posologie et mode d'administration
Réservé à l’adulte et à l’enfant à partir de 6 ans.
1 à 2 pulvérisations, 3 à 6 fois par jour.
Espacer les prises dès amélioration et cesser les prises dès la disparition des symptômes.
La durée du traitement est limitée à 5 jours.
Un avis médical devra être pris si les symptômes persistent au-delà de 5 jours.
Mode d’administration
Voie buccale.
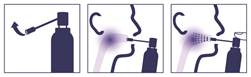
Tenir le flacon pulvérisateur (spray) verticalement, la pompe vers le haut.
Faire pivoter la tige sur le côté pour la mettre en position horizontale et la diriger vers la partie supérieure de la gorge.

Avant la première utilisation, amorcer la pompe en appuyant 3 à 4 fois en dehors de la bouche.
Nettoyer la tige après chaque utilisation.
· Enfants de moins de 6 ans.
· Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
- en l’absence d’amélioration au bout de 5 jours.
- en cas d’aggravation ou de survenue de fièvre élevée (> 38,5°C), d’expectoration (crachats) purulente, d’une gêne à la déglutition des aliments.
- en cas d’aphte, si le nombre de poussées est supérieur à 4 par an.
· Ce médicament contient de faibles quantités d’éthanol (alcool), inférieures à 100 mg pour deux pulvérisations. La faible quantité d'alcool contenue dans ce médicament n'est pas susceptible d'entraîner d'effet notable.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Sans objet.
4.6. Fertilité, grossesse et allaitement
BOCEAL, solution pour pulvérisation buccale peut être utilisé pendant la grossesse et l’allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Médicament homéopathique.
En l’absence de données scientifiques, l’indication de ce médicament repose sur l’usage homéopathique traditionnel de ses composants.
5.2. Propriétés pharmacocinétiques
5.3. Données de sécurité préclinique
Eau purifiée, éthanol (96% V/V), glycérol, L-carvone.
Avant première utilisation: 5 ans.
Après première utilisation: 6 mois
6.4. Précautions particulières de conservation
À conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
Boite contenant 20 mL de solution en flacon pulvérisateur (aluminium), muni d’une pompe (PE) et d’un embout buccal (PE/PP). Le flacon n’est pas pressurisé.
6.6. Précautions particulières d’élimination et de manipulation
Sans objet.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
2 AVENUE DE L’OUEST LYONNAIS
69510 MESSIMY
France
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 105 9 8 : 20 ml en flacon pulvérisateur (Aluminium) muni d’une pompe (PE) et d’un embout buccal (PE/PP)
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.