RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 22/10/2020
APOMORPHINE KALCEKS 5 mg/mL, solution pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chlorhydrate d'apomorphine hémihydraté................................................................................. 5 mg
Pour 1 mL de solution.
Chaque ampoule de 10 mL contient 50 mg de chlorhydrate d'apomorphine hémihydraté.
Excipient(s) à effet notoire : voir rubrique 4.4.
Métabisulfite de sodium (E223) : 1,0 mg par mL.
Chaque mL de solution contient 3,27 mg de sodium.
Chaque ampoule de 10 mL contient 32,7 mg de sodium.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution limpide incolore à jaunâtre, exempte de particules visibles.
pH de la solution 3,0 - 4,0.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Sélection de patients candidats au traitement par APOMORPHINE KALCEKS 5 mg/mL, solution pour perfusion
Les patients chez qui le traitement par APOMORPHINE KALCEKS 5 mg/mL, solution pour perfusion est indiqué doivent pouvoir reconnaître les symptômes annonciateurs de la phase « off » et être capables de se faire leurs injections ou disposer d’un soignant capable de faire les injections à leur place si nécessaire.
Les patients traités par le chlorhydrate d'apomorphine hémihydraté (ci-après dénommé apomorphine) devront généralement commencer la dompéridone au moins deux jours avant le début du traitement. La dose de dompéridone doit être ajustée à la dose efficace la plus faible et arrêtée dès que possible. Avant la décision d'initier un traitement par dompéridone et apomorphine, les facteurs de risque d'allongement de l'intervalle QT chez chaque patient doivent être soigneusement évalués afin de s'assurer que le bénéfice l'emporte sur le risque (voir rubrique 4.4).
L'apomorphine doit être initiée dans l'environnement contrôlé d'une clinique spécialisée. Le patient doit être surveillé par un médecin expérimenté dans le traitement de la maladie de Parkinson (par exemple un neurologue). Le traitement du patient par la lévodopa, avec ou sans agonistes dopaminergiques, doit être ajusté avant de débuter le traitement par apomorphine.
Mode d’administration
APOMORPHINE KALCEKS 5 mg/mL, solution pour perfusion est une ampoule pré-diluée destinée à être utilisée sans dilution pour une utilisation sous-cutanée et à être administrée en perfusion sous-cutanée continue par mini pompe et/ou pousse-seringue (voir rubrique 6.6). Il n'est pas destiné à être utilisé pour une injection intermittente.
L’apomorphine ne doit pas être utilisée par voie intraveineuse.
Posologie
Adultes
Perfusion continue
Chez les patients qui ont montré une bonne réponse sous forme de période « on » au cours du stade d’instauration du traitement par l’apomorphine, mais chez qui le contrôle global demeure insuffisant en recourant à des injections intermittentes ou qui nécessitent des injections nombreuses et fréquentes (plus de 10 par jour), il est possible de débuter ou de passer à un traitement par perfusion sous-cutanée continue au moyen d’une mini pompe et/ou d’un pousse-seringue comme suit :
Le choix, de la mini pompe et/ou du pousse-seringue à utiliser, et les paramètres d’administration requis seront déterminés par le médecin en fonction des besoins spécifiques du patient.
Détermination de la dose seuil
La dose seuil pour une perfusion continue doit être déterminée comme suit : La perfusion continue débutera à raison de 1 mg d'apomorphine (0,2 mL) par heure, puis augmentée en fonction de la réponse individuelle chaque jour. Les augmentations de la vitesse de perfusion ne doivent pas dépasser 0,5 mg à des intervalles d'au moins 4 heures. Les débits de perfusion horaires peuvent varier entre 1 mg et 4 mg (0,2 mL et 0,8 mL), ce qui équivaut à 0,014-0,06 mg/kg/heure. Les perfusions ne doivent être administrées que durant les périodes d’éveil. Sauf si le patient est confronté à de graves problèmes pendant la nuit, les perfusions 24 heures sur 24 sont déconseillées. Une tolérance au traitement ne semble pas apparaître dans la mesure où l’on respecte une période nocturne sans traitement d’au moins 4 heures. Dans tous les cas, il est nécessaire de changer de site de perfusion toutes les 12 heures.
Les patients peuvent avoir besoin de compléter leur perfusion continue par des bolus intermittents si nécessaire selon les directives du médecin.
Une réduction de la posologie des autres agonistes dopaminergiques peut être envisagée pendant la perfusion continue.
Mise en place du traitement
Des ajustements de la posologie peuvent être établis en fonction de la réponse du patient.
La dose optimale d’apomorphine varie selon les individus, mais, une fois établie, elle demeure relativement constante pour chaque patient.
Précautions lors de la poursuite du traitement
La dose journalière d'apomorphine est très variable d’un patient à l’autre, généralement entre 3 et 30 mg.
Il est recommandé de ne pas dépasser une dose journalière totale de 100 mg d’apomorphine.
Dans les études cliniques, il a été possible de réduire dans une certaine mesure la dose de lévodopa, cette diminution varie considérablement selon les patients et doit être réalisée avec précaution sous le contrôle d’un médecin expérimenté.
Une fois le traitement établi, il est possible de réduire progressivement le traitement par dompéridone chez certains patients mais il ne peut être éliminé avec succès seulement chez quelques patients, sans vomissements ou hypotension.
Population pédiatrique
APOMORPHINE KALCEKS 5 mg/mL, solution pour perfusion est contre-indiquée chez les enfants et les adolescents de moins de 18 ans (voir rubrique 4.3).
Sujets âgés
Les sujets âgés constituent une population importante de patients atteints de la maladie de Parkinson et une proportion importante des sujets inclus dans les études cliniques d'apomorphine. La prise en charge des patients âgés traités par apomorphine ne diffère pas de celle des patients plus jeunes. Cependant, une prudence toute particulière est recommandée lors de l'initiation du traitement chez des patients âgés en raison du risque d’hypotension posturale.
Insuffisance rénale
Un schéma posologique similaire à celui recommandé pour les adultes et les sujets âgés peut être utilisé chez les patients atteints d’insuffisance rénale (voir rubrique 4.4).
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· Dépression respiratoire.
· Démence.
· Troubles psychotiques.
· Insuffisance hépatique.
· Utilisation concomitante avec l'ondansétron (voir rubrique 4.5).
· Enfants et adolescents âgés de moins de 18 ans.
Un traitement intermittent à l’apomorphine n’est pas indiqué pour les patients ayant une réaction « on » à la lévodopa accompagnée de dystonies ou de dyskinésies sévères.
4.4. Mises en garde spéciales et précautions d'emploi
Une plus grande prudence est recommandée lors de l'initiation du traitement chez les sujets âgés et/ou les patients affaiblis.
Comme l’apomorphine risque de provoquer une hypotension, même en cas de traitement préalable par dompéridone, il faut être prudent chez les patients atteints de maladie cardiaque ou les patients prenant des médicaments vaso-actifs tels les antihypertenseurs, et particulièrement chez les patients avec une hypotension orthostatique préexistante.
L’apomorphine, particulièrement à doses élevées, pouvant causer une prolongation de l’intervalle QT, une attention particulière est nécessaire lors du traitement de patients présentant un risque d’arythmie de type torsades de pointe.
En cas d’utilisation en association avec la dompéridone, les facteurs de risque doivent être évalués soigneusement chez chaque patient. Cela doit être fait avant le début du traitement et pendant le traitement. Les facteurs de risque importants comprennent les affections cardiaques sous-jacentes telles que l’insuffisance cardiaque congestive, l’insuffisance hépatique sévère ou les déséquilibres électrolytiques significatifs. De plus, un traitement ayant un effet possible sur l’équilibre électrolytique, le métabolisme par le CYP3A4 ou l’intervalle QT doit être évalué. La surveillance d’un effet sur l’intervalle QTc est recommandée. Un ECG doit être réalisé :
· avant le traitement par la dompéridone,
· pendant la phase d’instauration du traitement,
· lorsqu'il est cliniquement indiqué par la suite.
Le patient doit être invité à signaler les symptômes cardiaques possibles, y compris les palpitations, la syncope ou la quasi-syncope. Ils doivent également signaler les changements cliniques qui pourraient conduire à une hypokaliémie, comme une gastro-entérite ou l'initiation d'un traitement diurétique. À chaque visite médicale, les facteurs de risque doivent être revus.
L’injection d’apomorphine est associée à l’apparition des lésions sous-cutanées. Ces effets sous-cutanés locaux peuvent parfois être atténués par la rotation des sites d’injection ou éventuellement par l’utilisation d’ultrasons (le cas échéant) afin d’éviter les zones présentant des nodules et des indurations.
Des cas d’anémie hémolytique et de thrombocytopénie ont été signalés chez les patients traités de l’apomorphine. Des examens hématologiques devront être réalisés à intervalles réguliers, en cas d’association de lévodopa à l’apomorphine.
La plus grande prudence est recommandée avant d’associer l’apomorphine à d’autres médicaments, en particulier ceux avec une marge thérapeutique étroite (voir rubrique 4.5).
Des troubles neuropsychiatriques existent chez de nombreux patients au stade avancé de la maladie de Parkinson. Pour certains patients, l’apomorphine pourrait accentuer les troubles neuropsychiatriques. Il convient de faire très attention lorsque l’apomorphine est utilisée chez ces patients.
Une somnolence a été rapportée lors du traitement par apomorphine ainsi que des épisodes d’endormissement soudain particulièrement chez les patients atteints de maladie de Parkinson. Les patients doivent être informés de la possibilité de survenue de ces effets et ils doivent être avertis d’être prudents lors de la conduite automobile ou l’utilisation de machines pendant le traitement avec l’apomorphine (voir rubrique 4.7). Les patients ayant présenté une somnolence ou un endormissement soudain ne doivent pas conduire des véhicules ou utiliser des machines. En outre, une réduction des doses ou un arrêt du traitement peut être envisagé.
Troubles du contrôle des impulsions
Les patients doivent être contrôlés régulièrement en cas de développement des troubles du contrôle des impulsions. Les patients et les soignants doivent être informés que les symptômes du comportement dans les troubles du contrôle des impulsions comprenant le jeu pathologique, l’augmentation de la libido, l’hypersexualité, les dépenses et achats compulsifs, la frénésie alimentaire, la boulimie peuvent apparaître chez des patients traités avec des agonistes de la dopamine comme l'apomorphine. Il convient de réduire les doses ou d’arrêter progressivement le traitement en cas d’apparition de ces symptômes.
Le syndrome de dysrégulation dopaminergique (SDD) est un trouble de l’addiction résultant en une utilisation excessive du produit, observé chez certains patients traités par l'apomorphine. Aussi, avant l’instauration du traitement, les patients et les aidants doivent être avertis du risque potentiel de survenue de ce type de syndrome.
Excipients
Ce médicament contient du métabisulfite de sodium (E223) et peut, dans de rares cas, provoquer des réactions d’hypersensibilité sévères et des bronchospasmes.
Ce médicament contient du sodium. Si de grandes quantités de solution sont administrées (par exemple 10 mL ou plus équivalent à plus de 1 mmol de sodium), les points suivants doivent être pris en compte : Ce médicament contient 3,27 mg de sodium par mL de solution, ce qui équivaut à 0,16 % de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium par adulte.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les médicaments antipsychotiques peuvent avoir un effet antagoniste avec l’apomorphine. Il existe une interaction potentielle entre la clozapine et l’apomorphine, cependant la clozapine peut être utilisée pour réduire les symptômes de complications neuropsychiatriques.
Si des antipsychotiques doivent être utilisés chez les patients atteints de maladie de Parkinson traités par agonistes dopaminergiques, il doit envisager une réduction progressive de la dose d’apomorphine en cas d’administration par mini pompe et/ou par pousse-seringue (des symptômes suggérant un syndrome malin des neuroleptiques ont été rapportés lors de l’arrêt brutal des dopaminergiques).
Les effets possibles de l’apomorphine sur les concentrations plasmatiques d’autres médicaments n’ont pas été étudiés. Par conséquent, la prudence est de mise lorsque l’apomorphine est associée à d’autres médicaments, en particulier à des médicaments qui présentent une marge thérapeutique étroite.
Antihypertenseurs et médicaments agissant sur le cœur
Même en cas d’administration concomitante de dompéridone, l’apomorphine est susceptible de potentialiser les effets antihypertenseurs de ces médicaments (voir rubrique 4.4).
Il est recommandé d’éviter l’association d’apomorphine avec d’autres médicaments qui allongent l’intervalle QT.
Sur la base des rapports d'hypotension profonde et de perte de conscience lors de l'administration d'apomorphine avec l'ondansétron, l'utilisation concomitante d'apomorphine et d'ondansétron est contre-indiquée.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'y a pas de données sur l'utilisation de l'apomorphine chez la femme enceinte. Les études sur la reproduction animale n'ont pas montré d'effets tératogènes, mais, chez le rat, des doses toxiques pour la mère peuvent induire des troubles respiratoires chez le nouveau-né. Le risque potentiel pour l'homme est inconnu. Voir section 5.3.
Ce médicament ne doit pas être utilisé pendant la grossesse sauf en cas de nécessité absolue.
On ne sait pas si l'apomorphine est excrétée ou non dans le lait maternel. La décision de continuer ou d'interrompre l'allaitement ou de continuer ou d'interrompre le traitement avec l'apomorphine doit être faite en fonction du bénéfice de l'allaitement pour l'enfant et du bénéfice du traitement par l'apomorphine pour la mère.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les patients traités à l'apomorphine présentant une somnolence et/ou des épisodes d’endormissement soudain doivent être informés qu'ils ne doivent pas conduire de véhicules ni exercer une activité (par exemple l'utilisation des machines) où une altération de la vigilance pourrait les exposer eux-mêmes ou d'autres personnes à un risque d'accident grave ou de décès, jusqu'à la disparition de la somnolence et des épisodes d’endormissement soudain (voir également rubrique 4.4).
Les effets indésirables ont été classés selon les classes de systèmes d'organes MedDRA en utilisant la convention de fréquence suivante :
Très fréquent (≥ 1/10)
Fréquent (≥ 1/100, < 1/10)
Peu fréquent (≥ 1/1 000, < 1/100)
Rare (≥ 1/10 000, < 1/1 000)
Très rare (< 1/10 000)
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
|
Affections hématologiques et du système lymphatique |
Peu fréquent Des cas d’anémie hémolytique et de thrombocytopénie ont été signalés chez les patients traités par l’apomorphine. Rare Une éosinophilie est survenue rarement pendant le traitement par le chlorhydrate d'apomorphine hémihydraté. |
|
Affections du système immunitaire |
Rare Compte tenu de la présence de métabisulfite, des réactions allergiques (y compris anaphylaxie et bronchospasme) peuvent survenir. |
|
Affections psychiatriques |
Très fréquent Hallucinations. Fréquent Des troubles neuropsychiatriques (incluant une légère confusion transitoire et des hallucinations visuelles) sont survenus pendant le traitement par le chlorhydrate d'apomorphine hémihydraté. Indéterminée Troubles du contrôle des impulsions : des jeux pathologiques, une augmentation de la libido, une hypersexualité, des dépenses ou achats compulsifs, une consommation excessive de nourriture et une alimentation compulsive peuvent survenir chez les patients traités par des agonistes dopaminergiques, y compris l’apomorphine (voir rubrique 4.4). Agressivité, agitation. |
|
Affections du système nerveux |
Fréquent Au début du traitement, une sédation transitoire avec chaque dose d’apomorphine peut être rapportée ; elle disparaît habituellement après quelques semaines de traitement. L’apomorphine peut entraîner une somnolence. Vertiges/étourdissements ont été aussi rapportés. Peu fréquent L’apomorphine peut induire des dyskinésies pendant les périodes « on » qui peuvent être sévères dans certains cas, obligeant à l’arrêt du traitement chez quelques patients. L'apomorphine a été associée à des épisodes d'endormissement soudain. Voir rubrique 4.4. Indéterminée Syncope. Maux de tête. |
|
Affections vasculaires |
Peu fréquent Une hypotension orthostatique est peu fréquente et généralement transitoire (voir rubrique 4.4). |
|
Affections respiratoires, thoraciques et médiastinales |
Fréquent Bâillements ont été rapportés pendant le traitement par l’apomorphine. Peu fréquent Des cas de troubles respiratoires ont été rapportés. |
|
Affections gastro-intestinales |
Fréquent Nausées et vomissements, en particulier au début du traitement à l'apomorphine, généralement suite à une omission de dompéridone (voir rubrique 4.2). |
|
Affections de la peau et du tissu sous-cutané |
Peu fréquent Des réactions cutanées locales et généralisées ont été rapportées. |
|
Troubles généraux et anomalies au site d’administration |
Très fréquent Des lésions sous-cutanées se développent souvent aux sites d’injection chez la plupart des patients, et en particulier avec une utilisation continue. Il peut s'agir de nodules sous-cutanés, d'induration, d'érythème, de sensibilité et de panniculite. D’autres lésions locales (comme irritation, prurit, ecchymoses et douleur) peuvent aussi survenir. Peu fréquent Nécrose au site d’injection et ulcères ont aussi été rapportés. Indéterminée Œdème périphérique a été rapporté. |
|
Investigations |
Peu fréquent Des cas de positivité du test de Coombs ont été rapportés chez des patients traités par apomorphine. |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Les effets cliniques du surdosage avec l’apomorphine par cette voie d’administration sont peu connus.
Les symptômes de surdosage peuvent être traités empiriquement comme cela est suggéré ci-dessous :
· Des vomissements excessifs peuvent être traités par la dompéridone.
· La dépression respiratoire peut être traitée par la naloxone.
· Hypotension : prendre des mesures appropriées, par exemple relever les pieds du lit.
· La bradycardie peut être traitée par l’atropine.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Antiparkinsonien Dopaminergique, Agents dopaminergiques, Agonistes dopaminergiques, code ATC : N04BC07.
Mécanisme d’action
L'apomorphine est un stimulant direct des récepteurs de la dopamine et même si elle présente des propriétés agonistes des récepteurs D1 et D2, elle ne partage pas les voies de transport ou métaboliques de la lévodopa.
Même si chez les animaux de laboratoire intacts, l'administration d'apomorphine supprime la fréquence de décharge des cellules nigro-striatales et, si à faibles doses, elle produit une réduction de l'activité locomotrice (censé représenter l'inhibition pré-synaptique de la libération de dopamine endogène), son effet sur les troubles moteurs du parkinsonien semble lié à une action sur les sites récepteurs post-synaptiques. Cet effet biphasique s'observe également chez l'homme.
5.2. Propriétés pharmacocinétiques
Le métabolisme de l'apomorphine fait appel à la glucuro-conjugaison et la sulfono-conjugaison pour au moins dix pour cent du total, aucune autre voie n'a été décrite.
5.3. Données de sécurité préclinique
Des études de génotoxicité in vitro ont démontré un effet mutagène et clastogène, dû la plupart du temps à des dérivés formés par oxydation de l'apomorphine. Cependant, l'apomorphine n'était pas génotoxique dans les études réalisées in vivo.
Les effets de l'apomorphine sur la reproduction ont été investigués chez le rat. Dans cette espèce, l'apomorphine n'est pas tératogène, mais il a été noté que des doses toxiques pour la mère peuvent produire une carence de soins maternels et des troubles respiratoires chez le nouveau-né.
Des études de carcinogénèse n'ont pas été réalisées.
Chlorure de sodium, métabisulfite de sodium (E223), acide chlorhydrique (pour ajustement du pH), eau pour préparations injectables.
Ce médicament ne doit pas être mélangé avec d'autres médicaments.
18 mois.
Après ouverture de l'ampoule : Une fois ouvert, le médicament doit être utilisé immédiatement.
D'un point de vue microbiologique, sauf si la méthode d'ouverture et de manipulation ultérieure prévient tout risque de contamination microbienne, le médicament doit être utilisé immédiatement. En cas d’utilisation non immédiate, la durée et les conditions de conservation en cours d’utilisation relèvent de la seule responsabilité de l’utilisateur.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 30 °C. A conserver dans l'emballage d'origine, à l'abri de la lumière. Ne pas mettre au réfrigérateur, ne pas congeler.
Pour les conditions de conservation après ouverture du médicament, voir rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Ampoule de 10 mL de solution en verre brun (Type I) munie d’un système d’ouverture OPC (One Point Cut).
Les ampoules sont emballées dans une pellicule. Les pellicules sont emballées dans une boîte en carton.
Présentations :
· 5, 10, 25 ou 50 ampoules.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
À usage unique seulement.
La solution doit être inspectée visuellement avant utilisation et après le remplissage du médicament dans la seringue. Ne pas utiliser si la solution est devenue verte. Une solution claire et incolore à jaunâtre, exempte de particules visibles dans une ampoule non endommagée doit être utilisée.
Après ouverture de l'ampoule, le produit doit être utilisé immédiatement. Jetez toute portion inutilisée.
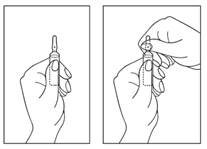
Instruction sur l'ouverture de l'ampoule :
1) Tournez l'ampoule avec la pointe colorée vers le haut. S'il y a une solution dans la partie supérieure de l'ampoule, tapotez doucement avec votre doigt pour amener toute la solution dans la partie inférieure de l'ampoule.
2) Utilisez les deux mains pour ouvrir ; tout en tenant la partie inférieure de l'ampoule d'une main, utilisez l'autre main pour casser la partie supérieure de l'ampoule dans le sens opposé au point coloré (voir les images ci-dessous).
|
|
Tout médicament non utilisé ou déchet doit être éliminé conformément aux exigences locales.
Perfusion continue et utilisation d'une mini pompe et/ou d'un pousse-seringue
Le choix de la mini-pompe et/ou du pousse-seringue à utiliser, ainsi que les réglages de dosage requis, seront déterminés par le médecin en fonction des besoins particuliers du patient.
APOMORPHINE KALCEKS 5 mg/mL, solution pour perfusion est compatible avec les seringues en polypropylène (PP) et polycarbonate (PC) et les tubes en polychlorure de vinyle (PVC) et en polyéthylène (PE).
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
AKCIJU SABIEDRIBA KALCEKS
KRUSTPILS IELA 53
RĪGA, LV-1057
LETTONIE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 164 9 1 : 10 mL de solution en ampoule (verre), boîte de 5.
· 34009 302 165 0 7 : 10 mL de solution en ampoule (verre), boîte de 10.
· 34009 302 165 1 4 : 10 mL de solution en ampoule (verre), boîte de 25.
· 34009 302 165 3 8 : 10 mL de solution en ampoule (verre), boîte de 50.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I