RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 04/05/2020
VACCIN RABIQUE INACTIVE MERIEUX, poudre et solvant pour suspension injectable
Vaccin rabique préparé sur cellules diploïdes humaines
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Après reconstitution, 1 dose (1 mL) contient :
Virus de la rage* souche WISTAR Rabies PM/WI38 1503-3M
(inactivé par la bêta-propiolactone)…………........................................................................ ≥ 2,5 UI**
* Produit sur cellules diploïdes humaines.
** Activité mesurée par le test NIH avant et après chauffage à 37°C pendant un mois.
Pour la liste complète des excipients, voir rubrique 6.1.
VACCIN RABIQUE INACTIVE MERIEUX peut contenir des traces de néomycine, utilisée lors du procédé de fabrication (voir rubrique 4.4).
Poudre et solvant pour suspension injectable.
Poudre homogène de couleur beige rosé à jaune orangé.
4.1. Indications thérapeutiques
VACCIN RABIQUE INACTIVE MERIEUX doit être utilisé sur la base des recommandations officielles.
La prophylaxie de pré-exposition doit être proposée aux sujets ayant un risque élevé de contamination par le virus de la rage.
Toute personne à risque continu, tel que le personnel de laboratoire de diagnostic, de recherche et de production qui travaille sur le virus rabique, doit être vaccinée.
La vaccination est également recommandée pour les catégories suivantes :
· les chiroptérologues et personnes régulièrement exposées aux virus de la rage des chauves-souris.
· les professionnels exposés (personnels des services vétérinaires, personnels des laboratoires manipulant du matériel contaminé ou susceptible de l’être, équarrisseurs, personnels des fourrières, naturalistes, taxidermistes, gardes-chasse, gardes forestiers, personnels des abattoirs).
· les adultes et les enfants résidant ou séjournant dans les zones d'enzootie.
Les rappels seront fonction du niveau de risque d’exposition et des contrôles sérologiques, conformément aux recommandations officielles.
4.2. Posologie et mode d'administration
La dose recommandée est de 1 mL de vaccin reconstitué.
Prophylaxie pré-exposition
En primovaccination, 3 doses de VACCIN RABIQUE INACTIVE MERIEUX de 1 mL sont administrées aux jours (J) J0, J7, J28. La dose prévue à J28 pourra éventuellement être administrée à J21.
Les rappels seront fonction du niveau de risque d’exposition et des contrôles sérologiques, conformément aux recommandations officielles.
Propylaxie post-exposition
La prophylaxie post-exposition comprend le traitement local non spécifique de la blessure, la vaccination et selon le cas l’immunisation passive par les immunoglobulines rabiques.
Elle doit être intitiée le plus tôt possible après une exposition suspectée à la rage. Dans tous les cas, un traitement approprié de la plaie (lavage soigneux de toutes les morsures et griffures avec du savon ou du détergent et des quantités abondantes d’eau et/ou d’agents virucides) doit être effectué immédiatement ou dès que possible après exposition. Il doit être mis en œuvre avant l’administration du vaccin ou des immunoglobulines rabiques lorsqu’elles sont indiquées. La prophylaxie post-exposition sera adaptée en fonction de la catégorie d’exposition, de l’état de l’animal (voir tableau 2) et du statut vaccinal du patient, conformément aux recommandations officielles (voir Tableau 1, recommandations de l’OMS).
La vaccination de post-exposition doit être effectuée sous contrôle médical et uniquement dans un centre antirabique, le plus tôt possible après l’exposition.
La prophylaxie post-exposition doit être complétée si nécessaire par une prophylaxie antitétanique et antibiotique afin de prévenir l’apparition d’infections autres que la rage.
Tableau 1 : Guide OMS de la prophylaxie post-exposition en fonction de la sévérité de l’exposition (à adapter selons les recommandations officielles locales)
|
Catégorie d’exposition |
Type d'exposition à un animal domestique ou sauvage, suspecté ou confirmé enragé ou non disponible pour le test |
Prophylaxie post-exposition recommandée |
|
I |
Contact ou alimentation de l'animal (pas d’exposition) |
Aucune si une anamnèse peut être obtenue(a). |
|
II |
Peau découverte mordillée (exposition) |
Administrer le vaccin immédiatement. Arrêter le traitement si l’animal est en bonne santé à l’issue de la période d’observation de 10 jours(b) ou si la recherche de la rage par les techniques de laboratoire appropriées est négative. Traiter comme une catégorie III en cas d’exposition aux chauves-souris. |
|
III |
Morsure(s)(c) ou griffure(s) ayant traversé la peau, léchage sur peau érodée ou contamination des muqueuses par la salive (léchage), exposition aux chauves-souris (exposition sévère) |
Administrer le vaccin immédiatement, et les immunoglobulines rabiques, de préférence dès que possible après le début de la prophylaxie post-exposition. Les immunoglobulines rabiques peuvent être injectées jusqu'à 7 jours après l'administration de la première dose de vaccin. Arrêter le traitement si l’animal est en bonne santé à l’issue de la période d’observation de 10 jours(b) ou si la recherche de la rage par les techniques de laboratoire appropriées est négative. |
(a) S'il s'agit d'un chien ou d'un chat apparemment en bonne santé vivant dans une zone à risque faible et placé sous observation vétérinaire, le traitement peut être différé (voir tableau 2).
(b) Cette durée d’observation ne s’applique qu’aux chats et aux chiens. À l’exception des espèces en voie de disparition ou menacées, les animaux domestiques et les animaux sauvages présumés enragés seront euthanasiés et leurs tissus examinés par les techniques de laboratoire appropriées (voir tableau 2).
(c) Les morsures, en particulier celles de la tête, du cou, du visage, des mains et des organes génitaux sont des expositions de catégorie III en raison de la forte innervation de ces zones.
Tableau 2 : Guide de la conduite à tenir après exposition en fonction du statut de l’animal (recommandations OMS à adapter selon les recommandations locales)
|
Circonstances |
Mesures à prendre concernant |
Remarques |
|
|
L’animal |
Le patient |
||
|
Animal indisponible Circonstances suspectes ou non |
|
Le conduire au centre antirabique pour traitement |
Le traitement(b) sera toujours mené jusqu’à son terme |
|
Animal mort Circonstances suspectes ou non |
Faire acheminer l’encéphale à un laboratoire agréé pour analyse |
Le conduire au centre antirabique pour traitement |
Le traitement(b) sera interrompu si les analyses sont négatives ou poursuivi dans le cas contraire |
|
Animal vivant Circonstances non suspectes |
Le mettre sous surveillance vétérinaire(a) |
Différer le traitement antirabique |
Le traitement(b) sera poursuivi selon la surveillance vétérinaire de l’animal |
|
Animal vivant Circonstances suspectes |
Le mettre sous surveillance vétérinaire(a) |
Le conduire au centre antirabique pour traitement |
Le traitement(b) sera interrompu si la surveillance vétérinaire infirme les doutes initiaux, ou poursuivi dans le cas contraire |
(a) En France, la surveillance vétérinaire comporte 3 certificats établis à J0, J7 et J14 déclarant l'absence de signe de rage. Selon les recommandations de l'OMS, la durée d'observation minimale de la surveillance vétérinaire pour les chiens et les chats est de 10 jours.
(b) Le traitement est recommandé en fonction de la la sévérité de l’exposition (voir tableau 1).
· Prophylaxie post-exposition des sujets non-immunisés (sujets n’ayant pas reçu de vaccination pré-exposition)
Cinq doses de VACCIN RABIQUE INACTIVE MERIEUX de 1 mL sont administrées à J0, J3, J7, J14 et J28 (schéma Essen).
Le VACCIN RABIQUE INACTIVE MERIEUX peut également être adminsitré selon le schéma Zagreb qui consiste à administrer 2 doses de vaccin à J0, en deux sites différents du corps, puis 1 dose à J7 et 1 dose à J21.
Des immunoglobulines rabiques doivent être administrées en association en cas d’exposition de catégorie III (Classification OMS, voir tableau 1). Se reporter à la notice de l’immunoglobuline rabique utilisée.
Si possible, le vaccin doit être administré contro-latéralement aux sites d’administration de l’immunoglobuline.
· Prophylaxie post-exposition des sujets déjà immunisés
Les sujets déjà immunisés doivent recevoir 1 dose de vaccin à J0 et 1 dose à J3 par voie intramusculaire. Les immunoglobulines rabiques ne sont pas indiquées dans ce cas.
Conformément aux recommandations officielles, ceci s’applique aux sujets ayant déjà reçu une prophylaxie pré-exposition, une prophylaxie post-exposition ou ayant arrêté la prophylaxie post-exposition après avoir reçu au moins deux doses de vaccin.
Sujets immunodéficients
· Prophylaxie pré-exposition
Pour les sujets immunodéficients, un contrôle sérologique des anticorps neutralisants doit être réalisé 2 à 4 semaines après la vaccination afin d’évaluer la nécessité d’une éventuelle dose supplémentaire de vaccin.
· Prophylaxie post-exposition
Pour les sujets immunodéficients, un schéma vaccinal complet doit être administré en post-exposition. Des immunoglobulines rabiques doivent être administrées en association avec le vaccin devant toute exposition de catégorie II et III (voir tableau 1).
Population pédiatrique
Un enfant doit recevoir la même dose qu’un adulte (1mL).
Mode d’administration
Précautions à prendre avant la manipulation ou l’administration du médicament
Le vaccin est administré par voie intramusculaire uniquement. Le vaccin doit être administré dans la région antérolatérale du muscle de la cuisse chez les nourrissons et les jeunes enfants ou dans le deltoïde chez les enfants plus âgés et les adultes.
Ne pas injecter dans la région fessière, car l’absorption est imprévisible.
Ne pas injecter par voie intravasculaire.
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique 6.6.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1, à une précédente administration ou à un vaccin contenant les mêmes composants.
La vaccination doit être différée en cas de maladies fébriles ou aigües.
Prophylaxie post-exposition
En raison de l’évolution toujours fatale de l’infection rabique déclarée, la vaccination de post-exposition ne connaît aucune contre-indication.
4.4. Mises en garde spéciales et précautions d'emploi
Comme tous les vaccins, VACCIN RABIQUE INACTIVE MERIEUX peut ne pas protéger 100 % des personnes vaccinées.
A utiliser avec prudence chez les personnes présentant une allergie connue à la néomycine (présente à l’état de traces dans le vaccin) ou à d’autres antibiotiques de la même classe.
Précautions d’emploi
Les recommandations relatives au schéma d’injection doivent être scrupuleusement suivies.
Le recours à des contrôles sérologiques (afin d’évaluer la séroconversion des sujets) doit être évalué conformément aux recommandations officielles.
Lorsque le vaccin est administré à des sujets présentant une immunodéficience connue, due à une maladie suppressive ou à un traitement immunosuppresseur concomitant, un contrôle sérologique doit être réalisé 2 à 4 semaines après la vaccination (voir rubrique 4.2).
Ne pas injecter par voie intravasculaire : s’assurer que l’aiguille ne pénètre pas dans un vaisseau sanguin.
Comme pour tout vaccin injectable, un traitement médical approprié doit être disponible immédiatement et une surveillance doit être effectuée dans le cas d’une réaction anaphylactique rare survenant après l’administration du vaccin.
Comme pour tout vaccin injectable, VACCIN RABIQUE INACTIVE MERIEUX doit être administré avec précautions en cas de thrombocytopénie ou de troubles de la coagulation car l’injection intramusculaire peut entrainer un saignement chez ces sujets.
Des réactions liées à l'anxiété, notamment des réactions vasovagales (syncope), une hyperventilation ou des réactions liées au stress peuvent survenir après toute vaccination, voire même avant, comme réaction psychogène à l'injection avec une aiguille.
Ceci peut s'accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision et des paresthésies. Il est important que des mesures soient mises en place afin d'éviter toute blessure en cas d'évanouissement.
Les tip-caps (capuchons de protection) des seringues préremplies contiennent un dérivé naturel de latex qui pourrait provoquer des réactions allergiques sévères chez les personnes sensibles au latex.
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Population pédiatrique
Le risque potentiel d’apnée avec nécessité de surveillance respiratoire pendant 48-72 h doit être soigneusement pris en compte lors de l’administration des doses de primovaccination chez les grands prématurés (nés à 28 semaines de grossesse ou moins) et particulièrement chez ceux ayant des antécédents d’immaturité respiratoire.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les traitements immunosuppresseurs, incluant la corticothérapie au long cours par voie systémique, peuvent interférer avec la production d’anticorps et entrainer l’échec de la vaccination. Il est donc recommandé de réaliser un contrôle sérologique 2 à 4 semaines après la vaccination (voir rubriques 4.2 et 4.4).
Les immunoglobulines rabiques ou tout autre produit et le vaccin rabique ne doivent jamais être associés dans la même seringue ou administrés au même site (voir rubrique 6.2).
Etant donné que les immunoglobulines rabiques interfèrent avec le développement de la réponse immunitaire au vaccin rabique, les recommandations d’administration des immunoglobulines rabiques doivent être strictement suivies.
4.6. Fertilité, grossesse et allaitement
Grossesse
Une étude de toxicité chez l’animal sur la reproduction et le développement, conduite avec un autre vaccin rabique inactivé produit sur cellules VERO, n’a pas mis en évidence d’effet délétère sur la fertilité des femelles ni sur le développement pré et post natal.
En clinique, l’utilisation des vaccins contre la rage (ʺsouche WISTAR Rabies PM/WI38 1503-3M" inactivée) au cours d’un nombre limité de grossesses n’a révélé aucun effet malformatif ou fœtotoxique à ce jour.
En raison de la gravité de la maladie, la vaccination doit être réalisée pendant la grossesse, conformément au schéma habituel de vaccination, en cas de risque élevé de contamination.
L’utilisation de ce vaccin est possible au cours de l’allaitement.
Fertilité
VACCIN RABIQUE INACTIVE MERIEUX n’a pas été évalué dans des études de fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont pas été étudiés.
Résumé du profil de tolérance
Plus de 1600 sujets, incluant environ 600 enfants et adolescents, ont reçu au moins une dose de VACCIN RABIQUE INACTIVE MERIEUX, dans le cadre d’études cliniques.
Les effets indésirables étaient généralement d’intensité modérée et survenus dans les 3 jours suivant la vaccination. La plupart des effets se sont spontanément résolus dans les 1 à 3 jours suivant leur apparition.
Les effets indésirables les plus fréquents, dans tous les groupes d’âges, étaient douleur au site d’injection, céphalées, malaises et myalgies.
Liste tabulée des effets indésirables
Les effets indésirables listés ci-dessous sont ceux issus d’études cliniques et de la surveillance après commercialisation à travers le monde.
Dans chaque classe de système d’organes, les événements indésirables sont classés par fréquence, les réactions les plus fréquentes en premier, selon la convention suivante :
· très fréquent (≥ 1/10) ;
· fréquent (≥ 1/100 et < 1/10) ;
· peu fréquent (≥ 1/1 000 et < 1/100) ;
· rare (≥ 1/10 000 et < 1/1 000) ;
· très rare (< 1/10 000), y compris incluant des cas isolés ;
· Fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Effets indésirables |
Adultes |
Enfants et Adolescents Jusqu’à 17 ans |
|
Fréquence |
Fréquence |
|
|
ETUDES CLINIQUES |
||
|
Affections hématologiques et du système lymphatique |
||
|
Lymphadénopathies |
Peu fréquent |
- |
|
Affections gastro-intestinales |
||
|
Nausées |
Fréquent |
- |
|
Douleurs abdominales |
Peu fréquent |
- |
|
Diarrhées |
Peu fréquent |
- |
|
Vomissements |
Peu fréquent |
- |
|
Troubles généraux et anomalies au site d’administration |
||
|
Douleur au site d’injection |
Très fréquent |
Très fréquent |
|
Malaise |
Très fréquent |
Très fréquent |
|
Erythème au site d’injection |
Fréquent |
Fréquent |
|
Gonflement / Œdème / Induration au site d’injection |
Fréquent |
Fréquent |
|
Fièvre |
Fréquent |
Fréquent |
|
Prurit au site d’injection |
Fréquent |
Peu fréquent |
|
Hématome au point d’injection / Ecchymose |
Fréquent |
Peu fréquent |
|
Fatigue / asthénie |
Fréquent |
- |
|
Frissons |
Peu fréquent |
- |
|
Affections du système nerveux |
||
|
Céphalées |
Très fréquent |
Très fréquent |
|
Vertiges |
Peu fréquent |
Peu fréquent |
|
Paresthésies |
Peu fréquent |
- |
|
Affections musculo-squelettiques et du tissu conjonctif |
||
|
Myalgies |
Très fréquent |
Très fréquent |
|
Arthralgie |
Peu fréquent |
Peu fréquent |
|
Affections du système immunitaire |
||
|
Réaction allergique avec atteinte cutanée ou atteinte respiratoire |
Peu fréquent
|
-
|
|
Angiœdème |
Rare |
- |
|
EXPERIENCE APRES COMMERCIALISATION |
||
|
Affections du système nerveux |
||
|
Encéphalite |
Indéterminée |
Indéterminée |
|
Convulsions |
Indéterminée |
Indéterminée |
|
Neuropathies |
Indéterminée |
Indéterminée |
|
Affections du système immunitaire |
||
|
Réactions anaphylactiques |
Indéterminée |
Indéterminée |
|
Réactions de type maladie sérique |
Indéterminée |
Indéterminée |
Les réactions de type maladie sérique pourraient être associées à la présence d'albumine humaine modifiée par la bêta-propiolactone dans le VACCIN RABIQUE INACTIVE MERIEUX.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Aucun cas de surdosage n’a été rapporté.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Vaccins rabiques, Code ATC : J07BG01.
Mécanisme d’action
La protection après la vaccination est assurée par l'induction d'anticorps neutralisants antirabiques.
Des études cliniques ont été menées pour évaluer l'immunogénicité du vaccin en prophylaxie pré-exposition et post-exposition. Un taux d’anticorps neutralisants antirabiques ≥ 0,5 UI/mL est considéré comme protecteur.
Prophylaxie pré-exposition
Dans les essais cliniques évaluant un schéma à 3 doses (J0, J7, J28 (ou J21)) chez les adultes et les enfants, presque tous les sujets ont obtenu une réponse immunitaire adéquate avec des taux d'anticorps neutralisants antirabiques ≥ 0,5 UI/mL deux semaines après la fin de la première série.
Un suivi de dix ans chez 17 sujets ayant reçu le vaccin selon un schéma à 3 doses (J0, J7, J28) suivi d'une dose de rappel un an plus tard a montré la persistance de la réponse immunitaire avec des titres d’anticorps neutralisants antirabiques ≥ 0,5 UI/mL jusqu'à 10 ans chez 96,2 % des sujets (IC à 95 % : 88,8 ; 100).
Prophylaxie post-exposition
Dans les essais cliniques évaluant le schéma Essen à 5 doses (J0, J3, J7, J14, J28) chez les adultes et les enfants, avec ou sans immunoglobulines, le VACCIN RABIQUE INACTIVE MERIEUX a induit des titres adéquats d’anticorps neutralisants antirabiques (≥ 0,5 UI/mL) chez presque tous les sujets à J14 et chez tous les sujets à J42.
Dans un essai de phase 2, 124 adultes sains séronégatifs ont reçu le vaccin suivant le schéma Essen IM à 5 doses (D0, D3, D7, D14, D28) et des immunoglobulines humaines rabiques à J0. Tous les vaccinés ont atteint un titre d'anticorps neutralisants antirabiques ≥ 0,5 UI/mL à J14 avec un taux maximal à J42. Un an plus tard, le taux protecteur des anticorps neutralisants était maintenu chez 98,3 % des sujets (IC à 95 % : 93,9 ; 99,8).
Dans un essai clinique simulant une prophylaxie post-exposition, 47 sujets adultes déjà immunisés ont reçu 2 doses du VACCIN RABIQUE INACTIVE MERIEUX à 3 jours d'intervalle (J0 et J3), 1 an après l’immunisation primaire. Un taux protecteur en anticorps neutralisants antirabiques (≥ 0,5 UI/mL) a été atteint à J7 chez tous les sujets.
Population pédiatrique
L’immunogénicité du schéma pré-exposition (3 doses à J0, J7 et J28 par voie intramusculaire) a été évalué à J42 chez 112 sujets âgés de 2 à 17 ans inclus dans l'étude VRV06, et chez 190 sujets âgés de 5 à 13 ans inclus dans l’étude RAC03396. Tous les sujets vaccinés ont atteint un taux d’anticorps neutralisants antirabiques ≥ 0,5 UI/mL à J42.
5.2. Propriétés pharmacocinétiques
Aucune étude pharmacocinétique n’a été réalisée.
5.3. Données de sécurité préclinique
Solvant : eau pour préparations injectables.
Ce médicament ne doit pas être mélangé avec d’autres médicaments ou d’autres vaccins.
Après reconstitution, le vaccin doit être administré immédiatement.
6.4. Précautions particulières de conservation
A conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler.
A conserver dans l'emballage extérieur d'origine, à l'abri de la lumière.
Pour les conditions de conservation du médicament après reconstitution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Poudre en flacon (verre de Type I) muni d'un bouchon (chlorobutyle) et d'une capsule + 1 mL de solvant en seringue préremplie (verre de Type I) sans aiguille (Luer-lok™) avec un adaptateur rigide (polycarbonate) et un capuchon de protection en plastique rigide (« PRTC ») (polypropylène et isoprène- bromobutyle) munie d'un bouchon-piston (bromobutyle). Boîte de 1.
6.6. Précautions particulières d’élimination et de manipulation
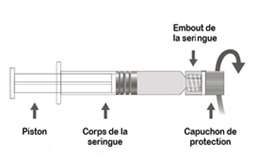
Instructions spécifiques pour la seringue Luer-lok™ :
1. En tenant l’embout de la seringue d’une main (éviter de tenir le piston ou le corps de la seringue), dévisser le capuchon de protection en le tournant dans le sens inverse des aiguilles d’une montre.
2. Pour fixer l’aiguille à la seringue, visser doucement l’aiguille dans le sens des aiguilles d’une montre sur la seringue jusqu’à sentir une légère résistance.
Reconstitution du vaccin : introduire le solvant dans le flacon de poudre et faire tourner doucement jusqu’à la mise en suspension complète de la poudre. La suspension doit être limpide ou légèrement opalescente, de couleur rouge à rouge violacé. Sans retirer l’aiguille du flacon, dévisser la seringue de l’aiguille afin d’éliminer la pression négative (le flacon étant scellé sous vide). Rattacher l'aiguille restée dans le flacon à la seringue (voir étape 2). Aspirer la totalité du contenu du flacon dans la seringue. Dévisser l’aiguille pour reconstitution et la remplacer par une aiguille stérile pour injection intramusculaire (voir étape 2) de longueur appropriée au patient. Injecter immédiatement.
Le vaccin doit être inspecté visuellement avant administration pour vérifier l'absence de particules étrangères dans le vaccin.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Figure A : Seringue Luer-Lok™
|
|
Figure B: Etape 1
|
|
Figure C: Etape 2
|
|
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
14 ESPACE HENRY VALLÉE
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.