RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 13/04/2021
PROPOFOL BIOQ 10 mg/mL, émulsion pour perfusion en système d’administration
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 mL d’émulsion pour perfusion contient 10 mg de propofol. Chaque pompe à perfusion préremplie (système d'administration) contient une cartouche de 50 mL correspondant à 500 mg de propofol.
Excipient(s) à effet notoire : 1 mL d’émulsion pour perfusion contient 100 mg d’huile de soja raffinée.
Chaque pompe à perfusion préremplie (système d'administration) contient 5 g d’huile de soja raffinée.
Pour la liste complète des excipients, voir rubrique 6.1.
Emulsion pour perfusion.
Emulsion isotonique blanche huile-dans-eau.
Osmolarité : 285 à 320 mOsm/kg.
Le pH se situe entre 6,0 et 8,5.
4.1. Indications thérapeutiques
PROPOFOL BIOQ est un agent anesthésique intraveineux, d’action rapide pour :
· L’induction et l’entretien de l’anesthésie générale chez les adultes, les adolescents et les enfants de 40 kg ou plus.
· La sédation lors de gestes chirurgicaux ou de procédures diagnostiques, seul ou associé à une anesthésie locale ou régionale, chez les adultes, les adolescents et les enfants de 40 kg ou plus.
· La sédation des patients ventilés âgés de plus de 16 ans, en unité de soins intensifs.
4.2. Posologie et mode d'administration
PROPOFOL BIOQ doit être uniquement administré au sein d’un établissement hospitalier ou dans des centres de jour équipés de manière adéquate par des médecins formés à l'anesthésie ou à la prise en charge des patients en soins intensifs.
Les fonctions circulatoires et respiratoires doivent être surveillées de façon constante (par exemple : électrocardiogramme, oxymètre de pouls) et le matériel nécessaire pour le maintien des voies respiratoires, la ventillation artificielle, ainsi que les autres équipements de réanimation doivent être immédiatement accessibles à tout moment.
Pour la sédation durant les procédures chirurgicales et diagnostiques, le PROPOFOL BIOQ ne doit pas être administré par la même personne conduisant la procédure chirugicale ou diagnostique.
Le PROPOFOL BIOQ n’a pas de propriétés analgésiques, c’est pourquoi des agents analgésiques sont généralement nécessaires en association au PROPOFOL BIOQ.
Posologie
La dose de PROPOFOL BIOQ est définie en saisissant le poids du patient (valeur minimale : 40 kg et la vitesse de perfusion (en mg/kg de poids corporel/h) sur la pompe à perfusion préremplie (système d'administration, voir rubrique 6.6). Elle doit être adaptée individuellement selon la réponse du patient.
PROPOFOL BIOQ n’est pas destiné à être utilisé dans le cadre d’une perfusion contrôlée par la cible.
L’administration rapide en bolus (simple ou répétée) ne doit pas être utilisée chez le sujet âgé car cela peut conduire à une dépression cardiorespiratoire.
Anesthésie générale chez les adultes, les adolescents et les enfants de 40 kg ou plus
Induction de l’anesthésie
Pour l’induction de l’anesthésie, il faut ajuster la dose de PROPOFOL BIOQ (environ 20 - 40 mg de propofol, correspondant à 2 – 4 mL de PROPOFOL BIOQ toutes les 10 secondes) en fonction de la réponse du patient, jusqu’à ce que les signes cliniques montrent l’apparition de la narcose, en appuyant sur le bouton « Bolus/Amorce » de la pompe à perfusion préremplie (système d'administration, voir rubrique 6.6).
Chez les adultes âgés de moins de 55 ans, la dose requise sera généralement de 1,5 à 2,5 mg de propofol/kg de poids corporel.
Chez les adultes âgés de plus de 55 ans et chez les patients ASA (American Society of Anaesthesiologists) grades III et IV, en particulier ceux présentant une insuffisance cardiaque, la dose requise sera généralement moindre et la dose totale de PROPOFOL BIOQ pourra être réduite à un minimum de 1 mg de propofol/kg de poids corporel. Une vitesse d’administration de PROPOFOL BIOQ plus lente doit être utilisée (environ 2 mL, soit 20 mg de propofol, toutes les 10 secondes).
Entretien de l’anesthésie
L’entretien de l’anesthésie peut se faire par perfusion de PROPOFOL BIOQ.
Pour l’entretien de l’anesthésie par perfusion continue, des doses de 4 à 12 mg de propofol/kg de poids corporel/heure sont généralement utilisées.
Chez les patients âgés, les patients avec des fonctions générales instables, les patients présentant une insuffisance cardiaque ou les patients hypovolémiques et les sujets ASA de grade III et IV, la dose de PROPOFOL BIOQ peut être réduite ultérieurement selon l’état du patient et la technique anesthésique utilisée.
Sédations pour les procédures diagnostiques et les interventions chirurgicales chez les adultes, les adolescents et les enfants de 40 kg ou plus
Afin d’apporter une sédation pendant les interventions chirurgicales et diagnostiques, il convient d’adapter les doses et les vitesses d’administration à la réponse clinique.
Chez la plupart des patients, il faudra utiliser 0,5 à 1,0 mg de propofol/kg de poids corporel administrés sur 1 à 5 minutes pour l’induction de la sédation.
Pour l’entretien de la sédation, la perfusion de PROPOFOL BIOQ devra être adaptée jusqu’à obtention du niveau de sédation désiré. Une dose de 1,5 à 4,5 mg/kg de poids corporel/heure sera généralement requise.
Cette perfusion pourra être complétée par des injections en bolus de 20 mg (2 mL de PROPOFOL BIOQ) si un niveau de sédation plus profond est requis rapidement.
Chez les patients de plus de 55 ans et chez les patients ASA de grades III et IV, il peut être nécessaire de réduire le débit d’administration et le dosage.
Sédation des patients sous ventilation artificielle adultes et adolescents (âgés de plus de 16 ans) durant les soins intensifs
Lors de l’utilisation en sédation chez les patients ventilés nécessitant des soins intensifs, il est recommandé d’administrer PROPOFOL BIOQ en perfusion continue. Il faudra ajuster la dose en fonction de la profondeur de la sédation souhaitée.
Pour la plupart des patients, une sédation suffisante est obtenue avec une dose de 0,3 – 4,0 mg de propofol/kg de poids corporel/heure (voir rubrique 4.4).
Il est recommandé de mesurer les taux de lipides sanguins si PROPOFOL BIOQ doit être administré à des patients présentant un risque élevé de surcharge lipidique. L’administration de PROPOFOL BIOQ devra être ajustée de manière appropriée si les analyses montrent que les lipides ne sont pas correctement éliminés de l’organisme. Si le patient reçoit en même temps d’autres lipides par voie intraveineuse, la quantité sera réduite de manière à prendre en compte la teneur en lipides dans la perfusion de la formulation PROPOFOL BIOQ ; 1,0 mL de PROPOFOL BIOQ contient environ 0,1 g de lipides.
Surveiller les lipides après 3 jours de traitement en unité de soins intensifs.
Population pédiatrique
Le PROPOFOL BIOQ ne peut pas être utilisé pour l’induction et l’entretien de l’anesthésie générale et la sédation pour les procédures diagnostiques/chirurgicales chez les enfants et les adolescents dont le poids corporel est inférieur à 40 kg. Toutefois, d’autres formulations de propofol sont disponibles pour une utilisation avec les enfants âgés de plus de 1 mois.
L’utilisation de PROPOFOL BIOQ est contre-indiquée chez les enfants et les adolescents de 16 ans ou de moins de 16 ans pour la sédation en soins intensifs (voir rubrique 4.3).
Mode d’administration
Le PROPOFOL BIOQ est administré par voie intraveineuse en perfusion continue.
Le contenu d’une pompe à perfusion préremplie (système d'administration) est réservé à un usage unique, pour un seul patient.
Afin d’atténuer la douleur au point de perfusion, il est possible d’injecter de la lidocaïne juste avant l’utilisation de PROPOFOL BIOQ. Pour les risques spécifiques liés à l’utilisation de lidocaïne, voir les rubriques 4,4 et 4,8.
Voir la rubrique 6.6 pour les précautions et les informations à respecter avant l’utilisation de la pompe à perfusion préremplie (système d'administration).
Il ne faut pas mélanger PROPOFOL BIOQ avec d’autres solutions pour perfusion ou injection excepté celles mentionnées dans la rubrique 6.6.
Durée d’administration
Comme toujours dans le cas de l’administration parentérale de toutes sortes d’émulsions lipidiques, la durée d’utilisation d’une même pompe à perfusion préremplie PROPOFOL BIOQ pour une perfusion continue ne doit pas dépasser 12 heures
La durée d’administration de propofol ne doit pas dépasser 7 jours.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· Hypersensibilité à l’arachide ou au soja.
· pour la sédation de patients âgés de 16 ans ou de moins de 16 ans en unité de soins intensifs (voir rubrique 4.4).
4.4. Mises en garde spéciales et précautions d'emploi
PROPOFOL BIOQ doit être administré par des médecins spécialisés en anesthésie (ou, si approprié, par des médecins formés aux soins aux patients en soins intensifs).
Les patients doivent être maintenus sous surveillance constante et le matériel nécessaire pour le maintien des voies respiratoires libres, la ventilation artificielle, l'enrichissement en oxygène, ainsi que les autres équipements de réanimation, doivent être immédiatement accessibles à tout moment. Le PROPOFOL BIOQ ne doit pas être administré par la même personne conduisant la procédure chirurgicale ou diagnostique.
Des abus médicamenteux et dépendances au PROPOFOL BIOQ ont été rapportés, majoritairement chez des professionnels de la santé. De même que pour les autres anesthésiques généraux, l’administration du PROPOFOL BIOQ sans soins aux voies respiratoires peut conduire à des complications respiratoires fatales.
Lorsque le PROPOFOL BIOQ est administré pour induire une sédation consciente afin de pratiquer des procédures chirurgicales ou diagnostiques, les patients doivent être maintenus sous surveillance constante afin de détecter tout signe précoce d'hypotension, d'obstruction des voies respiratoires et de désaturation en oxygène.
De même que pour tout agent sédatif, lorsque le PROPOFOL BIOQ est administré pour induire une sédation au cours de procédures chirurgicales, des mouvements spontanés du patient peuvent survenir. Lorsque des procédures requièrent une immobilité totale, ces mouvements peuvent être source de danger au niveau du site de l’intervention.
Après l'utilisation du PROPOFOL BIOQ, il convient de prévoir une période suffisante avant la sortie du patient de l’hôpital afin de s'assurer de sa récupération complète. Très rarement, l'utilisation du propofol peut être associée à la survenue d'une période d'inconscience post-opératoire, laquelle peut être accompagnée d'une augmentation du tonus musculaire. Cette période peut, ou non, être précédée d'une période d'éveil. Bien que la récupération soit spontanée, des soins appropriés doivent être apportés au patient inconscient.
Les troubles induits par le propofol ne sont généralement plus détectables au-delà de 12 heures. Les effets du propofol, la procédure, les médications concomitantes, l'âge et l'état de santé du patient doivent être pris en compte concernant les éventuelles recommandations faites aux patients de :
· se faire accompagner à la sortie du lieu d'administration
· patienter un certain temps avant de reprendre des activités dangereuses ou requérant certaines compétences, telles que la conduite de véhicules
· prendre des précautions concernant la prise d'autres agents ayant un éventuel effet sédatif (tels que benzodiazépines, opiacés, alcool).
Lors de l’induction de l’anesthésie, une hypotension et une apnée transitoire peuvent apparaître en fonction de la dose et de l’utilisation de prémédications et d’autres agents.
Groupes de patients spéciaux
Patients atteints d’une insuffisance cardiaque, circulatoire ou pulmonaire, ou atteints d’hypovolémie.
Comme avec d’autres anesthésiques intraveineux, il convient de procéder avec prudence chez les patients souffrant d’insuffisance cardiaque, respiratoire, rénale ou hépatique, ou chez les patients affaiblis ou hypovolémiques. La clairance du propofol est dépendante du flux sanguin, c'est pourquoi les traitements concomitants réduisant le débit cardiaque réduisent également la clairance du propofol.
Avant l’administration de propofol, il faudra compenser une éventuelle insuffisance cardiaque, circulatoire ou pulmonaire, de même qu’une éventuelle hypovolémie.
Chez les patients présentant une insuffisance cardiaque sévère, il est recommandé d’administrer PROPOFOL BIOQ avec beaucoup de prudence et sous surveillance intensive.
En cas de surcharge pondérale sévère, les doses requises étant plus élevées, il faudra tenir compte de l’augmentation du risque d’effets indésirables hémodynamiques.
Le propofol n’a pas d'activité vagolytique et a été associé à des cas de bradycardie (occasionnellement grave) ainsi que d'asystole. On devra envisager l'administration intraveineuse d'un agent anticholinergique avant l'induction ou pendant l'entretien d'une anesthésie par PROPOFOL BIOQ, en particulier dans les situations lors desquelles un tonus vagal risque d'être prédominant ou lorsque PROPOFOL BIOQ est utilisé en même temps que d'autres médicaments susceptibles d'induire une bradycardie.
Personnes âgées
Chez les personnes âgées, le PROPOFOL BIOQ l doit être administré avec prudence et à une vitesse réduite (voir rubrique 4.2).
Épilepsie
L'administration du PROPOFOL BIOQ chez un patient épileptique peut provoquer des convulsions.
Avant l’anesthésie d’un patient épileptique, il faudra vérifier que le patient ait bien reçu un traitement antiépileptique. Bien que plusieurs études aient démontré une efficacité dans le traitement du mal épileptique, l’administration du propofol chez les patients épileptiques peut également augmenter le risque de crise d’épilepsie.
L’utilisation du propofol n’est pas recommandée lors de traitement par électroconvulsivothérapie.
Patients présentant une pression intracrânienne élevée
Un soin particulier devrait être apporté aux patients présentant une pression intracrânienne élevée et une pression artérielle basse puisqu’il y a un risque de diminution significative de la pression de perfusion intracérébrale.
Patients atteints de troubles héréditaires
PROPOFOL BIOQ ne doit pas être utilisé en association, avec une solution de lidocaïne chez les patients présentant une prédisposition héréditaire à la porphyrie aiguë.
Population pédiatrique
PROPOFOL BIOQ ne doit pas être utilisé pour l’induction ou l’entretien de l’anesthésie générale et pour la sédation dans le cadre des procédures diagnostiques et chirurgicales chez les enfants et les adolescents dont le poids corporel est inférieur à 40 kg car c’est le poids minimum qu’il est possible de saisir sur la pompe à perfusion préremplie (système d'administration).
PROPOFOL BIOQ est contre-indiqué chez les patients âgés de 16 ans ou moins pour l’indication de sédation en soins intensifs étant donné que la tolérance et l’efficacité du propofol n'ont pas été démontrées pour la sédation chez les enfants âgés de 16 ans ou de moins de 16 ans (voir rubrique 4.3).
Recommandations en unité de soins intensifs
L'utilisation du PROPOFOL BIOQ, émulsion pour perfusion pour la sédation en unité de soins intensifs a été associée à toute une constellation de troubles métaboliques et de défaillances de systèmes d'organes pouvant entraîner le décès.
Des cas ont été observés combinant : acidose métabolique, rhabdomyolyse, hyperkaliémie, hépatomégalie, insuffisance rénale, hyperlipidémie, arythmie cardiaque, ECG de type Brugada (sus-décalage du segment ST et ondes T en aspect de dôme), ainsi qu'insuffisance cardiaque d'évolution rapide, ne répondant généralement pas à un traitement inotrope de soutien. Les combinaisons de ces événements sont appelées « syndrome de perfusion au propofol ». Ces événements ont été principalement observés chez des patients souffrant de sévères lésions à la tête et chez les enfants souffrant d'infections des voies respiratoires ayant reçu des dosages supérieurs à ceux recommandés chez l’adulte pour la sédation en unité de soins intensifs.
Les principaux facteurs de risque constatés de développer ces événements sont les suivants : réduction de l'apport en oxygène aux tissus ; lésion neurologique sévère et/ou septicémie ; doses élevées d'un ou plusieurs des agents pharmacologiques suivants : vasoconstricteurs, stéroïdes, inotropes et/ou propofol (généralement suite à une administration prolongée à des dosages supérieurs à 4 mg/kg/h pendant plus de 48 heures).
Les prescripteurs doivent être conscients de l'éventualité de la survenue de ces effets indésirables chez les patients présentant les facteurs de risque mentionnés ci-dessus et doivent arrêter immédiatement l’utilisation du propofol dès l’apparition des signes indiqués ci-dessus. Tous les agents sédatifs et thérapeutiques utilisés en unité de soins intensifs (USI), dont le propofol, doivent être titrés afin de maintenir un apport en oxygène et des paramètres hémodynamiques optimaux. Les patients présentant une pression intracrânienne élevée (PIC) doivent recevoir un traitement approprié pour maintenir la pression d’irrigation cérébrale lors de ces modifications de traitement. Il est rappelé au prescripteur de ne pas dépasser, dans la mesure du possible, la posologie de 4 mg/kg de poids corporel/h.
Il faudra être particulièrement prudent chez les patients présentant des troubles du métabolisme des lipides et dans les autres situations dans lesquelles les émulsions lipidiques doivent être utilisées avec précaution.
Il est recommandé de mesurer les taux de lipides sanguins si PROPOFOL BIOQ doit être administré à des patients présentant un risque élevé de surcharge lipidique. L’administration de PROPOFOL BIOQ devra être ajustée de manière appropriée si les analyses montrent que les lipides ne sont pas correctement éliminés de l’organisme. Si le patient reçoit en même temps d’autres lipides par voie intraveineuse (ex. nutrition parentérale), la quantité sera réduite de manière à prendre en compte la teneur en lipides dans la perfusion de la formulation PROPOFOL BIOQ ; 1,0 mL de PROPOFOL BIOQ contient environ 0,1 g de lipides.
Autres précautions d'emploi
Il est recommandé de procéder avec prudence pour le traitement de patients souffrant d'une maladie mitochondriale. Ces patients peuvent être sujets à des exacerbations de leurs troubles lors d'une anesthésie, d'une intervention chirurgicale et de soins intensifs. Il est recommandé de maintenir une normothermie, un apport en glucides ainsi qu'une bonne hydratation chez ces patients. Les signes précoces d'exacerbation d'une maladie mitochondriale et du « syndrome de perfusion au propofol » peuvent être similaires.
Le PROPOFOL BIOQ ne contient pas de conservateurs antimicrobiens et est donc susceptible de favoriser le développement de micro-organismes.
PROPOFOL BIOQ est réservé à un usage unique, pour un seul patient. Conformément aux guidelines établies pour les autres émulsions lipidiques, une perfusion unique de PROPOFOL BIOQ ne doit pas excéder 12h. À la fin de l’administration ou au bout de 12h, en fonction de la première échéance, la pompe à perfusion préremplie (système d'administration) et la tubulure de perfusion doivent être retirées et remplacées de manière appropriée.
Excipients
Ce médicament contient moins de 1 mmol (23 mg) de sodium par pompe à perfusion préremplie (système d'administration), c.-à-d. qu’il est essentiellement « sans sodium ».
Ce médicament contient de l’huile de soja. Si vous êtes allergique à l’arachide ou au soja, ne pas utiliser ce médicament.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
PROPOFOL BIOQ a été utilisé en association avec une anesthésie péridurale et une rachianesthésie, ainsi qu’en même temps que d’autres agents en prémédication, agents bloquants neuromusculaires, anesthésiques volatils, analgésiques ; à ce jour, aucune incompatibilité n’a été rencontrée. Des doses inférieures de PROPOFOL peuvent être nécessaires lorsqu’une anesthésie générale ou une sédation est utilisée en combinaison avec des techniques d'anesthésie régionale.
Des cas d'hypotension profonde ont été rapportés suite à l'induction d'une anesthésie par propofol chez des patients traités par rifampicine.
PROPOFOL BIOQ peut être utilisé en même temps que d’autres médicaments pour l’anesthésie (prémédication, anesthésiques volatils, analgésiques, myorelaxants, anesthésiques locaux). A ce jour, aucune interaction sévère avec ces médicaments n’a été rapportée. Certains de ces médicaments à action centrale peuvent produire un effet dépresseur circulatoire et respiratoire, entraînant ainsi une majoration de ces effets lorsqu’ils sont utilisés avec PROPOFOL BIOQ.
L’administration concomitante de benzodiazépines, de parasympatholytiques ou d’anesthésiques volatils allonge la durée de l’anesthésie et diminue la fréquence respiratoire.
Quand une anesthésie générale est associée à une anesthésie régionale, les doses requises de PROPOFOL BIOQ peuvent être moindres.
Après une prémédication additionnelle d’opiacés, les effets sédatifs du propofol peuvent être majorés et prolongés, et l’incidence et la durée des apnées augmentées.
La survenue d’une bradycardie et d’un arrêt cardiaque est possible après traitement par le suxaméthonium ou la néostigmine.
L’utilisation concomitante de propofol et de médicaments de prémédication, d’anesthésiques volatils ou d’analgésiques peut potentialiser l’anesthésie et les effets indésirables cardiovasculaires. L’utilisation concomitante de médicaments dépresseurs du système nerveux central comme par exemple, l’alcool, les anesthésiques généraux et les analgésiques narcotiques, peut provoquer une majoration de leurs effets sédatifs.
Après administration de fentanyl, les taux plasmatiques de propofol peuvent augmenter de façon temporaire avec une augmentation de la fréquence des apnées.
Chez des patients traités par de la ciclosporine, une leuco-encéphalopathie a été rapportée après administration d’émulsions lipidiques telles que le propofol.
Il a été constaté que les patients prenant du valproate avaient besoin de doses de propofol inférieures. En cas d’utilisation concomitante, une réduction de la dose de propofol doit être envisagée.
4.6. Fertilité, grossesse et allaitement
Grossesse
La sécurité du propofol chez la femme enceinte n'a pas été établie. Les études effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction (voir rubrique 5.3). Le PROPOFOL BIOQ n’est donc pas recommandé pendant la grossesse, sauf en cas de nécessité clairement établie. Le propofol franchit la barrière placentaire et peut provoquer une dépression des fonctions vitales néonatales. Le PROPOFOL BIOQ peut toutefois être utilisé au cours d'un avortement provoqué.
Des doses élevées (supérieures à 2,5 mg de propofol/kg de poids corporel en induction ou supérieures à 6 mg de propofol/kg de poids corporel/heure pour l’entretien de l’anesthésie) sont à éviter.
Allaitement
Des études menées auprès de mères allaitantes ont montré que de faibles quantités de propofol étaient excrétées dans le lait maternel. Par conséquent, pendant les 24 heures suivant l’administration de PROPOFOL BIOQ, l’allaitement doit être interrompu et le lait jeté.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les patients doivent être informés que leurs performances lors d'activités requérant certaines compétences, telles que la conduite de véhicules ou l'utilisation de machines, peuvent être perturbées pendant un certain temps après l'utilisation de PROPOFOL BIOQ.
Après l’administration de PROPOFOL BIOQ, il faudra garder le patient en observation pendant une durée de temps suffisante. Il faudra lui dire de ne pas conduire, utiliser des machines ou travailler dans des situations potentiellement dangereuses. Le patient devra quitter l’hôpital accompagné et la consommation d’alcool sera déconseillée pendant au moins 12 heures avant et après l’administration du médicament.
Les effets du propofol disparaissent généralement au bout de 12 heures (voir section 4.4).
L'induction et l'entretien de l'anesthésie ou de la sédation par propofol sont généralement réguliers et bien tolérés avec des signes d'excitation minimes. Les effets indésirables les plus fréquents pour le propofol sont les effets secondaires prévisibles d'un point de vue pharmacologique des agents anesthésiques/sédatifs, tels que l’hypotension. La nature, la gravité et l'incidence de ces effets indésirables observés chez les patients recevant du propofol peuvent être associées à l'état de santé des patients et aux procédures opératoires ou thérapeutiques mises en œuvre.
|
Système |
Fréquence |
Effets indésirables |
|
Affections du système immunitaire |
Très rare (< 1/10 000) |
Anaphylaxie : incluant œdème de Quincke, bronchospasme, érythème et hypotension |
|
Métabolisme et troubles nutritionnels |
Fréquence indéterminée(9) |
Acidose métabolique(5), hyperkaliémie(5), hyperlipidémie(5) |
|
Affections psychiatriques |
Fréquence indéterminée(9) |
Euphorie et abus médicamenteux(8) |
|
Affections du système nerveux |
Fréquent (≥ 1/100, < 1/10) |
Excitation, maux de tête lors de la période de réveil |
|
Rare (≥ 1/10 000, < 1/1 000) |
Mouvements épileptiques incluant opisthotonos et crises convulsives lors des périodes d'induction, d'entretien de l'anesthésie et de réveil, vertiges, frissons et sensation de froid lors de la période de réveil |
|
|
Très rare (< 1/10 000) |
Inconscience postopératoire |
|
|
Fréquence indéterminée(9) |
Mouvements spontanés |
|
|
Affections cardiaques |
Fréquent (≥ 1/100, < 1/10) |
Bradycardie(1) |
|
Très rare (< 1/10 000) |
Œdème pulmonaire |
|
|
Fréquence indéterminée(9) |
Arythmie cardiaque(5), insuffisance cardiaque(5, 7) |
|
|
Affections vasculaires |
Fréquent (≥ 1/100, < 1/10) |
Hypotension(2) |
|
Peu fréquent (≥ 1/1000, < 1/100) |
Thrombose et phlébite |
|
|
Affections respiratoires, thoraciques et médiastinales |
Fréquent (≥ 1/100, < 1/10) |
Apnée transitoire, toux lors de l’induction de l’anesthésie |
|
Peu fréquent (≥ 1/1000, < 1/100) |
Toux lors de l’entretien de l’anesthésie |
|
|
Rare (≥1/10 000, <1/1000) |
Toux lors de la période de réveil |
|
|
Fréquence indéterminée (9) |
Dépression respiratoire (dépendant de la dose) |
|
|
Affections gastro-intestinales |
Fréquent (≥ 1/100, < 1/10) |
Nausées et vomissements lors de la période de réveil, hoquet lors de l’induction de l’anesthésie |
|
Très rare (< 1/10 000) |
Pancréatite |
|
|
Affections hépatobiliaires |
Fréquence indéterminée(9) |
Hépatomégalie(5) |
|
Affections musculo-squelettiques et du tissu conjonctif |
Fréquence indéterminée(9) |
Rhabdomyolyse(3, 5) |
|
Affections du rein et des voies urinaires |
Très rare (< 1/10 000) |
Décoloration des urines après administration prolongée |
|
Fréquence indéterminée(9) |
Insuffisance rénale(5) |
|
|
Appareil reproducteur et seins |
Très rare (< 1/10 000) |
Levée de l’inhibition sexuelle |
|
Troubles généraux et anomalies au site d’administration |
Très fréquent (≥ 1/10) |
Douleur locale lors de l’induction de l’anesthésie |
|
Fréquent (≥ 1/100, < 1/10) |
Bouffées de chaleur lors de l’induction de l’anesthésie |
|
|
Très rare (< 1/10 000) |
Nécrose des tissus (10) suite à une administration extravasculaire accidentelle |
|
|
Fréquence indéterminée(9) |
Douleur locale, gonflement suite à une administration extravasculaire |
|
|
Investigations |
Fréquence indéterminée (9) |
ECG de type Brugada(5, 6) |
|
Lésion, intoxication et complications opératoires |
Très rare (< 1/10 000) |
Fièvre post-opératoire |
(1) Les cas de bradycardie sévère sont rares. Des cas isolés d'aggravation progressive en asystole ont été observés.
(2) Occasionnellement, une hypotension peut nécessiter une diminution de la vitesse d’administration et l'administration de solutés intraveineux.
(3) Des cas très rares de rhabdomyolyse ont été observés lorsque le propofol était administré à des doses supérieures à 4 mg/kg/h lors de sédation en unité de soins intensifs.
(4) Peut être atténuée par l’utilisation des veines plus larges de l’avant-bras et du pli du coude. Avec le propofol 1%, la douleur locale peut également être atténuée par l’administration en même temps de lidocaïne.
(5) La combinaison de ces événements, reportée comme « syndrome de perfusion au propofol », peut être observée chez des patients gravement malades qui ont souvent plusieurs facteurs de risque de développement de ces événements (voir rubrique 4.4).
(6) ECG de type Brugada avec sus-décalage du segment ST et ondes T en aspect de dôme.
(7) Insuffisance cardiaque progressant rapidement (issue fatale dans certains cas) chez l'adulte. L'Insuffisance cardiaque dans ces cas ne répondait généralement pas à un traitement inotrope de soutien.
(8) Abus médicamenteux et dépendance au propofol, principalement par les professionnels de santé.
(9) Indéterminée car ne peut être estimée sur la base des données issues d'essais cliniques disponibles.
(10) Des cas de nécrose ont été observés lorsque la viabilité des tissus a été affectée.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Un surdosage accidentel provoquerait vraisemblablement une dépression respiratoire et cardiovasculaire. La dépression respiratoire sera traitée par ventilation artificielle avec oxygène. La dépression cardiovasculaire nécessitera la mise en position déclive du patient et, si elle est accentuée, un remplissage vasculaire et des agents vasopresseurs.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Autres anesthésiques généraux, code ATC : N01AX10
Le début de l’effet hypotonique apparaît rapidement après injection intraveineuse de propofol. Selon la vitesse d’administration, le temps d’induction de l’anesthésie se situe entre 30 et 40 secondes. La durée de l’anesthésie après une administration en bolus est courte du fait du métabolisme et de l’excrétion rapides (4 - 6 minutes).
Avec le schéma posologique recommandé, aucune accumulation cliniquement significative de propofol après injections répétées de bolus ou après perfusion n’a été observée. Les patients recouvrent la conscience rapidement.
La bradycardie et l’hypotension signalées occasionnellement lors de l’induction de l’anesthésie peuvent être dues à un manque d’activité vagolytique. Cependant, les paramètres hémodynamiques reviennent généralement à la normale pendant l’entretien de l’anesthésie.
5.2. Propriétés pharmacocinétiques
Après administration intraveineuse, le taux de liaison du propofol aux protéines plasmatiques est de 98%.
Le propofol se distribue largement (volume de distribution central de 0,2 à 0,79 l/kg de poids corporel ; volume de distribution à l’équilibre de 1,8 à 5,3 l/kg de poids corporel) et s'élimine rapidement de l’organisme (clairance totale: 1,5 à 2 litres/min). L’élimination s'effectue par métabolisme, essentiellement au niveau du foie où elle est dépendante du débit sanguin hépatique. Le propofol est transformé en conjugués inactifs (glucuronides) et en dérivés quinoléiques (composés glucuronides et sulfates) qui sont excrétés dans les urines (88% de la dose administrée). Tous les métabolites sont inactifs. Seule 0,3% de la dose administrée est excrétée sous forme inchangée dans les urines.
Pendant l’élimination, la diminution des taux sanguins est plus lente. La demi-vie d’élimination pendant la phase β est comprise entre 30 et 60 minutes. Par la suite apparaît un troisième compartiment, représentant la redistribution de propofol depuis un tissu faiblement perfusé.
Après une dose unique intraveineuse de 3 mg/kg, la clairance du propofol/kg de poids corporel augmente avec l'âge comme suit : La clairance médiane a été considérablement diminuée chez les nouveau-nés âgés de moins de 1 mois (n = 25) (20 mL/kg/min) par rapport à des enfants plus âgés (n = 36, âge entre 4 mois et 7 ans). De plus, la variabilité interindividuelle est considérable chez les nouveau-nés (3,7 - 7,8 mL/kg/min). Les données limitées de cet essai clinique montrant une grande variabilité interindividuelle, aucune recommandation de dose ne peut être donnée dans cette catégorie d'âge.
5.3. Données de sécurité préclinique
Les données précliniques basées sur des études classiques de toxicité à doses répétées et de génotoxicité ne révèlent aucun risque particulier pour l’homme.
Il n’a pas été mené d’études de carcinogénicité.
Les études de toxicité sur la reproduction ont mis en évidence des effets liés aux propriétés pharmacodynamiques du propofol à hautes doses. Des études publiées chez l'animal (y compris chez les primates) ont mis en évidence que l'utilisation d'agents anesthésiques, à des doses entraînant une anesthésie légère à modérée, pendant la période de croissance cérébrale rapide ou de synaptogenèse, entraîne une perte de cellules dans le cerveau en développement pouvant être associée à des déficiences cognitives prolongées. La pertinence de ces observations non-cliniques pour une utilisation chez l'homme n'est pas connue. Aucun effet tératogène n’a été observé.
Dans les études de tolérance locale, une injection intramusculaire a provoqué des atteintes tissulaires autour du site d’injection.
Huile de soja raffinée
Phospholipides d’œuf purifiés
Glycérol
Hydroxyde de sodium (pour ajuster le pH)
Eau pour préparations injectables
Ce médicament ne doit pas être mélangé avec d’autres médicaments à l’exception de ceux mentionnés dans la rubrique 6.6.
Les myorelaxants, atracurium et mivacurium ne peuvent pas être administrés par le même connecteur en Y que PROPOFOL BIOQ sans rinçage préalable.
1 an
Durée de conservation après première ouverture
Conformément aux guidelines établies pour les autres émulsions lipidiques, une perfusion unique de PROPOFOL BIOQ ne doit pas excéder 12h. A la fin de l’administration ou au bout de 12h, en fonction de la première échéance, la pompe à perfusion préremplie (système d'administration) doit être retirée et remplacée de manière appropriée.
La stabilité physico-chimique du produit reconstitué a été démontrée pour une durée de 24 heures à 25°C.
Toutefois d’un point de vue microbiologique, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, la durée et conditions de conservation en cours d’utilisation relèvent de la responsabilité de l’utilisateur.
6.4. Précautions particulières de conservation
Ne pas congeler.
A conserver dans l’emballage d’origine, à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
Chaque pompe à perfusion préremplie (système d'administration, voir rubrique 6.6) contient 50 mL d’émulsion pour perfusion en flacon de verre incolore de type I avec piston en bromobutyle revêtu de téflon et bouchon en polypropylène
Chaque boîte contient une pompe à perfusion préremplie (système d'administration).
6.6. Précautions particulières d’élimination et de manipulation
L’administration simultanée de PROPOFOL BIOQ et d’une solution de glucose à 50 mg/mL (5%) pour perfusion intraveineuse ou une solution de chlorure de sodium à 9 mg/mL (0,9%) pour perfusion intraveineuse ou une combinaison d’une solution de glucose à 40 mg/mL (4%) et de chlorure de sodium à 1.8 mg/mL (0,18%) par l’intermédiaire d’une tubulure en Y située près du site d’injection, est possible.
Usage unique.
Les produits à usage parentéral doivent être examinés visuellement avant administration afin de vérifier l’absence de particules. Si la présence de particules est évidente, l’émulsion ne doit pas être utilisée.
Agiter la pompe à perfusion préremplie (système d'administration) avant l'emploi. Si l'on observe deux couches après agitation, ne pas utiliser le produit.
Utilisation de la pompe à perfusion préremplie (système d'administration)
Pour des instructions détaillées concernant l’utilisation, les indicateurs d’alarme et le traitement des erreurs, veuillez consulter la notice jointe dans l’emballage.
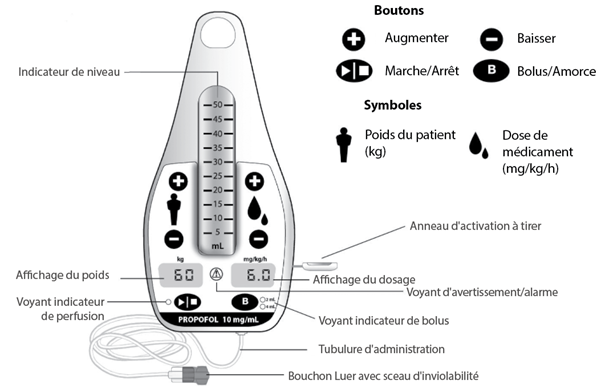
Éléments de la pompe à perfusion préremplie (système d'administration)

Activation de la pompe à perfusion préremplie (système d'administration)
Pour activer la pompe à perfusion préremplie (système d'administration), il convient de tirer sur la languette d’activation située sur le côté de la pompe à perfusion au moyen de l’anneau attaché. Une alarme se déclenche et les affichages s’allument.
Retirer la bande de la tubulure d’administration et dérouler la tubulure. Retirer le capuchon de protection.
Amorçage du système
Afin de retirer toute bulle d’air emprisonnée dans le système, il convient de renverser la pompe à perfusion préremplie (système d'administration) en maintenant le point de sortie de la tubulure d’administration vers le haut. Pour garantir l’amorçage correct et la bonne orientation de la pompe à perfusion pendant la procédure d’amorçage, une pochette indiquant les instructions pour l’amorçage est attachée à la pompe à perfusion.
Orientez-la en veillant à ce que la flèche de la pochette pointe vers le haut et appuyez sur le bouton « Bolus/Amorce », puis sur le bouton « Marche/Arrêt » pour amorcer. Il est possible d’arrêter l’amorçage en appuyant sur le bouton « Marche/Arrêt ». Il convient de retirer le bouchon Luer pour amorcer la tubulure.
Si vous continuez à voir des bulles d’air dans la tubulure après plusieurs tentatives d’amorçage, la pompe à perfusion ne peut pas être utilisée.
Réglages et initialisation
Après raccordement de la tubulure d’administration à la tubulure IV principale du patient, on peut régler le dosage en appuyant sur les boutons « + » ou « - » du poids et du sélecteur de dosage.
Le poids du patient peut être saisi par incréments de 5 kg (de 40 à 140 kg) en choisissant la valeur la plus proche du poids du patient. La fourchette de dosage se situe entre 0,3 et 18,0 mg/kg/h. Celui-ci peut être réglé à la valeur désirée en mg/kg de poids corporel/h. La première augmentation est de 0,3 à 0,5 mg/kg/h. Puis, des incréments de 0, 5 mg/kg de poids corporel/h (dans une fourchette de 0,5 à 5,0 mg/kg de poids corporel/h) et de 1,0 mg/kg de poids corporel/h (dans la fourchette de 5,0 à 18,0 mg/kg de poids corporel/h) sont possibles.
La circulation du liquide est lancée en appuyant sur le bouton « Marche/Arrêt ». Un seul voyant lumineux vert indique que le liquide est en cours d’administration. Pour interrompre l’administration, il est possible d’appuyer à nouveau sur le bouton « Marche/Arrêt ». Le voyant vert s’éteint, indiquant que le liquide n’est plus en cours d’administration.
Si elle est mise en pause pour 60 minutes, la pompe à perfusion préremplie (système d'administration) est désactivée définitivement.
Il est possible de modifier le poids ou la dose en appuyant sur les boutons « + » ou « - » lorsque l’administration est en pause.
Il est possible de modifier la dose en cours d’utilisation en appuyant sur les boutons « + » ou « - » du sélecteur de dosage pour saisir la valeur désirée. Appuyer sur le bouton « Marche/Arrêt » pour confirmer la modification de débit, sinon le débit précédent sera conservé.
Administration d’un bolus
Pour administrer une dose de charge ou une dose supplémentaire en bolus, appuyer sur le bouton « Bolus/Amorce » pour sélectionner une dose de bolus de 2 mL ou 4 mL. Un voyant blanc s’allume, la pompe à perfusion préremplie (système d'administration) bipe et le voyant vert de perfusion clignote pour indiquer que le bolus doit être confirmé. Appuyer sur le bouton « Marche/Arrêt » pour administrer le bolus. Le bolus sera administré en 10 secondes environ. Pour interrompre l’administration d’un bolus, il est possible d’appuyer sur le bouton « Marche/Arrêt ».
Si l’émulsion est en déjà en cours d’administration avant l’administration du bolus, la perfusion reprendra son cours (arrêt) de l’administration du bolus.
Désactivation et élimination
Après utilisation, il convient de désactiver définitivement la pompe à perfusion préremplie (système d'administration) en appuyant simultanément sur les deux boutons « - » pendant 5 secondes. L’alarme sonne et les voyants et les affichages clignotent, puis s’éteignent. La pompe à perfusion préremplie est alors hors d’état de fonctionner.
La pompe à perfusion préremplie ainsi que tout médicament non utilisé et déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
BIOQ PHARMA B.V.
PRINS BERNHARDPLEIN 200
1097 JB AMSTERDAM
PAYS-BAS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 550 610 5 2 Emulsion en flacon (verre) + pompe à perfusion pré-remplie, boîte de 1
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I
Médicament réservé à l’usage hospitalier.
Médicament pouvant être administré par tout médecin spécialisé en anesthésie-réanimation ou en médecine d'urgence dans les cas où il intervient en situation d'urgence ou dans le cadre d'une structure d'assistance médicale mobile ou de rapatriement sanitaire (article R. 5121-96 du code de la santé publique).